一只半野生病死川金丝猴肠道微生物多样性分析
2017-09-19刘燕郑常明李林海张成林刘学锋姚辉余辉亮李莹杨明海贾婷卢岩夏茂华
刘燕郑常明李林海张成林*刘学锋姚辉余辉亮李莹杨明海贾婷卢岩夏茂华
(1.北京动物园,北京,100044;2.圈养野生动物技术北京市重点实验室,北京,100044;3.国家林业局林产工业规划设计院,北京,100010;4.湖北省金丝猴保护研究中心,神农架,442421)
一只半野生病死川金丝猴肠道微生物多样性分析
刘 燕1,2郑常明1,2李林海张成林1,2*刘学锋1,2姚 辉4余辉亮李 莹1,2杨明海1,2贾 婷1,2卢 岩1,2夏茂华1,2
(1.北京动物园,北京,100044;2.圈养野生动物技术北京市重点实验室,北京,100044;3.国家林业局林产工业规划设计院,北京,100010;4.湖北省金丝猴保护研究中心,神农架,442421)
稿件运行过程
川金丝猴; 肠道菌群; 多样性分析; 投食群; 神农架
川金丝猴(Rhinopithecusroxellana)是中国特有的珍稀动物,具有极高的生态地位和研究价值,仅次于大熊猫,被誉为中国的第二国宝。神农架保护区内的川金丝猴种群相对孤立,主要包括大龙潭投食群和小龙潭圈养种群。大龙潭的猴群自2006年开始进行人工投食以来,种群数量正在逐年增加,种群内和种群间存在着个体迁移,近交水平较低,遗传多样性得以维持[1]。
本次死亡川金丝猴是1只老年雄性金丝猴,年龄在20岁左右。自2006~2015年间一直是大龙潭保护站投食种群中一个16只金丝猴家庭的家长。其在家庭中地位较为稳固,对家庭中雌性成员较好,与它们分享食物,帮它们梳理毛发,经常协助照顾幼猴,并干预家庭中雌性之间的冲突等。2015年6月9日该川金丝猴出现咳嗽,16日服用乙酰螺旋素片2片,治疗无效,25日因肺炎死亡。随后对其进行剖检,采集4个部位的肠内容物利用高通量测序技术进行肠道菌群分析[2-4]。
1 材料与方法
1.1样品采集
川金丝猴死后,立即剖检,采集十二指肠段、小肠(包括空肠和回肠)段、盲肠段及大肠(包括结肠和直肠)段共4份样品进行-80℃保存。
1.2肠道菌群基因组DNA的提取
使用E.Z.N.A.@Stool DNA Kit(Omega Bio-tek,Norcross,GA,U.S.),均按试剂盒要求操作。提取DNA,用紫外分光光度计测定其A260值,计算其浓度,通过A260/A280值鉴定纯度,进行0.8%的琼脂电泳验证其完整性。
1.3 16S rRNA的PCR扩增和Illumina MiSeq测序
以样品中菌群总DNA 为模板,用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACCAGGGTATCTAAT-3′),对细菌16S rRNA 的V3 ~ V4 区域进行PCR扩增。PCR采用20 μL 反应体系,包括0.4 μL FastPfu DNA Polymerase(购买于北京全式金生物技术有限公司),浓度为5U/μL,4 μL 5×FastPfu Buffer,引物浓度均为5 μmol / L,各0.4 μL,2.5 mmol/LdNTP 2 μL,总DNA 10 ng,补ddH2O 至20 μL。
PCR 过程在ABI Gene Amp 9700 上进行,反应条件为:95 ℃ 预变性3 min;随后变性循环27次(95 ℃,30 s;55 ℃,30 s;72 ℃,45 s 为1 个循环);72 ℃ 延伸10 min,10 ℃ 冷却。PCR 产物用含溴化乙锭的2%琼脂糖凝胶电泳鉴定并用PCR纯化试剂盒Qiagen纯化和回收,回收的PCR产物用QuantiFlourTM-ST fluorometer定量,并按测序要求进行混合。然后送至上海美吉生物医药科技有限公司。
1.4 ITS rRNA的PCR扩增和Illumina MiSeq测序
以样品中菌群总DNA为模板,用真菌通用引物1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和2043R(5′-GCTGCGTTCATCGATGC-3′),针对真菌ITS区域进行PCR扩增。PCR采用反应体系同上。PCR 过程在ABI Gene Amp 9700 上进行,反应条件为:95 ℃ 预变性3 min;随后变性循环32 次(95 ℃,30 s;55 ℃,30 s;72 ℃,45 s 为1 个循环);72 ℃ 延伸10 min,10 ℃ 冷却。其他同上。
1.5数据分析
首先对原始数据进行过滤处理,得到优化序列。然后在去除嵌合体序列后进行OTU聚类分析,对OTU的代表序列作分类学分析。基于OTU聚类分析结果,对OTU进行多种多样性指数分析,以及对测序深度的检测;基于分类学信息,在各个分类水平上进行群落结构的统计分析。
2 结果
2.1样品信息
将采集的十二指肠段、小肠段、盲肠段及大肠段4份肠内容物,分别命名为SJ1、SJ2、SJ3和SJ4。提取微生物DNA,进行测序和分析。
2.2样品测序深度
用Illumina MiSeq平台对细菌16S rRNA的V3~V4区进行测序,共获得184 412条有效序列(cleandata),平均每个样品含有(46 103)条序列,每条序列的平均长度是439 bp。基于相似度大于97%的原则,将获得的有效序列进行OTU聚类,共获得240个OTU,其中SJ1含181个、SJ2含208个、SJ3含220个和SJ4含213个。根据样品的稀释曲线(图1),在本试验的测序深度下,全部样品的稀疏曲线均趋于平缓,获得的OTU数量变化不大,说明本试验的测序量可以覆盖各样品的大多数微生物,测序数据量合理。
用Illumina MiSeq平台对真菌的ITS片段进行测序,共获得103 316条有效序列,平均每个样品含有(25 829)条序列,每条序列的平均长度是241 bp。基于相似度大于97%的原则,将获得的有效序列进行OTU聚类,共获得341个OTU,其中SJ1含150个、SJ2含166个、SJ3含129个和SJ4含104个。根据样品的稀释曲线(图2),在本试验的测序深度下,全部样品的稀疏曲线均趋于平缓,获得的OTU数量变化不大,说明本试验的测序量可以覆盖各样品的大多数微生物,测序数据量合理。
2.3 α多样性分析
应用软件mothur version v.1.30.1进行ace、chao、coverage、shannon、simpson 5种常用指数的测定(表1),4份样品的序列覆盖率coverage均达到99%以上。根据反应菌群多样性的指数Simpson和Shannon和菌群丰度指数Chao和Ace可以看出,细菌丰度最高的是盲肠段,细菌多样性最高的是大肠段,其中十二指肠是细菌多样性较高但细菌丰度较低。
表1 4份样品16S rRNA基因库多样性指数和覆盖率

Tab.1 Phylotype coverage and diversity estimation of the 16S rRNA gene of four samples
应用软件mothur version v.1.30.1进行ace、chao、coverage、shannon、simpson 5种常用指数的测定(表2),4份样品的序列覆盖率均达到99%以上。根据反应菌群多样性的指数Simpson和Shannon和菌群丰度指数Chao和Ace可以看出,真菌丰度最高的是小肠段,真菌多样性最高的是大肠段,其中大肠段是真菌多样性较低同时真菌丰度也较低的肠段。
2.4 菌群分类组成
2.4.1 门分类水平上细菌分类组成
从门的水平上看,金丝猴肠道内的细菌主要分属于7个门类,包括厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、互养菌门(Synergistetes)及其他。其中占有优势的是厚壁菌门、疣微菌门和变形菌门。十二指肠中厚壁菌门占比可高达69%,其他门类细菌丰度很低。从十二指肠到最后的直肠,厚壁菌门所占比例逐渐降低,疣微菌门、变形菌门及梭杆菌门所占比例逐渐升高。
表2 4份样品ITS基因库多样性指数和覆盖率
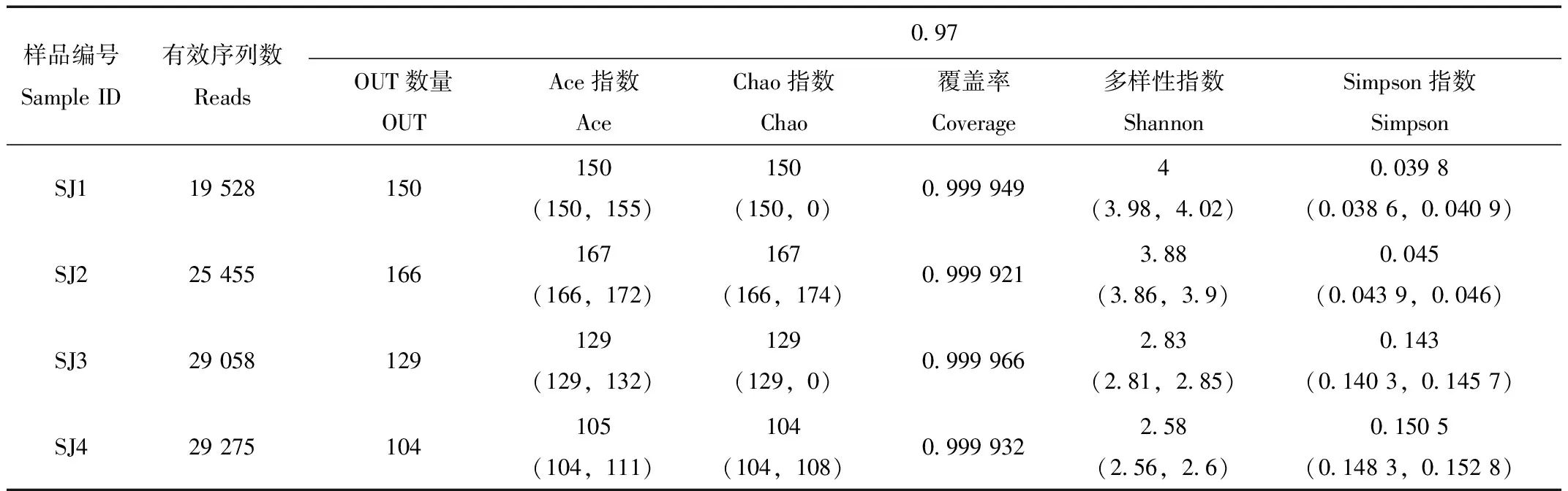
Tab.2 Phylotype coverage and diversity estimation of the ITS gene of four samples

图1 4份样品的稀释性曲线Fig.1 Rarefaction curve of four samples

图2 4份样品的稀释性曲线Fig.2 Rarefaction curve of four samples

图3 各肠段内容物在属水平上的细菌分布Fig.3 Bacterial distribution of the intestinal bacteria at the level of genus

图4 各肠段内容物在属水平上的真菌分布Fig.4 Bacterial distribution of the intestinal fungus at the level of genus
2.4.2 属分类水平上细菌分类组成
从属的水平上看,金丝猴肠道内的细菌主要分属于31个属(图3),其中Akkermansia、瘤胃菌科未培养菌属(Ruminococcaceae_uncultured)、大肠-志贺氏菌属(Escherichia_Shigella)、韦荣氏菌科未分类菌属(Veillonellaceae_unclassified)以及毛螺旋菌属(Lachnospiraceae_unclassified)是主要的属。其中厚壁菌门的瘤胃菌科(Ruminococcaceae)是十二指肠中最主要的细菌。
2.4.3 门分类水平上真菌分类组成
从门的水平上看,金丝猴肠道内的真菌主要分属于4类,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)以及未分类真菌(Fungi-unclassified)。从所占比例上看,子囊菌门具有绝对的优势地位,是金丝猴肠道内真菌的最主要的门类。从变化趋势上看,从十二指肠到直肠,接合菌门和未分类真菌所占比例逐渐升高,而子囊菌门和担子菌门所占比例略微降低。子囊菌门真菌在肠道内比例可达67%~74%,是最主要的真菌。
2.4.4 属分类水平上真菌分类组成
从属的水平上看,金丝猴肠道内的真菌主要分属于28个属(图4)。从十二指肠到大肠,最主要的4个属未分类Montagnulaceae、松萝属(Usnea)、鬼笔属(Phallus)、槽枝属(Sulcaria)所占比例逐渐变大,从31%升至82%,而其他24个属的真菌所占比例逐渐降低,从54%降至8%。
3 讨论
湖北神农架国家级自然保护区的大龙潭保护站多年来一直对川金丝猴进行人工投食。以往对投食群的研究主要集中于行为学观察、社群行为等方面[5-6]。对肠道内的菌群的研究,传统方法较多[7],通过高通量测序的方法进行研究较少[8]。本次死亡的投食群的川金丝猴属于老年半野生金丝猴,为我们研究提供了难得的材料。其从开始出现咳嗽现象到最后死亡大概经历半月左右时间。期间食欲逐步下降,药物治疗是在16日投喂了2片乙酰螺旋素片。本研究中川金丝猴肠道内菌群多样性特征代表了老年死亡金丝猴肠道特点。另外,不可忽略的是乙酰螺旋素会对肠道菌群多样性有一定的影响。乙酰螺旋素是大环内酯类抗生素,对金黄色葡萄球菌、链球菌、肺炎球菌以及脑膜炎球菌等有抑菌作用,这将降低阳性球菌所占比例。
根据本次研究川金丝猴肠道内菌群多样性有如下几个特点:(1)十二指肠中厚壁菌门细菌占比可高达69%,其他门类细菌丰度很低。厚壁菌门[9]通常是人类和灵长类动物肠道内的主要细菌,但是能达到70%左右的还是非常少见。可能因为十二指肠离胃较近,pH较低,不太适宜其他门类细菌的存在。(2)该金丝猴肠道内细菌组成的另一个特点是疣微菌门在整个肠道内所占比例较高,仅次于厚壁菌门,位居第二,比例在4%~35%之间。金丝猴和人同属于灵长类,食性都是杂食,肠道菌群结构具有一定相似性。人类的肠道细菌主要是属于厚壁菌门和拟杆菌门,疣微菌门所占比例甚小。疣微菌门是一门被划出不久的门类,包括的细菌种类不是很多,具有胞质突出形成的两个到多个突起,因此得名,在人类粪便中常被发现。疣微菌门的Akkermansia在川金丝猴的肠道比在人类肠道内占有丰度要高。(3)子囊菌门[10]是该只金丝猴肠道内真菌的最主要的门类,具有绝对的比例优势。从变化趋势上看,从十二指肠到直肠,接合菌门和未分类真菌所占比例逐渐升高,而子囊菌门和担子菌门所占比例略微降低。子囊菌门真菌在肠道内比例可达67%~74%,是最主要的真菌。以往对金丝猴肠道内真菌分布情况研究较少,本研究为老年金丝猴肠道内真菌多样性提供参考。
肠道菌群对动物健康有着重要影响和作用,近年来研究结果很多。人的优势菌门为厚壁菌门、拟杆菌门、变形菌门[11];大熊猫(Ailuropodamelanoleuca)肠道优势菌门为厚壁菌门、变形菌门、梭杆菌门[12];老虎肠菌优势菌门为厚壁菌门、梭杆菌门、拟杆菌门[13]。已有研究显示健康成年川金丝猴粪样菌群以厚壁菌门和拟杆菌门为主[14]。另外,不同年龄段多样性也不同,变化趋势是随着年龄的增大,多样性也变高[7]。不同年龄阶段的金丝猴肠道菌群在种属上的类别上差别不大,不同主要体现在比例上。本次研究的川金丝猴与以往测定的肠道菌群多样性有一定差异,可能是由于健康状况不同、年龄不同、个体不同以及用过1次乙酰螺旋素片有关系。
[1] 周素容.神农架川金丝猴投食群的遗传多样性及种群动态[D].武汉:华中师范大学,2015.
[2] 蔡言安,李冬,毕学军,等.基于不同测序技术的生物群落结构及功能菌分析[J].中国环境科学,2016,36(6):1830-1834.
[3] 曹露芬,殷婷婷,袁振亚,等.基于高通量测序的陕西花马池和苟池微生物群落多样性分析[J].生物技术通讯,2016,27(3):374-380.
[4] 胡海兵,崔立,郭靓骅,等.基于高通量测序技术的冠心病患者肠道菌群多样性研究[J].上海交通大学学报:农业科学版,2016,34(2):1-11,19.
[5] 周芸芸,杨万吉,张于光,等.神农架川金丝猴人工补食群的遗传多样性和亲缘关系[J].兽类学报,2015,35(3):229-240.
[6] 蔚培龙,杨敬元,鲍伟东,等.神农架川金丝猴投食群的攻击行为及等级序列[J].兽类学报,2009,29(1):7-11.
[7] 简平,王强,王剑,等.不同年龄段川金丝猴肠道菌群结构差异分析[J].动物营养学报,2015,27(4):1302-1309.
[8] 许文涛,郭星,罗云波,等.微生物菌群多样性分析方法的研究进展[J].食品科学,2009,30(7):258-260.
[9] 韩岗,马婧,陶士珩,等.厚壁菌门细菌及其祖先蛋白的氨基酸偏好性研究[J].安徽农业科学,2011,39(30):18408-18410.
[10] 孟庆峰,魏江春.中国霜盘衣属(文字衣科,子囊菌门)地衣的研究[J].菌物学报,2008,27(4):525-531.
[11] Wang Tingting,Cai Guoxiang,Qiu Yunping,et al.Structural segregation of gut microbiota between colorectal cancer patients and healthy volunteers[J].The ISME Journal,2012,6(2):320-329.
[12] Zhu Lifeng,Wu Qi,Dai Jiayin,et al.Evidence of cellulose metabolism by the giant panda gut microbiome[J].Proceedings of the National Academy of Sciences,2011,108(43):17714-17719.
[13] 田银平.人工饲养条件下虎肠道菌群结构研究[D].哈尔滨:东北林业大学,2013.
[14] 王剑,王强,曾东,等.健康和腹泻川金丝猴粪样菌群比较分析[J].中国兽医学报,2015,35(8):1232-1238.
Golden snub-nosed monkey; Intestinal flora; Diversity analysis; Provisioned group; Shennongjia
对神农架保护区大龙潭保护站1只半野生病死川金丝猴的不同部位的肠道内容物进行了微生物多样性研究。在无菌条件下取十二指肠段、小肠段、盲肠段及大肠段4个部位的肠内容物,提取微生物基因组DNA,应用高通量测序技术,对细菌和真菌多样性进行了详细的分析,比较了不同部位肠道的细菌和真菌的丰度、分布、多样性及变化趋势等。发现该川金丝猴肠道细菌主要分属于厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和Synergistetes 7个门,真菌主要分属于子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)以及未分类真菌(Fungi_unclassified)。细菌丰度最高的是盲肠段,细菌多样性最高的是大肠段,真菌丰度最高的是小肠段,真菌多样性最高的是大肠段。
Gut Microbiota of a Dead Semi-Wild Golden Snub-Nosed Monkey in a Shennongjia Nature Reserve
Liu Yan1,2Zheng Changming1,2Li Linhai3Zhang Chenglin1,2*Liu Xuefeng1,2Yao Hui4Yu Huiliang4Li Ying1,2Yang Minghai1,2Jia Ting1,2Lu Yan1,2Xia Maohua1,2
(1.Beijing zoo,Beijing,100044,China;2.Beijing Key Laboratory of Captive Related Technologies in Wildlife,Beijing,100044,China;3.Planning and Design Academy of Forest Products Industry,Beijing,100010,China;4.Hubei Golden Monkey Research Center,Shennongjia,442421,China)
We analyzed the gut microbiota from different parts of the intestine of a dead semi-wild golden snub-nosed monkey in Dalongtan Station of Shennongjia National Nature Reserve.Intestinal content was sampled from the duodenum,small intestine(jejunum and ileum),cecum,and large intestine(colon and rectum)under aseptic condition.Microbial genome DNA were extracted and sequenced by high-output sequencing.Then we analyzed the intestinal bacterial and fungal diversity and compared bacterial and fungal abundance,distribution,diversity and change trends between different parts of the intestinal.The intestinal bacteria of the golden snub-nosed monkey mainly belong to Firmicutes,Verrucomicrobia,Proteobacteria,Fusobacteria,Actinobacteria,Bacteroidetes,and Synergistetes.The intestinal fungi mainly belong to Ascomycota,Basidiomycota,Zygomycota,and unclassified fungi.Bacteria abundance was highest in the cecum while bacterial diversity was highest in the large intestine.Fungi were most abundant in the small intestine while fungus diversity was highest in the large intestine.
北京市公园管理中心科研项目:高通量测序技术分析北京动物园大熊猫肠道菌群多样性,项目编号:zx2015013;国家科技支撑计划课题(2013BAD03B01)
刘燕,女,35岁,硕士,畜牧师;主要从事野生动物致病细菌分离等方面研究。E-mail:liuyanllh@sohu.com
*通讯作者:张成林,E-mail:zhch6465@263.net
2016-09-02
S852.61
A
修回日期:2016-10-25
发表日期:2017-05-10
2310-1490(2017)02-194-06
