环尾狐猴源弓形虫多位点基因的克隆、测序及基因分型
2017-09-19杨芳李康信徐春忠单芬陈武彭仕明李婉萍李国清
杨芳李康信徐春忠单芬陈武*彭仕明李婉萍李国清
(1.华南农业大学,广州,510642;2.上海市野生动物园有限公司,上海,201300;3.广州动物园,广州,510070)
环尾狐猴源弓形虫多位点基因的克隆、测序及基因分型
杨 芳李康信徐春忠单 芬3陈 武3*彭仕明李婉萍李国清1*
(1.华南农业大学,广州,510642;2.上海市野生动物园有限公司,上海,201300;3.广州动物园,广州,510070)
稿件运行过程
刚地弓形虫; 基因分型; 环尾狐猴
刚地弓形虫(Toxoplasmagondii)是一种呈世界性分布的专性细胞内寄生原虫,其宿主范围十分广泛,能感染包括人类在内的几乎所有温血动物,引起人兽共患寄生虫病[1]。人类对弓形虫普遍易感,据估计全球约有1/3的人感染弓形虫,我国人群弓形虫血清抗体平均阳性率为7.88%[2]。本虫的终末宿主为猫及其他猫科动物,人、多种哺乳动物和鸟类为其中间宿主。人和动物感染弓形虫主要是通过食入含有包囊的生的或未煮熟的肉类,摄入被卵囊污染的食物或饮水,及垂直传播[3]。免疫系统正常者感染弓形虫通常表现为无症状的隐性感染,但对于免疫功能低下或缺陷者(如恶性肿瘤、器官移植或HIV感染者)则可引起中枢神经系统损害和全身性播散感染,甚至引起死亡[4]。孕妇感染弓形虫后可通过胎盘或者母体生理性免疫应答紊乱导致不良妊娠[5]。
刚地弓形虫的基因型有着高度的地域差异性和丰富的遗传多样性,目前,DNA序列分析是研究弓形虫基因多态性的最精确的分子生物学的方法之一,通过PCR-限制性片段长度多态性分析(PCR-RFLP)、微卫星DNA序列分析和多位点DNA序列分析等方法可实现对弓形虫的高分辨率基因分型[6-8]。一系列不同的遗传位点已经作为靶基因应用于弓形虫的PCR检测方法中,目前应用较多的特异性遗传标记是B1基因、SAG2基因和529 bp DNA序列。Burg等[9]在1989年首次对B1基因进行鉴定,B1基因在弓形虫基因组中有35个拷贝,具有公认的高度特异性。袁恒青等[5]对安徽猪源弓形虫529 bp重复序列进行了PCR扩增和序列分析,结果表明该基因适合作为弓形虫病诊断的靶基因。陈志强等[10]对弓形虫上海株SAG2基因进行克隆与鉴定,并进行同源性分析,发现不同宿主和不同区域上的弓形虫SAG2基因序列差异很小,作为候选疫苗和诊断抗原,有着广阔的发展前景。
环尾狐猴(Lemurcatta)对弓形虫有较强的易感性,感染弓形虫后可出现急性死亡。Sureau等[11]在1962年首次从环尾狐猴身上分离到刚地弓形虫,随后,有关环尾狐猴感染弓形虫的研究相继被报道。Dubey等[12]报道了辛辛那提动物园环尾狐猴由于感染弓形虫而死亡,其传染源可能是来自关在狐猴附近的猫排出的弓形虫卵囊;Spencer等[13]报道了1头3岁雌性环尾狐猴由于急性Ⅱ型弓形虫感染而引起中度肺炎和肝病,最后导致死亡的病例;Yabsley等[14]对美国52头环尾狐猴进行弓形虫阳性率的检测,结果发现其阳性率为5.8%(3/52)。我国弓形虫病的发现较晚,对于环尾狐猴弓形虫病的报道极少,目前尚未见有关环尾狐猴源弓形虫遗传进化和生物学特性等方面的研究报道。本研究首次以环尾狐猴源弓形虫株为研究对象,采用多位点DNA序列分析对中国广东地区环尾狐猴源弓形虫株进行基因分型,旨在探讨其基因型以及丰富我国弓形虫基因型资源库,从而为弓形虫病的流行病学调查、诊断和治疗提供理论依据。
1 材料与方法
1.1材料
1.1.1病料来源
从广东某地采集具有典型弓形虫病临床症状的死亡环尾狐猴心肝肺肾和脑组织。
1.1.2主要试剂
Ex-Taq酶、buffer、MgCl2、dNTPs、DL 2000 DNA Marker、pMD-18 Vector均购自宝生物工程(大连)有限公司;普通琼脂糖凝胶DNA回收试剂盒、大肠杆菌DH5α感受态细胞均购自北京天根生化科技有限公司;TIANamp Genomic DNA Kit试剂盒为天根公司产品;TaKaRa MiniBEST Plasmid Purifiction Kit Ver 4.0质粒提取试剂盒为大连宝生物公司产品。
1.2方法
1.2.1病理组织学观察
剖检死亡环尾狐猴并观察病理变化。采集心肝肺肾和脑等组织样品,于10%中性福尔马林中固定48 h后制作常规石蜡切片,经HE染色,显微镜下观察病理组织学变化。
1.2.2 DNA的提取
将采集的病料组织用灭菌的微型剪刀剪碎,然后加入200 μL的Buffer GA反复研磨,再加入20 μL的蛋白酶K,混匀后置于54℃恒温水浴锅中消化3~4 h(每30 min震荡混匀1次)。消化好的组织悬液按TIANamp Genomic DNA Kit试剂盒使用说明进行组织DNA的提取,DNA样品于-20℃冰箱保存备用。
1.2.3 PCR扩增
参照文献[15]中的10个分型标志物基因特异性引物(其中SAG1、SAG2、SAG3、BTUB、GRA6、c22-8、c29-2、L358和PK1为核基因位点,Apico为顶质体基因位点),以本次分离的虫株基因组DNA为模版,扩增上述10个基因片段。反应体系如下:DNA模板2 μL(约55 ng总DNA),上下游引物各1 μL(25 μmol/mL),PCR PremixTaq25 μL,总体积为50 μL。扩增条件:94℃预变性5 min,94℃变性40 s,60℃退火40 s,72℃延伸60 s,共35个循环,最后72℃延伸10 min。扩增产物在含溴化乙锭(EB)的1%琼脂糖凝胶中110 V电泳30 min,于紫外透射仪上观察,并通过凝胶成像系统摄像记录结果。
1.2.4 PCR扩增产物的克隆及鉴定
用DNA胶回收试剂盒对扩增产物进行回收和纯化,纯化产物连接pMD18-T Vector上,之后将连接产物转化至大肠杆菌DH5α感受态细胞中,取转化好的菌液涂布于加有Amp + IPTG + X-gal的LB固体培养基上,倒置平皿,于37℃温箱中培养12~16 h,无菌挑选白色单菌落(每个PCR产物挑选3个白色单菌落,作重复对照),接种于含Amp的LB培养基中于37℃摇床振荡培养过夜,对菌液进行PCR鉴定。
1.2.5序列测定与同源性分析
阳性菌液采用TaKaRa MiniBEST Plasmid Purifiction Kit Ver 4.0试剂盒抽提重组质粒,并将质粒委托生工生物(上海)公司测序,测序采用Sanger法。所得序列运用GenBank中的BLAST工具进行序列比对,并运用DNAStar软件进行同源性分析。
1.2.6系统进化树的构建
利用Clustalx 1.81及MEGA 5.05软件对获得的弓形虫部分基因位点序列进行比对及计算遗传距离,然后用MEGA 5.05程序中的邻接法(neighbor-joining method,NJ)绘制种系发育树,采用Tamura-Nei模型进行分析,采用自展检验(Bootstrap值)估算所构建系统树的可靠性,复制数为1 000。
2 结果
2.1病理组织学变化
肺脏见肺内积尘,呈间质性肺炎变化,肺泡壁内见大量炎性细胞浸润,肺泡腔中有炎性渗出物(图1A);气管黏膜上皮脱落、出血;气管固有层内见大量淋巴和巨噬细胞为主的炎性细胞浸润灶(图1B);肝发生局灶性坏死性肝炎,见大淋巴细胞、巨噬细胞等炎性细胞浸润(图1C);脑血管周围水肿,神经元变性,脑皮质内可见炎性粒细胞结节(图1D);肾小管上皮细胞发生不同程度的变性,甚至坏死,大量炎性细胞浸润(图1E);心肌细胞出现变性、肌间水肿,可见巨噬细胞和淋巴细胞浸润(图1F)。

A:肺;B:肺;C:肝;D:脑;E:肾;F:心A:lung;B:lung;C:liver;D:brain;E:kidney;F:heart图1 五种脏器的病理组织学观察(×400)Fig.1 Histopathological observation of five organs(×400)
2.2 PCR扩增
以从环尾狐猴心肝肺肾组织中提取的基因组DNA为模板,对SAG1、SAG2、SAG3、BTUB、GRA6、c22-8、c29-2、L358、PK1及Apico这10个基因片段进行PCR扩增,PCR产物于1%琼脂糖凝胶中进行电泳,分别可见400 bp、550 bp、300 bp、400 bp、350 bp、500 bp、450 bp、400 bp、900 bp和600 bp左右大小的条带,均与预期目的片段大小相一致(图2),且无非特异性条带。

图2 刚地弓形虫10个基因片段的PCR扩增结果Fig.2 PCR amplification of 10 gene segments of Toxoplasma gondii 注:M.DL 2000 DNA Marker;1.SAG3位点;2.BTUB位点;3.SAG1位点;4.c29-2位点;5.L358位点;6.GRA6位点;7.PK1位点;8.c22-8位点;9.Apico位点;10.SAG2位点;11.阴性对照 Note:M.DL 2000 DNA Marker;1.SAG3;2.BTUB;3.SAG1;4.c29-2;5.L358;6.GRA6;7.PK1;8.c22-8;9.Apico;10.SAG2;11.Negative control
2.3测序与序列分析
PCR扩增产物经测序,结果显示,SAG1基因片段大小为390 bp,SAG2基因片段大小为546 bp,SAG3基因片段大小为311 bp,BTUB基因片段大小为411 bp,GRA6基因片段大小为344 bp,c22-8基因片段大小为521 bp,c29-2基因片段大小为446 bp,L358基因片段大小为418 bp,PK1基因片段大小为903 bp,Apico基因片段大小为614 bp。将测序所得的10个基因片段序列与GenBank和ToxoDB网站(www.toxodb.org)下载的典型弓形虫株RH株、ME49株和VEG株相应序列进行比对,结果表明环尾狐猴弓形虫株(TgRTL1)在SAG2、SAG3、c22-8、GRA6、PK1位点为基因Ⅱ型;在SAG1、L358、BTUB、c29-2位点为非典型基因型;在Apico位点为基因Ⅰ型(图3)。
2.4弓形虫部分基因系统进化树的构建
种系发育分析结果显示,基于L358、PK1、c22-8基因序列以NJ法建立的系统进化树基本一致(图4),弓形虫RH株和GT1株属于基因型Ⅰ型,位于同一分支上,弓形虫基因Ⅰ型和Ⅱ型虫株之间得到了较好的区分。本次所获环尾狐猴源弓形虫株(TgRTL1)基于L358、PK1、c22-8基因序列构建的系统进化树均与基因Ⅱ型虫株遗传距离最近,在遗传进化树上处于同一分支。

MarkerSAG1-ChrVIIISAG2-ChrVIIIL358-ChrvNucleotide104192285302337355ALLELE92693594610861329ALLELE35157205ALLELEConsensusGCCGACCGGAATGCRHATGAGTⅠ.....Ⅰ..GⅠME49......ⅡGCTC.ⅡCA.ⅡVEG......Ⅲ....GⅢ...ⅢTgRTL1....G.U1GCTC.ⅡC..U1A

Markerc22-8-ChrIbGRA6-ChrXBTUB-ChrIXNucleotide6696168376ALLELE98128163228ALLELE2489126129289ALLELEConsensusAATGCTCACCCGCRH..CAⅠ.G..Ⅰ....TⅠME49....ⅡT..GⅡGGGC.ⅡVEGTG..Ⅲ..T.Ⅲ.....ⅢTgRTL1....ⅡT..GⅡ...C.U1B

Markerc29-2-ChrIIIPK1-ChrVINucleotide164680190384403ALLELE3156144249325350437635766ALLELEConsensusGCAGTGGCGACGATCRHA.C.A.ⅠA.AC...GTⅠME49...A.AⅡ.........ⅡVEG.G....Ⅲ.A..TATG.ⅢTgRTL1AG....U1.........ⅡC

MarkerApicoSAG3-ChrXIINucleotide150528ALLELE118145189ALLELEConsensusTCGTGRH..ⅠC..ⅠME49C.Ⅱ.CAⅡVEG.TⅢ-..ⅢTgRTL1..Ⅰ.CAⅡD
图3环尾狐猴源弓形虫10个遗传标记基因多态性分析
Fig.3.Polymorphisms at 10 genetic markers by direct PCR-DNA sequencing ofToxoplasmagondiiisolates fromLemurcattafrom China
注:A、B、C、D分别为SAG1,SAG2,L358基因位点;c22-8,GRA6,BTUB基因位点;c29-2,PK1基因位点和Apico,SAG3基因位点的DNA序列分析。Consensus序列由至少2个典型Type I,II和III基因型的共同等位基因组成。使用RH株作为参考虫株,其序列登录号GQ253075,M33572,EU258490,AM055943,JX044183,JX045446 和 L42007分别对应SAG1,SAG2,L358,c22-8,GRA6,BTUB和PK1基因位点,c29-2,Apico和SAG3基因片段在ToxoDB网站(www.toxodb.org)进行blasted搜索;使用ME49株作为参考虫株,其序列登录号XM_018781602,XM_018781958和XM_002371898分别对应SAG2,L358和GRA6基因位点,SAG1,c22-8,BTUB,c29-2,PK1,Apico和SAG3基因片段在ToxoDB网站(www.toxodb.org)进行blasted搜索;使用VEG株作为参考虫株,其序列登录号LN714498,LN714498,LN714494,LN714490,LN714500,LN714499,LN714492和LN714495分别对应SAG1,SAG2,L358,c22-8,GRA6,BTUB,c29-2和PK1基因位点,Apico和SAG3基因片段在ToxoDB网站(www.toxodb.org)进行blasted搜索。“.”指代和consensus序列相一致;“-”指代基因的插入或缺失。“u”指代非典型等位基因;I,II 和III分别指TypeⅠ,Ⅱ和Ⅲ基因型分离株的典型等位基因序列
Note:DNA sequence analysis at(A)SAG1,SAG2,L358;(B)c22-8,GRA6,BTUB;(C)c29-2,PK1 and(D)Apico,SAG3.Consensus sequence is defined as the nucleotide shared by at least two of the three archetypal Type I,II and III strain alleles.GenBank accession no.GQ253075,M33572,EU258490,AM055943,JX044183,JX045446 and L42007 for SAG1,SAG2,L358,c22-8,GRA6,BTUB and PK1 respectively,for c29-2,Apico and SAG3 the amplicon was blasted(using the BlastN algorithm)at ToxoDB(www.toxodb.org)and the corresponding RH sequence used as the reference;GenBank accession no.XM_018781602,XM_018781958 and XM_002371898 for SAG2,L358 and GRA6 respectively,for SAG1,c22-8,BTUB,c29-2,PK1,Apico and SAG3 the amplicon was blasted(using the BlastN algorithm)at ToxoDB(www.toxodb.org)and the corresponding ME49 sequence used as the reference;GenBank accession no.LN714498,LN714498,LN714494,LN714490,LN714500,LN714499,LN714492 and LN714495 for SAG1,SAG2,L358,c22-8,GRA6,BTUB,c29-2and PK1 respectively,for Apico and SAG3 was blasted(using the BlastN algorithm)at ToxoDB(www.toxodb.org)and the corresponding VEG sequence used as the reference.“.”indicates identity with consensus;“-”indicates an insertion/deletion.“u”indicates a nonarchetypal allele;Ⅰ,Ⅱ or Ⅲ refers to an archetypal allelic sequence from a Type Ⅰ,Ⅱ or Ⅲ strain

图4 弓形虫 L358(A)、PK1(B)、c22-8(C)基因以NJ法建立的系统进化树Fig.4 Phylogenetic tree based on L358(A),PK1(B),c22-8(C)gene of Toxoplasma gondii by neighbor-joining (NJ)method
2.5 弓形虫基因分型
采用10个遗传位点,对本室分离的环尾狐猴源弓形虫株进行PCR扩增和序列分析,对其进行基因分型,共揭示了1个基因型(ToxoDB#3)(表1)。
表1 中国广州环尾狐猴源弓形虫虫株基因型
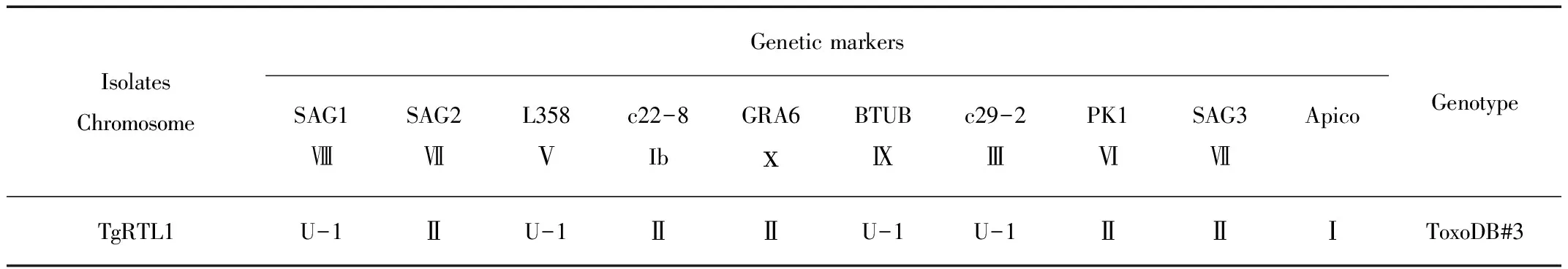
Tab.1 Multi-locus genotypes of Toxoplasma gondii isolates from Lemur catta from Guangzhou,China
3 讨论
将广东某地圈养感染弓形体死亡的环尾狐猴的心肝肺肾和脑组织制作石蜡切片,观察其病理组织变化主要表现为间质性肺炎的变化、肝发生局灶性坏死性肝炎、肾小管上皮细胞不同程度的变性和坏死变化、脑神经元变性,脑皮质内可见炎性粒细胞结节和心肌细胞出现变性,可见巨噬细胞和淋巴细胞浸润等变化,这些与王小波[16]等报道的猪感染弓形虫主要病理组织学变化基本一致。
传统的弓形虫基因型分类基于弓形虫对小鼠的毒力强弱可将其分为typeⅠ型、typeⅡ型和typeⅢ型。typeⅠ型虫株为强毒株(LD100=1 parasite),typeⅡ型和type Ⅲ型虫株为弱毒株(LD50>1 000 parasites)。随着PCR及其衍生技术在弓形虫分离株的基因鉴定和分型中的广泛应用,对弓形虫有了更广泛深入的研究,越来越多的弓形虫克隆世系被研究者们发现。研究表明,世界各地的弓形虫株基因型具有丰富的遗传多态性,王林等[3]对世界各地区弓形虫株种群结构分布概况的研究显示,typeⅠ型、Ⅱ型和Ⅲ型为流行于北美和欧洲的优势基因型;流行南美洲的弓形虫具有复杂的遗传多态性,主要包括BrⅠ型、BrⅡ型、BrⅢ型和BrⅣ型,此外还有少数其他的基因型,如:ToxoDB#65型、ToxoDB#7型等;流行于非洲的弓形虫分离株基因型主要以Ⅱ型和Ⅲ型为主,此外,Africa1型和Africa3型亦为流行非洲的弓形虫株优势基因型。然而对于我国流行的弓形虫虫株基因型方面的研究尚十分欠缺,本研究在广东省1只发生弓形虫病死亡的环尾狐猴中分离得到弓形虫虫株(TgRTL1),并采用多位点PCR-DNA测序法进行基因型鉴定,结果显示其基因型为ToxoDB#3。通过构建系统发育树,结果发现,基于L358、PK1、c22-8基因构建的进化树具有一致性,均与属于基因Ⅱ型的PTG株和ME49株位于同一分支,而属于基因Ⅰ型的RH株和GT1株位于另一分支,这表明L358、PK1和c22-8基因能作为遗传标记区分刚地弓形虫虫株。
PCR-DNA测序是对生物遗传信息鉴定的标准,是研究弓形虫基因多态性的最精确的分子生物学的方法之一。Frazão-Teixeira等[17]采用PCR-RFLP和PCR-DNA测序法分析来源于猪的弓形虫分离株的基因,对两种方法进行对比研究,认为PCR-DNA测序法比PCR-RFLP方法更能有效地发现非典型等位基因,并且PCR-RFLP技术对于存在大量非典型等位基因的部分地区分离株很难做出准确的基因分型,而PCR-DNA测序法却能弥补PCR-RFLP技术的这一不足,能对含有较多非典型等位基因的弓形虫虫株做出准确分型。Binas等[18]对DNA聚合酶α基因的625 bp的内含子进行序列分析,进而鉴定10株属于两个不同世系的弓形虫虫株是有毒力的。
我国地域辽阔,动物种类繁多,但研究显示,流行于中国的弓形虫分离株具有有限的遗传多态性,且以Chinese 1型(ToxoDB#9)为其优势基因型[2,19-21]。本研究对从广东分离的环尾狐猴源弓形虫株采用PCR-DNA测序法进行基因型分析,结果显示其基因型为ToxoDB#3(表1),该基因型亦在分离自中国青海的绵羊、新疆维吾尔自治区的鸟类弓形虫中有过报道[22]。同时,Zhou等[23]应用PCR-RFLP分析17株来自中国不同地区不同宿主的弓形虫株基因型,结果显示,12株(70.6%)属于ToxoDB#3;Dubey等[24]报道的17株从广东分离到的猫源性弓形虫中,15株(88%)属于ToxoDB#3型谱系。这些数据表明我国弓形虫不仅有优势基因型Chinese 1型流行,ToxoDB#3也是中国大陆流行的主要世系之一。
基因型ToxoDB#3在斯里兰卡、哥伦比亚、越南和澳大利亚的狗源和猫源弓形虫分离株中亦有过报道,这表明它在亚洲、澳洲和南美也普遍流行[25-28]。本研究对广东环尾狐猴源弓形虫株进行基因分型,运用DNA序列分析法对10个遗传位点进行扩增和序列分析,结果发现感染广东环尾狐猴的弓形虫株基因型为ToxoDB#3型,进一步验证了我国弓形虫株优势基因型不仅有Chinese 1型,且ToxoDB#3也有广泛的分布。同时丰富了我国现有的弓形虫虫株基因库的数据,也为进一步探讨我国弓形虫生物学、流行病学、弓形虫病的诊断和疫苗的研究提供了理论依据。
[1] Switaj K,Master A,Skrzypczak M,et al.Recent trends in molecular diagnostics forToxoplasmagondiiinfections [J].Clinical Microbiology and Infection,2005,11(3):170-176.
[2] Chen Z W,Gao J M,Huo X X,et al.Genotyping ofToxoplasmagondiiisolates from cats in different geographic regions of China [J].Veterinary Parasitology,2011,183(1/2):166-170.
[3] 王林,沈继龙.刚地弓形虫基因型和与基因型相关的致病机制研究进展[J].中国寄生虫学与寄生虫病杂志,2013,31(4):319-324.
[4] 徐晓佩,刘文阁,张念章,等.刚地弓形虫GRA25基因的克隆及序列分析[J].中国畜牧兽医,2016,43(3):650-655.
[5] 袁恒青,徐前明,李培英.弓形虫529 bp基因的克隆及序列分析[J].畜牧与兽医,2012,44(11):60-63.
[6] Ajzenberg D,Banuls A L,Su C,et al.Genetic diversity,clonality and sexuality inToxoplasmagondii[J].International Journal for Parasitology,2004,34(10):1185-1196.
[7] Khan A,Fux B,Su C,et al.Recent transcontinental sweep ofToxoplasmagondiidriven by a single monomorphic chromosome [J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(37):14872-14877.
[8] Su C,Shwab E K,Zhou P,et al.Moving towards an integrated approach to molecular detection and identification ofToxoplasmagondii[J].Parasitology,2010,137(1):1-11.
[9] Burg J L,Grover C M,Pouletty P,et al.Direct and sensitive detection of a pathogenic protozoan,Toxoplasmagondii,by polymerase chain reaction [J].Journal of Clinical Microbiology,1989,27(8):1787-1792.
[10] 陈志强,程天印,王权,等.弓形虫上海株SAG2基因克隆和序列分析[J].中国兽医寄生虫病,2007,15(2):12-15.
[11] Sureau P,Raynaud J P,Lapeire C,et al.1st isolation ofToxoplasmagondiiin Madagascar.Spontaneous and experimental toxoplasmosis inLemurcatta[J].Bulletin de la Société de Pathologie Exotique et de Ses Filiales,1962,55(3):357-362.
[12] Dubey J P,Kramer L W,Weisbrode S E.Acute death associated withToxoplasmagondiiin ring-tailed lemurs [J].Journal of the American Veterinary Medical Association,1985,187(11):1272-1273.
[13] Spencer J A,Joiner K S,Hilton C D,et al.Disseminated toxoplasmosis in a captive ring-tailed lemur(Lemurcatta)[J].Journal of Parasitology,2004,90(4):904-906.
[14] Yabsley M J,Jordan C N,Mitchell S M,et al.Seroprevalence ofToxoplasmagondii,Sarcocystisneurona,andEncephalitozooncuniculiin three species of lemurs from St.Catherines Island,GA,USA [J].Veterinary Parasitology,2007,144(1/2):28-32.
[15] Ferreira I M R,Vidal J E,de Mattos C C B,et al.Toxoplasmagondiiisolates:multilocus RFLP-PCR genotyping from human patients in Sao Paulo State,Brazil identified distinct genotypes [J].Experimental Parasitology,2011,129(2):190-195.
[16] 王小波,许金俊,吴力力,等.猪源弓形虫YZ株的分离与鉴定[J].中国预防兽医学报,2013,35(11):940-942.
[17] Frazão-Teixeira E,Sundar N,Dubey J P,et al.Multi-locus DNA sequencing ofToxoplasmagondiiisolated from Brazilian pigs identifies genetically divergent strains [J].Veterinary Parasitology,2011,175(1/2):33-39.
[18] Binas M,Johnson A M.A polymorphism in a DNA polymerase alpha gene intron differentiates between murine virulent and avirulent strains ofToxoplasmagondii[J].International Journal for Parasitology,1998,28(7):1033-1040.
[19] Wang L,Chen H,Liu D,et al.Genotypes and mouse virulence ofToxoplasmagondiiisolates from animals and humans in China [J].PLoS One,2013,8(1):e53483.
[20] Wang H,Wang T,Luo Q,et al.Prevalence and genotypes ofToxoplasmagondiiin pork from retail meat stores in Eastern China [J].International Journal of Food Microbiology,2012,157(3):393-397.
[21] Jiang H H,Huang S Y,Zhou D H,et al.Genetic characterization ofToxoplasmagondiifrom pigs from different localities in China by PCR-RFLP [J].Parasites & vectors,2013,6(1):227.
[22] Huang S Y,Cong W,Zhou P,et al.First Report of Genotyping ofToxoplasmagondiiIsolates From Wild Birds in China [J].Journal of Parasitology,2012,98(3):681-682.
[23] Zhou P,Zhang H,Lin R Q,et al.Genetic characterization ofToxoplasmagondiiisolates from China [J].Parasitology International,2009,58(2):193-195.
[24] Dubey J P,Zhu X Q,Sundar N,et al.Genetic and biologic characterization ofToxoplasmagondiiisolates of cats from China [J].Veterinary Parasitology,2007,145(3/4):352-356.
[25] Dubey J P,Rajapakse R P V J,Wijesundera R R M K K,et al.Prevalence ofToxoplasmagondiiin dogs from Sri Lanka and genetic characterization of the parasite isolates [J].Veterinary Parasitology,2007,146(3/4):341-346.
[26] Dubey J P,Cortés-Vecino J A,Vargas-Duarte J J,et al.Prevalence ofToxoplasmagondiiin dogs from Colombia,South America and genetic characterization ofT.gondiiisolates [J].Veterinary Parasitology,2007,145(1/2):45-50.
[27] Dubey J P,Huong L T T,Sundar N,et al.Genetic characterization ofToxoplasmagondiiisolates in dogs from Vietnam suggests their South American origin [J].Veterinary Parasitology,2007,146(3/4):347-351.
[28] Brennan A,Donahoe S L,Beatty J A,et al.Comparison of genotypes ofToxoplasmagondiiin domestic cats from Australia with latent infection or clinical toxoplasmosis [J].Veterinary Parasitology,2016,228:13-16.
Toxoplasmagondii; Genotyping; Ring-tailed lemur (Lemurcatta)
为确定引起广东环尾狐猴(Lemurcatta)疑似弓形虫病的病原,从2只死亡的环尾狐猴体内无菌采集肺脏、肝脏、心、肾和脑等组织制作常规石蜡切片,HE染色。通过病理组织学观察,鉴定为弓形虫(Toxoplasmasp.)后,采用PCR-DNA测序分析方法对环尾狐猴源分离虫株(TgRTL1)的SAG1、SAG2、SAG3、BTUB、GRA6、L358、PK1、c22-8、c29-2和Apico基因位点进行PCR扩增、克隆和测序,采用DNAStar和MEGA5.05软件,将所获序列与网上下载的弓形虫RH株、ME49株和VEG株相应序列进行比对和同源性分析,并构建系统发育树。结果显示,从广东分离的环尾狐猴源弓形虫株,在10个遗传位点经PCR-DNA测序分析,确定该虫株的基因型为ToxoDB#3。本研究是对中国环尾狐猴源弓形虫采用多位点DNA序列分析进行基因型鉴定的首次报道,为进一步研究我国弓形虫流行病学、生物学特性以及弓形虫病的诊断提供了科学理论依据。
Multi-Locus Genotyping of the Toxoplasma gondii Isolated from Captive Ring-Tailed Lemur (Lemur catta)in China
Yang Fang1Li Kangxin1Xu Chunzhong2Shan Fen3Chen Wu3*Peng Shiming3Li Wanping3Li Guoqing1*
(1.South China Agricultural University,Guangzhou,510642,China;2.Shanghai Wild Animal Park Company Limited,Shanghai,201300,China;3.Guangzhou Zoo,Guangzhou,510070,China)
To determine the pathogen of a case suspected toxoplasmosis in lemurs in Guangdong,we sampled tissues of lung,liver,heart,kidney and brain from two dead ring-tailed lemurs and made routine paraffin sections for HE staining.After the pathogen was identified asToxoplasmaby pathological histology observation,10 genetic markers of theT.gondiistrain (TgRTL1),including 9 nuclear loci of SAG1,SAG2,SAG3,BTUB,GRA6,L358,PK1,c22-8,c29-2 and an apicoplast locus of Apico were amplified,cloned and sequenced.The nucleotide variations and sequence similarities amongT.gondiistrains were analyzed by software DNAStar and MEGA version 5.05,and a phylogenetic tree was constructed.The result indicated that theT.gondiiisolates fromLemurcattain Guangdong belong to the genotype of ToxoDB#3 according to 10 genetic markers.This study is the first report of genotyping of theT.gondiiisolates fromLemurcattain China by multi-locus DNA sequencing,and provides basis for research onT.gondiiepidemiology and its biological characteristics,and the diagnosis of toxoplasmosis in future.
杨芳,女,24岁,硕士研究生;主要从事兽医寄生虫研究。
*通讯作者:陈武,E-mail:guangzhouchenwu@sina.com;李国清,E-mail:gqLi@scau.edu.cn
2016-11-18
S852.73
A
修回日期:2016-12-06
发表日期:2017-05-10
2310-1490(2017)02-187-07
