丝氨酸吸收系统多基因敲除对大肠杆菌产L-丝氨酸的影响
2017-09-18,,,,,,*
,,,,, ,*
(1.石河子大学生命科学学院,新疆石河子 832000;2.中国科学院上海高等研究院,上海 201210)
丝氨酸吸收系统多基因敲除对大肠杆菌产L-丝氨酸的影响
石斌超1,2,崔云风1,王晨阳2,赵志军2,史吉平2,张霞1,*
(1.石河子大学生命科学学院,新疆石河子 832000;2.中国科学院上海高等研究院,上海 201210)
sstT、cycA、sdaC和tdcC是大肠杆菌L-丝氨酸的四个吸收基因,本文在前期吸收基因单基因敲除菌的基础上,系统研究了四个吸收基因不同组合敲除对菌株生长及L-丝氨酸生产的影响。摇瓶发酵结果表明,在11个多基因敲除突变菌中,sstT·sdaC双基因敲除菌,sstT·sdaC·tdcC和sstT·cycA·sdaC三基因敲除菌的L-丝氨酸产量与对照相比有明显提升,分别达到271.11、312.58和322.57 mg/L;sstT·cycA·sdaC·tdcC四基因敲除菌的L-丝氨酸产量最高,达到了450.58 mg/L,是对照菌的6倍。在菌株生长方面,双基因敲除菌和三基因敲除菌的生长量优于对照菌或者与对照菌相近,而四基因敲除菌的生长量与对照菌相比则下降了28%。
L-丝氨酸,吸收基因,菌株生长,产丝氨酸能力
L-丝氨酸是一种重要的非必需氨基酸,参与了多个关键的生物代谢进程,尤其是在细胞增殖、生长过程中发挥着重要的作用[1],此外,丝氨酸以其独特的生物学特性,在医药、食品、化妆品等领域得到了广泛应用。目前,L-丝氨酸的工业生产方法主要有蛋白水解法[2]、化学合成法[3]和酶转化法[4]等,而微生物直接发酵法具有环境友好、生产成本低、生产效率高等优点,其菌株育种研究受到研究者的广泛关注。谷氨酸棒杆菌和大肠杆菌是L-丝氨酸主要生产菌株。其中谷氨酸棒杆菌产量最高可达42.62 g/L[5]。而大肠杆菌产L-丝氨酸的研究起步较晚,工程改造主要集中在L-丝氨酸合成途径及降解途径。Mundhada等人在大肠杆菌MG1655基础上敲除三个L-丝氨酸脱氨酶编码基因sdaA、sdaB、tdcG以及丝氨酸羟甲基转移酶编码基因glyA,并过表达L-丝氨酸合成基因serAmut(突变serA,解除反馈抑制)、serB、serC,使L-丝氨酸产量达到8.3 g/L,在提高菌株对L-丝氨酸耐受性后,产量可达11.7 g/L[6]。本实验室前期在W3110基础上敲除基因sdaA并突变基因glyA得到菌株SWCH-05,在此基础上敲除L-丝氨酸吸收基因sdaC并过表达基因serAfbr(抗反馈抑制突体)、serB、serC和pgk后进行流加补料发酵,L-丝氨酸产量达到16.3 g/L[7]。
氨基酸转运系统,分为吸收系统和分泌系统两部分,对微生物生理代谢具有重要的调控作用[7-9]。氨基酸转运系统工程可以通过加速氨基酸的分泌或者减弱氨基酸的吸收从而达到高效积累目标氨基酸的目的。目前氨基酸转运系统改造已在多种氨基酸[10-13]的育种研究中取得成功。文献报道sstT、cycA、sdaC和tdcC是大肠杆菌中四个参与了L-丝氨酸吸收调控的基因。转运蛋白SstT是一种Na+偶联的L-丝氨酸和苏氨酸协同转运载体[14-15]。转运蛋白CycA最初发现是丙氨酸的主要转运子,但随后发现其也参与细胞对丝氨酸和甘氨酸的吸收[16-18]。转运蛋白SdaC和TdcC同属H+协同转运子家族:其中,SdaC是一种具有高度特异性的L-丝氨酸转运子,TdcC则也是一种苏氨酸-丝氨酸协同转运子[19-22]。
实验室前期构建了L-丝氨酸四个吸收基因sstT、cycA、sdaC和tdcC的单基因敲除菌,本研究在此基础上,进一步利用Red重组系统构建了四个L-丝氨酸吸收基因的组合突变菌,共计11个多基因敲除菌;将实验室前期构建的质粒pSC-05导入至敲除菌中,考察L-丝氨酸吸收基因不同组合敲除情况下,菌株的生长及发酵产L-丝氨酸的情况。
1 材料与方法
1.1材料与仪器
E.coliSWCH-05、E.coliW3110的sdaA敲除和glyA突变衍生菌 实验室保藏;菌株E.coliSWCH-51、E.coliSWCH-52、E.coliSWCH-53和E.coliSWCH-54 实验室前期以E.coliSWCH-05为出发菌株构建的sstT、cycA、sdaC和tdcC四个基因的单基因敲除菌;E.colipSC-05 实验室前期构建的携带丝氨酸合成关键基因serAfbr(抗反馈抑制突体)、serB、serC以及pgk的低拷贝质粒,以上菌株和质粒的具体特性见表1;蛋白胨、酵母粉及琼脂粉 购自Thermo Scientific;Primer STAR HS DNA Polymerase、Taq DNA Polymerase(Mix) 购自宝生物工程(大连)有限公司;DNA ladder Mix 购自Fementas;Kan抗生素 购自上海捷倍思基因技术有限公司;细菌基因组DNA小量制备试剂盒、质粒DNA小量制备试剂盒和清洁试剂盒 购自AxyPrep;工具质粒pKD13、pKD46和pCP20 购自美国耶鲁大学大肠杆菌菌株库(E.coliGenetic Stock Center,New Haven,USA);L-丝氨酸标准样品,L-甘氨酸标准样品及异硫氰酸苯酯(PITC) 购自Sigma;其他化学试剂 购自上海国药;常规试剂 采用分析纯;液相用乙酸钠 采用优级纯;甲醇及乙腈 采用色谱纯;LB培养基(1 L) 酵母粉5 g,蛋白胨10 g,NaCl 10 g;摇瓶培养基(1 L) 低聚麦芽糊精8 g,酵母粉4 g,蛋白胨2 g,尿素2 g,K2HPO415.07 g,(NH4)SO43 g,KH2PO41.82 g,MgSO4·7H2O 1.5 g,Na-Citrate·2H2O 0.6 g,NaCl 0.5 g,FeSO4·7H2O 0.035 g,CaCl2·2H2O 0.0085 g,1000×微量元素液0.75 mL;1000×微量元素液(1 L) H3BO325 g,MnCl2·4H2O 16 g,CoCl2·6H2O 7 g,ZnSO4·7H2O 3 g,CuSO4·5H2O 2.5 g,Na2MoO4·2H2O 1.5 g。
核酸电泳仪、凝胶成像系统、PCR仪以及电转仪 美国BIO-RAD公司;紫外分光光度计 德国Beckman公司;冷冻离心机和移液枪 德国Eppendorf公司;高效液相色谱仪 日本岛津公司。
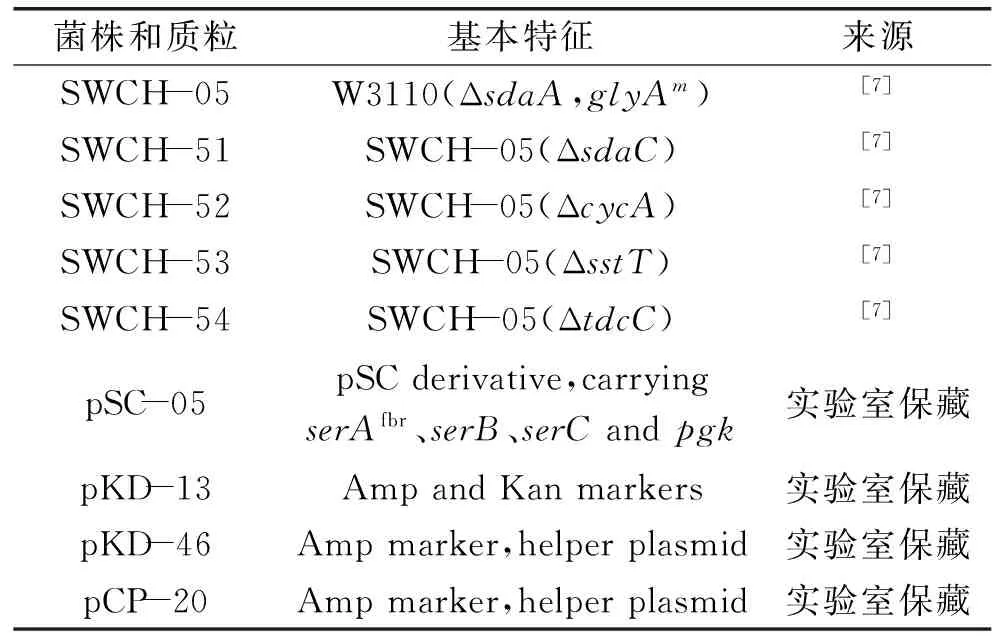
表1 实验菌株和质粒Table 1 Strains and plasmid in the experiment
1.2实验方法
1.2.1 引物设计 根据大肠杆菌W3110基因组序列设计四对敲除引物:sstT-p1 & p2,cycA-p1 & p2,sdaC-p1 & p2和tdcC-p1 & p2以及四对验证引物:sstT-v1 & v2,cycA-v1 & v2,sdaC-v1 & v2和tdcC-v1 & v2,K1 & K2为Kan基因内部序列,具体操作方法参照文献[7];引物合成由英潍捷基(上海)贸易有限公司合成;测序工作由苏州金唯智完成。
1.2.2 敲除菌的构建 本研究采用Red重组系统在sstT、cycA、sdaC和tdcC四个单基因敲除菌基础上进一步构建了11株组合敲除突变菌。具体操作方法参照文献[12]。
1.2.3 摇瓶发酵条件 从平板挑取敲除菌的单菌落接种至50 mL含有Kan抗生素的LB培养基中,35 ℃,200 r/min,培养12 h;按8%接种量(v/v)取4 mL LB培养液转接至50 mL含有Kan抗生素的摇瓶培养基中,35 ℃,200 r/min,预培养6 h;预培养结束后,将培养条件调整至38 ℃,200 r/min;摇瓶发酵实验开始后,每6 h取样一次,测定OD值及pH。
1.2.4 检测方法
1.2.4.1 菌体密度测定 采用紫外分光光度计检测,用600 nm处的吸光度OD600表示。
1.2.4.2 L-丝氨酸产量测定 采用高效液相色谱(HPLC)检测,样品预处理采用异硫氰酸苯酯柱前衍生法,具体方法参照文献[23]。

表2 实验引物Table 2 Primers used in the experiment
注:下划线表示用于同源重组的同源臂。
高效液相色谱分析条件:色谱柱为Agilent Extend C18(250 nm×4.6 nm,5 μm)。流动相为A 0.05 mol/L乙酸钠(pH:6.50±0.5)和B甲醇∶乙腈∶水(20∶60∶20)。流速为0.8 mL/min。进样体积10 μL,柱温箱温度为45 ℃。
L-丝氨酸标准曲线的绘制:准确称取L-丝氨酸标品5.25 g溶于1 L容量瓶中,加蒸馏水定容,得到浓度为0.05 mol/L的L-丝氨酸标准母液。利用该母液加蒸馏水稀释,得到浓度分别为0.001、0.002、0.004、0.008、0.02、0.03和0.04 mol/L的L-丝氨酸标准溶液。采用异硫氰酸苯酯柱前衍生法处理后进行HPLC检测,以标准溶液浓度为横坐标,峰面积为纵坐标,绘制标准曲线。最终标准曲线为y=2128648382.27x-14834.45,R2=0.99。
1.3数据处理
实验中每个处理重复三次,采用SPSS 17.0软件进行数据的显著性分析,应用Origin 7.0软件作图。
2 结果与分析
2.1双基因敲除菌的构建
sstT·cycA双基因敲除菌SWCH-61和sstT·sdaC双基因敲除菌SWCH-62是在sstT单基因敲除菌SWCH-53的基础上分别敲除基因cycA和sdaC得到的,sstT·tdcC双基因敲除菌SWCH-63和cycA·tdcC双基因敲除菌SWCH-65是在tdcC单基因敲除菌SWCH-54的基础上分别敲除基因sstT和cycA得到的,cycA·sdaC双基因敲除菌SWCH-64和sdaC·tdcC双基因敲除菌SWCH-66则是在sdaC单基因敲除菌SWCH-51的基础上分别敲除基因cycA和tdcC得到,构建流程如图1所示,DNA琼脂糖凝胶电泳验证图谱如图2所示。测序验证正确后,则成功构建了sstT·cycA双基因敲除菌SWCH-61、sstT·sdaC双基因敲除菌SWCH-62、sstT·tdcC双基因敲除菌SWCH-63、cycA·sdaC双基因敲除菌SWCH-64、cycA·tdcC双基因敲除菌SWCH-65和sdaC·tdcC双基因敲除菌SWCH-66,菌株特征如表3所示。
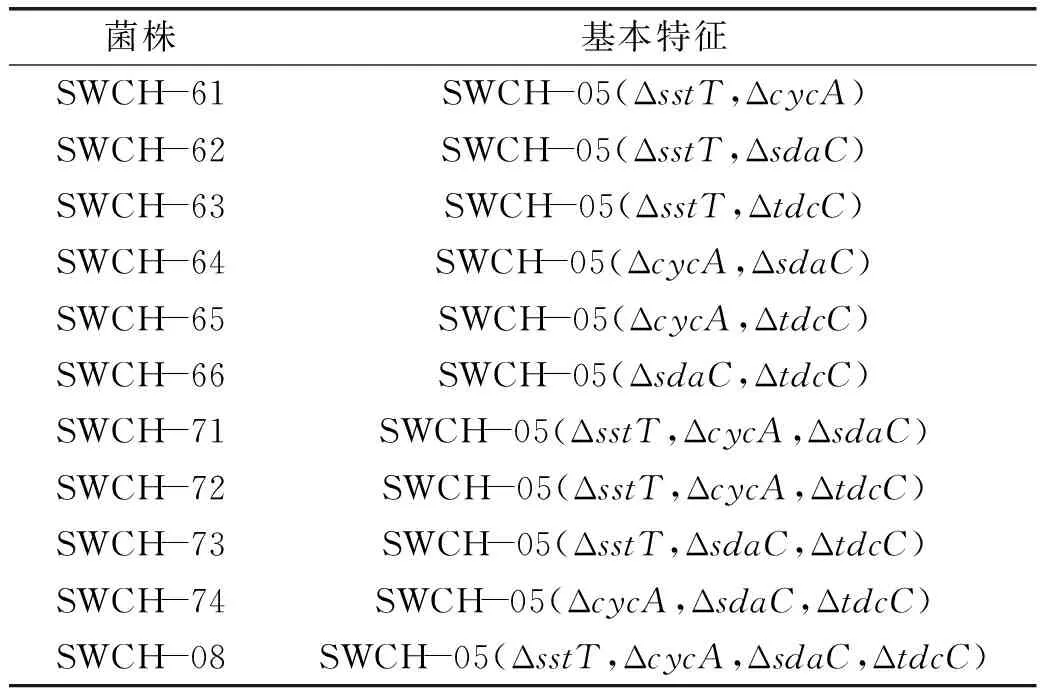
表3 实验构建菌株Table 3 Strains constructed in the experiment
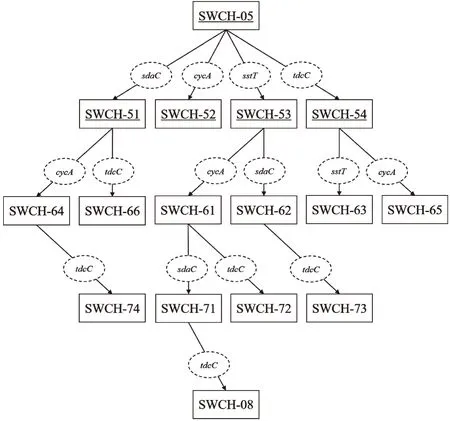
图1 多基因敲除菌的构建流程Fig.1 Construction process of multi-gene deletion mutants注:实线矩形代表实验菌株,其中带有下划线的菌株为实验室前期构建所得,未带有下划线的菌株为本实验构建所得;虚线椭圆代表被敲除的L-丝氨酸吸收基因。
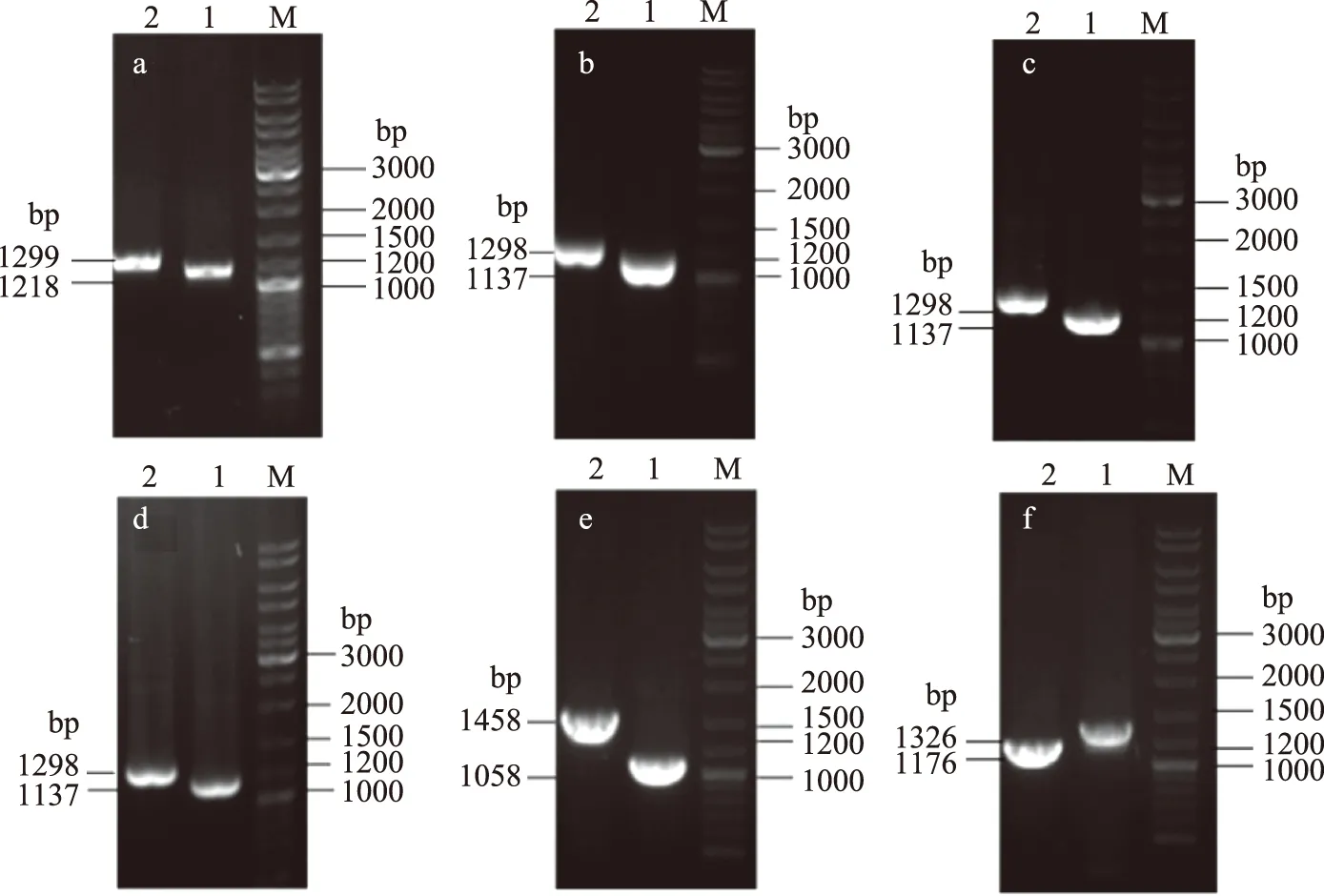
图2 吸收基因sstT、cycA、sdaC和tdcC同源重组的PCR验证Fig.2 PCR test of homologous recombination about uptake genes sstT,cycA,sdaC and tdcC注:a为SWCH-62,其中1:sdaC-v1 & K1,2:sdaC-v2 & K2;b为SWCH-64,其中1:cycA-v1 & K1,2:cycA-v2 & K2;c为 SWCH-61,其中1:cycA-v1 & K1,2:cycA-v2 & K2;d为SWCH-65,其中1:cycA-v1 & K1,2:cycA-v2 & K2;e为SWCH-63,其中1:sstT-v1 & K1,2:sstT-v2 & K2;f为SWCH-66,其中1:tdcC-v1 & K2,2:tdcC-v2 & K1。
2.2三基因及四基因敲除菌的构建
sstT·cycA·sdaC三基因敲除菌SWCH-71是在sstT·cycA双基因敲除菌SWCH-61基础上敲除吸收基因sdaC获得;sstT·cycA·tdcC三基因敲除菌SWCH-72、sstT·sdaC·tdcC三基因敲除菌SWCH-73和cycA·sdaC·tdcC三基因敲除菌SWCH-74是分别在sstT·cycA双基因敲除菌SWCH-61、sstT·sdaC双基因敲除菌SWCH-62和cycA·sdaC双基因敲除菌SWCH-64基础上敲除吸收基因tdcC获得;sstT·cycA·sdaC·tdcC四基因敲除菌则是在sstT·cycA·sdaC三基因敲除菌SWCH-71基础上敲除吸收基因tdcC得到,构建流程如图1所示,DNA琼脂糖凝胶电泳验证图谱如图3所示。测序验证正确后,就分别成功构成了sstT·cycA·sdaC三基因敲除菌SWCH-71、sstT·cycA·tdcC三基因敲除菌SWCH-72、sstT·sdaC·tdcC三基因敲除菌SWCH-73、cycA·sdaC·tdcC三基因敲除菌SWCH-74及sstT·cycA·sdaC·tdcC四基因敲除菌SWCH-08,菌株特征如表3所示。
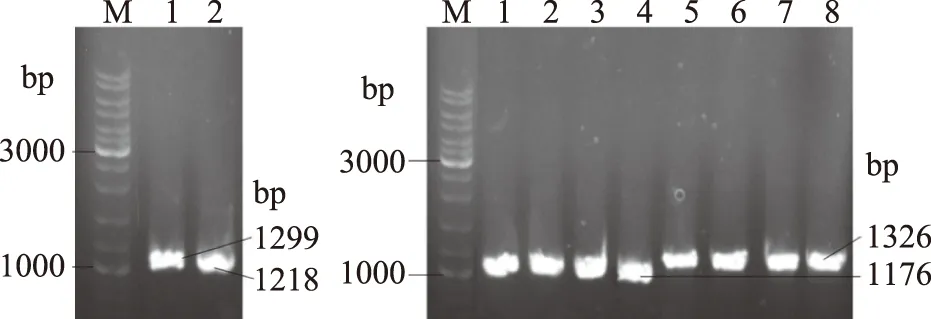
图3 吸收基因sdaC和tdcC同源重组的PCR验证Fig.3 PCR test of homologous recombination about uptake genes sdaC and tdcC注:A为SWCH-71,其中1:sdaC-v2 & K2,2:sdaC-v1 & K1;B为SWCH-72(1和5),SWCH-73(2和6)、SWCH-74(3和7)和SWCH-08(4和8),1、2、3、4:tdcC-v2 & K1,5、6、7、8:tdcC-v1 & K2。
2.3双基因敲除菌的摇瓶发酵
实验室前期以SWCH-05为出发菌株构建了L-丝氨酸吸收基因sstT、cycA、sdaC和tdcC的单基因敲除菌,研究发现sdaC基因敲除菌在发酵罐分批补料实验中L-丝氨酸产量最高,达到16.3 g/L[7];与发酵罐发酵结果类似,在单基因敲除菌的摇瓶发酵实验中,sdaC单基因敲除菌的L-丝氨酸产量为105.07 mg/L,同样是四个单基因敲除菌中L-丝氨酸产量最高的。
在单基因敲除菌基础上进一步构建双基因敲除菌,并将质粒pSC-05导入到双基因敲除菌中。在双基因敲除菌摇瓶发酵实验中发现:sstT·sdaC双基因敲除菌株SWCH-62/pSC-05的L-丝氨酸产量达到271.11 mg/L,是对照菌SWCH-05/pSC-05(74.98 mg/L)的3.6倍,而其他5株双基因敲除菌的L-丝氨酸产量很低,仅为10 mg/L左右。菌株SWCH-62的现象说明基因sstT和sdaC的敲除组合在菌株L-丝氨酸产量提升方面作用明显;但同样作为敲除基因sdaC的菌株SWCH-64/pSC-05和SWCH-66/pSC-05其产量却仅为6.64和7.68 mg/L,说明基因sdaC的L-丝氨酸吸收作用受其它三个吸收基因的影响不同(如图4)。在菌株生长方面,除sstT·sdaC双基因敲除菌SWCH-62/pSC-05(OD600=5.73)的生长与对照菌(OD600=6.28)相近外,其他双基因敲除菌的生长都明显优于对照菌(如图5)。
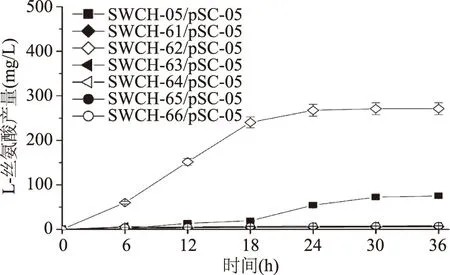
图4 L-丝氨酸双基因敲除菌产L-丝氨酸情况Fig.4 The L-serine yield of double-gene deletion mutants
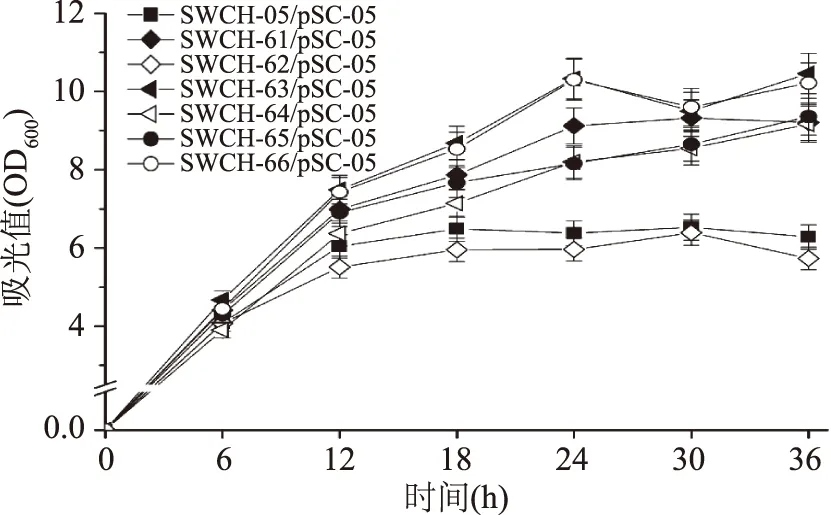
图5 L-丝氨酸双基因敲除菌生长情况Fig.5 The cell growth of double-gene deletion mutants
2.4三基因敲除菌的摇瓶发酵
在三基因敲除菌中导入表达质粒pSC-05后,进行摇瓶发酵实验。从三基因敲除菌产L-丝氨酸的情况可以发现:sstT·cycA·sdaC三基因敲除菌SWCH-71/pSC-05和sstT·sdaC·tdcC三基因敲除菌SWCH-73/pSC-05的L-丝氨酸产量分别达到322.57 mg/L和312.58 mg/L,是对照菌SWCH-05/pSC-05的4.3和4.2倍,而其他2株三基因敲除菌的L-丝氨酸产量均不超过5 mg/L。这种现象说明基因sstT和sdaC的敲除组合确实有利于菌株L-丝氨酸产量提高(如图6)。从菌株生长方面看,三基因敲除菌的生长状态普遍与对照菌相似,但菌体OD总体略低(如图7)。
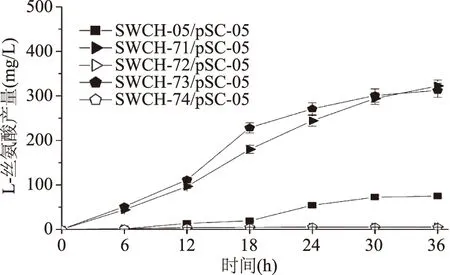
图6 L-丝氨酸三基因敲除菌产L-丝氨酸情况Fig.6 The L-serine yield of triple-gene deletion mutants
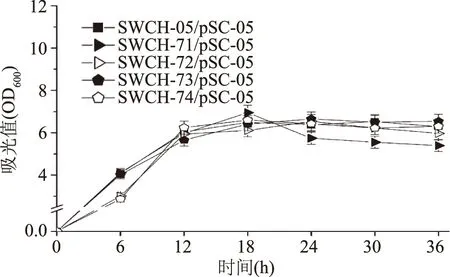
图7 L-丝氨酸三基因敲除菌生长情况Fig.7 The cell growth of triple-gene deletion mutants
2.5四基因敲除菌的摇瓶发酵
sstT·cycA·sdaC·tdcC四基因敲除菌SWCH-08/pSC-05的L-丝氨酸产量是所有敲除菌中最高的,达到450.58 mg/L,是对照菌SWCH-05/pSC-05(74.98 mg/L)的6倍(如图8);但其菌株生长同样是所有敲除菌中最低的,OD600仅为4.52,与对照菌(OD600=6.28)相比,下降28%(如图9)。四基因敲除菌L-丝氨酸产量的大幅提升说明当所有L-丝氨酸吸收基因被全部敲除后,对菌株产L-丝氨酸的促进作用明显,但同时也会对菌株生长产生不利影响。
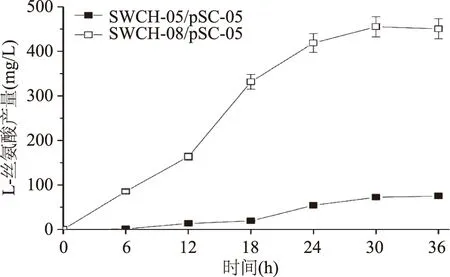
图8 L-丝氨酸四基因敲除菌产L-丝氨酸情况Fig.8 The L-serine yield of quadruple-gene deletion mutants

图9 L-丝氨酸四基因敲除菌生长情况Fig.9 The cell growth of quadruple-gene deletion mutants
3 结论与讨论
本文首次系统考察了不同组合敲除L-丝氨酸四个吸收基因sstT、cycA、sdaC和tdcC,对菌株产L-丝氨酸和生长的影响。在11个组合敲除突变菌中,sstT·sdaC双基因敲除菌,sstT·cycA·sdaC和sstT·sdaC·tdcC两个三基因敲除菌以及sstT·cycA·sdaC·tdcC四基因敲除菌的L-丝氨酸产量均明显高于对照菌,可见敲除多个L-丝氨酸吸收基因确实可以提升菌株产L-丝氨酸的能力;其次,上述三个敲除突变菌的基因组上均具有sstT·sdaC双基因缺失特征,可见吸收基因sdaC和sstT在细胞调控L-丝氨酸吸收方面起主要作用;但值得注意的是,一些吸收基因敲除后,菌体L-丝氨酸的产量反而出现了下降,但当四个吸收基因均被敲除后,菌体L-丝氨酸产量又是最高的,这说明四个吸收基因之间可能存在一定的相互作用。在菌株生长方面,当四个吸收基因均被敲除后,菌体的生长受到明显抑制,这可能是由于菌体L-丝氨酸吸收基因全部被敲除后,培养液中的L-丝氨酸已经无法转移至胞内供给菌体生长所致。
[1]M Yang,Vousden K H. Serine and one-carbon metabolism in cancer[J]. Nature Reviews Cancer,2016,16(10):650-662.
[2]G Y Zhu,Zhu X,Wan X L,et al. Hydrolysis technology and kinetics of poultry waste to produce amino acids in subcritical water[J]. Journal of Analytical and Applied Pyrolysis,2010,88(2):187-191.
[3]F Effenberger,Zoller G. Investigations on the synthesis of DL-serine fromα-haloacrylic acid derivatives(Aminoacid;13)[J]. Tetrahedron,1988,44(17):5573-5582.
[4]W Jiang,Xia B,Liu Z. A serine hydroxymethyltransferase from marine bacterium Shewanella algae:Isolation,purification,characterization and l-serine production[J]. Microbiological Research,2013,168(8):477-484.
[5]Q J Zhu,Zhang X M,Luo Y C,et al. L-Serine overproduction with minimization of by-product synthesis by engineered Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology,2015,99(4):1665-1673.
[6]H Mundhada,Schneider K,Christensen H B,et al. Engineering of High Yield Production of L-Serine inEscherichiacoli[J]. Biotechnology and Bioengineering,2016,113(4):807-816.
[7]崔云风,石斌超,李晶,等. 大肠杆菌丝氨酸转运系统单基因敲除对丝氨酸生产的影响[J]. 食品工业科技,2016,37(14):191-195.
[8]K Marin,Kramer R. Amino acid transport systems in biotechnologically relevant bacteria[J]. Microbiol Monogr,2007,5:290-325.
[9]Y Liu,Wang H,Shi J P,et al. Research progress on metabolic engineering for microbial production of L-serine[J]. Biotechnology Bulletin,2015,31(8):44-49.
[10]K H Lee,Park J H,Kim T Y. Systems metabolic engineering ofEscherichiacolifor L-threonine production[J]. Molecular Systems Biology,2007,3(1):149.
[11]Q Liu,Cheng Y S,Xie X X,et al. Modification of tryptophan transport system and its impact on production of L-tryptophan inEscherichiacoli[J]. BIoresource Technology,2012,114:549-554.
[12]Z J Zhao,Chen S,Wu D,et al. Effect of gene knockouts of l-tryptophan uptake system on the production of l-tryptophan inEscherichiacoli[J]. Process Biochemistry,2012,47:340-344.
[13]J H Park,Lee K H,Kim T Y,et al. Metabolic engineering ofEscherichiacolifor the production of L-valine based on transcriptome analysis and in silico gene knockout simulation[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(19):7797-7802.
[14]W Ogawa,Kayahara T,Tsuda M,et al. Isolation and characterization of anEscherichiacolimutant lacking the major serine transporter and cloning of a serine transporter gene[J]. Biochemical Journal,1997,122(6):1241-1245.
[15]W Ogawa,Kim Y M,Mizushima T,et al. Cloning and Expression of the Gene for the Na+-Coupled Serine Transporter fromEscherichiacoliand Characteristics of the Transporter[J]. Journal of Bacteriology,1998,180(24):6749-6752.
[16]S D Cosloy. D-serine transport system inEscherichiacoliK-12[J]. Journal of Bacteriology,1973,114:679-684.
[17]F Schneider,Kramer R,Burkovski A. Identification and characterization of the main beta-alanine uptake system inEscherichiacoli[J]. Applied Microbiology and Biotechnology,2004,65(5):576-582.
[18]R J Wargel,Shadur C A,Neyhaus F C. Mechanism of D-cycloserine action:transport systems for D-alanine,D-cycloserine,L-alanine,and glycine[J]. Journal of Bacteriology,1970,103:778-788.
[19]H Hama,Shimamoto T,Tsuda M,et al. Properties of a Na+-coupled serine-threnine transport system inEscherichiacoli[J]. Biochim Biophys Acta,1987,905:231-239.
[20]H Hama,Shimamoto T,Tsuda M,et al. Characterization of a novel I-serine transport system inEscherichiacoli[J]. Journal of Bacteriology,1988,170(5):2236-2239.
[21]Z Q Shao,Lin R T,Newman E B. Sequencing and characterization of thesdaCgene and identification of thesdaCBoperon inEscherichiacoliK1[J]. Eur J Biochem,1994,222:901-907.
[22]V N Sumantran,Schweizer H P,Datta P. A Novel Membrane-Associated Threonine Permease Encoded by thetdcCGene ofEscherichiacoli[J]. Journal of Bacteriology,1990,172(8):4288-4294.
[23]Q Chen,Wang Q,Wei G,et al. Production inEscherichiacoliof poly(3-hydroxybutyrate-co-3-hydroxyvalerate)with differing monomer compositions from unrelated carbon sources[J]. Applied and Environmental Microbiology,2011,77(14):4886-4893.
Effectofmulti-geneknockoutofL-serineuptakesystemonL-serineproductioninEscherichiacoli
SHIBin-chao1,2,CUIYun-feng1,WANGChen-yang2,ZHAOZhi-jun2,SHIJi-ping2,ZHANGXia1,*
(1.College of Life Science,Shihezi University,Shihezi 832000,China; 2.Shanghai Advanced Research Institute of Chinese Academy of Sciences,Shanghai 201210,China)
Four genes have been reported to be involved in serine uptake inEscherichiacoli,which weresstT,cycA,sdaCandtdcC. In this study,combinatorial deletion of these genes was performed and effects on L-serine production and strain growth were investigated. The result revealed that,in all 11 multi-gene deletion mutants,sstT·sdaCdouble-gene deletion mutant,sstT·sdaC·tdcCandsstT·cycA·sdaCtriple-gene deletion mutants had higher L-serine production than the original strain and their L-serine production were 271.11,312.58 and 322.57 mg/L,respectively. Besides,thesstT·cycA·sdaC·tdcCquadruple-gene deletion mutant achieved the highest L-serine production of 450.58 mg/L,which was 6-fold when compared to that of the original strain. In addition,the cell growth of double-and triple-gene deletion mutants were similar or above to that of the original strain. But the cell growth of the quadruple-gene deletion mutant decreased remarkably,whose OD600was 28% lower than that of the original strain.
L-serine;uptake genes;strains growth;ability to produce L-serine
2017-02-27
石斌超(1991-),男,硕士研究生,研究方向:代谢工程,E-mail:shibc@sari.ac.cn。
*通讯作者:张霞(1964-),女,大学本科,教授,研究方向:植物资源与遗传,E-mail:xiazh@shzu.edu.cn。
国家自然科学基金青年科学基金项目(31300048)。
TS201.3
:A
:1002-0306(2017)16-0106-07
10.13386/j.issn1002-0306.2017.16.021
