持续寡照对冬季日光温室黄瓜生长及抗氧化酶活性的影响*
2017-09-16刁家敏薛晓萍吕学梅张继波
熊 宇,刁家敏,薛晓萍,吕学梅,张继波
持续寡照对冬季日光温室黄瓜生长及抗氧化酶活性的影响*
熊 宇1,刁家敏1,薛晓萍2**,吕学梅3,张继波2
(1.南京信息工程大学气象灾害预报预警与评估协同创新中心,南京 210044;2.山东省气候中心,济南 250031;3.临沂市气象局,临沂 276000)
选取黄瓜品种‘德瑞特L108’(L. cv.)为试材,在日光温室中利用遮阳网设计不同寡照(PAR<200µmol·m-2·s-1)持续日数(1、3、5、7、9d)及正常光照条件下的恢复试验,观测黄瓜植株的生长指标以及叶片中抗氧化酶活性的变化。结果表明:(1)持续寡照使黄瓜叶片SPAD(相对叶绿素)值增加,净光合速率下降,持续寡照日数越长,黄瓜叶片净光合速率越小,光合恢复能力越差。(2)寡照7d以上对黄瓜植株的形态指标影响显著,株高、茎粗及单株叶面积均低于CK,且经过9d正常光照恢复后,以上指标均无法恢复到正常水平;且持续寡照使黄瓜果实产量和商品性均下降。(3)寡照胁迫下黄瓜叶片中SOD(超氧化物歧化酶)、POD(过氧化物酶)活性增加,CAT(过氧化氢酶)活性先增加后减小,MDA(丙二醛)含量持续增加,持续寡照日数越长,黄瓜叶片受膜脂过氧化损伤越严重,持续寡照7d以上,黄瓜叶片代谢功能难以恢复至正常水平。
寡照;日光温室;黄瓜;形态指标;产量;酶活性
黄瓜(L.)是中国设施栽培面积最大的蔬菜种类,属葫芦科甜瓜属,喜温喜湿,忌高温,且对光照强度有较高要求[1-2]。黄瓜的营养价值、保健功能、美容功能等越来越受到人们的重视[3],在设施蔬菜生产中占有重要地位[4]。长期观测表明,雪、雾、霾造成的寡照已经成为设施黄瓜生产中最为主要的气象灾害,常导致日光温室内温度难以回升,设施作物受到伤害。随着霾日发生频率的增加,寡照将进一步严重威胁设施农业的可持续发展[5-7]。
叶片是植株主要的感光器官,也是对光照敏感的部位,弱光可直接影响叶片的发育和光形态建成,导致叶片光合能力下降[8-10]。近年来,关于设施环境对黄瓜光合及生理生态特性的影响已有一定报道,目前研究结论较一致,均认为弱光使作物净光合速率下降,从而影响干物质的形成。Ody[11]研究发现弱光使植物净光合速率下降,下降幅度受温度、CO2浓度和相对湿度等其它环境因素的影响;还有研究认为,弱光低温不仅影响PSI的活性,PSII的活性也会受到影响[12-13]。钱芝龙等[14]对辣椒幼苗活性氧代谢变化的研究表明,一定范围内,逆境胁迫会使叶片中抗氧化酶活性升高,从而达到清除过量活性氧自由基的目的。国内许多学者也认识到弱光逆境已成为日光温室生产中最普遍的限制因素,其与低温相伴,给设施农业生产带来严重危害,针对弱光低温对作物影响的研究报道已取得不少成果。陈青君等[15]利用人工气候箱对黄瓜苗期叶绿素含量、叶面积、光合及酶活性变化进行研究,认为光照强度对黄瓜的生长起主导作用;艾希珍等[16-19]研究表明弱光亚适温胁迫下黄瓜植株生长速度明显减慢,叶片受胁迫后光合功能7d内可基本恢复正常。马德华等[20]在黄瓜上的研究表明,黄瓜在弱光环境下POD活性明显增强,MDA含量均有不同程度的提高,酶带数量明显增加;杨广东等[21]研究认为,黄瓜植株在弱光环境下超氧自由基产生速率、H2O2和MDA含量降低。周艳虹等[22]以设施栽培黄瓜“津春3号”为试材,发现低温弱光处理过程中SOD和POD活性上升,在恢复过程中抗氧化酶的活性均能恢复至对照水平;POD活性在弱光处理5d后迅速上升,恢复期间下降,MDA持续积累。相关研究说明叶片膜保护酶的活性对于引发植物体内膜脂过氧化的逆境胁迫的反应很灵敏。
针对某一气象灾害如低温、寡照对设施农业的影响,以往相关研究主要集中在对温室内蔬菜生长发育的影响。对于黄瓜,更多的是开展了苗期叶片光合作用和叶绿素荧光特性等参数的影响研究,而就花果期遭遇连续寡照对黄瓜的生长和产量的影响鲜有研究报道。实际生产中,温室外气象条件是通过影响温室内的光合有效辐射和温度,从而影响黄瓜的光合作用、器官干物质积累与分配以及产量品质形成。同时,由于气象条件对温室内小气候的影响具有一定的滞后性,前期温室内外的气象因子对其亦存在一定的制约作用。国内外相关研究主要集中在利用人工气候箱研究恒定光强对盆栽苗期黄瓜生理特性的影响,试验环境与实际温室环境有一定差距,试验结果的应用受到限制。为此,本研究利用遮阳网在日光温室中模拟持续寡照环境,在黄瓜花果期进行试验,研究持续寡照对日光温室黄瓜生长及抗氧化酶活性的影响,以期为黄瓜温室栽培环境管理提供理论参考。
1 材料与方法
1.1 试验设计
试验于2015年12月-2016年5月在山东省临沂市设施农业气象试验站日光温室内进行。温室顶高4.6m,宽10.0m,长68.0m,温室覆盖棚膜为聚乙烯无滴膜,膜厚0.6mm,透光率为75%。黄瓜品种为“德瑞特L108”。2015年12月25日,选取长势茁壮且一致的黄瓜幼苗定植,垄宽95cm,走道80cm,行距50cm,株距31cm,种植密度为4.42株·m-2,定植缓苗后覆盖地膜,田间管理按高产栽培要求进行。试验前期观测表明,阴雨(雪)天气时日光温室内光合有效辐射为100~200µmol·m-2·s-1,因此,试验时用遮阳网覆盖(阴雨天气不遮,多云天气遮一层,晴天遮两层),模拟连续阴天寡照环境,使温室内光合有效辐射保持在200µmol·m-2·s-1以下。于黄瓜花果期(2016年2月20日),在温室中设置6个小区,每个处理5垄,设置6个连续寡照日数处理:0、1、3、5、7、9d,分别以CK、T1、T3、T5、T7、T9表示,寡照处理结束后继续于温室内进行正常光照恢复试验,恢复期为9d,试验时间持续一个月,测定黄瓜植株的月产量。试验前期进行的预实验结果与前人研究结果[23]表明,短期遮阴(<7d)对设施作物的影响在恢复正常光照条件后能迅速恢复,一周内基本能够恢复到正常水平,因此试验对恢复后的处理不再取样测定指标。进行寡照处理期间温室内及时通风,保证温室内温度不高于28℃。
1.2 项目测定与方法
1.2.1 气象数据测定
日光温室内气象数据由数据采集器(WatchDog 2000,USA)自动采集,采集内容包括1.5m处空气温度和冠层相对湿度。采集频率为每10s 1次,存储每30min的平均值。
2016年试验期间日光温室外部日平均温度和空气相对湿度变化如图1所示,日光温室内部日平均温度和空气相对湿度变化如图2所示。
处理当天(2016年2月20日)至恢复期结束(2016年3月9日)用手持式数字照度计(Lux Meter AR813A,HK)测量各处理的光照强度,挂好遮阳网当天和每次取样当日10:00-11:00(揭网后)进行。2016年2月20日-3月9日室外及各处理冠层光照强度日变化情况见图3。
注:试验共设置5个寡照处理,T1、T3、T5、T7 和T9分别为持续1、3、5、7、9天的寡照,CK为正常光照下的处理
Note: T1,T3,T5,T7 and T9 is low irradiation treatments inside greenhouse for 1 day, 3 days, 5 days, 7days and 9 days, respectively. CK is normal irradiation
1.2.2 叶片光合参数的测定
(1)净光合速率
利用LI-6400便携式光合作用测定系统(LI-COR Biosciences Inc.,USA)在寡照处理结束当日9:00-11:00,对叶片净光合速率(Pn,μmol·m-2·s-1)进行测量,进入恢复期后隔一天测量一次,每个处理选择长势均匀的植株重复测定3次,取平均值。
(2)叶绿素
利用SPAD-502型叶绿素计(Soil and Plant Analyzer Development,Japan)在9:00-11:00测定不同叶位叶片的SPAD值,与光合速率同时进行测定,每个处理随机选择3株长势均匀的植株,每个植株分别测定从上往下数第3-5片展开叶,每片叶测定6次,取平均值。
1.2.3 形态指标及产量测定
每个处理随机选定3株长势均匀的黄瓜植株进行破坏性取样,分别使用精度为1cm米尺测定样本植株的株高,用精度为1mm量程为30cm的刻度尺测量叶长和叶宽,用精度为0.02mm游标卡尺测定茎粗。
叶长:黄瓜叶片主脉的长度。
叶宽:黄瓜叶片垂直于主脉最宽处的长度。
测产按照农业气象观测规范标准,每个处理选定10株黄瓜挂牌定株采收,每隔3d采收一次,记录单果重、单株果实数、次果数、病果数、果实纵径、果实横径等产量结构项目。
1.2.4 抗氧化酶活性测定
(1)酶液的配制
每个处理随机选取长势相当的黄瓜植株采集3片功能叶片迅速于液氮中冷冻后置于冰箱冷冻层中保存。测定时称取0.4g鲜样,加入磷酸缓冲液(0.05mol·L-1,pH=7.8)冰浴研磨,于0℃冷冻离心20min(10500rpm),冷藏保存。
(2)SOD活性的测定
SOD的测定参考李合生的氮蓝四唑(NBT)法于分光光度计560nm下比色[24]。SOD酶活性(units·g-1FW)的计算式为
式中,W为样重(g),V为样液总体积(mL),Vt为测定时酶液用量(mL),ACK为对照管的吸光度,AE为样品管的吸光度。
(3)POD活性的测定
POD的测定参考李合生的愈创木酚法于分光光度计中470nm下比色,POD酶活性(△OD470·min-1·g-1FW)的计算式为
式中,A为样品管的吸光度值,W为鲜样重(g),V为样液总体积(mL),Vt为测定时酶液用量(mL),t为反应时间。
(4)CAT活性的测定
CAT活性(△OD240·min-1·g-1FW)的测定参考李合生的方法于分光光度计中240nm下比色,CAT酶活性的计算式为
式中,A 为样品管的吸光度值,W为鲜样重(g),V为样液总体积(mL),Vt为测定时酶液用量(mL),t为反应时间。
(5)MDA活性的测定
MDA活性(µmol·g-1FW)的测定参考李合生的硫代巴比妥酸比色法在600、532、450nm共3个波长下比色[22]。
式中,A600、A532和A450分别为样品在600nm、532nm和450nm处的吸光度值,W为鲜样重(g),V为样液总体积(mL)。
(6)可溶性蛋白含量的测定
可溶性蛋白含量采用考马斯亮蓝-250法测定。
1.3 数据处理
采用Microsoft Excel 2007及SPSS 20.0软件进行统计分析与图表绘制。
2 结果与分析
2.1 持续寡照对温室黄瓜叶片光合参数的影响
由图4a可见,未经寡照的处理(CK),整个分析时段内叶片绿度值(SPAD值)一直处于相对较低的水平,保持在42.9~44.0范围内,而持续寡照结束后第1天,除T1处理外,黄瓜叶片SPAD值均明显高于CK,且持续时间越长数值越高,说明寡照处理3~9d会使叶片SPAD值升高。从各寡照处理结束后恢复时段内叶片绿度值的变化曲线可见,恢复的第2天均有明显峰值且经历寡照时间越长反弹的峰值越高,T9处理的峰值最大,与CK相比增加了9.5%;从第3天开始,SPAD值逐渐降低,至第3-9天(T1恢复3d、T3恢复5d、T5-T9恢复9d)达到与CK一致的水平。可见,持续寡照在短时间内会明显提高叶片绿度值。不同日数寡照处理结束后,恢复时段内,除T1处理恢复的3d内、T3处理恢复的第3、4天外,其它恢复日所测叶片绿度值均明显高于CK;而且寡照处理时间越长、恢复期内叶片绿度值越高,T9处理中黄瓜叶片SPAD值增加最多。
由图4b可见,整个分析时段内CK的叶片净光合速率(Pn)一直处于相对较高的水平,保持在18.8~22.2μmol·m-2·s-1范围内,随着持续寡照日数的增加黄瓜叶片的净光合速率逐渐下降。寡照1d对叶片净光合速率的影响较小,寡照处理结束后黄瓜叶片的净光合速率下降1.0%;寡照9d黄瓜叶片的净光合速率为15.21μmol·m-2·s-1,比CK低28.6%,说明寡照处理3d以上会使叶片净光合速率下降。从各寡照处理结束后恢复时段内叶片净光合速率的变化曲线可见,恢复正常光照后,T3、T5、T7和T9处理的黄瓜叶片净光合速率均逐渐增大,且经历寡照持续时间越短,上升曲线越平缓。T3处理恢复5d、T5处理恢复9d后叶片净光合速率均能达到CK水平。T7和T9处理恢复9d后黄瓜叶片的净光合速率仍未恢复至CK水平,与CK相比分别低23.5%和28.6%。
注:短线表示均方差,下同
Note:The bar is MSE.The same as below
2.2 持续寡照对温室黄瓜形态指标的影响
从图5可以看出,整个分析时段内,各处理黄瓜的株高和茎粗持续增加,且各寡照处理株高和茎粗均低于CK。持续寡照1~5d,黄瓜的株高和茎粗与CK 相比,差异均不显著;持续寡照7d,黄瓜的株高、茎粗分别比CK低8.1%、11.9%,而持续寡照9d,黄瓜的株高、茎粗分别比CK低9.6%、21.4%。可见,7d 以上持续寡照会使黄瓜植株的株高和茎粗生长减缓。寡照处理结束后的恢复时段内,各寡照处理黄瓜株高和茎粗生长率逐渐增加,受寡照小于5d的处理,其株高和茎粗在恢复正常光照9d后均能恢复到正常生长水平,而T7和T9处理的植株株高和茎粗恢复9d后仍低于CK水平,说明寡照7d以上黄瓜株高和茎粗生长受到抑制,且短期内难以恢复。
由图6可见,未经寡照的处理中,整个分析时段内,黄瓜单株叶面积持续增长,各寡照处理黄瓜单株叶面积也均持续增加,但均低于CK。持续寡照9d后,黄瓜植株的单株叶面积为2219.8cm2,与CK相比下降了28.0%。恢复正常光照后,各处理黄瓜植株的叶面积增长率均有提升。恢复期(9d)结束后,T1、T3、T5处理的单株叶面积增长率接近CK水平,T7和T9处理仍分别比CK低13.1%和11.2%,说明持续寡照7d以上对黄瓜叶面积增长造成的影响短期内难以恢复到正常水平。
2.3 持续寡照对温室黄瓜叶片抗氧化酶活性的影响
如图7a所示,随着持续寡照时间的增加,温室黄瓜叶片中SOD活性均保持一个较好的增长趋势。寡照7d后的黄瓜叶片SOD活性最大,达到233.2U·g-1(FW),与CK处理的163.5U·g-1相比,增加了42.6%;寡照9d处理比7d处理叶片中SOD活性略有降低,为228.6U·g-1,与CK相比增加了26.1%。
如图7b所示,随着寡照天数的增加,黄瓜叶片中POD活性逐渐增大。寡照处理3d后黄瓜叶片中POD活性显著增长;T5和T7处理黄瓜叶片中POD活性分别为12.7 和15.7U·min-1·g-1,与CK相比分别增加了96.6%和127.4%;黄瓜叶片POD活性在持续寡照9d后达到最大,为16.1U·min-1·g-1,与CK相比增加了74.7%。
由图7c可见,在整个寡照处理过程中,各处理温室黄瓜叶片中CAT活性均呈先增大后减小的变化趋势。持续寡照3d,温室黄瓜叶片中CAT的活性增加了34.4%,达到28.2U·min-1·g-1;在持续寡照7d后,黄瓜叶片中CAT活性达到峰值,为43.3U·min-1·g-1,与CK相比增加了98%;T9处理的黄瓜叶片CAT活性较T7略有降低,为40.7U·min-1·g-1,与CK相比增加了76.8%。
由图7d可见,持续寡照下各处理温室黄瓜叶片中MDA的含量逐渐增加,持续寡照9d后MDA增长速率降低。T7和T9处理的黄瓜叶片中MDA含量与CK相比分别增加90.1%和96.8%,达到4.26和4.37µmol·g-1。
图8a、8b、8c和8d分别为恢复期间温室黄瓜叶片中SOD、POD、CAT活性和MDA含量的变化情况。由图可见,恢复正常光照后,温室黄瓜叶片中SOD、POD、CAT活性和MDA含量均逐渐下降。持续寡照1d和3d后的黄瓜叶片,3种酶的活性在恢复光照后均能较快恢复至CK水平;寡照处理5d后的黄瓜叶片在恢复正常光照9d后也逐渐恢复至正常水平;持续寡照7d处理后的黄瓜叶片,其保护酶的活性和MDA含量在恢复期间也逐渐减小,但9d之内很难恢复到寡照处理前的水平。恢复结束时,持续寡照9d后的黄瓜叶片中3种酶的活性分别为206.3、10.8、32.4U·min-1·g-1,MDA含量为3.0µmol·g-1,与CK相比分别增加16.6%、38.6%、29.2%和62.2%。说明持续寡照7d以上对黄瓜叶片中保护酶活性和MDA含量影响较大,短期内难以恢复至正常水平。
2.4 持续寡照对温室黄瓜叶片中可溶性蛋白含量的影响
如图9所示,随着寡照天数的持续增加,黄瓜叶片中可溶性蛋白的含量逐渐降低。寡照处理1d和3d的黄瓜叶片中可溶性蛋白含量较CK分别减少5.3%和13.9%;T5处理,黄瓜叶片中可溶性蛋白含量下降幅度较大,结束时为407.8mg·g-1,与CK相比减少30.4%;T7处理,黄瓜叶片中可溶性蛋白含量为414.9mg·g-1,比T5处理略高;T9处理的黄瓜叶片中可溶性蛋白含量降幅最大,仅320.4mg·g-1,比CK相比减少了43.1%。恢复正常光照后,黄瓜叶片中可溶性蛋白含量均持续增长。T1和T3处理很快恢复至正常水平;T5处理恢复9d后,其含量达到558.6mg·g-1,与CK相比仅减少8.9%,基本恢复至正常水平;T7和T9处理在恢复期间,黄瓜叶片中可溶性蛋白含量持续增加,恢复9d后分别为502.1mg·g-1和489.2mg·g-1,但均未达到CK水平,与CK相比分别减少12.3%和18.5%。说明持续寡照7d以上造成黄瓜叶片中可溶性蛋白含量的升高在短期内难以恢复至正常水平。
2.5 持续寡照对黄瓜产量和商品性的影响
试验在寡照处理1个月后开始测定单株产量,延续测产1个月换算成当月产量,结果见图10。由图可见,正常光照下的黄瓜植株产量最大,为28900.5kg·hm-2;寡照处理导致黄瓜产量下降,且寡照持续日数越长,产量越低。寡照日数小于3d,各处理间差异不显著;寡照日数大于5d,黄瓜植株月产量下降明显,各处理间差异显著。T9处理的黄瓜植株产量最小,为18100.5kg·hm-2,与CK相比减小了37.3%。
注:小写字母表示处理间在0.05水平上的差异显著性
Note:Lowercase indicates the difference significance among treatments at 0.05 level
黄瓜的外观品质包括形状、颜色、大小、缺陷等,是黄瓜品质的重要组成部分,直接影响销售。将各处理黄瓜果实根据其形状、颜色、大小以及缺陷等特点进行3个等级的分类,分类结果见表1。一级果应具备瓜条长棒形,顺直,纵径达到27cm以上,个头大小均匀,果皮深绿光泽好,刺瘤中等大小且均匀等特征,且无大肚、尖嘴、蜂腰等其它缺陷,从表1可以看出,随着寡照日数的增加,一级果占采收总量的的比率逐渐下降,三级果的比率逐渐增加,坏果率也逐渐增加,二级果的变化规律则不明显;寡照持续5d以上,果实开始出现灰霉病症状,花蒂部呈水渍状软化,表面密生灰色雾,且寡照时间越长坏果越多,T9处理黄瓜果实的坏果率达到25%。
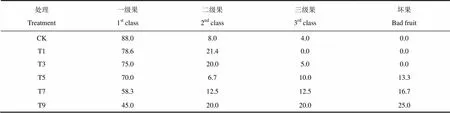
表1 不同处理各级别果实所占比例统计(%)
3 结论与讨论
持续寡照致使日光温室内温度难以回升,往往造成弱光亚适温逆境,黄瓜在花果期对弱光低温十分敏感,光合作用受到抑制。前人研究表明,叶片SPAD值与叶绿素含量成正比,因此,SPAD值可以反映寡照胁迫引起的黄瓜叶片中叶绿素含量的变化[25-26]。本文研究结果表明,持续寡照使温室黄瓜叶片SPAD值增加,叶色加深,叶片净光合速率减小,光合能力减弱。解除寡照逆境后,黄瓜叶片净光合速率逐渐增大,光合能力逐渐恢复,SPAD值下降;持续寡照7d后的黄瓜植株,其叶片光合恢复能力减弱,短时间内难以恢复至正常水平。持续寡照1~5d对黄瓜植株的形态指标影响不大,持续寡照7d以上,黄瓜的株高、茎粗及单株叶面积均显著低于CK,且持续寡照日数越长,黄瓜植株的外观形态受影响越大,恢复能力越差。从黄瓜的外观品质来看持续寡照使黄瓜坏果比例增加,且寡照时间越长,坏果率越大。不同持续日数的寡照引起各处理黄瓜单果重不同程度的降低,单株产量下降,从而导致产量下降,寡照持续日数越长,黄瓜产量越小。
弱光逆境对黄瓜叶片的影响是通过影响膜上酶的活性来影响酶系统,使活性氧积累,造成黄瓜叶片细胞膜脂过氧化程度提高,使膜脂受到伤害,从而影响体内的代谢过程。SOD、POD和CAT统称活性氧清除剂,SOD是植物抗氧化系统的第一道防线,可以使活性氧转化成H2O2和O2,然后通过POD、CAT清除体内的H2O2,有效阻止活性氧和H2O2相互作用,从而维持体内活性氧代谢平衡[27-28]。而MDA是膜脂过氧化作用的最终产物之一,可以抑制蛋白质的合成[29],其含量在一定程度能够较好地鉴定黄瓜叶片细胞膜的损伤程度和对逆境反应的强弱[30]。本文研究结果表明,持续寡照使黄瓜叶片中SOD、POD活性升高,CAT活性先升高后降低,MDA含量持续增加,这与Hu等[31-32]研究结果一致。说明低温弱光可诱导SOD和POD活性提高,并在一定程度上防御或减轻膜脂过氧化伤害,从而保护黄瓜叶片光合膜不受伤害,这可能是黄瓜适应不良光温环境的一种保护反应。随着寡照天数的持续增加,CAT活性逐渐下降,可能是由于叶片内部物质通过部分阻断CAT活性,从而激发体内的抗性机制,提高植物的抗逆性的一种保护措施。叶片MDA含量随着寡照天数的持续增加而增大,反映了黄瓜叶片在逆境中随着持续寡照天数的增加,叶片受损伤程度越大。恢复正常光照条件后,叶片中MDA含量持续减少,T1、T3、T5黄瓜叶片中SOD、POD 和CAT的活性很快恢复至正常水平,代谢功能得以恢复。持续寡照7d以上,黄瓜叶片各项指标短时间内均不能恢复至正常水平。
通过研究不同持续寡照日数对日光温室中黄瓜花果期叶片的光合和抗氧化酶活性的影响,证实持续寡照使黄瓜叶片SPAD值增加,净光合速率下降,植株生长受抑制,果实产量和商品性均下降;SOD、POD活性升高,CAT活性先升高后降低,MDA含量持续增加。持续寡照日数小于7d,对黄瓜叶片光合和抗氧化酶活性有影响,但在正常光温条件下能很快恢复;持续寡照7d以上,叶片光合和抗氧化酶活性在短时间内难以恢复至正常水平,因此,实际生产中可将持续寡照7d作为寡照灾害的临界值。然而,从前人大量不一致甚至互相矛盾的结果可以看出,植物耐低温和弱光的机制是相当复杂的,温室实际生产条件下整个黄瓜生长发育阶段的耐低温弱光特性以及低温弱光对黄瓜产量品质的影响仍需进一步研究。
[1]孔慧英.黄瓜特征特性及无公害栽培技术[J].现代农业科技,2013,(23):94-95.
Kong H Y.Characteristics and pollution-free cucumber cultivation techniques of cucumber[J].Modern Agricultural Science and Technology,2013,(23):94-95.(in Chinese)
[2]邵慧东.黄瓜特征特性及日光温室栽培技术[J].现代农业科技,2012,(23):92-93.
Shao H D.Characteristics and greenhouse cultivation techniques of cucumber[J].Modern Agricultural Science and Technology,2012,(23):92-93.(in Chinese)
[3]Guan Y,Chen Q,Pan J S.Construction of a BAC library from cucumber(L.) and identification of linkage group specific clones[J].Progress in Natural Science:Materials International,2008,12(2):143-147.
[4]刘桂军,赵京岚,薛提燕,等.“春秋先锋5号”水果型黄瓜选育及栽培技术研究[J].北方园艺, 2014,24(18):175-177.
Liu G J,Zhao J L,Xue T Y,et al.Study on breeding and cultivation techniques of a new mini fruit cucumber‘Chunqiu Xianfeng No.5'[J].Northern Horticulture,2014,24(18): 175-177. (in Chinese)
[5]李春,郭晶.2013-2014年冬季天津地区连续雾霾天气对设施农业生产的影响[J].天津农林科技,2014,(3):36-37.
Li C,Guo J.Effect of continuous fog and haze of agricultural production facilities in Tianjin 2013-2014 winter[J].Science and Technology of Tianjin Agriculture and Forestry,2014, (3):36-37.(in Chinese)
[6]Lidon F C,Loureiro A S,Vieira D E,et al.Photoinhibition in chilling stressed wheat and maize[J]. Photosynthetica, 2001, 39(2):161-166.
[7]毛艺林.雾霾环境对设施农业的影响及应对策略[J].河南农业科学,2014,(7):76-79.
Mao Y L.Influence of haze on facility agriculture and coping strategy[J].Journal of Henan Agricultural Sciences,2014, (7): 76-79.
[8]Routaboul J M,Fischer S F,Browse J.Trienoic fatty acids are required to maintain chloroplast function at low temperatures[J]. Plant Physiology,2000,124(4):1697-705.
[9]Vijayan P,Browse J.Photoinhibition in mutants of Arabidopsis deficient in thylakoid unsaturation[J].Plant Physiology, 2002, 129(2):876-885.
[10]李新国,毕玉平,赵世杰,等.短时低温胁迫对甜椒叶绿体超微结构和光系统的影响[J].中国农业科学,2005, 38(6): 1226-1231.
Li X G,Bi Y P,Zhao S J,et al.Effects of short-term chilling stress on the photosystems and chloroplast ultrastructure in sweet pepper[J].Scientia Agricultura Sinica,2005,38(6): 1226-1231.(in Chinese)
[11]Ody Y.Effects of light intensity,concentration and leaf temperature on gas exchange of strawberry plants-feasibility studies on enrichment in Japanese conditions[J].Acta. Horticultruae, 1997,439:563-573.
[12]Shen J R,Terashima I,Katoh S.Cause for dark,chilling- induced inactivation of photosynthetic oxygen-evolving system in cucumber leaves[J].Plant Physiology,1990, 93(93): 1354-1357.
[13]Sonoike K.Various aspects of inhibition of photosynthesis under light/chilling stress:“Photoinhibition at chilling temperatures” versus “chilling damage in the light”[J]. Journal of Plant Research,1998,111:121-129.
[14]钱芝龙,丁犁平,曹寿椿.低温胁迫对辣(甜)椒膜脂过氧化水平及保护酶活性的影响[J].园艺学报,1994,21(2):203-204.
Qian Z L,Ding L P.Effect of temperature stress on pepper seedling lipid peroxidation level and protective enzyme activity[J].Acta Horticulturae Sinica,1994,21(2):203-204.(in Chinese)
[15]陈青君,张福漫,王永健,等.临界低温弱光对黄瓜光合特性及其酶变化的影响[J].华北农学报,2003,18(4):31-34.
Chen Q J,Zhang F M,Wang Y J,et al.Influence of critical low temperature and poor light on photosynthesis characters and enzyme variance of cucumber[J].Acta Agriculturae Boreali-sinica,2003,18(4):31-34.(in Chinese)
[16]艾希珍,马兴庄,于立明,等.弱光下长期亚适温和短期低温对黄瓜生长及光合作用的影响[J].应用生态学报, 2004,15(11):2091-2094.
Ai X Z,Ma X Z,Yu L M,et al.Effect of long-term suboptimal temperature and short-term low temperature under low light density on cucumber growth and its photosynthesis[J]. Chinese Journal of Applied Ecology,2004,15(11): 2091-2094. (in Chinese)
[17]艾希珍,王秀峰,郭延奎,等.弱光亚适温和低温对黄瓜气孔特性及叶绿体超微结构的影响[J].中国农业科学,2006, 39(10):2063-2068.
Ai X Z,Wang X F,Guo Y K,et al.Effects of suboptimal temperature and low temperature under low light intensity on stomatal characteristics and chloroplast ultrastructure of cucumber seedlings[J].Scientia Agricultura Sinica,2006, 39(10):2063-2068.(in Chinese)
[18]艾希珍,张振贤,何启伟,等.日光温室主要生态因子变化规律及其对黄瓜光合作用的影响[J].应用与环境生物学报,2002,8(1):41-46.
Ai X Z,Zhang Z X,He Q W,et al.Changes in ecological factors and their effects on photosynthesis of cucumber leaves (L.) in heliogreenhouse[J].Chinese Journal of Applied & Environmental Biology,2002, 8(1): 41-46.(in Chinese)
[19]王绍华,曹卫星,王强盛,等.水稻叶色分布特点与氮素营养诊断[J].中国农业科学,2002,35(12):1461-1466.
Wang S H,Cao W X,Wang Q S,et al.Positional distribution of leaf color and diagnosis of nitrogen nutrition in rice plant[J].Scientia Agricultura Sinica,2002,35(12): 1461-1466. (in Chinese)
[20]马德华,庞金安.弱光对黄瓜幼苗光合及膜脂过氧化作用的影响[J].河南农业大学学报,1998,23(1):1-3.
Ma D H,Pang J A.Effect of low light on photosynthesis and membrane-lipid peroxidation of Cucumis sativus seedling[J].Acta Agriculturae Universitatis Henanensis, 1998, 23(1):1-3.(in Chinese)
[21]杨广东,朱祝军.不同光照条件下缺镁对黄瓜生长及活性氧清除系统的影响[J].园艺学报,2001,28(5):430-434.
Yang G D,Zhu Z J.Effects of magnesium deficiency on growth and active oxygen scavenging system in cucumber under different light intensities[J].Acta Horticulturae Sinica, 2001,28(5):430-434.(in Chinese)
[22]周艳虹,喻景权,钱琼秋,等.低温弱光对黄瓜幼苗生长及抗氧化酶活性的影响[J].应用生态学报,2003,14(6):921-924.
Zhou Y H,Yu J Q,Qian Q Q,et al.Effects of chilling and low light on cucumber seedlings growth and their antioxidative enzyme activities[J].Chinese Journal of Applied Ecology, 2003,14(6):921-924.(in Chinese)
[23]Yang Z Q,Yuan C H,Han W,et al.Effects of low irradiation on photosynthesis and antioxidant enzyme activities in cucumber during ripening stage[J].Photosynthetic, 2016, 54(2):251-258.
[24]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
Li H S.Physiological and biochemical principles and techniques[M].Higher Education Press,2000.(in Chinese)
[25]Kumagai E,Araki T,Kubota F.Correlation of chlorophyll meter readings with gas exchange and chlorophyll fluorescence in flag leaves of rice (L.) plant[J].Plant Production Science,2009,12:50-53.
[26]Lin F F,Qiu L F,Deng J S,et al.Investigation of SPAD meter-based indices for estimating rice nitrogen status[J]. Computersand Electronics in Agriculture,2010,71(S):60-65.
[27]Green B R,Durnford D G.The chlorophyll-carotenoid proteins of oxygenic photosynthesis[J].Annual Review of Plant Physiology and Plant Molecular Biology, 1996, 47: 685-714.
[28]Kornyeyev D,Logan B A,Payton P,et al.Enhanced photochemical light utilization and decreased chilling-in- duced photoinhibition of photosystem II in cotton overex- pressing genes encoding chloroplast-targeted antioxidant enzymes[J].Physiologia Plantarum,2001, 113:323-331
[29]曹锡清.膜质过氧化对细胞与机体的作用[J].生物化学与生物物理进展,1986,(2):17-21.
Cao X Q.The role of membrane lipid peroxidation on the cell and body[J].Progress in Biochemistry and Biophysics, 1986,(2):17-21.(in Chinese)
[30]冯炘,于贤昌,郭恒俊,等.低温胁迫对黄瓜嫁接苗和自根苗保护酶活性的影响[J].山东农业大学学报:自然科学版,2002,33(3):302-304.
Feng X,Yu X C,Guo H J.et al.Effect of low temperature stress on the protective-enzyme activity of grafted cucumber seedling and own-root cucumber seedling[J].Journal of Shandong Agricultural University:Natural Sciences,2002, 33(3):302-304.(in Chinese)
[31]Hu W H,Wu Y,Zeng J Z,et al.Chill-induced inhibition of photosynthesis was alleviated by 24-epibrassinolide pretreatment in cucumber during chilling and subsequent recovery[J].Photosynthetic,2010,48:537-544.
[32]Rossa M M,Oliveira M C,Okamoto O K,et al.Effect of visible light on superoxide dismutase(SOD) activity in the red alga(Gracilariales, Rhodophyta) [J].Journal of Applied Phycology,2002,14:151-157.
Effects of Continuous Overcast Weather on Cucumber Growth and Antioxidant Enzyme Activities in Glasshouse
XIONG Yu1, DIAO Jia-min1, XUE Xiao-ping2, LV Xue-mei3, ZHANG Ji-bo2
(1.Collaborative Innovation Center on Forecast and Evaluation of Meteorological Disasters, Nanjing University of Information Science & Technology, Nanjing 210044, China; 2.Shandong Climate Center, Jinan 250031; 3. Linyi Meteorological Bureau, Linyi 276000)
In order to investigate the effects of overcast weather on cucumber (L. cv.) growth in glasshouse, the experiment was conducted under two levels of photosynthetic active radiation(PAR): normal irradiation and low irradiation (<200µmol·m-2·s-1photon), respectively. Five durations of continuous low irradiation were designed (1, 3, 5, 7 and 9 days), then both groups of plants were transferred under normal irradiation to recover for 9 days. The growth index and the activity of antioxidant enzymes in cucumber leaves were observed. The results showed that: (1) the SPAD value in cucumber leaves increased while the net photosynthesis rate decreased under low irradiation. The longer the duration, the smaller the net photosynthetic rate in cucumber leaves, and the worse on the recovery ability in cucumber leaves. (2) The morphological index of cucumber were significantly affected by low irradiation, and the height, the stem diameter and the leaf-area per plant were smaller under low irradiation after 7 and 9 days than the control respectively, and they could not return to the control level after 9 days under normal irradiation. The cucumber yield and the commercial character decreased with the continuous low irradiation. The activities of SOD, POD were increased and the CAT activity increased at the beginning and then decreased while the content of MDA continuous increased. The longer the duration of low irradiation, the cucumber suffered more by membrane lipid peroxidation. The metabolic function of cucumber leaves was difficult to recover when continuous low irradiation for more than 7 days.
Overcast weather; Glasshouse; Cucumber; Morphological index; Yield; Enzyme activities
2016-12-27
“十二五”农村领域国家科技计划子课题“气象服务信息平台关键技术集成与示范”(2014BAD10B07);山东省气象局“日光温室小气候要素适宜度定量评价技术研究”(2016sdqxm03);山东省2013年度农业重大应用技术创新课题“新型双屋面日光温室及高效种植模式研究”
熊宇(1991-),女,硕士,主要研究方向为设施农业气象灾害预警。E-mail:245712378@qq.com
10.3969/j.issn.1000-6362.2017.09.001
**通讯作者。E-mail:xxpdhy@163.com
熊宇,刁家敏,薛晓萍,等.持续寡照对冬季日光温室黄瓜生长及抗氧化酶活性的影响[J].中国农业气象,2017,38(9):537-547
