挤压温度对膨化豆粕品质及蛋白质结构的影响
2017-09-16赵城彬刘景圣
赵城彬,张 浩,刘景圣
(1.吉林农业大学 食品科学与工程学院,长春 130118; 2.小麦和玉米深加工国家工程实验室,长春 130118)
油料蛋白
挤压温度对膨化豆粕品质及蛋白质结构的影响
赵城彬1,2,张 浩1,2,刘景圣1,2
(1.吉林农业大学 食品科学与工程学院,长春 130118; 2.小麦和玉米深加工国家工程实验室,长春 130118)
采用挤压膨化法对高温脱溶豆粕进行处理,分析探讨挤压温度对膨化豆粕品质及蛋白质结构的影响。结果表明:随着挤压温度的升高,膨化豆粕的氮溶解指数和蛋白质分散指数先增大后减小,而胰蛋白酶抑制活性不断降低;当挤压温度为60℃时,膨化豆粕蛋白的二级结构稍有变化,蛋白质部分变性,此时氮溶解指数和蛋白质分散指数最大,表明蛋白质适当变性有利于提高豆粕品质;随着挤压温度的升高,膨化豆粕蛋白的荧光强度逐渐增加而后稍有降低,当挤压温度为60℃时,色氨酸残基的微环境极性增加,蛋白质的三级结构变得更加疏松。
挤压膨化;温度;豆粕品质;蛋白质结构
高温粕作为大豆加工的副产物,是由大豆浸出取油后高温脱溶所得。高温粕中蛋白质含量可达45%~50%,是一种优良的植物蛋白源[1]。目前大部分豆粕被用作饲料,降低了豆粕的利用率,浪费了蛋白质资源。食品的挤压加工是使物料成分在挤压机中力的作用下流动、混合、加热、剪切,通过模头成型或膨化干燥等一个或多个混合的工艺下制成产品[2]。挤压膨化可以提高豆粕的营养品质,如氮溶解指数和蛋白质分散指数等,这两个指标通常用来衡量豆粕热处理加工中的营养价值[3]。同时,挤压膨化还可以降低豆粕中的抗营养因子,如胰蛋白酶抑制剂等。Frederic等[4]利用双螺杆挤压膨化机处理豆粕,研究挤压膨化参数对豆粕营养价值的影响。结果表明,当挤压温度为127℃,挤压时间为17 s时,氮溶解指数和蛋白质分散指数升高,胰蛋白酶抑制活性由5 100 TIU/g降低到2 300 TIU/g,提高了豆粕的营养品质。此外,挤压膨化可以导致豆粕蛋白结构的改变,直接影响其溶解性、起泡性和乳化性等功能特性。郭树国等[5]研究发现,在豆粕挤压膨化过程中,高温、高压、高剪切作用使蛋白质的分子结构发生伸展、重组、分子表面的电荷重新分布,分子间氢键、二硫键部分断裂,导致蛋白质变性,但蛋白质的消化率明显提高,在此过程中蛋白质还与其他化合物发生化学反应,影响产品的品质。目前,大多数研究主要集中在豆粕营养价值的提高和抗营养因子的去除方面,而对挤压膨化后豆粕蛋白结构变化的研究较少。
本试验采用挤压膨化法对高温脱溶豆粕进行处理,分析不同挤压温度下膨化豆粕的营养品质及膨化豆粕蛋白的结构变化,探讨膨化豆粕的营养品质与蛋白质结构之间的关系,为豆粕的综合利用提供理论依据和参考。
1 材料与方法
1.1 试验材料
大豆:哈尔滨市九三油厂;其他试剂均为国产分析纯。
双螺杆挤压膨化机:东北农业大学工程学院农产品加工实验室自制;F2102型植物试样粉碎机;电热恒温水浴锅;LDZ5-2型台式低速离心机;LGJ-25型冷冻干燥机;DU800型紫外分光光度计:美国贝克曼库尔特有限公司;MAGNA-IR560傅里叶变换红外光谱仪:美国尼高力公司;F-4500型荧光分光光度计。
1.2 试验方法
1.2.1 膨化豆粕的制备
采用乙醚对清理粉碎后的大豆40℃下脱脂5 h,再放入90℃烘箱中高温脱溶1 d得到高温脱溶豆粕。采用双螺杆挤压膨化机,在物料含水量为15%、螺杆转速为100 r/min、模孔孔径为18 mm的条件下,选取挤压温度分别为45、60、75、90、105℃,对高温脱溶豆粕进行挤压膨化处理,得到膨化豆粕。
1.2.2 氮溶解指数的测定
取一定量膨化豆粕样品以1∶10的料液比分散于pH 8.5的蒸馏水中浸提2 h,然后1 500 r/min离心10 min,取上清液。采用Lorry等[6]的方法测定上清液蛋白质含量。豆粕的氮溶解指数用上清液蛋白质含量与样品溶液总蛋白质含量之比表示。计算公式如下:
氮溶解指数=水溶性氮含量/样品中总氮含量×100%
1.2.3 蛋白质分散指数的测定
取一定量膨化豆粕样品以1∶10的料液比分散于蒸馏水中,在8 500 r/min下搅拌30 min,然后将溶液于3 000 r/min下离心10 min,离心后取上清液测定蛋白质含量[7]。蛋白质分散指数的计算公式如下:
蛋白质分散指数=水分散蛋白质含量/样品中总蛋白质含量×100%
1.2.4 胰蛋白酶抑制活性的测定
参照Liu等[8]的方法。取1 g膨化豆粕样品,分散到50 mL蒸馏水中振荡0.5 h,然后调节pH 9.5室温下提取2.5 h,4 000 r/min离心10 min后取上清液,用蒸馏水稀释使样品溶液质量浓度为0.5~1.5 mg/mL。向样品溶液中加入2 mL胰蛋白酶振荡混匀,37℃下反应10 min,后加入1 mL 30%醋酸溶液终止反应,然后于410 nm处测定样品吸光度(As)。以蒸馏水替代样品,测得相应的吸光度(Ac)作为对照组。胰蛋白酶抑制活性的计算公式如下:
式中:Ac为对照组的吸光度;As为样品的吸光度;0.01为1个胰蛋白酶抑制剂活力单位使酶反应产物吸光度减少0.01;50为样品溶液体积,mL;D为样品溶液稀释倍数;M为样品质量,mg。
1.2.5 膨化豆粕蛋白的制备
将膨化豆粕粉碎后,以1∶10的料液比与水混合,调节混合液pH 8.5浸提4 h,4 500 r/min离心30 min,取上清液;调节上清液pH 4.5,静置2 h后4 500 r/min离心30 min,取沉淀。将沉淀加水复溶,调节pH 7.0,经冷冻干燥后即得膨化豆粕蛋白[9]。采用凯氏定氮法测定蛋白质含量为81.42%。
1.2.6 红外光谱(FTIR)分析
取1 mg充分干燥的膨化豆粕蛋白样品与100 mg溴化钾研磨混匀压片,进行FTIR分析。光谱扫描范围为400~4 000 cm-1,分辨率为4 cm-1,波数精度为0.01 cm-1,扫描次数64次[10]。采用Systat的Peakfit Version 4.12软件对酰胺 Ⅰ 带(1 600~1 700 cm-1)图谱做二阶导数谱并采用Gauss峰形进行拟合,估算子峰的个数和位置[11],分辨重叠在一起的不同谱带,确定各子峰与各二级结构的对应关系,根据其积分面积计算各二级结构的相对含量。
1.2.7 荧光光谱分析
参考Spotti等[12]的方法,采用F-4500型荧光分光光度计对膨化豆粕蛋白进行内源荧光光谱分析,样品蛋白溶液质量浓度为0.2 mg/mL,激发波长为290 nm,发射波长为300~400 nm,激发和发射狭缝均为5 nm。
1.2.8 统计分析
每个试验重复3次,结果表示为“平均数±标准差”。采用统计学软件SPSS17.0对试验数据进行统计分析,采用Origin8.5软件作图。
2 结果与分析
2.1 挤压温度对膨化豆粕品质的影响
图1为挤压温度对膨化豆粕品质的影响。

图1 挤压温度对膨化豆粕品质的影响
由图1可以看出,随着挤压温度的增加,膨化豆粕的氮溶解指数和蛋白质分散指数呈先增大后减小的趋势,当挤压温度为60℃时,氮溶解指数和蛋白质分散指数均达到最大,再继续增加挤压温度,氮溶解指数和蛋白质分散指数均减小。当挤压温度升高时,部分豆粕蛋白的分子结构被破坏,使一些小分子蛋白质溶解出来[13],从而提高豆粕的氮溶解指数和蛋白质分散指数;当挤压温度过高时,蛋白质分子结构被完全破坏,同时发生分子间重新组合、互相交联的不可逆变化,导致豆粕的氮溶解指数和蛋白质分散指数降低。这与Zhu等[14]研究的挤压膨化温度对大豆蛋白溶解度影响的结果相似。
随着挤压温度的不断升高,膨化豆粕的胰蛋白酶抑制活性不断降低。Van等[15]研究发现挤压和热处理共同作用将有效降低胰蛋白酶抑制活性,但单独增加压力对胰蛋白酶抑制活性的影响很小,说明温度是影响胰蛋白酶抑制活性的主要因素。热失活是大豆胰蛋白酶抑制剂最常用的失活方法,因此温度的升高将导致胰蛋白酶抑制活性的下降。
2.2 膨化豆粕蛋白的FTIR分析
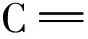



图2 不同挤压温度下膨化豆粕蛋白酰胺I带的拟合图谱
从图2可以看出,各子峰与各二级结构对应的关系指认:1 610~1 640 cm-1和1 670~1 690 cm-1为β-折叠;1 640~1 650 cm-1为无规则卷曲;1 650~1 660 cm-1为α-螺旋;1 660~1 700 cm-1为β-转角[17]。
表1为不同挤压温度下膨化豆粕蛋白的二级结构含量。

表1 不同挤压温度下膨化豆粕蛋白的二级结构含量
注:同列中不同字母差异显著(P<0.05)。
由表1可知,随着挤压温度的升高,α-螺旋含量呈先增大后减小的趋势,而β-折叠含量呈先减小后增大的趋势。挤压温度在45~90℃范围内,α-螺旋含量稍有变化但不显著,当挤压温度由90℃升高到105℃时,α-螺旋含量急剧下降,β-折叠含量急剧增加。β-转角含量随着挤压温度的增加变化没有规律,而无规卷曲含量与α-螺旋含量变化趋势相似,随着挤压温度的升高呈先增加后降低的趋势,但其变化没有α-螺旋含量的变化显著。温度是蛋白质变性的一个重要因素,随着温度的不断升高,达到蛋白质变性温度时,蛋白质分子间氢键、二硫键部分断裂,原有的空间结构开始被破坏,使蛋白质分子结构展开,导致部分蛋白质发生不可逆变性,这个阶段蛋白质二级结构的变化还不明显;随着温度的进一步升高,维持蛋白质分子空间结构的化学键完全被破坏,严重变性的蛋白质亚基之间发生重新聚集,使蛋白质的二级结构发生急剧变化[18]。
此外,当挤压温度为60℃时,蛋白质部分变性,使其二级结构轻微变化(见表1),此时氮溶解指数和蛋白质分散指数达到最大(见图1);而挤压温度为90~105℃时,蛋白质完全变性,其二级结构急剧变化,此时氮溶解指数和蛋白质分散指数均降低。这表明蛋白质的变性对豆粕品质具有一定影响,蛋白质适当变性有利于提高豆粕的品质,而过度变性会降低豆粕的品质。
2.3 膨化豆粕蛋白的荧光光谱分析
蛋白质内源荧光(色氨酸荧光基团)可作为探针检测蛋白质的构象变化,290 nm为激发波长的图谱主要是色氨酸(Trp)为发射基团的荧光光谱,表征Trp微环境极性的变化,蛋白质的最大发射波长反映水相中暴露Trp残基的平均值[19]。
不同挤压温度下膨化豆粕蛋白的荧光光谱如图3所示。
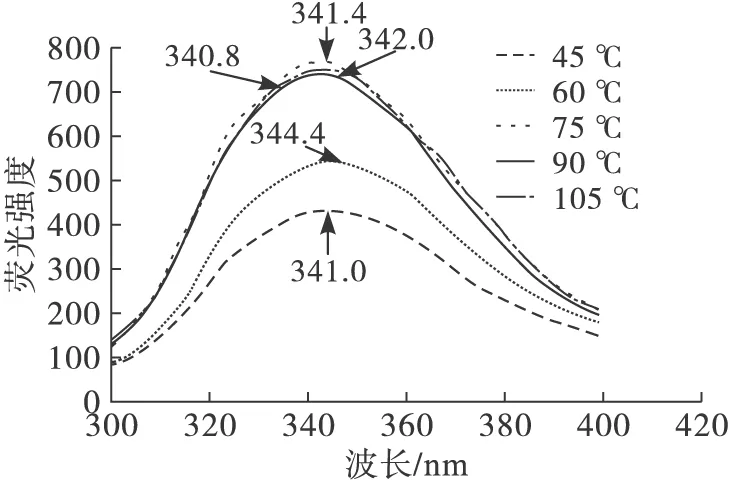
图3 不同挤压温度下膨化豆粕蛋白的荧光光谱
由图3可以看出,随着挤压温度的升高,膨化豆粕蛋白的荧光强度逐渐增加而后稍有降低,这可能由于热处理过程中蛋白质变性而导致Trp残基周围结构的变化[20],而荧光强度的下降与荧光猝灭相关(猝灭剂存在于溶剂或蛋白质分子内部)[21]。研究表明蛋白质的最大荧光峰波长(λmax)与Trp残基所处微环境的极性有关,λmax小于330 nm表示Trp残基位于蛋白质分子内部的非极性环境中,λmax大于330 nm表明Trp残基位于蛋白质分子外部的极性环境中[22]。图3中所有膨化豆粕蛋白的λmax均大于330 nm,表明Trp残基暴露于蛋白质分子外部的极性环境中。在挤压温度为60℃时,膨化豆粕蛋白的λmax最大为344.4 nm,与其他温度下膨化豆粕蛋白的λmax相比,发生了显著的红移,Trp残基的微环境极性增加,改变了蛋白质分子的空间构象,使蛋白质的三级结构变得更加疏松[23]。
3 结 论
将高温脱溶豆粕进行挤压膨化处理,对不同挤压温度下膨化豆粕的氮溶解指数、蛋白质分散指数、胰蛋白酶抑制活性进行测定,并对膨化豆粕蛋白进行红外光谱和荧光光谱分析,探讨挤压温度对膨化豆粕品质及蛋白质结构的影响。研究发现:随着挤压温度的增加,膨化豆粕的氮溶解指数和蛋白质分散指数先增大后减小,而胰蛋白酶抑制活性不断降低。红外光谱分析表明,当挤压温度为60℃时,膨化豆粕蛋白的二级结构稍有变化,蛋白质部分变性,此时氮溶解指数和蛋白质分散指数最大,表明蛋白质适当变性有利于提高豆粕品质。荧光光谱分析表明,随着挤压温度的升高,膨化豆粕蛋白的荧光强度逐渐增加而后稍有降低。当挤压温度为60℃时,蛋白质的λmax发生了显著的红移,Trp残基的微环境极性增加,改变了蛋白质分子的空间构象,使蛋白质的三级结构变得更加疏松。
[1] 许晶. 脱脂豆粕酶解物抗氧化与抗疲劳作用的研究[D]. 哈尔滨: 东北农业大学, 2010.
[2] 苏晓琳. 双螺杆挤压膨化对豆粕营养品质影响规律的研究[D]. 哈尔滨: 东北农业大学, 2009.
[3] ZHANG W N, LIU D A C. A new process for the preparation of soybean protein concentrate with hexane-aqueous ethanol mixed solvents[J]. J Aoac Int, 2005, 88: 1217-1222.
[4] FREDERIC T B, DAVID A J, STONE R W H. The effects of extrusion conditions on the nutritional value of soybean meal for rainbow trout[J]. Aquaculture, 2007, 265: 244-252.
[5] 郭树国,王丽艳,郭树行.豆粕挤压膨化过程中化学成分变化分析[J].中国农机化,2005(1):67-69.
[6] LORRY O H, ROSEBROUGH N J, FARR A L. Protein measurement with the folin phenol reagent[J]. J Biol Chem, 1951, 193(1):265-275.
[7] 陈春佳,张宝琴. 大豆蛋白质NSI和PDI的检测方法比较[J]. 西部粮油科技, 2000, 25(5): 47-49.
[8] LIU K, MARKAKIS P. An improved colorimetric method for determining antitryptic activity in soybean products[J]. Cereal Chem, 1989, 66(5): 415-422.
[9] 王显生,杨晓泉,高文瑞,等.不同亚基变异类型的大豆分离蛋白凝胶质构特性的研究[J]. 中国粮油学报, 2006, 21(3): 116-121.
[10] 张忠慧, 华欲飞. 大豆分离蛋白与低浓度尿素相互作用红外光谱分析[J]. 粮食与油脂, 2007(7): 20-21.
[11] SUREWICZ W K, MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra[J]. Biochim Biophys Acta, 1988, 952(2): 115-130.
[12] SPOTTI M J, MARTINEZ M J, PILOSOF A M R, et al. Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein/dextran systems[J]. Food Hydrocoll, 2014, 39: 223-230.
[13] SHIH M C, KUO C C, CHIANG W. Effects of drying and extrusion on colour, chemical composition, antioxidant activities and mitogenic response of spleen lymphocytes of sweet potatoes[J]. Food Chem, 2009, 117: 114-121.
[14] ZHU S, RIAZ M N, LUSAS E W. Effect of different extrusion temperatures and moisture content on lipoxygenase inactivation and protein solubility in soybeans[J]. J Agric Food Chem, 1996, 44: 3315-3318.
[15] VAN C,MATSER A M, VANDER B, et al. Inactivation of soybean trypsin inhibitors and lipoxygenase by high pressure processing[J]. J Sci Food Agric, 2005, 53: 1087-1092.
[16] 王辰, 江连洲, 魏冬旭,等. 不同品种大豆分离蛋白结构与表面疏水性的关系[J]. 食品科学, 2012, 33(9): 54-57.
[17] ZHANG X, HUANG L X,NIE S Q. FTIR characteristic of the secondary structure of insulin encapsulated within liposome[J]. J Chin Pharmac Sci, 2003, 12(1): 112-114.
[18] PETRA B W. Investigation of absorption-induced structural changes of proteins at solid/liquid interfaces by differential scanning calorimetry[J].Thermoch Acta, 2002, 382(1/2): 174-188.
[19] BROERSEN K, VORAGEN A G J, HAMER R J, et al. Glycoforms ofβ-lactoglobulin with improved thermostability and preserved structural packing[J]. Biotechnol Bioeng, 2004, 86: 78-87.
[20] RENARD D, LEFEBVRE J, GRIFFIN M C, et al. Effects of pH and salt environment on the association ofβ-lactoglobulin revealed by intrinsic fluorescence studies[J]. Int J Biol Macromol, 1998, 22(1): 41-49.
[22] VIVIAN J T,CALLIS P R. Mechanisms of tryptophan fluorescence shifts in proteins[J]. Biophys J, 2001, 80(5): 2093-2109.
[23] LIU Y, ZHAO G, REN J, et al. Effect of denaturation during extraction on the conformational and functional properties of peanut protein isolate[J]. Innov Food Sci Emerg Technol, 2011, 12: 375-380.
Effectsofextrusiontemperatureonqualityofextrudedsoybeanmealandproteinstructure
ZHAO Chengbin1,2, ZHANG Hao1,2,LIU Jingsheng1,2
(1.College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China; 2.National Engineering Laboratory of the Wheat-corn Deep Processing, Changchun 130118, China)
High temperature desolventized soybean meal was treated by extrusion method. The effects of extrusion temperature on quality of extruded soybean meal and protein structure were analyzed and discussed. The results showed that with the increase of extrusion temperature, nitrogen soluble index and protein dispersibility index increased at first and then decreased, while trypsin inhibitory activity decreased constantly. When the extrusion temperature was 60℃, the secondary structure of extruded soybean meal protein had a slight change and protein was denatured partly. At the same time, nitrogen soluble index and protein dispersibility index were the largest, which indicated that appropriate denaturation of protein was beneficial to improve the quality of soybean meal. In addition, fluorescence intensity of extruded soybean meal protein gradually increased and then slightly decreased with the increase of extrusion temperature. When the extrusion temperature was 60℃, the polarity of tryptophan residues microenvironment increased and the tertiary structure of protein was less compact.
extrusion; temperature; quality of soybean meal; protein structure
2016-10-24;
:2016-11-23
吉林省科技发展计划项目(20150520132JH)
赵城彬(1987),男,讲师,博士,研究方向为粮食、油脂及植物蛋白工程(E-mail)zhaochengbin66@126.com。
刘景圣,教授,博士(E-mail)liujingshengname@163.com。
TS214.2;TQ936.2
:A
:1003-7969(2017)07-0045-05
