真空脱水对花生油挥发性物质的影响
2017-09-16仇东朝宫明杰王兴国金青哲
仇东朝,张 攀,徐 伟,宫明杰,王兴国,金青哲
(1.山东龙大粮油有限公司,山东 烟台265200; 2.江南大学 食品学院,江苏 无锡 214122)
真空脱水对花生油挥发性物质的影响
仇东朝1,张 攀1,徐 伟1,宫明杰1,王兴国2,金青哲2
(1.山东龙大粮油有限公司,山东 烟台265200; 2.江南大学 食品学院,江苏 无锡 214122)
采用顶空固相微萃取结合气相色谱-质谱联用技术(HS-SPME-GC-MS),以对苯甲酚为内标物,对花生油在真空脱水过程中挥发性物质的变化进行了半定量研究。结果表明:真空脱水可以有效脱除花生油中的水分,真空脱水5 min即能脱去花生油中约50%的水分;真空脱水15 min之内,花生油挥发性物质的总量基本保持不变,但继续延长脱水时间,花生油所保有的挥发性物质总量的损失将增大;绝大部分挥发性物质在15 min的真空脱水时间内变化不大,但具有甜香味风味特征的苯乙醛、麦芽酚等挥发性物质含量随着脱水时间的延长呈近似线性的下降趋势。综合来看,真空脱水能够在保护花生油挥发性物质的前提下起到有效脱水的效果。
花生油;真空脱水;挥发性物质
浓香花生油一般采用压榨工艺制取,其特有的天然浓郁花生滋味和香气受到消费者的普遍欢迎。花生油的香气是其感官品质的重要指标[1],而花生油在加工或储存过程中赋予其特有香气的挥发性物质会发生变化[2]。引起花生油风味变化的因素很多,其中水分含量是影响其品质的重要指标之一,同时也是油脂发生氧化酸败的诱因[3]。过高的水分含量会使食用油水解作用加强、游离脂肪酸增加[4],从而使食用油风味损失、酸败变质。而脱水过程对花生油挥发性物质的影响研究报道不多,马传国等[5]提到花生油脱水过程中组成花生油浓香味的苯乙醛和吡嗪类物质易被蒸馏挥发出去,从而影响花生油香味的浓度。但花生油在脱水过程中挥发性物质的定量或半定量研究尚未见报道。
近年来,植物油挥发性物质的研究最常采用的技术方法为固相微萃取(SPME)结合气相色谱-质谱联用(GC-MS)的分析方法[6-9]。固相微萃取技术具有灵敏度高、检测限低、简便经济、选择性好等优点[10-12],在风味物质研究领域发挥重要作用。本研究采用顶空固相微萃取结合气相色谱-质谱联用技术(HS-SPME-GC-MS)研究花生油在真空脱水过程中挥发性物质的变化,分析不同真空脱水时间对花生油水分及主要挥发性物质的影响。
1 材料与方法
1.1 试验材料
花生油(过滤脱胶后的压榨花生油),山东龙大粮油有限公司;对苯甲酚标准品,德国Dr.Ehrenstorfer公司。
6890N-5973气相色谱质谱联用仪,美国Agilent公司;SPME固相微萃取装置(PDMS /DVB 65 μm萃取头),美国Supelco公司;DF-101S集热式磁力搅拌器,金坛市瑞华仪器有限公司; HPD-25A无油真空泵,天津市恒奥科技发展有限公司;C20卡尔费休水分测定仪,梅特勒-托利多国际贸易(上海)有限公司;AL204电子天平,梅特勒-托利多国际贸易(上海)有限公司;Model F罗维朋比色计,北京莱比信科技发展有限公司。
1.2 试验方法
1.2.1 花生油真空脱水
本试验采用实验室自制的真空脱水装置(见图1),即取1 000 mL 直三口圆底烧瓶以橡胶塞(打孔)密封,一口插入一根可通入干燥氮气的导气管(插入液面以下的花生油中),一口插入一根用于抽真空的通气管(刚好露出橡胶塞),另一口插入温度计至液面以下,装置需保证气密性良好。

图1 真空脱水试验装置
试验时,称取500 g花生油于烧瓶中,在集热式磁力搅拌器中油浴控温105℃,通入0.03 L/min的干燥氮气,并打开真空泵抽真空至容器内压强0.02 MPa进行试验。脱水后的样品迅速降温并密封冷冻保存。本试验研究了不同真空脱水时间(5、15、30 min和45 min)对花生油水分及主要挥发性物质的影响。
1.2.2 花生油水分的测定
花生油水分的测定参考GB/T 26626—2011《动植物油脂 水分含量测定 卡尔费休法(无吡啶)》。
1.2.3 挥发性物质的固相微萃取
称取10 g花生油样品(加入100 μL精炼花生油配制的0.02%对苯甲酚作为内标物)置于100 mL顶空瓶中。将顶空瓶置于50℃水浴中恒温预热20 min,通过隔垫插入已活化好的固相微萃取头(250℃活化60 min),推出纤维头,顶空吸附30 min后取出萃取头,手动插入气相色谱进样口,于250℃解吸 5 min。
1.2.4 GC-MS分析条件
GC条件:HP-5ms弹性石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);柱温升温程序为起始温度35℃,保持4 min,然后以3℃/min的升温速率升温至150℃,保持5 min;进样口温度250℃;载气He,流速0.8 mL/min,进样方式不分流进样。MS条件:电子轰击离子源(EI);电子能量70 eV;灯丝发射电流200 mA;离子源温度230℃;接口温度250℃;质量扫描范围(m/z)30~420。
1.2.5 定性和定量分析
挥发性物质经GC-MS分析得到总离子流图后,进行NIST谱库检索,并结合文献报道进行图谱解析定性。以经过对苯甲酚内标物校正后的峰面积分析某对应化合物的含量变化。
1.2.6 花生油感官品质评价
参考刘玉兰等[13]评价方法:取50 mL样品于100 mL的烧杯中加热至50℃,用玻璃棒边搅边闻气味。其气味评分为:不香(1~2分),有点香(3~4分),较香(5分),很香(6~7分),非常香(8~9分)。评价人员由12名熟悉花生油香味的人员组成,各样品随机排定。样品的色泽由罗维朋比色计测定。
2 结果与分析
2.1 真空脱水对花生油水分的影响
不同真空脱水时间对花生油水分的影响如图2所示。由图2可知,压榨花生油的含水量为0.051 8%,随着真空脱水时间的逐渐延长,花生油的含水量逐渐下降;真空脱水5 min,花生油的含水量即降低50%左右,降至0.026 3%,继续延长真空脱水时间,花生油含水量下降的趋势变小,说明花生油水分下降到一定水平后,脱水逐渐趋于困难。

图2 真空脱水对花生油水分的影响
2.2 花生油挥发性物质分析
用HS-SPME-GC-MS法测定压榨花生油的挥发性物质总离子流图,结果如图3所示。

图3 压榨花生油挥发性物质总离子流图
由图3可知,除去少量分析时萃取头引入的硅氧烷类杂质峰、增塑剂污染杂质峰及少量不易定性的杂峰,本次试验共分离鉴定出包含对苯甲酚内标物在内的42种化合物,主要为吡嗪、呋喃、吡啶、吡咯等杂环化合物及醛、酮、醇、酯类化合物。而各类化合物里面,尤以2,5-二甲基吡嗪(21.10%)、苯乙醛(14.92%)、2,3-二氢苯丙呋喃(9.00%)、2-乙基-5-甲基-吡嗪(7.55%)、麦芽酚(5.87%)、2-甲氧基-4-乙烯基苯酚(4.22%)、甲基吡嗪(3.71%)、4-丙基吡啶(3.00%)等化合物的含量较高。其中,吡嗪类化合物在检出的挥发性物质中含量最多,呈现出烤香、类似坚果香和烘焙香的风味特征,为美拉德反应的中间产物,是花生油最具代表性的特征性风味成分[14]。
本试验所用的压榨花生油的风味不同于市场上常见花生油的糊香或烘烤香味,而呈现出一种独有的丰满且让人愉悦的甜香味,这可能与苯乙醛、麦芽酚等具有甜香型风味的挥发性物质含量较高有关,特别是苯乙醛有浓郁的玉簪花香气,具有类似风信子的甜清香气味[15],Mason等[16]研究发现,苯乙醛对熟花生甜的芳香味贡献较大。
2.3 真空脱水对花生油挥发性物质的影响
不同真空脱水时间对花生油挥发性物质的影响如表1所示。
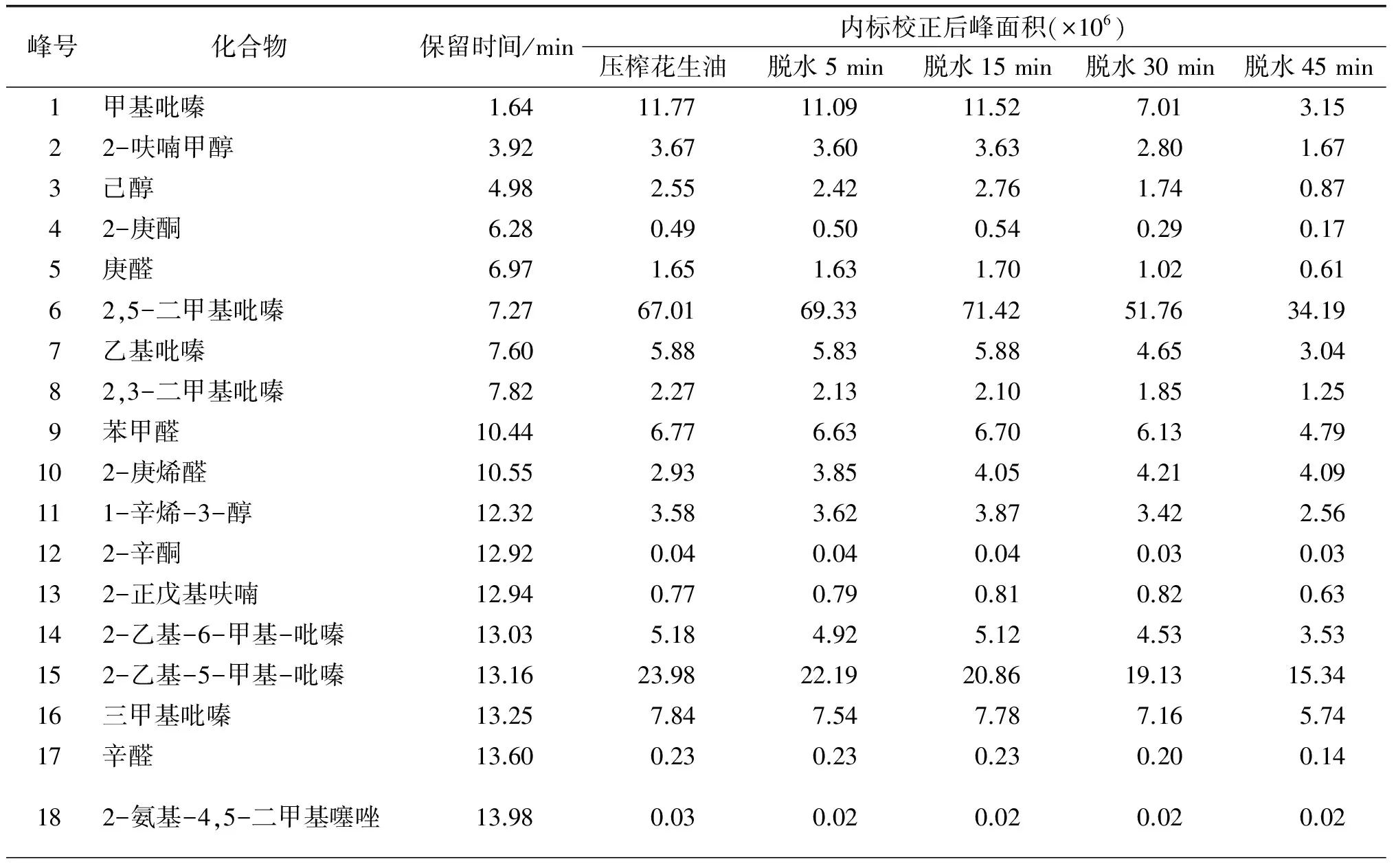
表1 真空脱水对花生油挥发性物质的影响
续表1
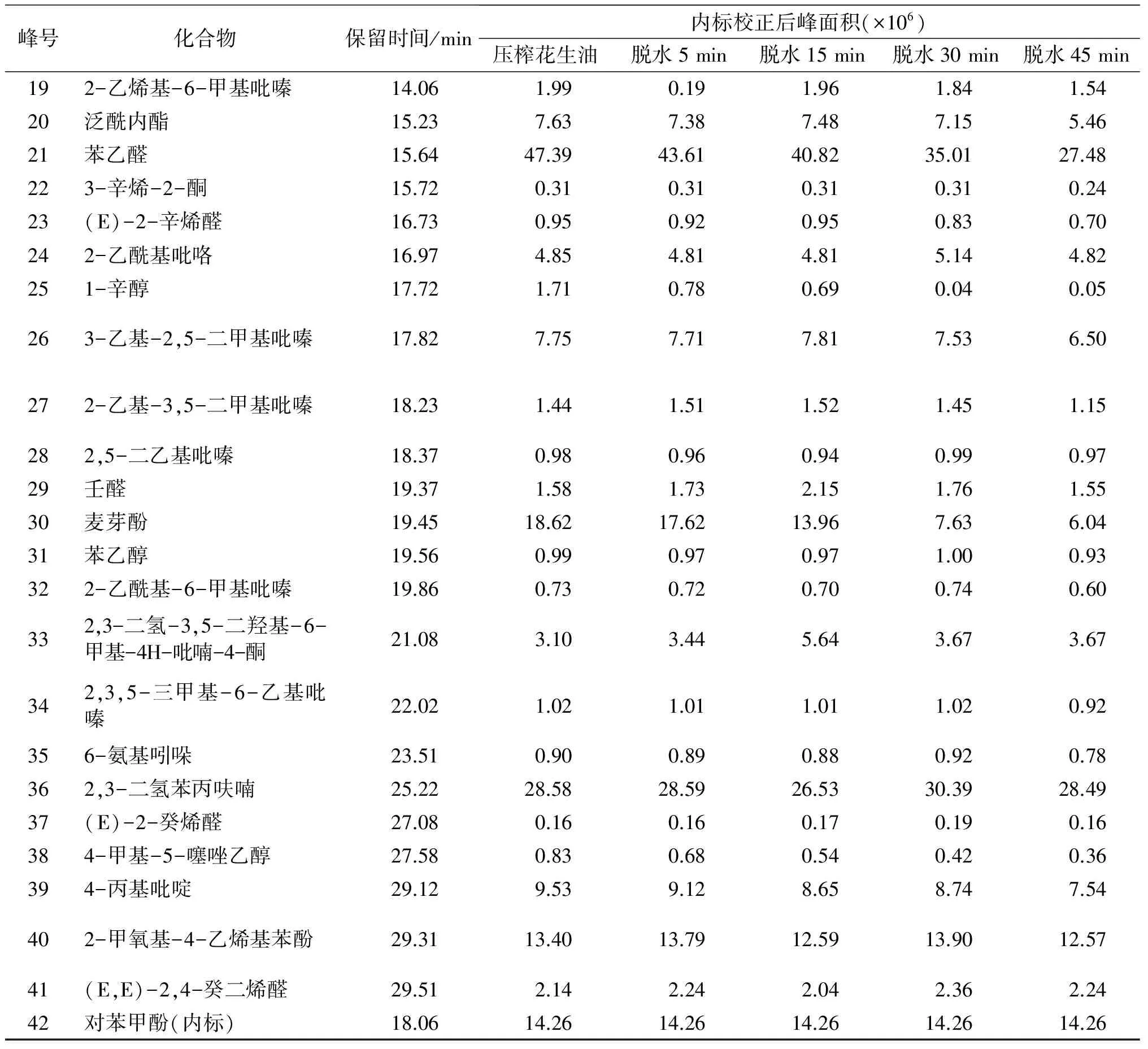
峰号化合物保留时间/min内标校正后峰面积(×106)压榨花生油脱水5min脱水15min脱水30min脱水45min192-乙烯基-6-甲基吡嗪14.061.990.191.961.841.5420泛酰内酯15.237.637.387.487.155.4621苯乙醛15.6447.3943.6140.8235.0127.48223-辛烯-2-酮15.720.310.310.310.310.2423(E)-2-辛烯醛16.730.950.920.950.830.70242-乙酰基吡咯16.974.854.814.815.144.82251-辛醇17.721.710.780.690.040.05263-乙基-2,5-二甲基吡嗪17.827.757.717.817.536.50272-乙基-3,5-二甲基吡嗪18.231.441.511.521.451.15282,5-二乙基吡嗪18.370.980.960.940.990.9729壬醛19.371.581.732.151.761.5530麦芽酚19.4518.6217.6213.967.636.0431苯乙醇19.560.990.970.971.000.93322-乙酰基-6-甲基吡嗪19.860.730.720.700.740.60332,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮21.083.103.445.643.673.67342,3,5-三甲基-6-乙基吡嗪22.021.021.011.011.020.92356-氨基吲哚23.510.900.890.880.920.78362,3-二氢苯丙呋喃25.2228.5828.5926.5330.3928.4937(E)-2-癸烯醛27.080.160.160.170.190.16384-甲基-5-噻唑乙醇27.580.830.680.540.420.36394-丙基吡啶29.129.539.128.658.747.54402-甲氧基-4-乙烯基苯酚29.3113.4013.7912.5913.9012.5741(E,E)-2,4-癸二烯醛29.512.142.242.042.362.2442对苯甲酚(内标)18.0614.2614.2614.2614.2614.26
分析得到的各挥发性物质的峰面积总和表示花生油挥发性物质的总量,不同真空脱水时间对花生油挥发性物质总量的影响如图4所示。

图4 真空脱水对花生油挥发性物质总量的影响
由图4可知,真空脱水时间在15 min以内时,花生油挥发性物质总量变化不大;真空脱水时间超过15 min以后,分析得到的挥发性物质的总响应峰面积随着脱水时间的延长而减小的趋势明显,这说明脱水时间越长,花生油所保有的挥发性物质损失越大。
花生油各挥发性物质在真空脱水过程中的变化规律不尽相同,由表1可以看出,随着真空脱水时间的延长,花生油大部分挥发性物质的变化规律与挥发性物质总量的变化相近,即真空脱水15 min以内,如甲基吡嗪、2-呋喃甲醇、2,5-二甲基吡嗪、乙基吡嗪、苯甲醛、1-辛烯-3-醇、2-乙基-6-甲基-吡嗪、三甲基吡嗪、泛酰内酯、3-乙基-2,5-二甲基吡嗪等主要挥发性物质变化不大,超过15 min以后,上述物质均有下降。
还有部分挥发性物质的峰面积随着脱水时间的延长呈近似线性的下降趋势,如2-乙基-5-甲基-吡嗪、苯乙醛、麦芽酚、4-丙基吡啶等,这说明上述物质在一定时间的真空脱水过程中会一直损失,特别是具有甜香味风味特征的苯乙醛、麦芽酚,真空脱水15 min两者的峰面积分别下降了13.86%和25.03%,真空脱水时间延长至30 min,两者的峰面积分别下降了26.12%和59.02%。
2-乙酰基吡咯、2,3-二氢苯丙呋喃、2-甲氧基-4-乙烯基苯酚等少部分挥发性物质随着真空脱水时间的延长无明显的变化规律,如2,3-二氢苯丙呋喃峰面积在一定脱水时间内略有下降,再延长脱水时间,峰面积反而增加。
2.4 真空脱水对花生油感官品质的影响
不同真空脱水时间对花生油感官品质的影响如表2所示。

表2 真空脱水对花生油感官品质的影响
由表2可知,不同真空脱水时间对花生油的色泽影响不大,脱水时间30 min后花生油的R值稍有增加。气味评价结果显示,真空脱水时间在15 min以内时,花生油的香味几乎不受影响,随着真空脱水时间的延长,花生油的香味会变淡,可见,过长的脱水时间会使花生油的香味受损失。
3 结 论
真空脱水可以有效脱除花生油中的水分,真空脱水5 min即能脱去花生油中50%左右的水分。真空脱水15 min之内,花生油挥发性物质的总量基本保持不变,但继续延长脱水时间,花生油所保有的挥发性物质总量的损失将增大。甲基吡嗪、2-呋喃甲醇、2,5-二甲基吡嗪、乙基吡嗪、苯甲醛、1-辛烯-3-醇、2-乙基-6-甲基-吡嗪、三甲基吡嗪、泛酰内酯、3-乙基-2,5-二甲基吡嗪等绝大部分挥发性物质在15 min的真空脱水时间内变化不大,但具有甜香味风味特征的苯乙醛、麦芽酚等挥发性物质的峰面积随着脱水时间的延长呈近似线性的下降趋势。综合来看,合理控制好脱水时间(15 min以内),本试验所采用的真空脱水方法能够在保护花生油挥发性物质的前提下起到有效脱水的效果。
[1] KATAOKA H, HEATHER L, PAWLISZYN J. Applications of solid-phase microextraction in food analysis[J].J Chromatogr A, 2000, 880(2): 35-62.
[2] 钟海雁, 黄永辉, 刘宁露, 等. 油脂气味的研究进展[J]. 中国油脂, 2006, 31(7): 12-15.
[3] 王玲, 李志西, 于修烛, 等. 近红外光谱法测定菜籽油中水分含量[J]. 中国油脂, 2010, 35(3): 74-77.
[4] 徐源, 黄金强, 王志亮, 等. 红外光谱法测量花生油中水分含量[J]. 实验技术与管理, 2012, 29(7): 47-48,53.
[5] 马传国, 梁少华, 王建国,等. 浓香花生油特殊脱胶工艺的研究[J]. 中国油脂, 2000, 25(5): 5-6.
[6] 刘晓君, 金青哲, 刘元法, 等. 花生油挥发性风味成分的鉴定[J]. 中国油脂, 2008, 33(8): 40-42.
[7] LIU X J, JIN Q Z, LIU Y F, et al. Changes in volatile compounds of peanut oil during the roasting process for production of aromatic roasted peanut oil[J].J Food Sci, 2011, 76(3):C404-C412.
[8] 顾赛麒, 张晶晶. 花生油在不同热处理温度下特征性香气成分鉴别研究[J]. 食品工业科技, 2013, 34(2): 133-138.
[9] 初丽君, 刘睿杰, 王珊珊, 等. 5S压榨工艺对花生油综合品质的影响[J]. 中国油脂, 2014, 39(2): 1-5.
[10] TAT L, COMUZZO P, STOLFO I, et al. Optimization of wine headspace analysis by solid-phase microextraction capillary gas chromatography with mass spectrometric and flame ionization detection[J]. Food Chem, 2005, 93(2):361-369.
[11] BOUTOU S, CHATONNET P. Rapid headspace solid-phase microextraction/gas chromatographic/mass spectrometric assay for the quantitative determination of some of the main odorants causing off-flavours in wine[J]. J Chromatogr A, 2007, 1141(1):1-9.
[12] LORENZO J M. Influence of the type of fiber coating and extraction time on foal dry-cured loin volatile compounds extracted by solid-phase microextraction (SPME)[J]. Meat Sci, 2014, 96(1):179-186.
[13] 刘玉兰, 刘瑞花, 钟雪玲,等. 不同制油工艺所得花生油品质指标差异的研究[J]. 中国油脂, 2012, 37(9): 6-10.
[14] 史文青, 薛雅琳, 何东平. 花生香味成分的研究现状[J]. 粮油食品科技, 2011, 19(6): 23-24.
[15] 王苹, 王世铭, 张建成. 香料苯乙醛合成的新途径[J]. 化学工业与工程, 2004, 21(5): 383-384.
[16] MASON M E, JOHNSON B, HAMMING M C. Volatile components of roasted peanuts. Major monocarbonyls and some noncarbonyl components[J]. J Agric Food Chem, 1967, 15(1):66-73.
Effectofvacuumdehydrationonvolatilecompoundsinpeanutoil
QIU Dongzhao1, ZHANG Pan1, XU Wei1, GONG Mingjie1, WANG Xingguo2, JIN Qingzhe2
(1.Shandong Longda Grains & Oil Co., Ltd., Yantai 265200, Shandong, China; 2. School of Food Science and Technology,Jiangnan University,Wuxi 214122,Jiangsu,China)
Withp-cresol as the internal standard, the change of volatile compounds in the process of vacuum dehydration of peanut oil was emi-quantitatively studied by headspace solid phase micro-extraction coupled with gas chromatography and mass spectrometry(HS-SPME-GC-MS). The results showed that vacuum dehydration could effectively remove the water from peanut oil and about 50% of water could be removed after vacuum dehydration for 5 min. The total volatile compounds in peanut oil remained basically the same when the vacuum dehydration time was within 15 min. But with the dehydration time prolonging, the loss of total volatile compounds in peanut oil increased. Most of the volatile compounds nearly unchanged when the vacuum dehydration time was within 15 min. A small amount of volatile compounds with sweet smelling flavor characteristics, such as benzene acetaldehyde and maltol, showed approximately linear downward trend with the dehydration time prolonging. Taken together, the vacuum dehydration could effectively remove water from peanut oil on the premise of the protection of volatile compounds.
peanut oil; vacuum dehydration; volatile compound
2016-10-31;
:2017-04-17
山东省技术创新项目(201610506016)
仇东朝(1987),男,硕士,研究方向为食用油加工理论与应用(E-mail)qiudz@longda.cn。
金青哲,教授,博士生导师(E-mail)jqzwuxi@163.com。
TS225.1;R284
:A
:1003-7969(2017)07-0019-05
