腹腔镜胃癌根治术治疗进展期远端胃癌的临床研究
2017-09-16李海春许家亮肖雷
李海春, 许家亮, 肖雷
临床与基础研究
腹腔镜胃癌根治术治疗进展期远端胃癌的临床研究
李海春, 许家亮, 肖雷
目的探讨腹腔镜辅助胃癌根治术治疗进展期远端胃癌的安全性及对患者手术后血清前白蛋白(PA)、白蛋白(ALB)、总淋巴细胞计数(TLC)及血红蛋白(HGB)的影响。方法选取2012年6月至2015年6月信阳市中心医院收治的120例进展期远端胃癌患者为研究对象,其中60例行腹腔镜辅助胃癌根治术(腹腔镜组),另60例行开腹胃癌根治术(开腹组),观察两组患者的手术时间、术中出血量、住院时间、术后排气时间、术后C反应蛋白(CRP)浓度、术后并发症,以及两组手术前后血清PA、ALB、TLC及HGB的变化。结果腹腔镜组手术用时长于开腹组(P<0.01),术中出血量、切口长度均小于开腹组(P<0.01),两组清扫的淋巴结数目差异无统计学意义(P>0.05);两组住院时间、术后排气时间、术后CRP浓度差异均有统计学意义(P<0.05);腹腔镜组术后并发症发生率低于开腹组(P<0.05);术后两组血清PA、ALB和HGB均较术前有上升(P<0.05),且腹腔镜组改善程度好于开腹组(P<0.05),但两组TCL手术前后无明显变化(P>0.05)。结论腹腔镜辅助胃癌根治术治疗进展期远端胃癌具有创伤小、术中出血量少、术后并发症发生率低等优点,同时对患者营养状况的干扰要少于开腹组,更利于患者的恢复。
胃肿瘤; 腹腔镜; 营养状况; 胃癌根治术; 手术并发症; 前白蛋白; 白蛋白类; 总淋巴细胞计数; 血红蛋白
调查显示,我国每年新发胃癌40余万,死亡率约35%,是胃癌发病率和死亡率最高的国家之一[1-2]。目前,手术是治疗胃癌的主要方法,腹腔镜辅助胃癌根治术因微创、有效、安全的优点在临床应用越来越广泛,但是相较于传统开腹胃癌根治术,尤其是对进展期胃癌,腹腔镜操作技术要求高、难度大,能否达到根治肿瘤的标准尚存在争议[3-5]。血清前白蛋白等常作为胃癌患者围手术期的营养评价指标[6-7]。本研究通过比较腹腔镜辅助胃癌根治术与传统开腹胃癌根治术治疗进展期远端胃癌患者的术中、术后情况,以及患者手术前后血清前白蛋白(PA)、白蛋白(ALB)、总淋巴细胞计数(TLC)及血红蛋白(HGB)的变化,探讨腹腔镜辅助胃癌根治术的安全性。
1 资料与方法
1.1 一般资料
选取2012年6月至2015年6月在我院行远端胃癌根治术的120例进展期胃癌患者为研究对象,其中60例行腹腔镜辅助胃癌根治术(腹腔镜组),另60例行开腹胃癌根治术(开腹组)。腹腔镜组中男42例,女18例;年龄33~75岁;体质量指数(21.85±1.54)kg/m2;肿瘤直径(4.71±1.32)cm;TNM分期Ⅱ期35例,Ⅲa期12例,Ⅲb期9例,Ⅲc期4例;组织病理分型:低分化23例,中、高分化34例,黏液腺癌3例。开腹组中男39例,女21例;年龄35~78岁;体质量指数(21.33±1.34)kg/m2;肿瘤直径(4.59±1.43)cm;TNM分期Ⅱ期33例,Ⅲa期15例,Ⅲb期7例,Ⅲc期5例;组织病理分型:低分化22例,中、高分化33例,黏液腺癌5例。所有患者经胃镜和组织病理学检查确诊为进展期胃癌;术前经体检和影像学检查排除了远处转移、腹盆腔种植转移以及向周围组织器官广泛侵袭者,无心、脑、肺等重要器官功能不全和精神障碍者。两组患者年龄、性别、体质量指数、肿瘤大小、病理类型和TNM分期等差异无统计学意义(P>0.05),具有可比性。本研究经院医学伦理委员会批准,治疗前征得患者和家属同意并签署知情同意书。
1.2 治疗方法
1.2.1 开腹组 行传统开腹远端胃癌根治术。患者取仰卧位,行气管插管全身麻醉。取上腹正中部纵行左绕脐长约20 cm切口,护皮。处理胃周围血管后行D2淋巴清扫,根据患者情况行毕Ⅰ或毕Ⅱ式胃肠吻合,重建消化道。
1.2.2 腹腔镜组 行腹腔镜远端胃癌根治术。术前准备和麻醉同开腹组。于患者脐下置入套管作为观察孔,建立气腹,维持腹压在1.46~1.86 kPa,探查腹腔,确定肿瘤位置和大小;于左侧肋缘腋前线置入套管作为主操作孔,锁骨中线平脐及右侧相应位置分别置入5 mm套管以便超声刀游离胃周围的血管和组织。腹腔镜安置完毕后行D2淋巴结清扫术。超声刀离断大网膜范围由脾曲至胃网膜右动脉根部,剥离横结肠系膜前叶,夹闭胃网膜右动脉,依次清扫胃大弯侧淋巴结、结肠血管周围淋巴结和第6组淋巴结;游离小网膜,暴露肝总动脉、十二指肠动脉和肝固有动脉,清扫第5、8、12组淋巴结;游离胃右动脉并钳夹,于幽门右侧约4 cm处离断十二指肠,分离并充分暴露脾动脉、腹腔动脉和胃左动脉,钳夹离断胃左动脉,清扫第7、9、11组淋巴结;离断小网膜,清扫第1、2组淋巴结。取上腹正中切口5~6 cm长,将胃移出腹腔,于预切除位置切除肿瘤,根据患者情况行毕Ⅰ或毕Ⅱ式吻合,重建消化道,常规引流,缝合切口,术毕。
两组患者术后进行常规抗生素预防感染,患者恢复饮食前采用肠外营养支持,术后2周开始进食流食。
1.3 观察指标
比较两组手术时间、术中出血量、切口长度、淋巴结清扫数目,术后胃肠道功能恢复时间,术前1 d及术后1、7、10 d患者的C反应蛋白(C-reactive protein,CRP)水平,术后并发症发生情况以及住院时间,另外分别于手术前1 d、手术后1 d检测两组患者血清PA、ALB、TLC及HGB值。
1.4 统计学方法
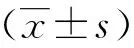
2 结果
2.1 两组患者术中指标的比较
腹腔镜组患者术中所用时间长于开腹组(P<0.01),而术中出血量以及切口长度均小于开腹组(P<0.01),两组术中清扫的淋巴结数目差异无统计学意义(P>0.05),见表1。
2.2 两组患者术后指标的比较
腹腔镜组住院时间和术后排气时间短于开腹组(P<0.01)。两组术前1 d的CRP水平差异无统计学意义(P>0.05);两组术后1 d的CRP水平均升高(P<0.05),且开腹组高于腹腔镜组(P<0.01);在术后7、10 d,两组CRP水平均逐渐降低,差异有统计学意义(P<0.01),且腹腔镜组的CRP水平比开腹组更低(P<0.05),见表2。
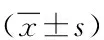
表1 腹腔镜组与开腹组患者术中指标的比较
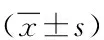
表2 腹腔镜组与开腹组患者术后指标的比较
注:*与开腹组相比,P<0.05;△与术前1 d相比,P<0.05
2.3 两组患者术后并发症发生率的比较
两组患者均顺利完成手术,腹腔镜组无中转开腹手术者。腹腔镜组术后并发肺部感染、肠梗阻和吻合口出血各1例,并发症总发生率为5.00%(3/60);开腹组术后并发肠梗阻3例,切口感染和肺部感染各2例,吻合口瘘、吻合口出血、术后胃瘫各1例,并发症总发生率为16.67%(10/60)。两组相比差异有统计学意义(P<0.05)。
2.4 两组手术前后相关营养指标的比较
术前两组患者的血清PA、ALB、TLC及HGB值差异均无统计学意义(P>0.05);手术后,两组患者的血清PA、ALB和HGB含量较术前上升(P<0.05),而又以腹腔镜组的改善程度好于开腹组(P<0.05),但两组的TLC均无变化(P>0.05),见表3、表4。
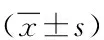
表3 腹腔镜组与开腹组术前血清PA、ALB、TLC、HGB的比较
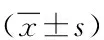
表4 腹腔镜组与开腹组术后血清PA、ALB、TLC、HGB的比较
注:*与开腹组相比,P<0.05;△与术前相比,P<0.05
3 讨论
上世纪90年代,Kitano等人首次将腹腔镜技术应用于早期胃癌根治术,经过20多年的应用和改进,其微创等优点已得到广泛认可[8]。进展期胃癌根治术对淋巴结清扫要求高,一般需要清扫至D2以上,但由于进展期胃癌患者的肿瘤周围血管、淋巴结转移多,解剖层面复杂,增加了手术的操作难度[9]。本研究结果显示,腹腔镜组手术耗时明显长于开腹组(P<0.05),可能与手术操作的熟练程度有关;但切口长度及术中出血量均小于开腹组(P<0.05),且淋巴结清扫数量两组的差异无统计学意义(P>0.05),说明腹腔镜辅助胃癌根治术能达到和传统开腹术相同的根治效果,而创伤更小。随着操作熟练程度提高,手术时间可能缩短。
CRP是一种参与炎症调节和感染反应的蛋白,腹部损伤后机体的CRP浓度会迅速升高,本研究中腹腔镜组的术后排气时间、CRP浓度以及住院时间均低于开腹组(P<0.05),表明腹腔镜胃癌根治术因创伤小,对患者的胃肠动力影响小,可降低术后急性期反应,减少感染发生率。同时,本研究结果显示,腹腔镜组术后并发症发生率明显低于开腹组,表明对进展期胃癌患者行腹腔镜辅助胃癌根治术具有较高的近期安全性。当然,远期疗效尚待进一步随访观察。
进展期胃癌患者消化道的消化、吸收能力降低,加上恶性肿瘤对机体的消耗,患者长期处于营养摄入不足的状态。有研究报道,患者术前以及术后的营养状况会影响到患者手术的耐受力及预后[10]。减少创伤、改善患者营养状况是临床始终关注的课题。血清PA在手术创伤或肝功能异常情况下会迅速降低,ALB是血液系统的重要组分,参与维持血液胶体渗透压,抗凝血,抑制血小板功能和转运氧自由基,PA、ALB的降低均会增加术后并发症的发生风险[11-12]。淋巴细胞主要参与机体免疫应答,HGB负责氧的运输,HGB降低会导致组织缺氧,影响组织修复愈合能力,TLC和HGB异常均会影响机体免疫功能和预后[13-14]。本研究发现,手术后两组患者血清PA、ALB和HGB均较术前升高,且腹腔镜组指标升高幅度多于开腹组(P<0.05);而两组手术前后TLC变化不明显(P>0.05),显示腹腔镜下胃癌根治术患者术后营养状态优于传统开腹胃癌根治术患者。
综上所述,腹腔镜辅助胃癌根治术治疗进展期远端胃癌患者具有创伤小、术后恢复快、并发症发生率低等优点,近期疗效优于传统开腹胃癌根治术,但是远期疗效尚有待进一步探讨。
[1] 郑朝旭, 郑荣寿, 张思维,等. 中国2010年胃癌发病与死亡分析[J]. 中国肿瘤, 2014, 23(10):795-800.
[2] 邹文斌, 李兆申. 中国胃癌发病率及死亡率研究进展[J]. 中国实用内科杂志, 2014,28(4):408-415.
[3] Hu JH, Tang HN, Ma YP, et al. Systemic analysis on laparoscope-assisted gastrectomy for patients with gastric cancer.[J]. Asian Pac J Cancer Prev, 2015, 16(5):2027-2029.
[4] 黄志清,李国新,许燕常,等. 腹腔镜辅助D2根治性全胃切除术与传统开腹手术的比较[J]. 中华胃肠外科杂志, 2014, 17(8):781-784.
[5] 刘江文,孙琳,仝德峰,等.远端进展期胃癌腹腔镜辅助与开腹 D2根治术淋巴结清扫的临床对照研究[J]. 中国微创外科杂志, 2014,14(11):981-983.
[6] 郭添羽,黄昌浩,袁伟杰.术前营养风险筛查对胃癌和结肠癌患者围手术期营养支持的临床意义[J].中国现代医学杂志,2016,26(5):119-123.
[7] Jiang N,Deng JY,Ding XW,et al.Prognostic nutritional index predicts postoperative complications and long-term outcomes of gastric cancer[J].World J Gastroenterol, 2014, 20(30):10537-10544.
[8] 韩晓鹏, 于建平, 刘宏斌,等. 应用无瘤技术行腹腔镜下胃癌D2根治术153 例[J]. 解放军医学杂志, 2014, 26(4):60-63.
[9] 颉宝平,雒芳芳,姚南,等.进展期胃癌腹腔镜手术对比传统开腹手术近期疗效的Meta分析[J].甘肃医药,2014,33(10):721-728.
[10] Horgan A.Pre-operative nutrition support in patients undergoing gastrointestinal surgery[J]. Tech Coloproctol, 2014, 18(11):1137-1138.
[11] 刘博. 胃癌全胃切除术后早期肠内营养支持的临床效果观察[J]. 海南医学, 2014, 25(3):338-340.
[12] Isik A, Okan I, Firat D, et al. A new prognostic strategy for gastric carcinoma: albumin level and metastatic lymph node ratio[J]. Minerva Chir, 2014, 69(3):147-153.
[13] 李晨. 胃癌患者术前中性粒细胞淋巴细胞比率(NLR)与淋巴结转移相关性临床研究[J]. 医学研究杂志, 2015, 44(1):93-97.
[14] Ye X, Liu J, Chen Y, et al. The impact of hemoglobin level and transfusion on the outcomes of chemotherapy in gastric cancer patients[J]. Int J Clini Exp Med, 2015, 8(3):4228-4235.
EffectoflaparoscopicradicalgastrectomyonPA,ALB,TLCandHGBlevelsinpatientswithadvancedgastriccancer
LIHaichun,XUJialiang,XIAOLei.
(DepartmentofSurgicalOncology,XinyangCentralHospital,Xinyang464000,China)
LIHaichun,Email:hxjuang213@163.com
ObjectiveTo investigate the effect of laparoscopic assisted gastrectomy on the safety of advanced gastric cancer and serum prealbumin (PA), albumin (ALB), total lymphocyte count (TLC) and hemoglobin (HGB).MethodsFrom January 2012 to June 2015, Xinyang Central Hospital recruited 120 patients with advanced gastric cancer. Sixty patients underwent laparoscopic assisted gastrectomy (the laparoscopic group) and 60 patients underwent gastrectomy (the open group). The levels of serum PA, ALB, TLC, HGB, operation time, intraoperative blood loss, hospitalization time, postoperative urination time, postoperative C-reactive protein (CRP) concentration, and postoperative complications were observed.ResultsThe time of the laparoscopic group was significantly longer than that of the open group (P<0.01). The intraoperative blood loss and incision length were lower than those in the open group (P<0.01). There was no significant difference in the number of lymph nodes removed (P>0.05). There were significant differences between the two groups in hospitalization time, postoperative urination time and postoperative CRP concentration (P<0.05). The incidence of postoperative complications in the laparoscopic group was significantly lower than that in the open group (P<0.05). The levels of PA, ALB and HGB in the two groups were significantly higher than those in the open group (P<0.05), the difference was not statistically significant (P>0.05). The improvement degree of the laparoscopic group was better than that of the open group (P<0.05), but there was no obvious change in TCL before and after operation between two groups (P>0.05).ConclusionsLaparoscopic assisted gastrectomy has the advantages of low trauma, less intraoperative blood loss and low incidence of postoperative complications of advanced gastric cancer. At the same time, the nutritional status of patients is with less interference than the open group, which is more conducive to patient recovery.
Advanced gastric cancer; Laparoscopy; Nutritional status; Radical gastrectomy; Complications of surgery; Prealbumin; Albumin; Total lymphocyte count; Hemoglobin
464000 河南 信阳,信阳市中心医院 肿瘤外科
李海春,Email:hxjuang213@163.com
10.3969/j.issn.1674-4136.2017.04.011
1674-4136(2017)04-0246-04
2016-09-25][本文编辑:李庆]
