低浓度重金属离子对脲酶活性的影响
2017-09-15姜丛慧郑艺华胡艳芳聂兆广
姜丛慧,郑艺华,胡艳芳,聂兆广
(1.青岛大学 化学化工学院,山东 青岛 266071;2.青岛大学 机电工程学院,山东 青岛 266071)
低浓度重金属离子对脲酶活性的影响
姜丛慧1,郑艺华2,胡艳芳1,聂兆广1
(1.青岛大学 化学化工学院,山东 青岛 266071;2.青岛大学 机电工程学院,山东 青岛 266071)
利用量热技术对脲酶的反应体系进行优化研究,并对各重金属离子抑制脲酶的活性进行研究。结果表明,在1.2 mL反应体系中,60U脲酶催化尿素时的最佳底物浓度为0.12 mol/L,磷酸缓冲溶液浓度为0.25 mol/L,最佳pH值为7.0。在此优化条件下,同时还发现在一定的重金属离子浓度范围内,Cu2+、Pb2+、Hg2+和Cd2+对脲酶有明显的抑制作用,且呈明显的线性关系,对脲酶的抑制程度大小为:Hg2+> Cu2+> Cd2+> Pb2+。
脲酶;量热法;重金属离子;抑制
脲酶,又称尿素酰胺水解酶,广泛存在于各种动物、植物、细菌、真菌和人体中,尤其是豆类中含量最为丰富,其活性中心含有两个金属镍离子,作为辅基对脲酶体系具有重要意义[1]。目前,脲酶存在的主要作用是将尿素变成可供有机体使用的氮源,在自然界氮的新陈代谢过程中扮演着重要角色。通常情况下,尿素极为稳定,不易水解,但是尿素在脲酶催化作用下的水解速率是无催化作用时的104倍[2]。由于脲酶不仅来源广泛,而且容易提取,所以它的价格低廉,除此之外,脲酶还具有对一些重金属离子的敏感度高等优点[3-4]。当脲酶活性中心的甲巯基或巯基与重金属离子结合后,其活性中心的性质与结构就会发生改变,酶的活力也会随着改变,最终使底物一酶系统中显色剂的吸光度、pH值、电导率、温度等都会发生改变,可以借助光信号、电信号和热信号等加以识别,重金属离子的含量就可以间接地被检测出来[5]。
近年来,酶抑制法因其快速简便、经济高效等优势,正迅速地被应用于环境污染和食品安全等方面的检测研究[6-7]。为了避免副产物、样品颜色和浊度等干扰因素的影响,本研究中将酶抑制法与简单易行的量热法结合起来对重金属离子溶液进行分析检测[8-10],具有潜在的社会效益和较强的实际意义,为监测环境污染提供了良好的判定依据。
1 实验材料和方法
1.1 供试材料及主要的试剂和仪器
实验材料主要有来自Sigma-Aldrich公司的脲酶,且配成300U/mL脲酶溶液于4℃下保存。
实验试剂主要有尿素、十二水磷酸二氢钠、二水磷酸氢二钠、硫酸铜、醋酸铅、硝酸镉和氯化汞,且皆为市售分析纯。
实验仪器主要有数字贝克曼温度计、分析天平、微量取样器等。
1.2 实验原理
本研究利用的是脲酶催化水解尿素的化学反应,此过程中脲酶能催化尿素水解经中间产物氨基甲酸盐,最终水解为氨和二氧化碳[2],同时伴随着焓变,能量以热的形式耗散。我们利用此反应的热效应可以对脲酶的各影响因素进行量热分析,来提高测量的灵敏度和分辨率;进而对重金属离子对脲酶的抑制程度进行量热分析,得出的其中关系可作为重金属离子定性和定量分析的判断依据。反应方程式:
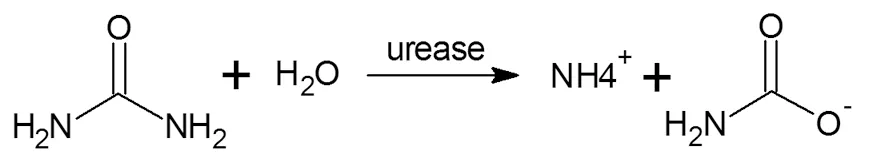
1.3 测定方法
1.3.1 优化实验的测定方法
采用两个数字式贝克曼温度计来测定,其中一个测反应溶液的温度变化,另一个同时测参比溶液的温度变化,目的是温度校正,消除环境温度波动和溶液扩散时温度波动对测量的影响。反应溶液:在酶促反应之前,尿素溶液和磷酸盐缓冲溶液的混合溶液的初始温度为T1,加入0.2 mL脲酶(60U),经过时间2min后,温度上升为T2,则反应溶液的温差为ΔT1(ΔT1=T2-T1)。参比溶液:尿素溶液和磷酸盐缓冲溶液的混合溶液的初始温度为T3,然后加入同体积的没有活性的脲酶或者蒸馏水,这个过程需要与反应溶液同步,2min后温度为T4,则参比溶液的温差为ΔT2(ΔT2=T4-T3)。
此过程必须要保温性能特别好,最好在绝热条件下测定。那么,脲酶催化尿素分解得到的热效应为ΔT(ΔT=ΔT1-ΔT2)。
1.3.2 重金属离子对脲酶抑制率的测定方法
采用数字式贝克曼温度计来测定。首先用上述方法(1)中测出不含金属离子溶液的反应体系热效应为ΔTa;然后在相同的反应条件下用相同方法测定出含有某种重金属离子溶液的反应体系热效应为ΔTb。
2 实验步骤
2.1 优化实验
2.1.1 最适底物浓度的选择
分别移取0.5 mL的0、0.03、0.06、0.09、0.12、0.15、0.18 mol/L尿素溶液和0.5 mL 0.25 mol/L磷酸盐缓冲溶液(pH值7.0)于2 mL小试管(套有很厚的保温棉)中混匀,再加入0.2 mL脲酶(60U)在室温25℃下按上述方法1.3.1可以测出它们的反应热效应ΔT,并比较考察底物浓度的影响。
2.1.2 最适磷酸盐缓冲溶液浓度的选择
分别移取0.5 mL0.10、0.15、0.20、0.25、0.30、0.35、0.40 mol/L磷酸盐缓冲溶液(pH值7.0)和0.5 mL的0.12 mol/L尿素溶液于2 mL小试管(套有很厚的保温棉)中混匀,再加入0.2 mL脲酶(60U)在室温25℃下按上述方法1.3.1可以测出它们的反应热效应ΔT,并比较考察磷酸盐缓冲溶液浓度的影响。
2.1.3 最适pH值的选择
分别移取0.5 mLpH值分别为6.0、6.5、7.0、7.5、8.0的0.25 mol/L磷酸盐缓冲溶液和0.5 mL的0.12 mol/L尿素溶液于2 mL小试管(套有很厚的保温棉)中混匀,再加入0.2 mL脲酶(60U)在室温25℃下按上述方法1.3.1可以测出它们的反应热效应ΔT,并比较考察酸碱度的影响。
2.2 重金属离子对脲酶的抑制实验
2.2.1 Cu2+对脲酶的抑制
配制0、1、2、3、4、5μmol/L铜离子溶液,再分别移取0.1 mL不同浓度的铜离子溶液、0.5 mL的0.25 mol/L磷酸盐缓冲溶液(pH值7.0)和0.5 mL的0.12 mol/L尿素溶液于2 mL小试管(套有很厚的保温棉)中混匀,再加入0.2 mL脲酶(60U)在室温25℃下按上述方法1.3.2可以得到反应热效应ΔT,并研究不同浓度铜离子对脲酶的抑制程度。
2.2.2 Pb2+对脲酶的抑制
配制0、20、40、60、80、100μmol/L铅离子溶液,同上方法研究不同浓度铅离子对脲酶的抑制程度。
2.2.3 Hg2+对脲酶的抑制
配制0、0.2、0.4、0.6、0.8、1.0μmol/L亚汞离子溶液,同上方法研究不同浓度亚汞离子对脲酶的抑制程度。
2.2.4 Cd2+对脲酶的抑制
配制0、4、8、12、16、20μmol/L镉离子溶液,同上方法研究不同浓度镉离子对脲酶的抑制程度。
3 结果与讨论
3.1 优化实验
3.1.1 最佳底物浓度的选择
不同的底物浓度对反应体系的影响见图1。

图1 不同浓度的尿素溶液对反应体系的影响
从图1可以看出,当尿素溶液的浓度低于0.12 mol/L时,其与分解时的热效应呈正比关系,此时的酶促反应速度随着底物浓度的增加而加快;当底物浓度超过0.12 mol/L时,曲线渐渐趋于平缓,底物浓度对其酶促反应的影响变小,原因可能是:(1)60U脲酶在1~2min内最多只能催化60μmol尿素,并释放出一定的热量;(2)当底物浓度过大时,有部分酶分子与底物相结合,进一步增加底物浓度也不能提高反应速度。因此,本研究中最佳底物浓度为0.12 mol/L。
3.1.2 最佳磷酸盐缓冲溶液浓度的选择
不同磷酸盐缓冲溶液的浓度对脲酶的影响见图2。
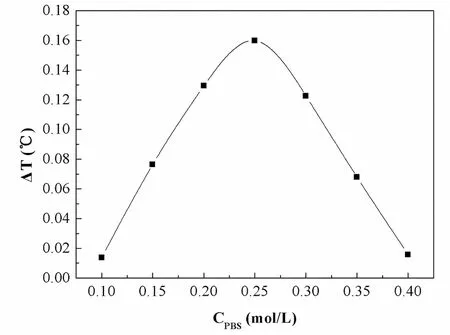
图2 不同浓度的磷酸盐缓冲溶液的对反应体系的影响
从图2中可以看出,磷酸盐缓冲溶液在0.1~0.25 mol/L范围内,反应的热效应随着磷酸盐缓冲溶液浓度的增加而增加;而当磷酸盐缓冲溶液浓度过高时,超过0.25 mol/L时,其趋势呈下降状态,其原因可能是缓冲溶液的浓度过高反而影响了反应体系环境的稳定性,也可能会对脲酶分子构型产生影响。因此,本研究中磷酸盐缓冲溶液的最佳浓度为0.25 mol/L。
3.1.3 最佳pH值的选择
不同的pH值对脲酶的影响见图3。
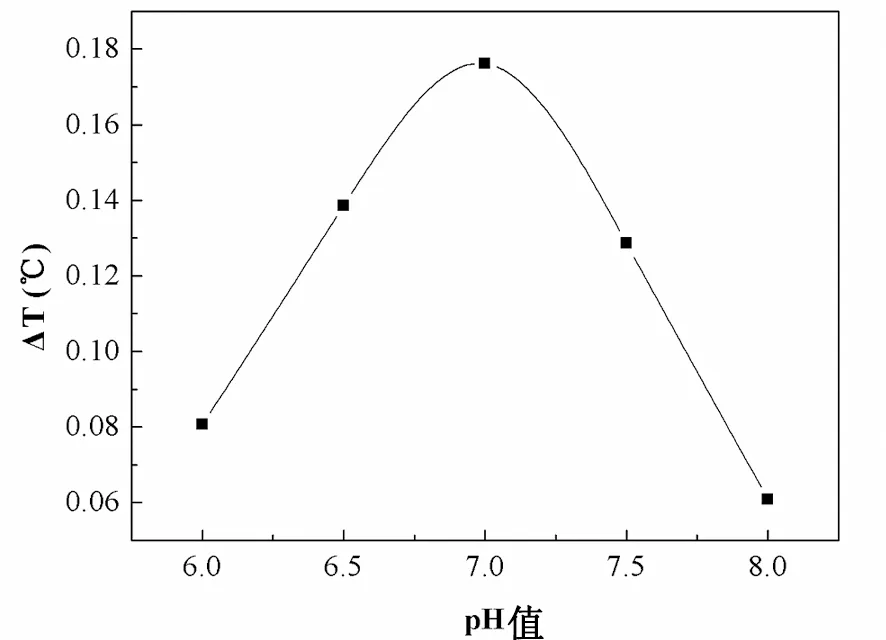
图3 不同pH值对反应体系的影响
从图3中可以看出,脲酶的适宜条件是偏中性的,当pH值≤7.0时,其热效应随着pH值的升高而升高;当pH值≥7.0时,它又随着pH值的降低而降低。这主要是因为pH值不仅能够影响脲酶的稳定性,还能影响脲酶与底物的结合,脲酶只有在一定的pH值范围内才具有最高的活力。因此,本研究中最佳pH值为7.0。
3.2 重金属离子对脲酶的抑制研究
3.2.1 Cu2+对脲酶的抑制研究
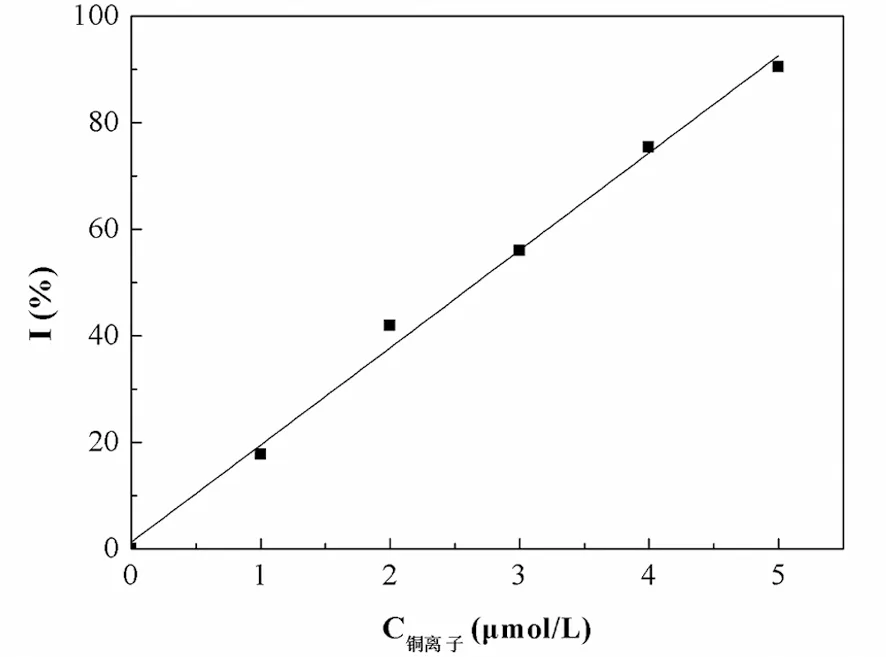
图4 不同浓度的铜离子溶液对脲酶的影响
从图4可以看出,当铜离子溶液的浓度在0~5μmol/L时,其对脲酶的抑制率与铜离子浓度呈很好的线性关系,即y=18.2646x+1.2558(x:铜离子溶液的浓度,μmol/L;y:抑制率I,%),R2=0.9942。
3.2.2 Pb2+对脲酶的抑制研究

图5 不同浓度的铅离子溶液对脲酶的影响
从图5可以看出,当铅离子溶液的浓度在0~100μmol/L时,其对脲酶的抑制率与铅离子浓度呈很好的线性关系,即y=0.9583x+2.9492(x:铅离子溶液的浓度,μmol/L;y:抑制率I,%),R2=0.9952。
3.2.3 Hg2+对脲酶的抑制研究
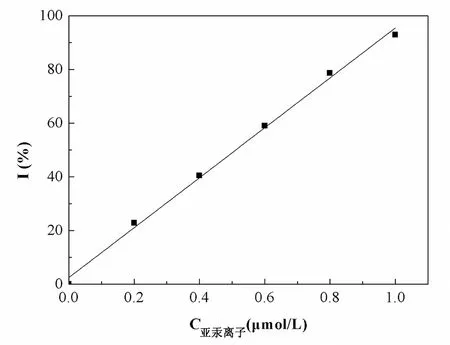
图6 不同浓度的亚汞离子溶液对脲酶的影响
从图6可以看出,当亚汞离子溶液的浓度在0~1.0μmol/L时,其对脲酶的抑制率与亚汞离子浓度呈很好的线性关系,即y=92.9765x+2.4776(x:亚汞离子溶液的浓度,μmol/L;y:抑制率I,%),R2=0.9960。
3.2.4 Cd2+对脲酶的抑制研究
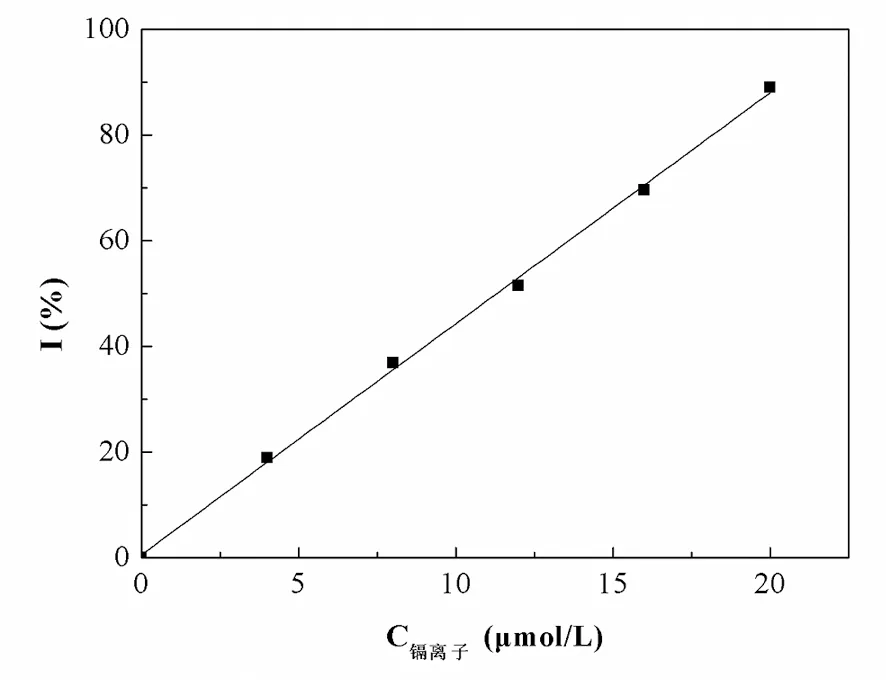
图7 不同浓度的镉离子溶液对脲酶的影响
从图7可以看出,当镉离子溶液的浓度在0~20μmol/L时,其对脲酶的抑制率与镉离子浓度呈很好的线性关系,即y=4.3701x+0.5910(x:镉离子溶液的浓度,μmol/L;y:抑制率I,%),R2=0.9983。
4 结论
本研究利用量热技术对重金属离子抑制脲酶的活性进行了研究,发现脲酶的活性受到底物浓度影响的同时,也对其它条件,如缓冲溶液的浓度、pH值等非常敏感。因此,根据脲酶的酶学性质对量热体系进行了一系列优化,从结果可以看出,在1.2 mL的反应体系中最佳的底物浓度是0.12 mol/L,最适pH值在7.0左右,最佳的磷酸盐缓冲溶液浓度为0.25 mol/L。
重金属离子与酶蛋白侧链残基结合而使酶的活性受到一定的影响,不同金属离子对酶的影响不同,它们对酶的结构和功能所起的作用也不相同。在最佳反应条件下,发现在一定的重金属离子浓度范围内,Cu2+、Pb2+、Hg2+和Cd2+对脲酶有明显的抑制作用,且呈明显的线性关系,同时还对这几种重金属离子对脲酶活性的抑制程度进行了比较:Hg2+> Cu2+> Cd2+> Pb2+。
利用量热技术能克服副产物、样品颜色和浊度等干扰因素的缺点,具有较高的灵敏度且易于操作,是重金属污染检测的有效手段,对今后的环境检测和食品安全等方面具有非常重要的实际意义。
[1] 吕 婧.脲酶结构与功能的动力学研究及其抑制剂的设计筛选[D].杭州:浙江大学,2011.
[2] 赵圣国,王加启,刘开朗,等.脲酶在生物工程中的应用[J].生物技术通报,2009(3):37-41.
[3] 华银锋,陆贻通.脲酶抑制法检测环境样品中重金属离子研究[J].上海环境科学,2003,22(12):939-942.
[4] 孙旭东,聂兆广,郑艺华,等.低浓度重金属离子的富集及其脲酶活性影响[J].青岛大学学报(工程技术版),2010,25(4):76-82.
[5] 宋熙熙.蛋白质-表面活性剂相互作用及酶催化反应的量热学研究[D].杭州:浙江大学,2008.
[6] 孙博思,赵丽娇,任 婷,等.水环境中重金属检测方法研究进展[J].环境科学与技术,2012,35(7):157-162.
[7] 王玉弢.食品中重金属检测方法研究探讨[J].科技视界,2014,5(27):357-358.
[8] Bianconi M L.Calorimetry of enzyme-catalyzed reactions[J].Biophysical Chemistry,2007,126(3):59-64.
[9] Oehlschläger K,Hüttl R,Wolf G.Calorimetric investigations of urease inhibition by heavy metal ions[J].Thermochimica Acta,1998,310:185-189.
[10] Hüttl R,Bohmhammel K,Wolf G,et al.Calorimetric investigations into enzymatic urea hydrolysis[J].Thermochimica Acta,1995,250:1-12.
(本文文献格式:姜丛慧,郑艺华,胡艳芳,等.低浓度重金属离子对脲酶活性的影响[J].山东化工,2017,46(11):7-9,12.)
Effects of Low Concentration Heavy Metal Ions on the Activity of Urease
JiangConghui1,ZhengYihua2,HuYanfang1,NieZhaoguang1
(1.College of Chemistry and Chemical Engineering,Qingdao University,Qingdao 266071,China; 2.College of Mechanical and Electrical Engineering,Qingdao University,Qingdao 266071,China)
The incubated conditions of 1.2 mL reaction system were optimized using the calorimetric method. The relations about the corresponding temperature change with different concentration of the heavy metal ions and the kind of the ions were studied. The results showed that 0.5mL urea(0.12 mol/L) and 0.2mL free urease(60U) were incubated in 0.5 mL phosphate buffer solution(0.25 mol/L, pH7.0), which were found to be the optimum reaction conditions. Under the optimum conditions,it was found that Cu2+, Pb2+, Hg2+and Cd2+had obvious inhibition on urease in a certain concentration range,and there was a significant linear relationship between the concentration of some heavy metal ions and the inhibition rate. The sequence of the inhibition on urease by different heavy metal ions was Hg2+> Cu2+> Cd2+> Pb2+.
urease;calorimetry;heavy metal ions;inhibition
2017-04-11
山东省自然科学基金项目(ZR2014EEM004);山东省重点研发计划项目(2015GSF117019)
姜丛慧(1992—),女,江苏南通人,在读硕士研究生,研究方向:生物传感器;通讯作者:聂兆广,副教授,研究方向为催化反应工程。
O642.3
A
1008-021X(2017)11-0007-03
