纳米铁酸钙的光催化活性与催化机理研究
2017-09-15薛红艳
薛红艳
纳米铁酸钙的光催化活性与催化机理研究
薛红艳
(永城职业学院食品化工系,河南永城476600)
采用一种改进的聚丙烯酰胺凝胶法合成了纳米铁酸钙,并研究了它的光催化活性。X射线衍射分析表明,制备的纳米铁酸钙主要为正交尖晶石相,无其他杂质相存在。利用紫外-可见吸收光谱研究了铁酸钙的光吸收特性,其带隙值约为1.83 eV。利用偶氮染料亚甲基蓝为目标降解物,研究了纳米铁酸钙的光催化活性,结果表明纳米铁酸钙在模拟太阳光辐照下具有良好的光催化活性。基于实验结果,研究了铁酸钙纳米颗粒的光催化机理。
聚丙烯酰胺凝胶法;铁酸钙;光催化活性;亚甲基蓝;光催化机理
铁酸钙是一种窄带隙半导体材料,带隙值约为1.89 eV,其对甲基蓝染料降解具有高的光催化活性。众所周知,光催化剂的形貌、尺寸、维度以及缺陷对其光催化活性将产生巨大的影响,特别是纳米材料通常比块体材料具有更优越的性质,因此纳米级铁酸钙光催化剂也被期盼着展示其更强的光催化活性以及新的性质。目前,制备纳米铁酸钙的方法很多,包括湿化学法、微波烧结技术以及共沉淀法等。其中湿化学法是一种制备纳米材料的有效方法,通过改变前驱体的组分、比例以及添加易去除的有机物等可以获得尺寸可控的纳米材料。聚丙烯酰胺凝胶法是湿化学法的一种,已被广泛用于制备纳米金属氧化物材料,包括多铁性材料、发光材料、纳米复合材料以及光催化剂等。通过调节单体与交联剂的比例以及改变螯合剂、pH及金属源的种类等可以合成出不同粒径的目标产物。最近,Wang等[1]采用这一方法制备了纳米铁酸钙磁性材料,其在室温下表现出顺磁行为;通过添加少量炭颗粒或改变多糖成分可以获得颗粒尺寸均匀、细小的纳米颗粒[1-2]。尽管Wang等获得了高分散的铁酸钙纳米颗粒,然而他们并未对纳米铁酸钙的光催化活性进行研究。因此,笔者采用改进的聚丙烯酰胺凝胶法制备了铁酸钙纳米颗粒,利用X射线衍射仪、紫外可见漫反射光谱仪对铁酸钙纳米颗粒的相纯度和光学性质进行了研究;利用721分光光度计对铁酸钙纳米颗粒在不同光照时间、染料质量浓度以及催化剂用量条件下的光催化活性进行了研究;基于实验结果,对铁酸钙纳米颗粒的光催化机理进行了讨论。
1 实验部分
1.1 铁酸钙纳米颗粒制备
在文献[2]基础上进行铁酸钙纳米颗粒的制备。将购买的炭颗粒用酒精清洗数遍,然后倒入去离子水清洗残余的酒精。按照n(Ca)∶n(Fe)=1∶2称取适量Ca(NO3)2·4H2O(99%)和Fe(NO3)3·9H2O(99.9%),缓慢将两种硝酸盐溶解在0.001 5 mol/L的稀硝酸溶液中,并将一定量炭颗粒倒入溶液中。选择金属硝酸盐的目的是为了不引入其他影响目标产物相纯度、形貌以及性质的杂质阴离子。待两种金属硝酸盐完全溶解后,加入与金属阳离子(Ca和Fe)物质的量比为1.5∶1的络合剂乙二胺四乙酸(EDTA),使其与Ca、Fe金属阳离子发生络合反应。待EDTA完全溶解后,加入防止凝胶在干燥过程中坍塌缩小的20 g葡萄糖,随后加入丙烯酰胺单体,随即加入与丙烯酰胺物质的量比为5∶1的亚甲基双丙烯酰胺,二者总物质的量是金属阳离子的9倍。为防止加入的丙烯酰胺在加热过程中迅速反应生成链状聚丙烯酰胺,在丙烯酰胺未完全溶解时就加入亚甲基双丙烯酰胺。上述每一步均需磁力搅拌,以使添加的原料充分溶解。待溶液混合均匀后,用氨水调节pH为3。将所得溶液加热至90℃,使丙烯酰胺与亚甲基双丙烯酰胺发生热聚合反应生成三维网状聚合物网络,约0.5 h后溶液成胶转变为红棕色凝胶体。将红棕色凝胶放入恒温干燥箱中在120℃干燥24 h形成黑色干凝胶。将干凝胶研磨成细粉,放入箱式炉中在800℃烧结5 h,制得纳米铁酸钙。
1.2 铁酸钙纳米颗粒表征
采用D8 Advanced型X射线衍射仪对纳米铁酸钙的物相进行分析。采用UV-2500型紫外可见分光光度计测试样品的光吸收特性。
1.3 铁酸钙纳米颗粒光催化活性评价
以亚甲基蓝偶氮染料为目标降解物研究纳米铁酸钙的光催化活性。将亚甲基蓝溶于去离子水中配成一定质量浓度的溶液。将一定量纳米铁酸钙加入亚甲基蓝溶液中,在暗室超声处理20 min以使纳米颗粒均匀分散,然后采用模拟太阳光辐照该溶液进行降解脱色实验。为防止纳米颗粒团聚,在光照过程中需连续磁力搅拌。光催化结束后,亚甲基蓝溶液用滤纸过滤去除铁酸钙颗粒,然后用721分光光度计测试亚甲基蓝的质量浓度(λ=665 nm),计算其降解率:η=(ρ0-ρt)/ρ0×100%。式中:ρ0和ρt分别为光照前和光照t时刻亚甲基蓝的质量浓度。
2 结果与讨论
2.1 铁酸钙样品XRD分析
图1是制备的铁酸钙样品XRD谱图。从图1看出,所有衍射峰都可以按正交相CaFe2O4标定(JCPDS 32-0168),没有出现Fe2O3、Fe3O4、CaO等其他杂质相衍射峰。为获得铁酸钙晶胞参数和晶粒尺寸等信息,利用Jade 6.0软件得到样品(040)(121)(241)峰的晶面间距d分别为2.659 9、2.520 5、1.831 3,利用公式(1/d2=h2/a2+k2/b2+l2/c2:d为晶面间距;h、k、l为晶面指数;a、b、c为晶格常数)通过计算得到样品的晶胞参数:a=0.928 9 nm、b=1.064 0 nm、c=0.300 9 nm。根据谢乐公式[D=kλ/(β·cos θ):k、D、 λ分别为晶粒形状因子、晶粒尺寸和X射线波长;θ为衍射峰(040)(121)(241)对应的衍射角分别为33.667、35.589、49.748;β为衍射峰(040)(121)(241)对应的半高宽分别为0.338、0.261、0.272]可以估算铁酸钙样品的晶粒尺寸约为29.242 9 nm。XRD计算结果比Wang等[2]通过扫描电镜(SEM)观察的颗粒尺寸要小。这可能存在两方面的原因:一是实验误差的影响;二是XRD计算出来的是晶粒尺寸,而SEM观察到的是由许多晶粒组成的颗粒[3-6]。
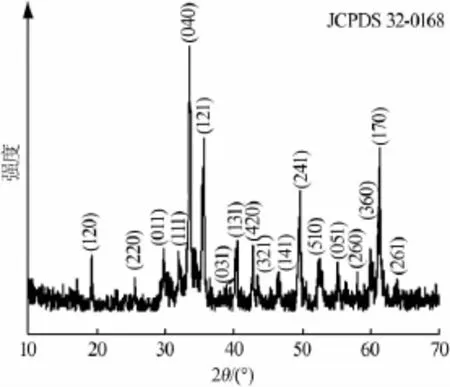
图1 制备的铁酸钙样品XRD谱图
2.2 铁酸钙纳米颗粒紫外-可见光吸收光谱分析
图2a为铁酸钙纳米颗粒紫外-可见吸收光谱。从图2a看出,铁酸钙纳米颗粒截止吸收波长约为1 000 nm,表明其能吸收所有颜色可见光谱(390~780 nm)的入射光,有可能在可见光催化降解有机物方面表现出较高的光催化活性。图2b是根据Tauc公式[7]获得的(αhν)1/2-hν关系曲线。式中:α、hν分别为吸收系数和入射光子能量。将Tauc曲线的线性部分外延至横坐标,交点处为铁酸钙带隙值(Eg),约为1.83 eV。与文献[8-9]相比,实验所得带隙值略小。
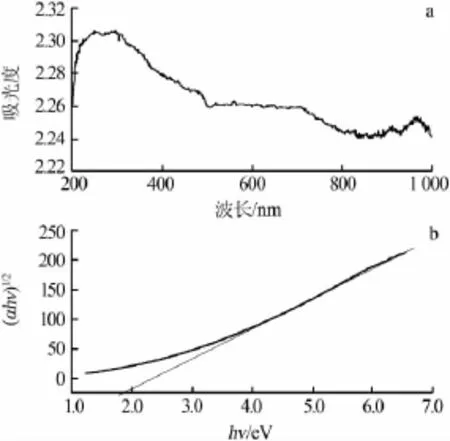
图2 铁酸钙纳米颗粒紫外-可见吸收光谱(a)以及(αhν)1/2-hν关系曲线(b)
2.3 光照时间对亚甲基蓝降解率的影响
图3a为铁酸钙纳米颗粒在模拟太阳光辐照下对亚甲基蓝降解率随时间的变化。亚甲基蓝初始质量浓度为15 mg/L,铁酸钙纳米颗粒质量浓度为1.2 g/L。为对比,在暗室中做了吸附实验以及不加催化剂仅光照的空白实验。结果表明:在暗室中铁酸钙的吸附几乎可以忽略;在不加催化剂条件下,经过150 min模拟太阳光辐照,亚甲基蓝降解率仅为3.8%左右;当加入铁酸钙催化剂并在模拟太阳光下辐照后,亚甲基蓝降解率达到90%左右;和P25 TiO2相比铁酸钙光催化活性大大增强。
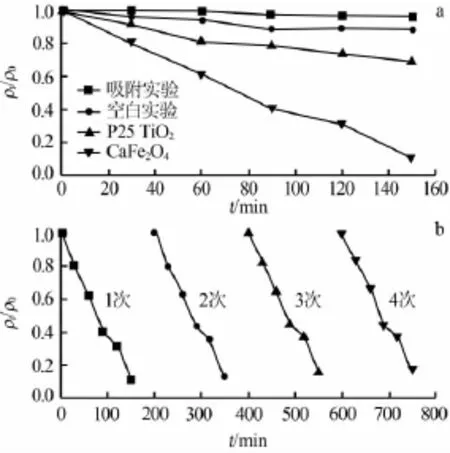
图3 铁酸钙纳米颗粒(a)及其重复使用(b)对亚甲基蓝的降解率随时间的变化
为研究光催化剂循环利用的效率,图3b给出了重复使用铁酸钙纳米颗粒对亚甲基蓝降解率与时间的关系。每次光催化实验结束后,均将光催化剂过滤、烘干然后重复使用。实现发现,光催化剂循环使用4次后亚甲基蓝降解率仅略微下降,表明可将光催化剂反复使用。
2.4 光催化机理
在光催化过程中导带电位和价带电位扮演了重要角色。CaFe2O4纳米颗粒导带电位(ECB)和价带电位(EVB)可用公式(1)(2)计算[10]得到。

式中:X为CaFe2O4纳米颗粒绝对电负性,可用公式(3)计算得到;Ee为自由电子在氢标定下的能量,取4.5 eV;Eg为CaFe2O4纳米颗粒带隙值,通过图2b可知约为1.83 eV。

式中:XCa、XFe、XO分别代表Ca、Fe、O元素绝对电负性,分别为2.20、4.06、7.54 eV(通过查表可知)。由式(3)可得X=5.30 eV。根据公式(1)(2)计算可知ECB=-0.115 eV和EVB=1.715 eV。
为更清晰地研究CaFe2O4纳米颗粒可能的光催化机理,图4给出了CaFe2O4纳米颗粒可能的光催化机理示意图。当一束能量大于CaFe2O4纳米颗粒带隙值(Eg)的光照射到该纳米颗粒表面时,价带电子将被激发跃迁到导带上,形成电子-空穴对。其中空穴(h+)处于价带位置,而电子(e-)位于导带位置,如式(4)所示。这些电子-空穴对迁移至CaFe2O4纳米颗粒表面,被不同陷阱捕获生成不同反应的活性物种。在光催化反应中,羟基自由基(·OH)和光生空穴(h+)通常是光催化降解有机污染物染料的主要活性物种。其中,价带上的光生空穴与吸附在CaFe2O4纳米颗粒表面的氢氧根(OH-)和水反应生成羟基自由基如式(5)(6)所示,但由于H2O/·OH和OH-/·OH的氧化还原电位分别是2.72 eV和1.89 eV[11],因此式(5)(6)的反应在CaFe2O4纳米颗粒光催化降解亚甲基蓝过程中无法进行。然而,有意义的是一部分光生空穴也能和染料分子作用生成无毒无害的产物,如式(8)所示。
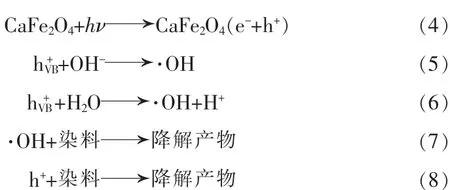
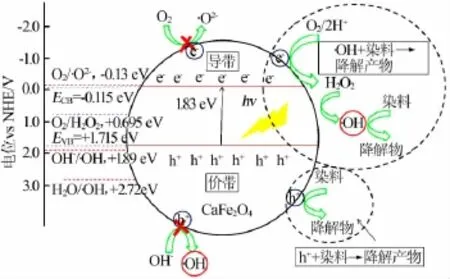
图4 CaFe2O4纳米颗粒可能的光催化机理示意图
另外,O2/H2O2氧化还原电位为+0.695 eV[12],高于CaFe2O4纳米颗粒的导带电位,因此在CaFe2O4纳米颗粒的导带能发生(9)(10)两个反应,生成的羟基自由基和染料作用发生式(7)反应。由于O2/·O2-氧化还原电位为-0.13 eV[13],因而光生电子很难与O2反应生成·O2-自由基。
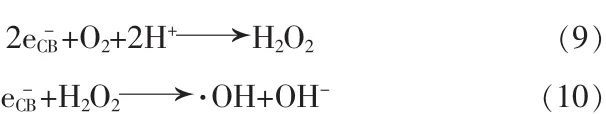
2.5 催化剂加载量及亚甲基蓝初始质量浓度对亚甲基蓝降解率的影响
众所周知,催化剂加载量和染料浓度对催化降解有机物降解率会造成影响。图5a为纳米铁酸钙光催化剂加载量对有机染料亚甲基蓝降解率的影响,亚甲基蓝初始质量浓度为15 mg/L,光照150 min。从图5a看出,随着催化剂用量增加亚甲基蓝降解率先增加后降低。当催化剂质量浓度小于1.2 g/L时有机染料的降解率随着催化剂质量浓度的增加而增加。可能的原因是,随着催化剂用量的不断增加,整个过程中光子的利用率增大,从而导致光催化反应过程中产生了大量的催化活性中心,进而增大有机染料的降解率。当催化剂质量浓度增加到1.2 g/L时有机染料的降解率最大,表明光催化效果达到最佳。然而,催化剂质量浓度大于1.2 g/L时有机染料的降解率呈现下降趋势。其原因可能是由于过量催化剂纳米颗粒对入射光的散射作用突出,光子利用率下降。
图5b为亚甲基蓝初始质量浓度对其降解率的影响。铁酸钙光催化剂质量浓度为1.2 g/L,光照150 min。实验表明,随着亚甲基蓝染料初始质量浓度增加其降解率呈现先增加后降低趋势。当染料质量浓度为15 mg/L时其降解率最大。其原因有二:一是染料浓度太大容易导致溶液透光率下降进而造成溶液中参与光催化降解反应有效光子数目减少;二是过量的有机物分子被吸附到铁酸钙催化剂表面导致活性位减少。二者相互作用导致染料降解率降低。
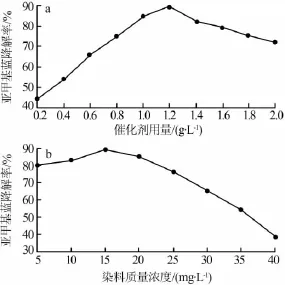
图5 催化剂用量(a)及亚甲基蓝初始质量浓度(b)对亚甲基蓝降解率的影响
3 结论
采用改进聚丙烯酰胺凝胶法制备了纳米铁酸钙光催化剂。XRD结果表明,制备的铁酸钙纳米颗粒为正交尖晶石结构。紫外-可见光吸收光谱分析表明,铁酸钙纳米颗粒带隙值为1.83 eV,比文献结果略小。模拟太阳光光催化实验结果表明,铁酸钙光催化剂对亚甲基蓝具有良好的光催化降解作用,其适宜加载量为1.2 g/L,适宜染料质量浓度为15 mg/L。
[1]Wang S F,Li Q,Zu X T,et al.Phase controlled synthesis of(Mg,Ca,Ba)-ferrite magnetic nanoparticles with high uniformity[J].J. Magn.Magn.Mater.,2016,419:464-475.
[2]Wang S F,Zu X T,Sun G Z,et al.Highly dispersed spinel(Mg,Ca,Ba)-ferrite nanoparticles:Tuning the particle size and magnetic properties through a modified polyacrylamide gel route[J].Ceram. Int.,2016,42(16):19133-19140.
[3]饶群力,路庆华,毕刚,等.纳米SiC颗粒SAXS表征及其与XRD、SEM的比较[J].上海交通大学学报,2004,38(10):1665-1668.
[4]王云,王虹,孙光爱,等.SnO2纳米颗粒的制备及其发光性能[J].材料研究学报,2014,28(6):420-426.
[5]查正兴,王小梅,何慧悦,等.钛铁矿微波场中氧化-还原反应的研究[J].无机盐工业,2015,47(6):23-26.
[6]付靖春.高纯球状碳酸钡晶体的制备研究[J].无机盐工业,2016,48(10):50-53.
[7]Tauc J.Optical properties and electronic structure of amorphous germanium[J].Phys.StatusSolidiB,1966,15(2):627-637.
[8]Zhang Z J,Wang W Z.Solution combustion synthesis of CaFe2O4nanocrystal as a magnetically separable photocatalyst[J].Mater. Lett.,2014,133:212-215.
[9]Dom R,Subasri R,Radha K,et al.Synthesis of solar active nanocrystalline ferrite,MFe2O4(M:Ca,Zn,Mg)photocatalyst by microwave irradiation[J].Solid State Commun.,2011,151(6):470-473.
[10]MorrisonSR.Electrochemistryatsemiconductorandoxidizedmetal electrodes[M].New York:Plenum Press,1980.
[11]Tachikawa T,Fujitsuka M,Majima T.Mechanistic insight into the TiO2photocatalytic reactions:Design of new photocatalysts[J].J. Phys.Chem.:C,2007,111(14):5259-5275.
[12]Jiang H Y,Cheng K,Lin J.Crystalline metallic Au nanoparticleloaded α-Bi2O3microrods for improved photocatalysis[J].Phys. Chem.Chem.Phys.,2012,14(35):12114-12121.
[13]Arai T.Efficient complete oxidation of acetaldehyde into CO2over
CuBi2O4/WO3composite photocatalyst under visible and UV light irradiation[J].J.Phys.Chem.:C,2007,111(21):7574-7577.
联系方式:24853198@qq.com
Photocatalytic activity and mechanism of nano-CaFe2O4
Xue Hongyan
(School of Food and Chemical Engineering,Yongcheng V ocational College,Yongcheng 476600,China)
A modified polyacrylamide gel route was introduced to synthesize CaFe2O4nanoparticles,where the photocatalytic activity of nano-CaFe2O4was investigated.X-ray diffraction(XRD)analysis indicated that the as-synthesized nano-CaFe2O4had a orthorhombic spinel structure without the presence of any other impurities.Ultraviolet-visible absorption spectroscopy was used to investigate the light-absorbing properties of nano-CaFe2O4,and the value of the bandgap energy was about 1.83 eV. The photocatalysis experiments revealed that the nano-CaFe2O4exhibited a pronounced photocatalytic activity for the methylene blue decomposition under simulated sunlight irradiation.The photocatalytic mechanism of nano-CaFe2O4has been discussed on the basis of the experimental results.
polyacrylamide gel technique;CaFe2O4;photocatalytic activity;methylene blue;photocatalytic mechanism
O463
A
1006-4990(2017)09-0085-04
2017-03-15
薛红艳(1982—),女,硕士研究生,讲师,研究方向为纳米材料、新型高分子材料、煤化工。
