高效制取磷酸二氢钾的优化中和法工艺研究*
2017-09-15周权宝李步通吴颖乔韦绪琴匡林英赵曼
周权宝,李步通,吴颖乔,韦绪琴,匡林英,赵曼
高效制取磷酸二氢钾的优化中和法工艺研究*
周权宝,李步通,吴颖乔,韦绪琴,匡林英,赵曼
(贵州师范学院化学与生命科学学院转化与分离研究所,贵州贵阳550018)
以工业磷酸和碳酸钾为原料,在饱和磷酸二氢钾溶液中通过反应、蒸发、25℃结晶循环制取磷酸二氢钾产品,饱和磷酸二氢钾母液采用二氧化硅吸附剂吸附净化后重复使用。用磷钼蓝分光光度法及邻菲啰啉分光光度法分别对磷酸二氢钾产品中的磷及铁元素含量进行测定。结果表明:所得磷酸二氢钾产品具有较高的纯度以及较低的铁杂质含量;二氧化硅吸附剂的使用能够在较低的产率损耗下有效地降低产品中的杂质含量。对比传统的中和法,该方法具有流程短、操作简单、产品质量稳定、杂质含量低、耗水少、耗能低等明显的优势。
磷酸二氢钾;饱和溶液;吸附;循环过程
磷酸二氢钾作为一种重要的无机化工原料,在现代工业、农业、医药、食品、石油等方面均有广泛的应用[1-3]。除中和法外,目前生产KH2PO4的方法还有复分解反应法、萃取法、离子交换法、结晶法等[1-8]。作为一种早期的生产方法,中和法具有工艺流程短、技术成熟、产品质量高等优点[1-3,6,9]。但是,由于原料KOH或碳酸钾的价格高于氯化钾,使得中和法逐渐失去市场竞争力。通过复分解反应法,以氯化钾与H3PO4为原料可以制得KH2PO4,但需除去副产物HCl,故反应必须在较高的温度和较低的气压中进行。该方法明显降低了原料成本,但是大量挥发的盐酸会给设备带来严重腐蚀,较高的温度导致生成焦磷酸盐等副产物[1-3,6]。萃取法是在反应体系中加入有机溶剂,使磷酸进入有机相与氯化钾反应生成KH2PO4并从中析出,有机相回收HCl后可以重复使用。该方法具有过程简单、反应条件温和、有机溶剂可循环利用等优点[8]。但是,有机溶剂价格昂贵,存在溶解损失、回收困难以及排放污染等问题[10-13]。离子交换法是利用阴离子或阳离子交换树脂对K+和H2PO4-的吸附再生过程来合成KH2PO4[14-15]。该方法能将原料较好地转化成产物,同时阴离子或阳离子交换树脂还能循环利用。但是,由于离子交换树脂价格昂贵、再生困难且容易中毒限制了其使用[2,4,6,9]。从节约成本的角度考虑,制备KH2PO4目前趋向于采用湿法磷酸作原料这就必须除掉其中的多种杂质离子,另外使用氯化钾作原料还要除掉大量生成的氯化氢,要解决这些问题并不容易。反观中和法,一些联产程度很高的化工企业若既能生产湿法磷酸又能生产碳酸钾,采用中和法生产KH2PO4仍然是一种最优的选择。目前,中国采用中和法生产KH2PO4的产能在KH2PO4总产能中仍然占相当大的比重[16],因此对传统中和法生产企业进行工艺优化具有重要意义。另外,现代的化工生产日益向定量化方向发展,若对中和法生产KH2PO4涉及的大量电解质溶液的热力学过程加以定量研究,对K2O-P2O5-H2O体系相图以及对KH2PO4、碳酸钾的溶解度特征加以分析与利用,仍然能够创新性地优化工艺操作过程,有效地提高产品质量和降低生产成本。
1 实验部分
1.1 试剂及仪器
试剂:85%磷酸(工业级,瓮福集团有限公司),吸附剂(SiO2颗粒,粒度为150~300 μm,山西富宏矿物制品公司),98%硫酸、65%~68%硝酸、36%~38%盐酸、碳酸钾、KH2PO4溶液(磷质量浓度为100mg/L)、二水合氯化亚锡、钼酸铵[(NH4)6Mo7O24·4H2O]、无水亚硫酸钠、硫酸铁铵、盐酸羟胺、邻菲啰啉均为分析纯。仪器:ME204型电子天平;DSHZ-300A型水浴恒温振荡器;UV-5500型紫外可见分光光度计。
1.2 实验原理
磷酸与碳酸钾按物质的量比为2∶1反应,反应方程式:

图1为25℃K2O-P2O5-H2O三元体系相图[17]。该反应体系产物复杂,不同n(K2O)/n(P2O5)时所得产物有KH2PO4、K2HPO4、K3PO4及其水化物,当磷酸比例较多时将产生过磷酸盐类。实际上,当n(K2O)/ n(P2O5)为0.8~1.1时能够通过溶解度差异析出KH2PO4单一盐产品,进一步分析0~75℃条件下K2O-P2O5-H2O三元体系相图[15]可知,在此温度范围内不会生成磷酸盐副产物。

图125 ℃条件下K2O-P2O5-H2O三元体系相图[17]
反应在室温(25℃)、n(K2O)/n(P2O5)为1∶1、饱和的KH2PO4溶液中进行(图1中R点)。在此条件下产物的转化率高、温度易于控制、操作容易进行,而且生成的KH2PO4溶解度最小,易于从溶液中析出。除了碳酸钾原料,从节约成本的角度考虑,实际的工业生产中常以质量分数为20%~30%的湿法磷酸作原料。湿法磷酸经萃取—反萃净化可得到工业级及以上的磷酸。为简化问题,直接采用净化的湿法磷酸即质量分数为85%的工业磷酸作原料。
图1中R点(100 g饱和溶液)K2O、P2O5、H2O质量分别为6.876、10.362、82.762 g[17],相当于19.868 g KH2PO4溶于80.132 g水形成的饱和溶液。依反应(1)换算成相应的反应物K2CO3为10.089 g、H3PO4为14.307 g,换算成85%H3PO4则为16.832 g。反应物带入溶剂水和化合水分别为2.525、1.315g共计3.840g。故形成饱和溶液还需要加入的水应为78.922 g。另一方面,要使工艺过程能够持续循环进行,碳酸钾、85%磷酸、应蒸发的水按质量计应分别为10.089、16.832、3.840g,则原料全部转化为KH2PO4结晶析出。
以85%磷酸和碳酸钾为原料制取磷酸二氢钾工艺流程见图2。将85%磷酸加入溶有碳酸钾的饱和KH2PO4溶液中,充分反应后趁热蒸发掉反应物带入的溶剂水和化合水,降温至25℃结晶,过滤、烘干即得到KH2PO4产品,母液加入洁净的SiO2颗粒吸附净化杂质后循环使用。
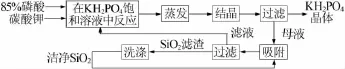
图2 以85%磷酸和碳酸钾为原料制取磷酸二氢钾工艺流程图
1.3 实验过程
1.3.1 制备磷酸二氢钾饱和溶液
按25℃K2O-P2O5-H2O体系相图(图1)物系点R(100 g饱和溶液),将10.089 g K2CO3、16.832 g 85%磷酸、78.922 g H2O混合,得到KH2PO4饱和溶液。
1.3.2 磷酸二氢钾的制取与分离
将KH2PO4饱和溶液用粒度为150~300 μm的SiO2颗粒(质量比为1∶0.5)浸泡吸附一定的时间(2~3 h),除去饱和溶液中的杂质离子。过滤所得SiO2颗粒用蒸馏水洗涤后重复使用。取净化的KH2PO4饱和溶液50.0 g,加入精制的5.045 g碳酸钾充分溶解。称量8.416 g 85%磷酸于分液漏斗中,逐步加入含有碳酸钾的母液中。完全反应后加热蒸发1.920 g水(天平称量)。然后置于恒温振荡水浴槽冷却至25℃结晶,结晶完全后过滤,烘干晶体并称其质量。过滤所得母液循环用于上述实验。8次循环实验中4次加入SiO2颗粒吸附、4次不加入SiO2颗粒共制得8个实验样品。
为估算吸附过程产品的损失情况,取某次过滤后已吸附杂质的二氧化硅颗粒用1 000.0 mL蒸馏水充分清洗,从洗涤水中取1.0 mL稀释至100.0 mL,用磷钼蓝分光光度法测定其中磷元素的质量浓度,计算吸附过程KH2PO4的损失率。
1.3.3 磷钼蓝分光光度法检测样品中磷元素含量
依据桑宏庆等的方法[18-21],取0.1098g KH2PO4用蒸馏水配制成250.0 mL磷质量浓度为100.0 mg/L的溶液,取100.0 mg/L的溶液10.0 mL稀释至100.0 mL制成10 mg/L的溶液。从10 mg/L的溶液中吸取系列体积(0.0~16.0mL)的溶液于锥形瓶中,加蒸馏水稀释至50.0mL配成系列磷质量浓度的溶液。取系列磷质量浓度的溶液各5.0 mL于试管中,依次加入硝酸溶液1.0 mL、钼酸铵溶液2.5 mL、氯化亚锡溶液2.5 mL、亚硫酸钠溶液1.0mL,振荡充分反应,定容至20.0mL。设定波长为735 nm,利用紫外可见分光光度计测定溶液吸光度制得标准曲线。标准溶液磷元素质量浓度(ρ)与吸光度(A)在0~1.5 mg/L具有良好线性关系,拟合得A=0.166 4 ρ,R2=0.999 4。
按上述类似方式,称取一定质量的KH2PO4用250.0 mL蒸馏水溶解,取1.0 mL加蒸馏水稀释至50.0 mL,从中取5.0 mL于试管中,依次加入硝酸溶液1.0 mL、钼酸铵溶液2.5 mL、氯化亚锡溶液2.5 mL、亚硫酸钠溶液1.0mL,振荡充分反应,定容至20.0mL,设定波长为735 nm,利用紫外可见分光光度计测定溶液吸光度。KH2PO4纯度计算公式:
w=[ρ·10-3·(136.09/30.97)·(20/5)·(50/1)·0.25/m]×100%(2)
式中:w为KH2PO4产品纯度,%;ρ为磷元素质量浓度,mg/L;m为样品质量,g。
1.3.4 邻菲啰啉分光光度法检测KH2PO4样品中Fe2+/Fe3+含量
参考姚雪霞等测定方案[22-24],用NH4Fe(SO4)2· 12H2O配制10 mg/L的铁标准溶液,并用硫酸酸化。分别取10 mg/L系列体积(0.00~1.0 mL)的铁标准溶液于试管中,依次加入4.0 mL HAc-NaAc缓冲溶液(pH为4~5)、10%盐酸羟胺溶液0.5 mL、0.2%邻菲啰啉溶液1.5 mL,振荡充分反应,加蒸馏水至25.0 mL,配成系列铁质量浓度的溶液,用分光光度计测其吸光度并绘制标准曲线。铁离子是一种典型的杂质离子,铁离子的含量在一定程度上反映了其他杂质的含量。Fe2+/Fe3+质量浓度(ρ)与吸光度(A)在0~1.5 mg/L线性拟合关系式为A=0.257 5ρ+0.000 7,R2=0.999 1,说明线性相关性很好。
称取5.0 g KH2PO4样品,按同样方法依次加入HAc-NaAc缓冲溶液、盐酸羟胺溶液、邻菲啰啉溶液配成25.0 mL溶液,设定测定波长为508 nm,测定溶液吸光度。KH2PO4中铁离子含量计算公式:

式中:w为KH2PO4样品中Fe的质量分数,%;ρ为Fe的质量浓度,mg/L;m为样品质量,g。
2 实验结果分析及讨论
2.1 产品的产率及纯度
表1为KH2PO4产品的产率。由表1可知,中和法制备KH2PO4的产率最低为96.96%、最高为99.45%,平均为98.44%,相对偏差较小(0.641%),表明实验制取的KH2PO4具有相当高且稳定的产率。
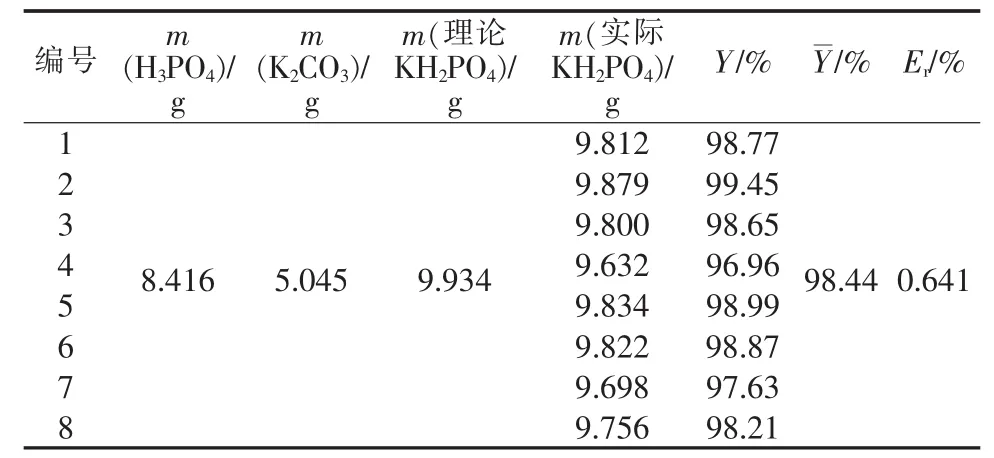
表1 磷酸二氢钾产品的产率
表2为多次循环制取KH2PO4产品纯度。KH2PO4产品平均纯度可达99.245%,相对平均偏差为0.18%,说明产品具有较高的纯度,且实验重复效果好。

表2 多次循环制得磷酸二氢钾产品纯度
表3为85%工业磷酸以及KH2PO4晶体中Ca2+、Mg2+、Fe2+/Fe3+等杂质离子含量。与Fe2+/Fe3+类似,从湿法磷酸到吸附净化过程以及结晶过程制得KH2PO4产品,各种杂质离子的含量均有明显的下降。

表385 %工业磷酸和KH2PO4晶体中主要杂质离子含量%
2.2 吸附剂对产品的净化作用
Fe2+/Fe3+作为杂质离子中一种典型的离子,其含量的变化在某种程度上反映了杂质离子含量的变化。表4为有/无吸附剂时制取的KH2PO4产品中铁离子的含量对比。无吸附剂时KH2PO4产品中铁离子质量分数平均为2.496×10-5,明显高于有吸附剂时的平均值1.593×10-5,由此说明SiO2颗粒吸附剂对杂质铁离子的净化作用明显。对比表3进一步说明,通过SiO2颗粒吸附剂的净化作用,产品中各种杂质离子的含量均有明显的下降。

表4 有/无吸附剂时制取的磷酸二氢钾产品铁含量对比
除了杂质离子外,SiO2颗粒对磷酸根也有一定的吸附作用,吸附净化过程对产品的损耗见表5。从表5可知,由于SiO2颗粒的吸附作用,KH2PO4产品的损失率为1.089%,这种损失在可接受的范围之内。

表5 吸附净化过程对产品的损耗
与其他吸附剂相比SiO2颗粒的吸附能力并不强。但一个明显的优势在于,SiO2颗粒吸附“变脏”后,可以通过洗涤重新变洁净,恢复吸附能力。随着循环进行,母液中包括Fe在内杂质离子不断积累,KH2PO4产品中杂质含量增多,使得工艺过程无法顺利循环,故而在循环工艺过程中加入吸附环节。
2.3 工艺条件控制
如前所述,磷酸与碳酸钾按物质的量比为2∶1进行反应,既能避免其他磷酸盐副产物的生成,也使得KH2PO4能以最小的溶解度析出。表6为不同温度下100 g KH2PO4饱和溶液中KH2PO4的质量(m)及其溶解度(S)。0℃时100 g水中KH2PO4的溶解度为14.2 g;30℃其溶解度达到28.3 g,为0℃时的2倍;80℃时其溶解度达到70.4 g,几乎为0℃时的5倍。由此可见,温度对磷酸二钾的溶解度具有显著的影响,因而对结晶温度进行精确控制具有重要意义。结晶温度过高,会使析出的晶体数量偏少,温度过低则析出的晶体数量偏多,都不利于产品产量和质量的稳定,也不利于工艺过程的持续循环。实验的整个反应过程都在恒温振荡水浴槽中进行,其保证了结晶过程和吸附过程的温度波动在0.2℃以内。由表1和表2也可以看出,多次实验得到的KH2PO4产品的质量、转化率、纯度均非常接近,说明每次循环得到的产品具有较好的稳定性。

表6 不同温度下100 g KH2PO4饱和溶液中KH2PO4的质量(m)及其溶解度(S)[15]
3 结论
以工业湿法磷酸和碳酸钾为原料,基于中和法循环制取了KH2PO4产品。该方法具有工艺流程短、操作简单、产品质量稳定、杂质含量低、耗水少、耗能低等明显优势。基于相图及可靠的热力学数据,在饱和溶液中定量制取KH2PO4产品,在传统中和法工艺基础上进行了明显的优化与改进,因而极大地降低了对水和能源的消耗。定量计算、温度的精确控制使得工艺操作过程运行稳定和循环过程持续运行。二氧化硅可逆性吸附剂的使用,有效地降低了反应体系杂质离子的含量,避免了杂质离子的不断积累,提高了产品的纯度,保证了产品质量的稳定性。二氧化硅颗粒作为吸附剂,可逆性好,清洁后可重复利用,因而具有绿色环保的特点。
[1]樊蕾,赵建国.我国磷酸二氢钾现状及前景展望[J].磷肥与复肥,2006,21(3):34-37.
[2]汪家铭.磷酸二氢钾生产现状与市场分析[J].上海化工,2010,35(11):31-37.
[3]谷利敏,孟新志,张燕玲,等.复分解法制备磷酸二氢钾的研究[J].河南化工,2002(10):11-12.
[4]谢英惠,刘景府,袁俊生,等.磷酸二氢钾的生产工艺[J].海湖盐与化工,2005,34(4):9-11.
[5]王东头,石香玉.磷酸二氢钾的生产方法综述[J].无机盐工业,2001,33(6):23-24.
[6]孙晓明,王新军,谢木香,等.磷酸二氢钾生产工艺研究[J].磷肥与复肥,2001,16(4):12-13.
[7]方进,周骏宏.湿法磷酸复盐结晶法制磷酸二氢钾[J].硫磷设计与粉体工程,2016(2):17-19.
[8]蒋彩丽,郑绍聪,郑远利,等.三辛胺-异戊醇有机溶剂萃取制备磷酸二氢钾[J].无机盐工业,2014,46(2):44-46.
[9]杨林,张志业,陈智勇.磷酸二氢钾的制备方法综述[J].磷肥与复肥,2004,19(1):54-56.
[10]陈路萍,樊继宽.湿法磷酸生产磷酸二氢钾新工艺[J].淮海工学院学报,2001(2):39-41.
[11]陈若愚,王国平,朱建飞,等.萃取法制备磷酸二氢钾新工艺研究[J].化工矿物与加工,2001(11):5-7.
[12]李海丽,曾波.萃取法生产磷酸二氢钾工艺[J].云南化工,2001,28(1):14-15.
[13]李春,徐世林,宿其.溶剂萃取法生产工业级磷酸二氢钾新工艺研究[J].无机盐工业,1997(3):14-16.
[14]张莉.液液离子交换法制备磷酸二氢钾过程的研究[D].上海:华东理工大学,2012.
[15]雷武.离子交换法制取磷酸二氢钾[J].磷肥与复肥,1995(3):33-34.
[16]陈红琼.磷酸二氢钾的制备方法[J].四川化工,2013,16(5):16-19.
[17]Linke W F,Seidell A.Solubility of inorganic and metal organic compounds[M].Washington:American Chemical Society,1965.
[18]孔素娟,袁菲,于旭博,等.3种磷含量测定方法的比较[J].中国生物制品学杂志,2014,27(10):1304-1308.
[19]李光明,万荣,李霞,等.饲料磷酸盐中磷含量的三种检测方法比较分析[J].饲料广角,2014(6):19-21.
[20]桑宏庆,于天宇,安乐.磷钼蓝分光光度法测定果蔬中有机磷[J].饮料工业,2011(1):30-34.
[21]桑宏庆,于天宇.磷钼蓝分光光度法测定果蔬中有机磷农药[J].饮料工业,2010(8):39-43.
[22]姚雪霞,戴存礼,李晓林,等.邻菲啰啉分光光度法测定微量铁实验条件的探讨[J].实验室研究与探索,2015,34(3):16-19.
[23]王新梅,郭然.邻菲啰啉分光光度法测定硝酸铵中铁离子含量[J].磷肥与复肥,2017,32(4):39-41.
[24]祁极冰,刘有智,罗莹,等.邻菲啰啉分光光度法测定络合铁脱硫液中铁的含量[J].现代化工,2016,36(1):187-190.
Efficient preparation of potassium dihydrogen phosphate by modified neutralization method
Zhou Quanbao,Li Butong,Wu Yingqiao,Wei Xuqin,Kuang Linying,Zhao Man
(Institute of Transformation and Separation,College of Chemistry and Life Science,Guizhou Education University,Guiyang 550018,China)
A method of the cyclical processing technology of preparing KH2PO4product was proposed.Reaction,evaporation,and crystallization at 25℃,the whole process was carried out in medium of KH2PO4saturated solution from purified industrial phosphoric acid and potassium carbonate.The saturated KH2PO4solution could be reused after purification with the adsorbent of SiO2.Phosphomolybdenum blue and phenanthroline spectrophotometries were adopted to determine the phosphorus and Fe content.Results showed that the product had high purity and low impurity content,and the SiO2adsorbent can effectively reduce the impurity content in the low yield loss.Compared with traditional neutralization methods,this process had less steps,simple operation,stable product quality,and low impurity content,and exhibited apparent advantages of less water and energy consumption.
potassium dihydrogen phosphate(KDP);saturated solution;adsorption;cyclic process
TQ126.35;131.13
A
1006-4990(2017)09-0031-04
2017-03-17
周权宝(1975—),男,博士,副教授,研究方向为溶液热力学及过程工艺。
贵州师范学院博士基金项目(12BS023);贵州省科技厅自然科学基金一般项目(QKJ[2014]2140);贵州省教育厅自然科学基金招标项目(QJKY(2012)052)。
联系方式:mfkscpy@163.com
