155例抗肿瘤药物不良反应分析
2017-09-15王奎鹏
王奎鹏,,
(1.河南中医药大学第一附属医院,河南 郑州 450052;2.原71320部队门诊部,河南 开封 475003)
155例抗肿瘤药物不良反应分析
王奎鹏1,刘建新2,余海滨1
(1.河南中医药大学第一附属医院,河南 郑州 450052;2.原71320部队门诊部,河南 开封 475003)
目的探讨抗肿瘤药所致不良反应(ADR)发生的特点及影响因素。方法对河南中医药大学第一附属医院血液肿瘤科2015年1月至2016年12月收治的155例涉及抗肿瘤药物的ADR进行统计和分析。结果155例ADR中,男84例(54.19%),女71例(45.81%);静脉滴注是引起ADR的主要给药途径(63例,40.65%);涉及抗肿瘤药物9大类45种;ADR累及的系统主要为消化系统(28.51%)、血液系统(20.85%)、皮肤及其附件(17.87%)。结论临床上引起ADR的主要给药途径是静脉滴注,容易累及系统为消化系统和血液系统,我们应加强ADR监测工作,预防和减少ADR的发生,确保临床安全合理用药。
抗肿瘤药物;不良反应;合理用药
近年来,随着抗肿瘤药物研究的研究飞速发展,恶性肿瘤患者的生活质量得到明显提高,生存期也逐渐延长,带瘤生存的状态慢慢被患者接受,视之为慢性病,但大多数药物在抑制或杀伤肿瘤细胞的同时,也对机体造成损害,抗肿瘤药物的不良反应(adverse drug reaction,ADR)尤为需要关注。现对我院血液肿瘤科发生的ADR共155例进行回顾性分析评价。
1 资料与方法
收集河南中医药大学第一附属医院血液肿瘤科2015年1月至2016年12月收治的涉及抗肿瘤药物ADR的恶性肿瘤患者155例,记录患者的年龄、性别、ADR发生时间、给药途径、具体药物、临床表现及转归等信息,采用描述性分析研究方法进行分类汇总、统计和分析。
2 结果
2.1性别与年龄分布155例抗肿瘤药物所致ADR患者中,男84例(54.19%),女71例(45.81%),男女之比为1.181。年龄在5~87(53±14)岁,主要分布在31~70岁。见表1。

表1 155例发生ADR患者的性别与年龄分布 n
2.2ADR发生时间分布155例ADR患者中,<0.5 h 的84例,占54.19%;0.5~2 h的35例,占 22.58%。ADR发生时间多在用药后24 h内,总共144例,占92.90%。见表2。

表2 ADR发生时间分布
2.3引起ADR的给药途径分布155例ADR涉及6种给药途径,主要为静脉滴注、口服给药和静脉注射,分别占40.65%、15.48%和14.84%。此外还包括局部注射和肌肉注射,共占13.55%。见表3。
2.4不良反应涉及药物155例ADR共涉及抗肿瘤药物9大类45种,其中以植物来源抗肿瘤药最多,其次为抗代谢药、铂类、中成药。见表4。
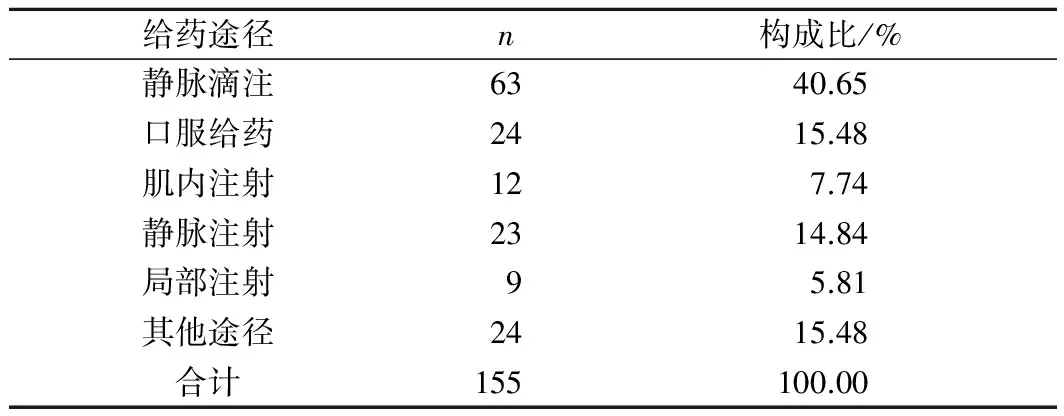
表3 ADR涉及给药途径的构成比

表4 ADR涉及抗肿瘤药物种类及构成比
2.5ADR涉及的器官或系统及临床表现由于同一抗肿瘤药物的ADR可能累及多个器官或系统,若以单个累及器官或系统计算,临床表现实际发生例数为235例。主要涉及9个器官或系统,以消化系统最多,共67例,占28.51%;其次为血液系统,共49例,占20.85%。见表5。

表5 ADR涉及的器官或系统及临床表现
注:若同时2个或2个以上系统出现不良反应,按2个或2个以上系统统计。
2.6ADR的临床转归155例ADR患者中,治愈37例,占23.87%;好转94例,占86.90%;死亡4例,占2.58%;致残1例,占0.65%;无法做出临床判断的19例,占12.26%。
3 讨论
3.1ADR与性别、年龄的关系155例ADR中,男女比例为1.181,男性稍高于女性,但基本平衡,表明ADR发生率在性别方面无显著性差异。从年龄分布上看, 51~60 岁患者的数量最多,占22.58%, ≥41岁患者抗肿瘤药物的ADR发生率明显增加,发生率合计为74.83%。这符合恶性肿瘤发病流行趋势,≥41岁人群组恶性肿瘤发病率快速升高[1]。中老年患者抗肿瘤药物不良反应发生率明显增加,分析其发生不良反应的主要原因:1)中老年患者的器官功能逐渐衰退,药物的生物转化率较年轻患者逐渐降低,药物易于在体内蓄积,对抗肿瘤药物耐受程度降低,导致其ADR发生率增加;2)中老年患者常伴有基础疾病,加之抗肿瘤药物的积极使用,多种药物联合用药的概率相对较高,这也增加了ADR的发生率;3)大多数抗肿瘤药物具有治疗指数低、不良反应重的特点,也是原因之一[2]。因此中老年患者在治疗过程中,应根据其特点制定个体化给药方案,以减少ADR的发生。
3.2ADR与发生时间、给药途径的关系155例ADR中,用药24 h内的ADR发生率为92.90%,ADR发生时间0.5 h内最多,表明多数抗肿瘤药物引起的ADR为速发型过敏反应。因此医务人员用药期间应密切关注0.5 h内给药时间段,发现ADR及时处理,把对患者的危害降至最低。
在6种给药途径中,静脉滴注的ADR发生率相对于其他给药途径更高,达到40.65%,静脉注射的ADR发生率也达到14.84%。其原因在于静脉给药时药物直接进入血液循环,无首过效应,迅速送达全身各个脏器,同时药物本身的pH值、微粒、内毒素、溶媒等因素都易导致ADR的发生[3]。临床静脉给药时,应严格控制药物剂量和给药速度,以降低ADR的风险。
3.3ADR与使用药物的关系调查显示ADR发生的药物分类较多,但主要集中在植物来源抗肿瘤药、抗代谢药、铂类及中成药。主要与这些药物抗肿瘤范围广,使用量大或不良反应较多等有关。铂类抗肿瘤药在化疗中的使用率高达40%[4],目前在胃癌、肺癌、恶性骨肿瘤等恶性肿瘤化疗方案中是不可或缺的。但铂类抗肿瘤药的胃肠道反应、肾毒性、血液毒性、神经毒性,需要在应用药物时做相应的对症处理。近年来中成药因其抗瘤减毒作用,已成为临床治疗的重要组成部分。其中中药注射剂多为复方制剂,成分复杂,极易引起不良反应[5]。中药注射剂应严格按照药品说明书使用,严格掌握功能主治和禁忌证,同时加强用药监测,确保用药安全。
3.4ADR的临床表现抗肿瘤药物的ADR主要累及的系统为消化系统(28.51%)、血液系统(20.85%)、皮肤及其附件(17.87%)。植物来源抗肿瘤药(如紫杉醇等)引发的ADR症状主要是骨髓抑制;铂类抗肿瘤药所引发的ADR症状主要在消化系统,抗代谢药主要发生在口腔或胃肠,中成药以过敏反应居多。
因此,肿瘤患者在选用治疗方案时,要根据患者个人体质,所选抗肿瘤药物特点及易诱发的ADR,选择合适的药物,有条件时可通过基因遗传多态性的检测预测临床疗效,制定个体化给药方案,以减少ADR的发生。加强医、护、药、患之间的联系,做到用药的前中后全程监控,及时掌握患者用药情况,减少或预防ADR,提高肿瘤化疗效果,确保临床用药的安全、有效、合理。
[1] 王儒强. 我院339例抗肿瘤药物及辅助治疗药物不良反应报告分析[J]. 淮海医药,2014,32(3):225-227.
[2] 曹媛,夏延哲,闫佳佳. 132例抗肿瘤药物不良反应分析[J]. 今日药学,2016,26(3):190-193.
[3] 郑瑜,朱志伟,郑志伟,等. 某院抗肿瘤药物不良反应的影响因素分析[J].肿瘤药学,2016,6(5):393-397.
[4] HARPER BW,KRAUSE-HEUER AM,Grant MP,et al. Advances in platinum chemotherapeutics[J]. Chemistry-A European Journal,2010,16( 64):7064-7077.
[5] 孙维,徐保宁,马泽通,等. 抗肿瘤相关药物不良反应报告回顾性分析[J]. 宁夏医科大学学报,2013, 35(1):91-94.
国家自然科学基金资助项目(编号:81473650)
王奎鹏(1977-),男,硕士,主管药师,主要从事临床药理研究工作。E-mail: wangkuipengzz@163.com
10.3969/j.issn.1673-5412.2017.04.028
R979.1;R730.6
B
1673-5412(2017)04-0359-03
2017-03-20)
