仙人草多糖提取及分离纯化工艺研究
2017-09-13吉惠杰曹雪玲郑凤梅沈启慧于丽颖
吉惠杰,曹雪玲,郑凤梅,沈启慧,吕 洋,于丽颖*
(1.吉林化工学院 化学与制药工程学院,吉林 吉林 132022;2.吉林石化炼油厂,吉林 吉林 132000)
仙人草多糖提取及分离纯化工艺研究
吉惠杰1,曹雪玲1,郑凤梅2,沈启慧1,吕 洋1,于丽颖1*
(1.吉林化工学院 化学与制药工程学院,吉林 吉林 132022;2.吉林石化炼油厂,吉林 吉林 132000)
选取仙人草为原料,采用微波辅助水提法对仙人草粗多糖进行提取。单因素试验考察微波功率、提取剂用量、提取时间、提取次数及提取温度对其粗多糖提取率的影响,利用正交试验优化提取工艺。结果表明:仙人草粗多糖最佳提取工艺条件为提取温度80℃、料液比(g·mL-1)1∶40、微波功率350 W、提取时间45 min,此条件下仙人草中粗多糖的平均提取率为2.40%。仙人草粗多糖经Sevage法脱蛋白,并利用SephadexG-200葡聚糖凝胶层析柱对其提取物分离纯化,得到3个主要的多糖组分。
仙人草;多糖;微波提取;分离纯化
仙人草(Mesona Chinensis.Benth)为唇形科凉粉草属(Mesona Chinensis)草本植物,又名凉粉草、仙草,分布于印度、东南亚及我国广东、福建、广西等地[1],是我国一种重要的药用植物[2]。
仙人草主要含有多糖、黄酮类化合物、酚类、齐墩果酸、熊果酸、α-香树精、β-香树精、果胶、色素(花青素)、氨基酸、挥发性油[3-4]等多种生物活性成分。多糖(Polysaccharides,PS)又称多聚糖,是由10个以上的单糖分子通过糖苷键聚合而成,有些多糖无生物活性,如淀粉、树胶和黏液质等,而具有药效作用的大多是活性多糖。仙人草多糖为酸性杂多糖,主要为半乳糖醛酸、葡萄糖醛酸,具有调节免疫力、抗肿瘤、抗氧化、降血脂、降血糖、抗辐射、保护肝脏[5-10]等作用,也可作为食品添加剂,制成各种保健食品或功能性食品[11]。
植物多糖提取方法[12-19]有热水浸提法(该法破细胞壁效果不好、提取率不高)、碱液浸提法(碱性较强会水解)、微波水提法及超声辅助水提法(对多糖破坏小、溶剂用量少、成本低、得率高)、生物酶提取法(条件温和、分解植物组织、加速多糖释放,但试剂成本高)。这些方法提取出的粗多糖含杂质且多糖为混合物需分离纯化为单一多糖[20-25]。本研究尝试微波辅助水提法提取仙人草粗多糖并优化其提取工艺,对粗多糖进行脱蛋白质、脱色素,采用葡聚糖凝胶柱层析分离纯化。
1 材料与方法
1.1 材料与试剂
仙人草为干燥全草,购于广东省长寿蕉岭仙人草种植基地;考马斯亮蓝G-250、SephadexG-200葡聚糖凝胶、无水乙醇、石油醚、三氯甲烷、正丁醇、苯酚、浓硫酸、无水葡萄糖、氯化钠、浓磷酸,均为国产分析纯;试验用水为双蒸水。
1.2 仪器与设备
CW2000-A型超声-微波协同萃取反应仪:上海新拓分析仪器科技有限公司;RE-52A型旋转蒸发仪:上海亚荣生化仪器厂;TU-1950型双光束紫外可见分光光度计:北京普析通用仪器责任有限公司;FA2005N型电子分析天平:上海舜宇恒平科学仪器有限公司;TS-200B型恒温振荡培养摇床:上海天呈仪器制造有限公司;H2050R型离心机:湖南湘仪实验仪器有限公司;葡聚糖凝胶柱:北京梦怡美生物科技有限公司。
1.3 试验方法
1.3.1 仙人草样品的制备
1.3.1.1 仙人草样品的提取
仙人草的产地、品种、提取方法都影响仙人草多糖的含量[18],因此原料的选择对仙人草的提取率影响很大。试验选择广东省长寿蕉岭仙人草种植基地的全草作为研究对象。
仙人草粉碎过40目筛,在烧瓶中加入一定量的石油醚加热回流3 h进行脱脂脱色素,待用。准确称取5.0 g干燥仙人草以一定料液比置于微波反应仪中,通过改变提取时间、微波功率、料液比、提取次数及提取温度进行提取。微波提取后过滤,收集滤液,连续提取2次,合并收集滤液,旋转蒸发仪真空浓缩提取液,得仙人草粗多糖提取液。
1.3.1.2 脱蛋白
采用 Sevage法脱蛋白,多糖样品中蛋白质含量的测定参照Bradford[26]的方法略作修改,该方法操作简单,是常用的去除蛋白的有效方法[27]。
1.3.1.3 分步醇沉法
仙人草提取液浓缩至药液比为1∶1~1∶2,加入适量乙醇使体积分数达到60%,醇沉24 h过夜,得多糖沉淀。过滤后,除去析出的脂溶性成分,取上清液继续加入乙醇使体积分数达到85%,醇沉24 h过夜,得多糖沉淀,抽滤,除单糖、苷类、低聚糖,即得到沉淀为仙人草粗多糖。
1.3.2 粗多糖含量的测定
1.3.2.1 绘制葡萄糖标准曲线
称取120℃干燥至恒质量的葡萄糖21.9 mg,加水溶解并定容至100 mL容量瓶中,即得葡萄糖贮备液。
精确量取贮备液 1.0、2.0、3.0、4.0、5.0、6.0 mL分别置于25 mL容量瓶中,加入去离子水稀释至刻度。取上述葡萄糖对照品溶液各2.0 mL,加入4%苯酚1.0 mL,迅速加入7.0 mL浓硫酸,摇匀,于40℃水浴放置30 min后,冷却至室温。以空白为对照,在最大波长489 nm处测定吸光度值。以质量浓度C(μg/mL)为横坐标,吸光度A为纵坐标,进行回归分析,建立线性方程:A=0.045 7 C+0.009,r=0.999 3。
1.3.2.2 仙人草粗多糖含量的测定
精确吸取仙人草提取液适量于10 mL容量瓶中,按1.3.2.1所述方法测定,以试剂空白做对照,在波长489 nm处测吸光度,通过线性方程计算提取液中粗多糖质量浓度,计算仙人草总多糖提取率。
多糖提取率=仙人草多糖质量/仙人草质量。
1.3.3 粗多糖蛋白质测定
1.3.3.1 考马斯亮蓝溶液的配制
称取100 mg考马斯亮蓝 G-250溶于5 mL 90%乙醇,再加入85%磷酸10 mL,定容于100 mL容量瓶中,即得考马斯亮蓝溶液。
1.3.3.2 牛血清白蛋白标准溶液的配制
称取牛血清白蛋白10 mg,用去离子水溶解,定容至10 mL,吸取5 mL定容于50 mL容量瓶中,即得100 μg/mL的牛血清白蛋白标准溶液。
1.3.3.3 绘制牛血清白蛋白标准曲线
吸取 100 μg/mL的牛血清白蛋白标准溶液0.0、0.2、0.4、0.6、0.8、1.0 mL 分别置于 10 mL 容量瓶中,加入去离子水至1.0 mL。加入考马斯亮蓝G-250溶液5 mL,混匀,放置2 min后于紫外分光光度计595 nm处测定吸光度值。以蛋白质含量(μg)为横坐标,吸光度值A为纵坐标,绘制牛血清白蛋白标准曲线,进行回归分析,建立线性方程:A=0.065C+0.059 8,r=0.999 0。
1.3.3.4 仙人草粗多糖蛋白质测定
配制适当浓度的粗多糖溶液,准确吸取1.0 mL,加入考马斯亮蓝 G-250溶液5 mL,混匀,放置2 min后于紫外分光光度计595 nm处测定吸光度值。参照杨培民[28]的方法略作修改,计算多糖保留率和蛋白脱除率。
多糖保留率=脱蛋白后多糖质量/粗多糖中多糖质量。
蛋白脱除率=(去除蛋白前的质量-去除蛋白后的质量)/去除蛋白前的质量。
1.3.4 葡聚糖凝胶柱柱层析分离
粗多糖进行脱蛋白质、脱色素后得到的仍是粗多糖,它们为含有不同分子质量的几种多糖,需进一步对其组分进行分离提纯。凝胶柱层析法为活性多糖纯化最常用的方法。洗脱液为不同浓度的盐溶液。
1.3.4.1 葡聚糖凝胶预处理
称取Sephadex G-200干粉5.0 g,加入适量蒸馏水,沸水浴进行溶胀3 h。冷却后用蒸馏水洗2~3次,进行湿法装柱,用蒸馏水平衡24 h备用。
1.3.4.2 葡聚糖凝胶装柱与加样
由于用以分离纯化,选择凝胶柱柱长与柱径之比为20∶1,将柱垂直安装固定,加入1/3柱体积蒸馏水,用玻璃棒边搅匀边将溶胀好的葡聚糖凝胶连续装入柱内,在柱内自然沉降,同时使蒸馏水从下口慢速流出。凝胶必须均匀装柱,不能有气泡或明显条纹。装好柱子后,用蒸馏水平衡2~3 h,可将样品分离。
1.3.4.3 样品上样洗脱
称取纯化后的仙人草粗多糖80 mg,用 10 mL蒸馏水充分溶解后上样。向柱内缓慢加入多糖溶液, 用 125 mL 蒸馏水和 0.01、0.03、0.05、0.1、0.2、0.5、1.0、1.5、2.0、2.3、2.5、2.7、3.0、3.3 mol/L NaCl溶液进行洗脱,流速1.5 mL/min,分步收集馏分装瓶(6 min/瓶),根据苯酚-硫酸法显色反应结果合并相同馏分,以收集的管数为横坐标、吸光度为纵坐标绘制洗脱曲线。
2 结果与分析
2.1 微波辅助提取仙人草粗多糖单因素试验
2.1.1 提取次数对粗多糖提取率的影响
准确称取5.0 g过60目筛的仙人草粉,按料液比1∶40 g/mL加入蒸馏水,每次提取60 min,提取温度80℃,提取次数分别为1、2、3次,提取次数对仙人草粗多糖提取率的影响见图1。
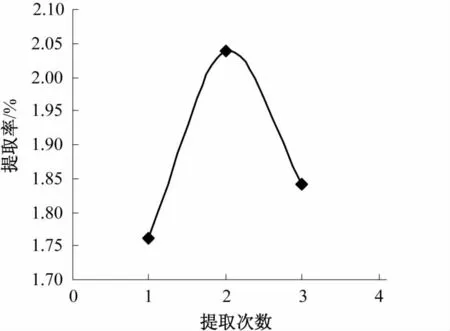
图1 提取次数对粗多糖提取率的影响Fig.1 Effect of extraction times on extraction rate of crude polysaccharides
由图1可知,当提取次数为2次时仙人草多糖提取率最高。增加提取次数,多糖提取率明显下降。再增加提取次数耗费试剂,综合考虑,仙人草多糖提取2次时效果最佳。
2.1.2 微波功率对粗多糖提取率的影响
准确称取5.0 g过60目筛的仙人草粉,料液比1∶40 g/mL,提取2次,提取温度80℃,每次提取60 min,微波功率分别为250 W、350 W、450 W、550 W,微波功率对仙人草粗多糖提取率的影响见图2。
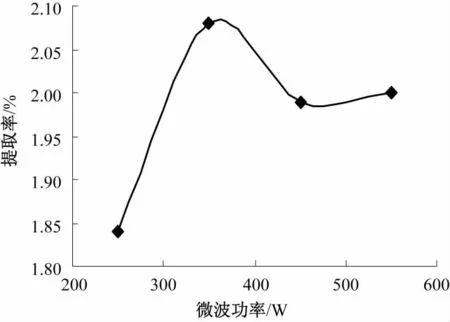
图2 微波功率对粗多糖提取率的影响Fig.2 Effect of microwave power on extraction rate of crude polysaccharides
由图2可知,当微波功率250 W时,总多糖的提取率很低,随着微波功率上升至350 W时,总多糖提取率上升得非常明显,仙人草多糖提取率最高,微波功率加大,物质吸收的微波能越多,细胞破壁效果就越好,有利于活性物质的溶出。而后,当微波功率继续上升时,提取率下降。故当微波功率为350 W时,仙人草多糖的提取效果最佳。
2.1.3 料液比对粗多糖提取率的影响
准确称取5.0 g过60目筛的仙人草粉,提取2次,提取温度80℃,每次提取60 min,微波功率为350 W,料液比分别为 1∶20、1∶30、1∶40、1∶50 (g/mL),料液比对仙人草粗多糖提取率的影响见图3。
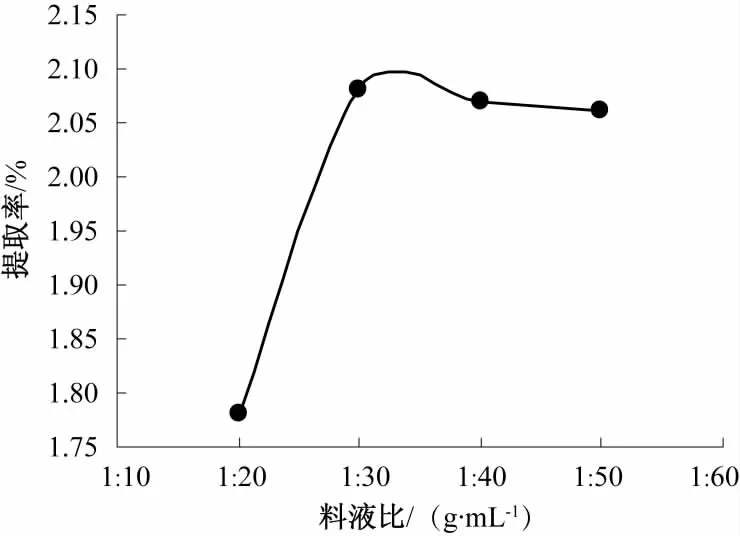
图3 料液比对粗多糖提取率的影响Fig.3 Effect of material-to-liquid ratio on extraction rate of crude polysaccharides
由图 3可知,料液比为 1∶30(g/mL)时仙人草多糖提取率最高。料液比偏小时,固液相中有效成分的浓度差偏少,随着料液比的增大,提取过程中两相浓度差增大,传质速度加快,多糖在溶剂中的量不断增加。当料液比增加到一定程度时,虽然两相中有效成分的浓度差依然存在,但传质动力增加不大,因此多糖的提取率减小。从资源的有效利用及降低能耗两方面考虑,选取仙人草多糖提取料液比为 1∶30(g/mL)。
2.1.4 提取时间对粗多糖提取率的影响
准确称取5.0 g过60目筛的仙人草粉,料液比 1∶30(g/mL),提取温度 80 ℃,微波功率为 350 W,提取 2 次,提取时间分别为 30、45、60、75 min,提取时间对仙人草粗多糖提取率的影响见图4。
由图4可知,随着提取时间的增加,多糖的提取率也随之增加,当提取60 min时,多糖的提取率最高,在45~60 min时,微波对细胞壁的破坏作用大,多糖溶出增多,提取率也相应地增加,当超过60 min后,细胞壁的过分破碎使溶解的杂质相应增多,溶剂几乎饱和,提取时间过长会使多糖发生水解,提取率减小。故当提取时间为60 min时,多糖的提取效果最佳。

图4 提取时间对粗多糖提取率的影响Fig.4 Effect of extraction duration on extraction rate of crude polysaccharides
2.1.5 提取温度对粗多糖提取率的影响
准确称取5.0 g仙人草粉, 料液比1∶30(g/mL),提取温度80℃,提取2次,每次提取60 min,微波功率为350 W,提取温度分别为60℃、70℃、80℃、90℃,提取温度对仙人草粗多糖提取率的影响见图5。

图5 提取温度对粗多糖提取率的影响Fig.5 Effect of extraction temperature on extraction rate of crude polysaccharides
由图5可知,随着提取温度的升高,仙人草多糖提取率不断增加,当提取温度到达80℃时,其提取率达到最高。之后提取温度逐渐提高提取率反而下降,其原因与多糖稳定性相关,高温下导致多糖降解。提取温度过高会破坏有效成分,影响多糖生物活性;提取温度太低,不利于水分子和多糖分子扩散,影响多糖溶出。综合考虑,确定仙人草多糖提取温度为80℃。
2.2 微波辅助提取仙人草粗多糖正交试验
在单因素试验基础上,以仙人草中粗多糖提取率为考察指标,选择提取温度、料液比、提取时间、微波功率为考察因素,设计正交试验,确定最佳工艺条件。
2.2.1 正交试验设计
选择L9(34)正交表优化提取工艺,因素与水平见表 1。
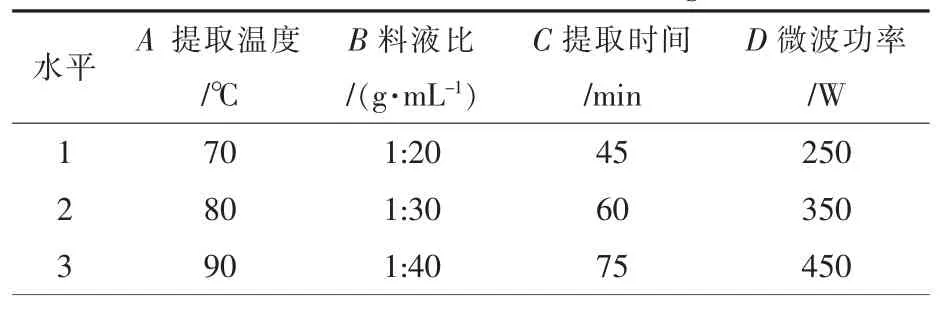
表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test
2.2.2 正交试验结果与分析
以仙人草粗多糖提取率为考察指标,正交试验结果与分析见表2,方差分析见表3。

表2 正交试验方案及结果Table 2 Design and results of orthogonal experiments
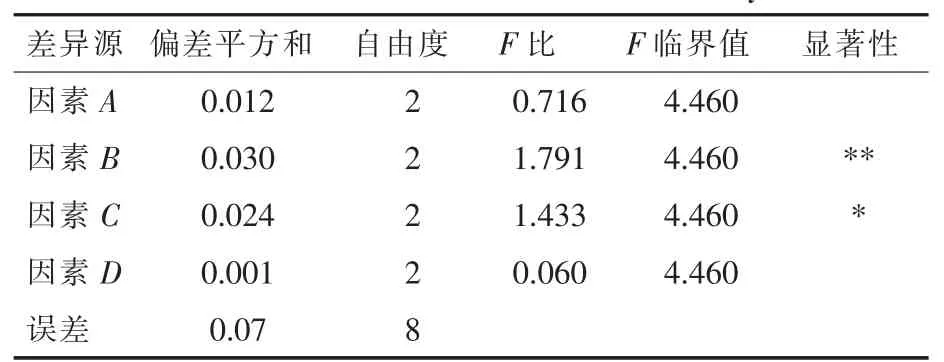
表3 方差分析结果Table 3 The results of variance analysis
由表2和表3可知,仙人草中多糖提取率受各因素影响的主次顺序为B>C>A>D,即料液比>提取时间>提取温度>微波功率。多糖提取率的最佳工艺条件为:提取温度80℃、料液比1∶40 g/mL、提取时间45 min、微波功率350 W,在此条件下总多糖的提取率为2.33%。
2.3 最佳工艺验证性试验
根据正交试验的最佳工艺条件,为进一步考察最佳工艺的稳定性和可行性,进行3次验证性试验。得到仙人草粗多糖提取率分别为2.49%、2.31%、2.40%,3次验证性试验的平均提取率2.40%,高于正交试验中的提取率,说明此工艺条件的稳定性好,可行性强。
2.4 仙人草粗多糖的分离纯化
2.4.1 分步醇沉法
当乙醇的体积分数在50%~60%时,会去除大量的杂质,如淀粉、树脂、黏液质等成分,醇体积分数为75%时,能去除鞣质、水溶性色素等成分,醇体积分数达到80%~85%时才会醇沉出粗多糖。体积分数太高,醇沉杂质大部分可以除去,但会包裹一部分有效成分,造成多糖的损失。体积分数低了,杂质除不尽;从而降低了有效成分在溶液中的含量。
2.4.2 Sevage法脱蛋白
在多糖溶液中加入氯仿-正丁醇(体积比4∶1),混合溶液在恒温摇床中充分振摇,重复7次,游离蛋白变性成不溶物除掉,经多次操作将大部分蛋白除去。

图6 Sevage法脱蛋白结果Fig.6 Removal of protein by Sevage method
由图6可知,随着处理次数的增加,蛋白质脱除率随之增加,可达80%以上;处理次数的增多会使多糖保留率降低,多糖的保留率近60%,之后趋于平稳。Sevage法脱蛋白的方法较为温和,对多糖的结构影响不大,使多糖的损失小,适宜仙人草粗多糖的脱蛋白处理,效果较好。
2.4.3 葡聚糖凝胶柱层析
多糖溶液加入到层析柱端,进入填料后,色带集中在填料顶部,当洗脱液NaCl的浓度较大时,发现有部分色素下移,不久后收集到的洗脱液呈现微黄色。
2.4.4 柱层析洗脱曲线
利用葡聚糖凝胶柱层析对仙人草多糖进行了初步的分离纯化,洗脱曲线见图7。从图7可以看出,经水和NaCl溶液梯度洗脱后,仙人草粗多糖分离得到3个主要组分,依次分别是水洗脱的组分、0.1 mol/L NaCl溶液洗脱组分和0.3 mol/L NaCl溶液洗脱组分。当出现洗脱峰时,没有加入洗脱液,使多糖不能被洗脱液洗脱,被洗脱下来的多糖较少,随着洗脱液的增加,大量多糖陆续被洗脱下来。洗脱液不能低于柱床的顶端,使凝胶颗粒浸泡在水中,否则影响洗脱效果。试验结果发现,选择0.1 mol/L NaCl作为洗脱剂,抑制凝胶吸附作用强,可有效减轻洗脱峰拖尾现象。只收集峰尖位置几管洗脱液,合并后旋转蒸发浓缩,浓缩液经真空冷冻干燥即可得到纯化的多糖样品。

图7 柱层析洗脱曲线Fig.7 Column chromatography elution curve
3 结论
通过单因素试验和正交试验确定微波辅助水提法提取仙人草粗多糖的最佳工艺条件为提取温度80℃、料液比1∶40 g/mL、提取时间45 min、微波功率350 W,粗多糖的平均提取率为2.40%。
多糖提取物一般混有淀粉、树脂、蛋白质等杂质,去除蛋白质一般采用Sevage法、三氯乙酸法、酶解法。Sevage法脱蛋白相对其他方法较为温和,不会对多糖大分子结构造成影响。Sevage法是去除游离蛋白最有效的方法。
粗多糖经葡聚糖凝胶层析柱分离纯化,得到3个主要的多糖组分,分别是水洗脱的组分、0.1 mol/L NaCl溶液洗脱组分和0.3 mol/L NaCl溶液洗脱组分。通过测定其多糖含量,纯度在85%~90%,如果需要做其活性和结构的鉴定,应该用葡聚糖凝胶柱再次进行纯化。
[1] 中国科学院《中国植物志》编委会.中国植物志[M].北京:北京科学技术出版社,1997:1849.
[2] 朱远平.仙人草总黄酮的微波提取工艺研究[J].农产品加工,2010(1):77-79.
[3] 王海华.凉粉草成分功效及提取方法的研究进展[J].中国药房,2014, 25(27):2584-2587.
[4] 程伟伟,栗俊广,蒋爱民,等.仙草多糖的研究进展及在肉品中的应用前景[J].肉类研究,2014,28(9):26-29.
[5] 刘晓庚,程梅梅.中国仙草的开发利用研究[J].食品研究与开发, 2004, 25(5):109-112.
[6] HUNG C Y,YEN G C.Extraction and Identification of antioxidative components of Hsiantsao (Mesona procumbens Hemsl.)[J].LWTFood Science and Technology,2001,34(5):306-311.
[7] YEH C T,HUANG W H,YEN G C.Antihypertensive effects of Hsian-tsao and its active compound in spontaneously hypertensive rats[J].Journal of Nutritional Biochemistry,2009,20(11):866-875.
[8] YSNG M, XU Z P,XU C J,et al.Renal protective activity of Hsian-tsao extracts in diabetic rats [J].Biomedical and Environmental Sciences,2008,21(3):222.
[9] SHYU M H,KAO T C,YEN G C.Hsian-tsao(Mesona procumbensHeml.)prevents against rat liver fibrosis induced by CCl4via inhibition of hepatic stellate cells activation[J].Food and Chemical Toxicolog,2008,46(12):3707-3713.
[10] FENG T,YE R,ZHUANG H N,et al.Physicochemical properties and sensory evaluation of Mesona Blumes gum/rice starch mixed gels as fat-substitutesin ChineseCantonese-style sausage[J].Food Research International,2013,50(1):85-93.
[11] 初敏.多糖研究概述[J].中药研究与信息,2013,5(2):18-20.
[12] 陈锦鹏,林晓翠,王碧玉.仙草多糖提取工艺研究[J].化学工程与装备,2009(3):1-3.
[13] 尹怀霞,黎锡流,朱良.从仙草中提取仙草胶的研究[J].现代食品科技, 2006, 22(3):134-136.
[14] 冯涛,郁晶晶,杨晓波.凉粉草多糖提取及纯化工艺的研究[J].食品工业,2010(1):82-85.
[15] 蒋文明,李爱军,汪辉,等.微波辅助碱液提取仙草多糖[J].食品科学,2011,32(4):11-14.
[16] 马星,林莹,刘小玲,等.凉粉草胶的超声辅助提取及胶体性质研究[J].食品与发酵工业,2010, 36(3):166-171.
[17] 于辉,蓝宝华,邱桂平.仙草胶提取方法比较研究 [J]. 中国食品添加剂,2011,22(1):141-147.
[18] 尹怀霞,黎锡流,潘兆广,等.纤维素酶提取仙草多糖的研究[J].食品科技,2007,38(5):126-128.
[19] SUN Y X,LIU J C.Structural characterization of a water-soluble polysaccharide from the roots of Codonopsis pilosula and immunity axtivity[J].Journal of Biological Macromolecules,2013,10(3):122-123.
[20] 邹林武.香菇多糖提取工艺及其分子结构改性研究[D].广州:华南理工大学,2013:9-13.
[21] 杨强.银杏果多糖的提取分离及功能特性研究[D].沈阳:沈阳农业大学,2013:45-48.
[22] 张占军.薤白多糖的制备、性质、结构及其生物活性研究[D].南京:南京农业大学,2012:51-52.
[23] 周鑫玉.石榴皮多糖的提取、分离纯化研究[D].西安:陕西师范大学,2014:15-18.
[24] 林爱琴.仙人掌多糖的分离纯化与结构表征的研究[D].福州:福建师范大学,2004:32-35.
[25] LIANG R J,ZHU Z P,BAI Y.Isolation,chemical composition and antioxidant activities of a water-soluble polysaccharide from rhizoma atrctylodis mocmcephalae[J].Jounnal of Medicinal Plants Research,2011,5(5):805-810.
[26] BRADFORD M M.A rapid and sensitive method forthe quantization ofmicrogram quantities of protein utilizing the principle of protein-dye binding[J].Analytic Biochemistry,1976,72(1-2):248-254.
[27] 吴玉娟.黄连多糖的提取及活性研究[D].成都:西南交通大学,2007:20.
[28] 杨培民.白花蛇舌草抗肿瘤有效部位黄酮和多糖的纯化及其脂质体复合物的研究[D].北京:北京中医药大学,2011:96.
STUDY ON EXTRACTION AND PURIFICATION TECHNOLOGY OF POLYSACCHARIDE FROM MESONA CHINENSIS
JI Huijie1, CAO Xueling1, ZHENG Fengmei2, SHEN Qihui1, LU Yang1, YU Liying1
(1.College of Chemical and Pharmaceutical Engineering, Jilin Institute of Chemical Technology, Jilin 132022,China;2.Jilin Petrochemical Refinery, Jilin 132000,China)
In thisstudy, crude polysaccharide wasextracted from raw materialMesona chinensisusing microwave-assisted water method.In order to evaluate the extraction efficiency of crude polysaccharide,the factors including microwave power, amount of extraction solvent,extraction time,extraction times and temperature were selected and their effects on the extraction yield of crude polysaccharides were investigated and the orthogonal experiment was used to optimize extraction process.The results showed that the optimal extraction conditions were as follows:extraction temperature was 80 ℃, solid/liquid ratio was 1∶40 g·mL-1, microwave power was 350 W and extraction time was 45 min.Under these optimal conditions,the average extraction ratio of crude polysaccharide was 2.40%.Afterwards,proteins in crude polysaccharide were removed by sevage method.Then the polysaccharide was isolated and purified by Sephadex G -200 gel chromatography, three polysaccharide fractions eluted obtained respectively.
Mesona chinensis;total polysaccharide;microwave extraction;separation and purification
TS201.2
:B
1673-2383(2017)04-0064-06
http://kns.cnki.net/kcms/detail/41.1378.N.20170828.0857.024.html
网络出版时间:2017-8-28 8:57:21
2017-01-05
吉惠杰(1973—),女,吉林省吉林市人,高级实验师,主要从事天然产物化学成分的提取与分离及生物活性的研究。
*通信作者
