十种旋唇纲纤毛虫的形态学描述
2017-09-12吕立平樊阳波胡晓钟
吕立平樊阳波,胡晓钟
(1. 中国海洋大学水产学院, 海水养殖教育部重点实验室, 青岛 266003; 2. 深圳市标准化技术研究院, 深圳 518055)
十种旋唇纲纤毛虫的形态学描述
吕立平1樊阳波1,2胡晓钟1
(1. 中国海洋大学水产学院, 海水养殖教育部重点实验室, 青岛 266003; 2. 深圳市标准化技术研究院, 深圳 518055)
借助活体观察和蛋白银染色方法对采集于中国山东、广东沿海的潮间带、红树林及淡水生境的10种旋唇纲纤毛虫(拉氏伪小双虫Pseudoamphisiella lacazei、四核伪小双虫Pseudoamphisiella quadrinucleata、中华偏全列虫Apoholosticha sinica、维尔伯特泡毛虫Tunicothrix wilberti、海洋后尾柱虫Metaurostylopsis marina、偏澳大利亚速体虫Notohymena apoaustralis、偏寡毛双眉虫Diophrys apoligothrix、寡毛双眉虫Diophrys oligothrix、盾圆双眉虫Diophrys scutum、张氏拟双眉虫Paradiophrys zhangi)进行了活体形态与纤毛图式水平的分类学研究。其中偏澳大利亚速体虫、偏寡毛双眉虫、张氏拟双眉虫为广东地区新记录种。基于新种群,对张氏拟双眉虫给出了新定义。研究表明, 中华偏全列虫地理分布较广, 可适应从淡水到不同盐度的咸水生境。首次发现, 寡毛双眉虫可在盐度较低的咸水中生存, 显示出其较强的环境适应能力。
纤毛虫; 纤毛图式; 形态学; 旋唇类
旋唇纲(Spirotrichea Bütschli, 1889)是结构最复杂高等的纤毛门原生动物(Ciliophora Doflein, 1901), 广泛分布于海洋、淡水和土壤等各类生境。按照Lynn[1], 该纲包含了45科、356属和2000余种,是迄今纤毛门中多样性最高的类群。因其常具有发达的口围带小膜而能有效地摄食细菌和单胞藻等微小生物, 在微食物网的物质循环与能量传递过程中发挥着重要作用[2]。近30年来, 我国对黄渤海和南海近岸海域内该类动物的细胞学、分类学、生态学等诸多内容进行了大量研究, 取得了许多新进展[3,4]。研究发现, 一方面, 其中的尾柱目、散毛目和游仆目类群具有极高的物种多样性; 另一方面, 许多物种的分类描述仅基于单一或少数种群的信息, 这无疑对于阐明纤毛虫形态种的外延和内涵、揭示自由生纤毛虫的地理分布特征是很不足的。因此, 依据现代分类学技术和观念对不同地理区域种群进行补充描述就显得非常必要。近5年来我们围绕以上3个目重点开展了区系分类和多样性研究。本文通过活体观察结合蛋白银染色方法, 对其中10种广义腹毛类纤毛虫的活体形态及纤毛图式进行了详尽的描述, 补足了活体和/或染色后的显微照片, 并给出了统计数据。
1 材料与方法
本文所涉10种纤毛虫获自山东和广东沿海近岸生境。拉氏伪小双虫Pseudoamphisiella lacazei、海洋后尾柱虫Metaurostylopsis marina和盾圆双眉虫Diophrys scutum分别于2011年3月18日、2011年11月24日和2012年3月6日采自山东青岛海滨潮间带(120°E, 36°N), 盐度30‰; 四核伪小双虫Pseudoamphisiella quadrinucleata于2012年5月12日采自广东湛江潮间带(110°E, 21°N), 盐度30‰; 维尔伯特泡毛虫Tunicothrix wilberti于2012年11月23日采自湛江海滨潮间带(110°E, 21°N), 水温约27℃, 盐度14‰; 偏寡毛双眉虫Diophrys apoligothrix于2012年11月12日采自湛江特呈岛潮间带沙滩(110°26′E, 21°9′N), 水温22.4℃, 盐度25‰; 寡毛双眉虫Diophrys oligothrix于2012年11月7日采自湛江特呈岛潮间带沙滩(110°26′E, 21°9′N), 盐度约5‰; 张氏拟双眉虫Paradiophrys zhangi于2013年3月11日采自惠州大亚湾潮间带沙滩(114°32′E, 22°44′N), 水温25℃, pH约8.2, 盐度约32‰; 中华偏全列虫Apoholosticha sinica和偏澳大利亚速体虫Notohymena apoaustralis分别于2012年4月26日和2013年3月13日采自惠州大亚湾红树林公园(114°34′E, 22°43′N)和湛江湖光岩景区(110°17′E, 21°9′N)内的淡水生境, 水温分别为22.8℃和27℃。原始采集样品在实验室内去除较大的浮游动物后室温条件下维持粗培养。同时, 运用微吸管分离目标种后用原位水进行纯培养。活体显微观察分别在明视野与微分干涉条件下进行, 记录活体大小和形态、皮层结构等形态特征, 同时拍摄静动态图像。运用蛋白银染色技术开展细胞学永久制片, 以显示皮层纤毛图式及细胞核特征。随后进行形态学特征统计分析和相近物种比较以完成分类鉴定。本文所采用的详细研究方法及名词术语主要参照Corliss和Song等[5,6]。
2 结果与讨论
2.1 拉氏伪小双虫Pseudoamphisiella lacazei (Maupas, 1883) Song, 1996(图版Ⅰ-1—9, 17; 表 1)
排毛亚纲Stichotrichia Small & Lynn, 1985
尾柱目Urostylida Jankowski, 1979
伪小双虫科Pseudoamphisiellidae Song et al., 1997
形态学描述(n=18) 虫体大小变化较大, 为(150—300) μm×(50—100) μm, 长椭圆形, 前后端钝圆, 左右缘几乎平行; 背腹扁平, 宽厚比约为3:1。口区约占体长的1/5(图版Ⅰ-1、2)。表膜十分柔软,虫体稍具伸缩性, 长宽比为2.5:1—5:1。横棘毛和顶端小膜长约15 μm, 腹棘毛长约10—15 μm, 缘棘毛长约8 μm, 背触毛长约3—4 μm。细胞表面明显呈透明泡状, 内密布短棒状射出体。低倍镜下虫体为浅灰色, 体内充满食物颗粒。大核数目不定, 14—55枚(平均35枚), 球形或椭球形; 小核数枚, 球形, 散布于大核之间。通常表现为底质上保持静息不动; 受到刺激后可缓慢运动。
口围带发达, 由33—64片小膜组成, 其远端可达体右前腹面(图版Ⅰ-2)。恒具3根额棘毛(图版Ⅰ-3, 长箭头)和2根口棘毛(图版Ⅰ-3, 短箭头)。14—23根尾棘毛(图版Ⅰ-2, 短箭头)。12—23根横棘毛向前延伸至虫体前1/3处。左腹棘毛列由13—25根排列稀疏的棘毛组成, 向后延伸至横棘毛; 右腹棘毛列由12—22根紧密排列的棘毛组成, 止于体中部或稍下。17—35根左缘棘毛和18—38根右缘棘毛。背触毛8—10列。
细胞发生 细胞发生表现以下发生学特点: (1)前、后仔虫分别产生新口原基从而分化成新口器(图版Ⅰ-4, 短箭头; 图版Ⅰ-5、8); (2)波动膜原基前端产生一根额棘毛(图版Ⅰ-5、8); (3)额-腹-横棘毛原基在前、后仔虫分别独立发生(图版Ⅰ-4, 长箭头), 无老结构参与; (4)2根口棘毛源自第2和第3列原基(图版Ⅰ-5、8)。在中期, 几乎所有额-腹-横棘毛原基各分化出3根棘毛, 其最后端的棘毛发育成横棘毛, 而来自后面几列原基的最前端棘毛在发育末期要发生退化(图版Ⅰ-5、8、9); (5)老背触毛列的前、后部分别产生原基(图版Ⅰ-4, 双箭头; 图版Ⅰ-5、6, 短箭头), 每列原基的末端均分化出1根尾棘毛(图版Ⅰ-17, 短箭头); (6)大核的演化经历融合后再分裂的过程(图版Ⅰ-5、7)。
比较与讨论 Song[7]在1996年建立伪小双虫属, 并将Maupas描述的Holosticha lacazei作为该属的模式种。目前该种的现代银染研究仅有两次,均来自青岛种群。本种群亦采自青岛栈桥海滨潮间带, 与之前种群相比在活体大小、纤毛图式方面基本吻合, 只是前者具有明显的外质透明层、稍多的腹棘毛以及大核数目变化较大。本种群所表现出的细胞发生学特点与Song等[8]1997年种群十分一致, 表明了该种细胞发生模式的稳定性。
2.2 四核伪小双虫Pseudoamphisiella quadrinucleata Shen et al., 2008(图版Ⅰ-10—16; 表 1)
排毛亚纲Stichotrichia Small & Lynn, 1985
尾柱目Urostylida Jankowski, 1979
伪角毛虫科Pseudokeronopsidae Borror & Wicklow, 1983
形态学描述(n=18) 虫体大小变化较大, 为(120—200) μm×(50—90) μm, 长椭圆形, 前后端宽圆, 左右缘几平行; 虫体极柔软, 具强的伸缩性, 运动时可伸长1/3—1/2; 背腹扁平, 宽厚比约为3:1。伸长时口区约占体长1/4, 静息时占比为1/3(图版Ⅰ-10、11)。横棘毛发达, 长约25 μm, 后部分伸出体后缘; 腹棘毛和缘棘毛长约15 μm, 背触毛长为3 μm。细胞表面具明显的透明层, 厚约3—5 μm, 内密布2 μm长的短棒状射出体(图版Ⅰ-10、12)。低倍镜下虫体后部为灰黑色, 前部透明, 体内充满油球和硅藻食物。大核数目较稳定, 多4枚, 球形或椭球形(图版Ⅰ-13); 小核数枚, 紧挨着大核(图版Ⅰ-14, 长箭头)。虫体通常于底质上长时间保持静息不动, 并有强的趋触性; 只在受惊扰或觅食时可缓慢运动。
口围带发达, 由41—74片小膜组成, 其远端可达体右前腹面(图版Ⅰ-16)。恒为2根口棘毛, 普遍额棘毛3根。11—19根尾棘毛(图版Ⅰ-16, 短箭头)。14—20根横棘毛向前延伸至虫体中部。左腹棘毛列近体中线, 由7—20根棘毛组成, 其中棘毛排列相对稀疏; 右腹棘毛列由13—22根棘毛组成, 其中棘毛排布相对紧密(图版Ⅰ-14、15)。10—25根左缘棘毛沿体左缘排列, 后端与尾棘毛相连; 右缘棘毛列平行于右腹棘毛列, 由12—20根右缘棘毛组成, 向后延伸至体后1/4处(图版Ⅰ-16)。背触毛11—19列。

表 1 拉式伪小双虫(第一行)和四核伪小双虫(第二行)的统计学数据Tab. 1 Morphometric data on Pseudoamphisiella lacazei (first line) and Pseudoamphisiella quadrinucleata (second line)
比较与讨论 本种由Shen等[9]2008年首次建立, 迄今仅有一次描述。本种群同样采自我国南海近岸, 显示其可能为亚热带海区特有种。湛江种群与2008年种群在体形、大小、口围带小膜数目、棘毛数目和排布方式以及大核数目上基本吻合, 因此它们应被视为同种, 两者主要的差异就在于本研究种群的额棘毛和大核数目稍有变动。
2.3 中华偏全列虫Apoholosticha sinica Fan et al., 2014(图版Ⅱ-18—30; 表 2)
排毛亚纲Stichotrichia Small & Lynn, 1985
尾柱目Urostylida Jankowski, 1979
伪角毛虫科Pseudokeronopsidae Borror & Wicklow, 1983
形态学描述(n=15) 虫体呈长带状, 为(200—300) μm×(30—40) μm, 前后端钝圆, 后端比前端明显窄削; 左右缘稍隆起(图版Ⅱ-18—20)。虫体柔软, 体形可变(图版Ⅱ-21、22); 背腹极扁平, 宽厚比约为5:1。口区约占体长的1/3。横棘毛发达,长约25 μm, 后部分伸出体后缘; 腹棘毛和缘棘毛长约15 μm, 背触毛长3 μm。表膜柔软, 其下具有2种皮层颗粒: 一种棕色, 围绕棘毛和背触毛分布(图版Ⅱ-30, 长箭头); 另一种无规则, 深层密集分布(图版Ⅱ-30, 短箭头)。虫体呈浅黄至黄色, 体内充满油球和硅藻等食物(图版Ⅱ-21)。大核26—56枚, 球形或椭球形(图版Ⅱ-23, 长箭头); 小核不可见。虫体通常在底质上保持静息不动; 受到刺激后可缓慢运动。体前后1/3处各有一个伸缩泡, 后一个更明显(图版Ⅱ-20、22; 长箭头)。
口围带分成两部分(图版Ⅱ-25, 长箭头), 前、后部分分别由9—12和26—36片小膜组成, 其远端可达体右前端; 波动膜短, 不及口区长的1/2(图版Ⅱ-25, 短箭头), 其中口侧膜长度又不及口内膜的一半。恒为6根额棘毛, 按前4根后2根排布(图版Ⅱ-24, 短箭头); 4根额前棘毛(图版Ⅱ-24, 长箭头); 无口棘毛; 3—4根横棘毛(图版Ⅱ-28); 28—39根中腹棘毛, 向后延伸至横棘毛; 除后端的3—4根构成中腹棘毛列(图版Ⅱ-27, 长见图)外, 其中均成对排布(图版Ⅱ-26, 长箭头)。左、右缘棘毛列分别由41—61根和43—64根棘毛组成。背触毛恒为3列(图版Ⅱ-29)。
比较与讨论 本种首次由Fan等[10]2014年首次报道于深圳红树林咸水生境。2015年Hu等[11]报道了一个英国盐碱地种群。本种群在体形、体色、纤毛图式、皮层颗粒的颜色和排布上与模式种群十分吻合, 主要的不同就在于前者横棘毛和额前棘毛数目相对稳定、中腹棘毛数稍多, 但缘棘毛数目则相对少, 这些无疑是种群间的差异。相比前两者, 英国种群明显个体稍大, 口围带小膜和棘毛数目亦相对较多, 这可能与较低的水温有关。另外的不同是我们的种群在体前1/3处也有一个伸缩泡,这或许和其淡水生境相关。目前看来, 此种很可能具有广泛的地理分布。
2.4 维尔伯特泡毛虫Tunicothrix wilberti (Lin & Song, 2004) Xu et al., 2006(图Ⅱ-31—36; 表 3)
排毛亚纲Stichotrichia Small & Lynn, 1985

表 2 中华偏全列虫的统计学数据Tab. 2 Morphometric data on Apoholosticha sinica

表 3 维尔伯特泡毛虫的统计学数据Tab. 3 Morphometric data on Tunicothrix wilberti
尾柱目Urostylida Jankowski, 1979
尾柱科Urostylidae Bu¨tschli, 1889
形态学描述(n=21) 虫体呈纺锤形, 两端圆,前端宽于后端, 最宽处于体前1/4—1/3处; 活体大小约(80—210) μm×(25—60) μm; 背腹扁平, 宽厚比约为2:1。口区约占体长的1/4, 其左前方有一明显的喙状突起。体呈灰褐色。体表被覆透明薄层。内质散布一些长约8 μm的星月状结构。大核2枚, 椭球状至长形(图版Ⅱ-32、34); 小核数枚(图版Ⅱ-32,长箭头)。运动较迅速。
口围带分成两部分(图版Ⅱ-31, 长箭头), 前后分别由8—10和15—19片小膜构成。口侧膜(图版Ⅱ-36, 长箭头)和口内膜(图版Ⅱ-36, 短箭头)几等长, 口侧膜明显前置。恒为3根额棘毛(图版Ⅱ-35,短箭头)、1根口旁棘毛(图版Ⅱ-35, 长箭头)、1根口棘毛、1对中腹棘毛、1根横前腹棘毛和4根横棘毛(图版Ⅱ-31、33); 中腹棘毛列由18—21根棘毛组成, 止于体后2/5处(图版Ⅱ-33, 长箭头)。23—31根左缘棘毛, 始于口区中部左侧, 止于体后端; 内侧右缘棘毛列由24—32根棘毛组成, 始于口围带远端,止于亚尾端(图版Ⅱ-33, 短箭头); 外侧列则由26—41根棘毛组成, 和左缘棘毛列始于同一水平(图版Ⅱ-36)。背触毛恒为3列, 纵贯体全长。
比较与讨论 本种原由Lin和Song[12]以Erniella wilberti报道, Xu等[13]将之转移至泡毛虫属。Wang等[14]基于深圳种群对其进行了重描述。目前该属仅包含2种。本种区别Tunicothrix rostrata在于较少的口围带小膜和棘毛。湛江种群个体大小上与青岛种群接近, 但中腹棘毛数目却和个体普遍小的深圳种群相近。2个红树林种群个体横棘毛恒为4根, 但模式种群变化较大。湛江种群的中腹棘毛对数介于另外两个种群间。
2.5 海洋后尾柱虫Metaurostylopsis marina (Kahl, 1932) Song et al., 2001 (图版Ⅲ-37—42)
排毛亚纲Stichotrichia Small & Lynn, 1985
尾柱目Urostylida Jankowski, 1979
尾柱科Urostylidae Bu¨tschli, 1889
形态学描述(n=5) 染色后的虫体呈卵圆形,大小约(80—100) μm×(50—70) μm (图版Ⅲ-37); 口区约占体长的2/5至1/3。口围带由25—29片小膜构成。具3根额棘毛、1根口旁棘毛(图版Ⅲ-38)、1根口棘毛(图版Ⅲ-38, 短箭头)、4—6根额前棘毛(图版Ⅱ-38, 长箭头)、5—8根横棘毛(图版Ⅱ-37, 长箭头); 中腹棘毛复合体包括前面的7—9对棘毛和后面的3—6根成列的棘毛(图版Ⅲ-37, 短箭头), 延伸至体后2/3处。左右缘棘毛各1列。大核数十枚, 椭球状, 大小约15 μm×8 μm。背触毛恒为3列, 纵贯体全长。
本研究观察到2个细胞发生时期, 显示如下特征: 后仔虫口原基始于中腹棘毛列左侧, 老棘毛未参与原基分化(图版Ⅲ-39, 长箭头; 图版Ⅲ-41); 前仔虫口原基出现于口腔背方, 与老结构无关(图版Ⅲ-39、40); 前、后仔虫的额-腹-横棘毛原基分别发生; 每列缘棘毛列前后各出现1列原基(图版Ⅲ-42)。
比较与讨论 本种群在体形、大小、纤毛图式及大核数目上与Song等[15]报道的种群十分吻合, 因此鉴定为该种是合适的, 两者间微小的差异就在于本种群缺少短列的背触毛。
2.6 偏澳大利亚速体虫Notohymena apoaustralis Lv et al., 2013(图版Ⅲ-43—52; 表 4)
排毛亚纲Stichotrichia Small & Lynn, 1985
散毛目Sporadotrichida Fauré-Fremiet, 1961
尖毛虫科Oxytrichidae Ehrenberg, 1830
形态学描述(n=10) 虫体呈长椭圆形, 前端钝圆, 后端窄削(图版Ⅲ-43—45); 个体大小变化较大, 约(100—200) μm×(30—60) μm; 右缘几平直, 左缘稍稍或明显隆起; 体最宽处于体中部稍前处。背腹扁平, 宽厚比约2:1。口区约占体长的1/3。体呈黄色。皮膜薄而脆。皮层颗粒黄绿色, 直径约1微米。在腹面, 围绕缘棘毛密集排列成短列而沿着棘毛列成带状, 其余则组成不规则短列; 在背面则围绕背触毛常6—10个成组分布(图版Ⅲ-49, 50)。内质无色或浅灰色, 常包含许多1—3微米的油球。顶端口小膜和缘棘毛长约10 μm, 额棘毛长15 μm; 横棘毛发达, 长25 μm, 伸出体后缘。背触毛长约3 μm。大核椭球状, 活体长约20 μm, 2枚, 位于体中部偏左位置(图版Ⅲ-48)。伸缩泡直径约10 μm, 位于体前1/3处, 近体左缘。
口围带由40—48片小膜组成(图版Ⅲ-46), 其远端绕过体前端达前腹面(图版Ⅲ-52, 长箭头); 每片小膜由1短3长列毛基粒组成(图版Ⅲ-51)。口侧膜和口内膜长而弯曲, 呈现速体虫排布模式(图版Ⅲ-52)。恒为3根额棘毛(图版Ⅲ-52, 短箭头)、4根额腹棘毛、1根口棘毛(图版Ⅲ-48, 长箭头)、3根口后腹棘毛(图版Ⅲ-48)、2根横前腹棘毛和5根横棘毛(图版Ⅲ-47)。背触毛稳定的为6列, 其中2列短的背缘触毛位于右缘棘毛列的右后背方。8—10根尾棘毛呈3组排布, 分别位于第1、2、4列背触毛的末端(图版Ⅲ-47, 短箭头)。

表 4 偏澳大利亚速体虫的统计学数据Tab. 4 Morphometric data on Notohymena apoaustralis
比较与讨论 围绕本种, 目前仅有一次报道[16]。与青岛种群相比, 湛江种群在虫体大小和体形、皮层颗粒的颜色和排布、纤毛图式上十分吻合, 微小的差异仅在于口围带小膜稍多、背触毛稍短, 而横棘毛明显长, 而这明显是环境等所导致的种群的差异。
2.7 偏寡毛双眉虫Diophrys apoligothrix Song et al., 2009(图版Ⅳ-53—55、59、60; 表 5)
游仆亚纲Euplotia Small & Lynn, 1985
游仆目Euplotida Small & Lynn, 1985
尾刺虫科Uronychiidae Jankowski, 1975
形态学描述(n=15) 虫体表膜坚实, 几呈长方形(图版Ⅳ-53), 大小约(70—142) μm×(35—70) μm; 背腹扁平(图版Ⅳ-59), 宽厚比约2:1。体后半部充满内质颗粒而在低倍镜呈灰黑色(图版Ⅳ-60)。口区约占体长的一半。口围带由24—33片小膜组成(图版Ⅲ-54、55), 其中前部8片位于体前背方的透明领部(图版Ⅳ-60), 纤毛长约25 μm。2片波动膜较发达, 其中口侧膜由许多短列的毛基粒组成。除横棘毛30 μm长外, 其余棘毛长约20—25 μm。普遍5根额棘毛和2根腹棘毛, 具典型双眉虫属的排布模式。仅单根左缘棘毛, 位于口围带近口端的左侧(图版Ⅳ-54, 长箭头)。3根尾棘毛, 位于体右后方的凹陷处(图版Ⅳ-53、54)。2枚腊肠状大核(图版Ⅲ-55)。恒为5列背触毛, 其中触毛排列稀疏而连续。运动较迅速, 表现为爬行, 偶或悬游于水中。
比较与讨论 本种最初由Song等[17]报道, 随后许媛等[18]基于另一青岛种群对其进行了重描述。湛江种群在体型、口围带小膜和左缘棘毛及背触毛列数目、大核的形态和数目方面十分吻合,因此鉴别为该种无疑。这是本种在中国南海的首次报道。本种群个体普遍大于青岛种群, 可能与该生境微藻食物丰富有关。另外, 该种群在额棘毛和横棘毛数目上相对不稳定。
2.8 寡毛双眉虫Diophrys oligothrix Borror, 1965(图版Ⅳ-56—58; 表 5)
游仆亚纲Euplotia Small & Lynn, 1985
游仆目Euplotida Small & Lynn, 1985
尾刺虫科Uronychiidae Jankowski, 1975
形态学描述(n=20) 虫体常为长椭圆形(图版Ⅳ-56), 大小约(70—100) μm×(40—60) μm; 体较透明。口区窄小, 约占体长的一半。背腹扁平, 宽厚比约2:1。2枚腊肠状大核。口围带由22—27片小膜组成, 前端小膜长约25 μm。两片波动膜较发达, 其中口侧膜由许多短列的毛基粒组成, 向前延伸至虫体前端(图版Ⅳ-57)。额棘毛恒为5根, 长约20 μm; 腹棘毛2根, 位于横棘毛前方, 长约15 μm。2根左缘棘毛长约15 μm, 相距较远, 前面一根位于口围带近口端左侧, 后面一根位于横棘毛左侧(图版Ⅲ-57, 长箭头)。5根横棘毛和3根尾棘毛较粗壮,长约25 μm, 其排布位置同其它双眉虫。恒具4列背触毛, 其中触毛排列稀疏而连续(图版Ⅳ-58, 短箭头), 活体长约5 μm。运动较迅速, 表现为爬行, 偶或悬游于水中。

表 5 盾圆双眉虫(第一行)、寡毛双眉虫(第二行)、偏寡毛双眉虫(第三行)、张氏拟双眉虫(第四行)的统计学数据Tab. 5 Morphometric data on Diophrys scutum (first line), Diophrys oligothrix (second line), Diophrys apoligothrix (third line) and Paradiophrys zhangi (fourth line)
比较与讨论 本种为海洋常见种, 国内已有多次报道[19,20]。本种区别与上一种在于具有2根左缘棘毛和仅4列背触毛以及较柔软的身体。这是该种首次发现于盐度较低的咸水中, 显示其较强的环境适应能力。与青岛种群相比, 湛江种群个体稍大,可能与该生境饵料食物比较丰富有关。
2.9 盾圆双眉虫Diophrys scutum (Dujardin, 1841) Kahl, 1932(图版Ⅳ-61—64、70; 表 5)
游仆亚纲Euplotia Small & Lynn, 1985
游仆目Euplotida Small & Lynn, 1985
尾刺虫科Uronychiidae Jankowski, 1975
形态学描述(n=30) 虫体为盾圆形, 大小约(150—250) μm×(80—150) μm; 口区阔大, 约占体长的2/3。体内充满大量内质颗粒而在低倍镜下呈现灰褐色或黑色。口围带由61—87片, 平均76片小膜组成, 远端小膜绕过虫体前端背面后止于体腹面右前2/5处; 口区右侧有两片发达的波动膜, 其中口侧膜由许多短列的毛基粒组成, 向前延伸至虫体前端(图版Ⅳ-61、62)。额棘毛普遍为5根, 长约50 μm;腹棘毛恒为2根, 长约25 μm; 5根横棘毛和3根尾棘毛均粗壮(图版Ⅳ-63、70), 分别长约60 μm和35 μm; 2根左缘棘毛长约45 μm。背触毛短茬状, 长约7 μm,在体侧和背面排列成5—7列, 其中毛基粒排列紧密(图版Ⅳ-61、62, 短箭头)。大核有2部分组成, 每部分念珠状, 由2—5个, 通常3个结节构成(图版Ⅳ-70)。运动较迅速, 爬行于基质上, 偶或悬游于水中。
细胞发生早期, 后仔虫口原基独立出现于左侧横棘毛左前皮下深层; 左右腹棘毛的两侧分别出现了3条和2条细长的棘毛原基(图版Ⅳ-63, 长箭头);最右侧的背触毛列前后各出现原基(图版Ⅳ-63, 双箭头)。细胞发生的后期, 前后仔虫中5条原基自左至右按3:2:2:3:1分化出新棘毛(图版Ⅳ-64); 波动膜原基前独立产生1根额棘毛; 老的缘棘毛前各出现一原基(图版Ⅳ-64); 最右侧背触毛原基后端产生3根尾棘毛(图版Ⅳ-64)。
比较与讨论 本种为本属常见的大型种, 常摄食硅藻, 国内外已有多次报道[18,21—23]。本种区别于同属种在于个体大且背触毛多列。在体形和纤毛图式方式方面与以往的青岛种群十分吻合。本种群个体大小与Song和Packroff[20]1997年种群差异不大, 因此两者的口围带小膜数十分接近, 均多于个体较小的2011年种群[18]。另一个较大的区别在于大核的形态: 以前的两青岛种群均为腊肠状, 而本青岛种群为念珠状。和以往的种群相同, 该种群在额棘毛和横棘毛及背触毛列数目上常有变动。
2.10 张氏拟双眉虫Paradiophrys zhangi Jiang et al., 2011(图版Ⅳ-65—69; 表 5)
游仆亚纲Euplotia Small & Lynn, 1985
游仆目Euplotida Small & Lynn, 1985
尾刺虫科Uronychiidae Jankowski, 1975
本种为Jiang等[24]新建立, 迄今仅有1次报道。基于新种群某些分类特征的变异, 此处对该种进行重新定义。
新定义: 活体大小约(70—110) μm×(40—60) μm,体呈矩形。体表略盔甲状。口围带分成两部分, 由26—34片小膜组成; 口侧膜发达, 由许多短列的毛基粒组成; 口内膜退化或消失。横棘毛多为4根; 普遍5或6根额棘毛; 2根腹棘毛紧密分布于横棘毛前方。左缘棘毛和尾棘毛各3根, 分布于体后左右缘。恒为6列背触毛和2枚大核。海水种。
形态学描述(n=13) 虫体体表坚实, 外形较稳定, 呈长方形(图版Ⅳ-65), 有时前部稍宽于后端,大小约(70—110) μm×(45—60) μm; 口区约占体长的2/3(图版Ⅳ-66)。体表具密集排列的颗粒。胞质灰暗, 但口区和尾部则形成透明区。内质充满直径在1—2 μm的油球和晶体。2枚球形或椭球形大核(图版Ⅳ-69)。口围带分成2组, 前者小膜7—9片, 着生于体前背方齿状凸起之间; 后者由22—26片小膜组成(图版Ⅳ-66、68)。波动膜仅口侧膜可见, 由横排短列的毛基粒构成楔形, 前伸至虫体前端(图版Ⅳ-67, 双箭头)。额棘毛恒为6根, 散布于额区(图版Ⅳ-66, 短箭头); 2根腹棘毛基体十分弱小, 紧密排布于最右侧横棘毛前方(图版Ⅳ-67, 长箭头)。4根较粗壮的横棘毛(图版Ⅳ-67、69)。3根左缘棘毛位于横棘毛左后方、近体缘的凹陷处(图版Ⅳ-65、66)。3根尾棘毛位于体右后背方的凹陷处。6列背触毛, 其中毛基粒对排列紧密, 第2列后端向右延伸并弯曲毛基粒排列紧密(图版Ⅳ-67、68, 短箭头);触毛活体观长约2—3 μm。重组后期个体腹面可见老的棘毛(图版Ⅳ-69, 长箭头)。运动表现为较缓慢地爬行于基质上, 偶绕体轴悬游于水中。
比较与讨论 本种群在活体形态、缘棘毛和尾棘毛以及背触毛列的数目和排布方式以及核型和青岛种群基本吻合, 但惠州种群未见口内膜。相比青岛种群, 我们的种群个体稍大, 具有较多的口围带小膜和额棘毛; 另外的不同是横棘毛数目十分稳定。
Lynn D. The Ciliated Protozoa: Characterization, Classi-
[1]fication, and Guide to the Literature (third edition) [M]. Heidelberg: Springer. 2008, 605
[2]Lei Y L, Xu K D. Research progress in the ecology of benthic ciliated protozoa [J]. Acta Hydrobiologica Sinica, 2008, 32(Suppl): 155—160 [类彦立, 徐奎栋. 底栖纤毛虫原生动物的生态学研究进展. 水生生物学报, 2008, 32(增刊): 155—160]
[3]Jiang Y, Xu H L, Hu X Z, et al. Functional groups of marine ciliated protozoa and their relationships to water quality [J]. Environmental Science Pollution Research, 2013, 20: 5272—5280
[4]Song W B, Warren A, Hu X Z. Free-living Ciliates in the Bohai and Yellow Seas, China [M]. Beijing: Science Press. 2009, 518 [宋微波, A. 沃伦, 胡晓钟. 中国黄渤海的自由生纤毛虫. 北京: 科学出版社. 2009, 518]
[5]Corliss J O. The Ciliated Protozoa: Characterization, Classification and Guide to the Literature (second edition) [M]. Oxford: Pergamon Press. 1979, 455
[6]Song W B, Xu K D, Shi X L, et al. Progress in Protozoology [M]. Qingdao: Qingdao Ocean University Press. 1999, 9—25 [宋微波, 徐奎栋, 施心路, 等. 原生动物学专论. 青岛: 青岛海洋大学出版社. 1999, 9—25]
[7]Song W B. Description of the marine ciliate Pseudoamphisiella lacazei (Maupas, 1883) nov. gen., nov. comb. (Protozoa, Ciliophora, Hypotrichida) [J]. Oceanologia et Limnologia Sinica, 1996, 27(1): 18—22 [宋微波. 海洋纤毛虫一新属, 伪小双虫属及新组合——拉氏伪小双虫. 海洋与湖沼, 1996, 27(1): 18—22]
[8]Song W B, Warren A, Hu X Z. Morphology and morphogenesis of Pseudoamphisiella lacazei (Maupas, 1883) Song 1996 with suggestion of establishment of a new family Pseudoamphisiellidae nov. fam. (Ciliophora, Hypotrichida) [J]. Archiv für Protistenkend, 1997, 147(3-4): 265—276
[9]Shen Z, Lin X F, Long H A, et al. Morphology and small subunit rDNA gene sequence of Pseudoamphisiella quadrinucleata n. sp. (Ciliophora, Urostylida) from the South China Sea [J]. Journal of Eukaryotic Microbiology, 2008, 55(6): 510—514
[10]Fan Y B, Chen X M, Hu X Z, et al. Morphology and morphogenesis of Apoholosticha sinica n. g., n. sp. (Ciliophora, Hypotrichia), with consideration of its systematic position among urostylids [J]. European Journal of Protistology, 2014, 50(1): 78—88
[11]Hu X Z, Fan Y B, Warren A. New record of Apoholosticha sinica (Ciliophora, Urostylida) from the UK: morphology, 18S rRNA gene phylogeny and notes on morphogenesis [J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(8): 2549—2561
[12]Lin X F, Song W B. A new marine ciliate, Erniella wilberti sp. n. (Ciliophora: Hypotrichida), from shrimp culturing waters in north China [J]. Acta Protozoologica, 2004, 43(1): 55—60
[13]Xu K D, Lei Y L, Choi J K. Tunicothrix rostrata n. g., n. sp., a new urostylid ciliate (Ciliophora, Stichotrichia) from the Yellow Sea [J]. Journal of Eukaryotic Microbiology, 2006, 53(6): 485—493
[14]Wang Y G, Hu X Z, Huang J, et al. Characterization of two urostylid ciliates, Metaurostylopsis flavicana spec. nov. and Tunicothrix wilberti (Lin & Song, 2004) Xu et al., 2006 (Ciliophora, Stichotrichia), from a mangrove nature protection area in China [J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(Pt 7): 1740—1750
[15]Song W B, Petz W, Warren A. Morphology and morphogenesis of the poorly-known marine urostylid ciliate, Metaurostylopsis marina (Kahl, 1932) nov. gen., nov. comb. (Protozoa, Ciliophora, Hypotrichida) [J]. European Journal of Protistology, 2001, 37(1): 63—76
[16]Lü Z, Chen L, Chen L Y, et al. Morphogenesis and molecular phylogeny of a new freshwater ciliate, Notohymena apoaustralis n. sp. (Ciliophora, Oxytrichidae) [J]. Journal of Eukaryotic Microbiology, 2013, 60(5): 455—466
[17]Song W B, Shao C, Yi Z Z, et al. The morphology, morphogenesis and SSrRNA gene sequence of a new marine ciliate, Diophrys apoligothrix spec. nov. (Ciliophora; Euplotida) [J]. European Journal of Protistology, 2009, 45(1): 38—50
[18]Xu Y, Li J Q, Hu X Z. Redescriptions of two marine ciliates, Diophrys scutum (Dujardin, 1841) Kahl, 1932 and Diophrys apoligothrix Song et al. 2009 (Protozoa, Ciliophora) [J]. Acta Hydrobiologica Sinica, 2011, 35(1): 14—21 [许媛, 李继秋, 胡晓钟. 盾圆双眉虫与伪寡毛双眉虫的形态学重描述(原生动物, 纤毛门). 水生生物学报, 2011, 35(1): 14—21]
[19]Song W B, Wilbert N. Morphogenesis of the marine ciliate Diophrys oligothrix Borror, 1965 during the cell division (Protozoa, Ciliophora, Hypotrichida) [J]. European Journal of Protistology, 1994, 30(1): 38—44
[20]Song W B, Packroff G. Taxonomische Untersuchungen an marinen Ciliaten aus China mit Beschreibungen von 2 neuen Arten, Strombidium globosaneum nov. spec. andStrom bidium platum nov. spec. (Protozoa, Ciliophora) [J]. Archiv für Protistenkunde, 1997, 147(3-4): 331—360
[21]Borror A C. Morphological comparison of Diophrys scutum (Dujardin, 1841) and Diophrys peloetes n. sp. (Hypotrichida, Ciliophora) [J]. Journal of Protozoology, 1965, 12(1): 60—66
[22]Song W B, Packroff G. Beitrag zur Morphogenese des marinen Ciliaten Diophrys scutum (Dujardin, 1841)(Cilophora, Hypotrichida) [J]. Zoologische Jahrbücher Abteilang Für Anatomie and Ontogenie Der Tiere, 1993, 123: 85—95
[23]Curds C R, Wu I C H. A review of the Euplotidae (Hypotrichida, Ciliophora) [J]. Bulletin of the British Museum (Natural History) Zoology, 1983, 44(3): 191—247
[24]Jiang J M, Warren A, Song W B. Morphology and molecular phylogeny of two new marine euplotids, Pseudodiophrys nigricans n. g., n. sp. and paradiophrys Zhang: n. sp. (Ciliophora: Euplotida) [J]. Journal of Eukaryotic Microbiology, 2011, 58(5): 437—445
MORPHOLOGICAL DESCRIPTIONS OF TEN SPIROTRICHEAN CILIATES FROM CHINA (PROTOZOA, CILIOPHORA)
LÜ Li-Ping1, FAN Yang-Bo1,2and HU Xiao-Zhong1
(1. Key Laboratory of Mariculture, Ministry of Education, College of Fisheries, Ocean University of China, Qingdao 266003, China; 2. School of Civil and Environmental Engineering, Harbin Institute of Technology Shenzhen Graduate School, Shenzhen 518055, China)
Ten species of spirotrichean ciliates, i.e., Pseudoamphisiella lacazei, P. quadrinucleata, Apoholosticha sinica, Tunicothrix wilberti, Metaurostylopsis marina, Notohymena apoaustralis, Diophrys apoligothrix, D. oligothrix, D. scutum and Paradiophrys zhangi, collected from intertidal zone, mangroves and freshwater habitats of Shandong and Guangdong, China, were morphologically investigated with live observation and protargol staining methods. Morphological descriptions and morphometric data were provided. The current research revealed that N. apoaustralis, D. apoligothrix and P. zhangi were first recorded in Guangdong province. Based on the new data, P. zhangi was redefined as below: body ca. (70—110) μm×(40—60) μm in vivo, rectangular, with sculptured surface; adoral zone bipartite, composed of 26—34 membranelles; endoral membrane reduced or absent; mostly four transverse and two ventral cirri, five or six frontal cirri; consistently three left marginal and three caudal cirri, six dorsal kineties, and two globular macronuclear nodules. A. sinica can survive under environments with different salinity, which suggests that it may have a wide geographical distribution. For the first time D. oligothrix was found having strong ability to adapt to the environment.
Ciliates; Infraciliature; Morphology; Spirotrichs

图版Ⅰ 拉氏伪小双虫(1—9、17、四核伪小双虫(10—16)PlateⅠ Pseudoamphisiella lacazei (1—9, 17), and Pseudoamphisiella quadrinucleata (10—16)1、2. 蛋白银制片标本; 示腹面纤毛器和核器, 长箭头示口围带远端, 短箭头示尾棘毛, 双箭头示小核; 3. 蛋白银制片标本; 短箭头示口棘毛, 长箭头示额棘毛; 4. 蛋白银制片标本; 短箭头示口原基, 长箭头示额-腹-横棘毛原基, 双箭头示背触毛原基; 5、6. 蛋白银制片标本, 示同一个体的腹面观和背面观, 长箭头示缘棘毛原基, 短箭头示背触毛原基; 7、9. 蛋白银制片标本, 示细胞发生末期的腹面纤毛器和大核分裂; 8、17. 蛋白银制片标本, 示细胞发生后期的腹面和背面观, 短箭头示尾棘毛; 10、11. 不同个体的活体腹面观; 12. 部分活体背面观, 示透明层和射出体; 13. 活体观, 示大核; 14—16. 蛋白银制片标本, 长箭头示小核, 短箭头示尾棘毛。AZM: 口围带; DK:背触毛; EM: 口内膜; LMR: 左缘棘毛列; PM: 口侧膜; RMR: 右缘棘毛列; RVR: 右腹棘毛列; TC: 横棘毛; 比例尺(Scale bars): 图版=100 μm1, 2. After protargol stained specimens, showing ventral ciliature and nuclear apparatus, arrow to show the distal end of adoral zone of membranelles, arrowheads to show caudal cirri, double-arrowheads to show micronuclei; 3. After protargol stained specimen, arrow to show frontal cirri, arrowheads to show buccal cirri; 4. After protargol stained specimen, arrows to show frontal-ventral-transverse cirral anlagen, arrowheads to show oral primordial, double-arrowheads to show dorsal kineties anlagen; 5, 6. After protargol stained specimen to show ventral and dorsal view of the same individual, arrows to show marginal cirral anlagen, arrowheads to show dorsal kineties anlagen; 7, 9. After protargol stained specimens, showing ventral ciliature and nuclear division in late divider; 8, 17. After protargol stained specimen to show ventral and dorsal view of the same individual, arrowheads to show caudal cirri; 10, 11. Ventral view in vivo of different cells; 12. Part dorsal view in vivo, showing transparent layer and extrusomes; 13. Ventral view in vivo, showing macronuclear nodules; 14—16. After protargol stained specimens, arrows to show micronuclei, arrowheads to show caudal cirri. AZM: Adoral zone of membranelles; DK: dorsal kinety; EM: endoral membrane; LMR: left marginal row; PM: paroral membrane; RMR: right marginal row; RVR: right ventral row; TC: transverse cirri
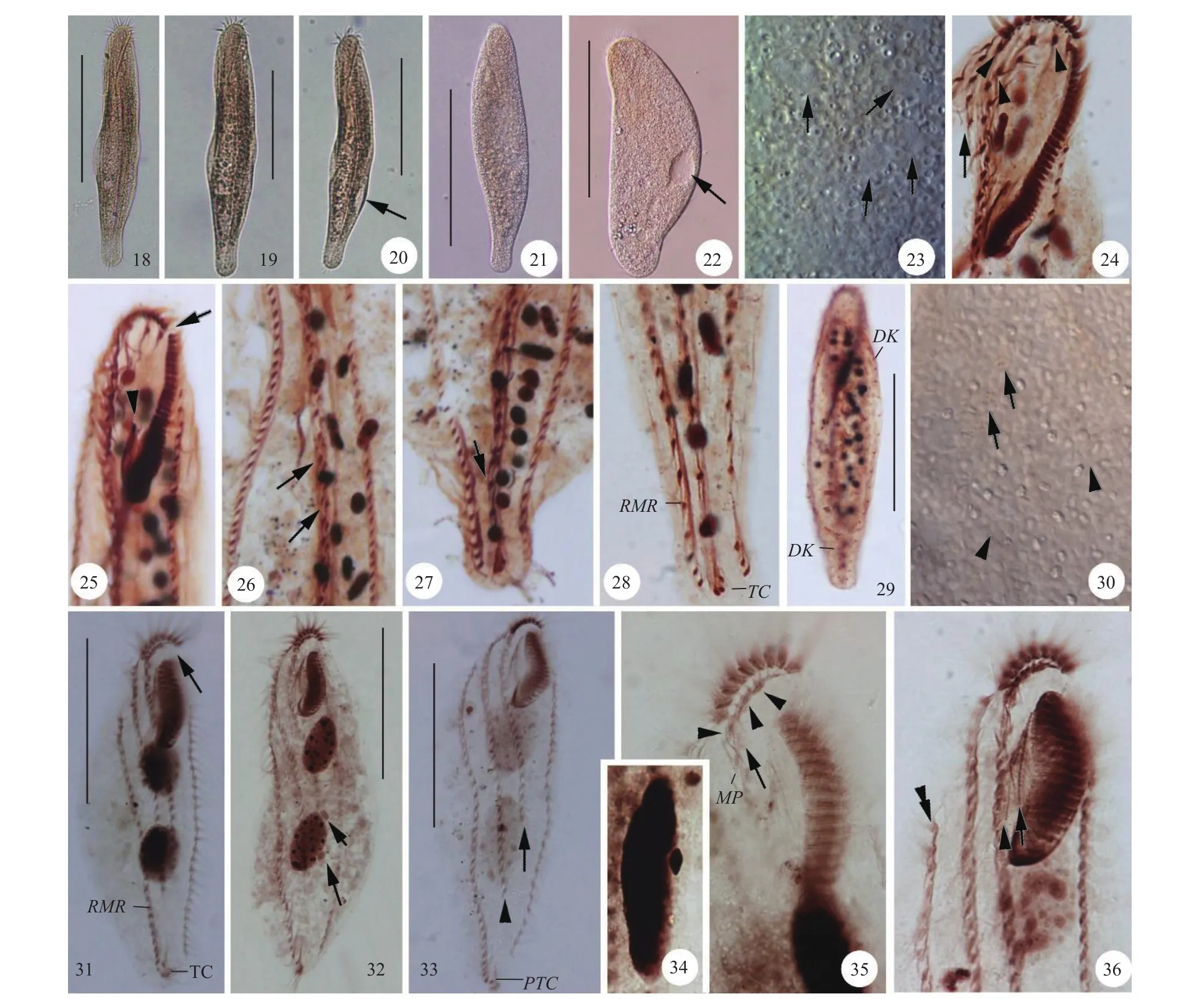
图版Ⅱ 中华偏全列虫(18—30)、维尔伯特泡毛虫(31—36)PlateⅡ Apoholosticha sinica (18—30), and Tunicothrix wilberti (31—36)18—22. 不同个体的活体观, 长箭头示伸缩泡; 23.活体观, 长箭头示大核; 24. 蛋白银制片标本, 长箭头示额前棘毛列, 短箭头示额棘毛; 25. 蛋白银制片标本, 长箭头示口围带两分, 短箭头示波动膜; 26. 蛋白银制片标本, 长箭头示中腹棘毛对; 27. 蛋白银制片标本, 长箭头示中腹棘毛列; 28. 蛋白银制片标本, 示横棘毛和缘棘毛列; 29. 蛋白银制片标本, 示背触毛列; 30. 活体观, 长箭头示色素颗粒, 短箭头示无色皮层颗粒; 31. 蛋白银制片标本, 长箭头示口围带两分; 32. 蛋白银制片标本, 示大核和小核(长箭头); 33. 蛋白银制片标本, 长箭头示额腹棘毛列, 短箭头示内侧右缘棘毛列; 34. 蛋白银制片标本, 示大核和小核; 35. 蛋白银制片标本, 长箭头示口旁棘毛, 短箭头示额棘毛; 36. 蛋白银制片标本, 长箭头示口侧膜, 短箭头示口内膜, 双箭头示外侧右缘棘毛列. DK: 背触毛; MP: 中腹棘毛对; PTC, 横前腹棘毛; RMR: 右缘棘毛列; TC: 横棘毛 比例尺(Scale bars): 图版=100 μm18—22. Ventral view in vivo of different cells, arrow to show contractile vacuole; 23. View in vivo, arrows to show macronuclear nodules; 24. After protargol stained specimen, arrow to show frontoterminal cirral row, arrowheads to show frontal cirri; 25. After protargol stained specimen, arrow to show bipartite adoral zone, arrowheads to show undulating membranes; 26. After protargol stained specimen, arrows to show midventral pairs; 27. After protargol stained specimen, arrow to show midventral row; 28. After protargol stained specimen, showing marginal rows and transverse cirri; 29. After protargol stained specimen, showing dorsal kineties; 30. View in vivo, arrows to show pigments, arrowheads to show colorless cortical granules; 31. After protargol stained specimen, arrow to show bipartite adoral zone; 32. After protargol stained specimen, showing micronuclei (arrows) and macronuclear nodules; 33. After protargol stained specimen, arrow to show frontoventral row, arrowhead to show the inner right marginal row; 34. After protargol stained specimen, showing macronuclear nodule and micronucleus; 35. After protargol stained specimen, arrow to show parabuccal cirrus, arrowheads to show frontal cirri; 36. After protargol stained specimen, arrow to show paroral membrane, arrowhead to show endoral membrane, double-arrowhead to show the outer right marginal row. DK: dorsal kinety; MP: midventral pair; PTC: pretransverse ventral cirri; RMR: right marginal row; TC: transverse cirri

图版Ⅲ 海洋后尾柱虫(37—42)、偏澳大利亚速体虫(43—52)PlateⅢ Metaurostylopsis marina (39—42), and Notohymena apoaustralis (43—52)37. 蛋白银制片标本, 长箭头示横棘毛, 短箭头示中腹棘毛列; 38. 蛋白银制片标本, 长箭头示额前棘毛列, 短箭头示口棘毛; 39—41. 蛋白银制片标本, 示前仔虫和后仔虫(长箭头); 42. 蛋白银制片标本, 示细胞发生中期个体腹面各原基; 43—45. 不同个体活体腹面观; 46.蛋白银制片标本, 示口器和额区纤毛器; 47. 蛋白银制片标本, 示横棘毛和尾棘毛(短箭头); 48. 蛋白银制片标本, 示腹面纤毛器, 长箭头示口棘毛; 49—50. 活体观, 示色素颗粒; 51. 蛋白银制片标本, 示口围带小膜; 52. 蛋白银制片标本, 箭头示口围带远端, 短箭头示额棘毛. AZM: 口围带; EM: 口内膜; FVC: 额腹棘毛; LMR: 左缘棘毛列; PM: 口侧膜; PVC: 口后腹棘毛; RMR: 右缘棘毛列; TC: 横棘毛比例尺(Scale bars): 图版=100 μm37. After protargol stained specimen, arrow and arrowhead to show transverse cirri and midventral cirral row, respectively; 38. After protargol stained specimen, arrow and arrowhead to show frontoterminal cirral row and buccal cirrus, respectively; 39, 40, 41. After protargol stained specimen, showing oral primordium of proter and opisthe (arrow); 42. After protargol stained specimen, showing different anlagen on ventral side of the middle divider; 43, 44, 45. Ventral view in vivo of different cells, showing shape variants; 46. After protargol stained specimen, showing oral apparatus and frontal ciliature extral; 47. After protargol stained specimen, showing transverse cirri and caudal cirri (arrowheads); 48. After protargol stained specimen, showing ventral ciliature, arrow to show buccal cirrus; 49, 50. View in vivo, showing pigment granules; 51. After protargol impregnated specimen, showing adoral membranelles; 52. After protargol stained specimen, arrow to show the distal end of adoral zone of membranelles, arrowheads to show frontal cirri AZM: adoral zone of membranelles; EM: endoral membrane; FVC: frontoventral cirri; LMR: left marginal row; PM: paroral membrane; PVC: postoral ventral cirri; RMR: right marginal row; TC: transverse cirri
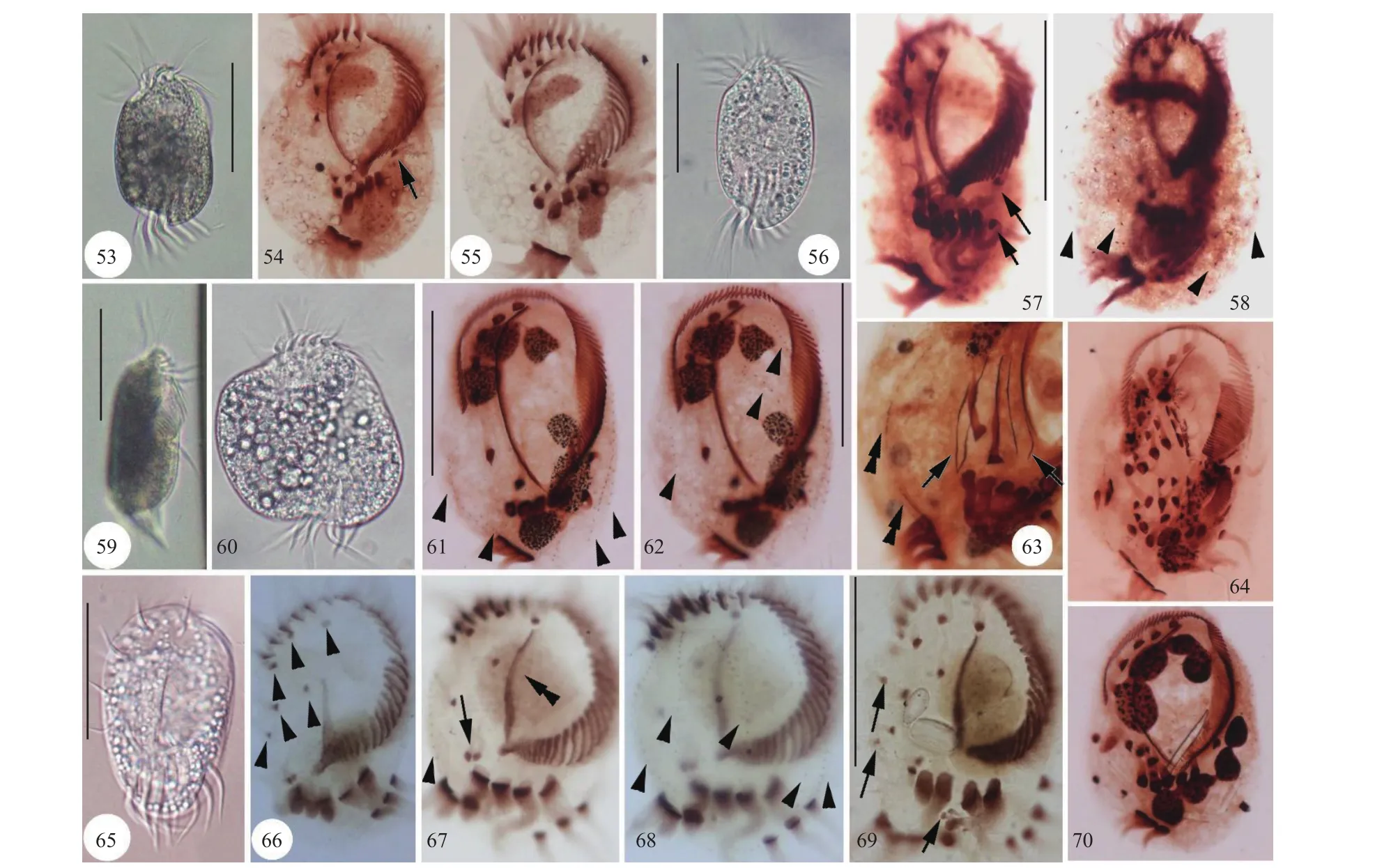
图版Ⅳ 偏寡毛双眉虫(53—55、59—60)、寡毛双眉虫(56—58)、盾圆双眉虫(61—64、70)、张氏拟双眉虫 (65—69)PlateⅣ Diophrys apoligothrix (53—55, 59—60), Diophrys oligothrix (56—58), Diophrys scutum (61—64, 70), and Paradiophrys zhangi (65—69)53. 活体腹面观, 示体形; 54—55. 蛋白银制片标本, 长箭头示左缘棘毛; 56. 活体腹面观; 57、58. 蛋白银制片标本, 示腹面纤毛器和核器, 长箭头示左缘棘毛, 短箭头示背触毛列; 59. 活体侧面观; 60. 活体观, 示内含物; 61、62. 蛋白银制片标本, 示腹面纤毛器和核器, 短箭头示背触毛列; 63. 蛋白银制片标本, 长箭头示额-腹-横棘毛原基, 双箭头示尾棘毛; 64. 蛋白银制片标本, 示发生后期个体腹面纤毛器; 65. 活体腹面观; 66. 蛋白银制片标本, 短箭头示额棘毛; 67、68. 蛋白银制片标本, 长箭头示腹棘毛, 短箭头示背触毛列, 双箭头示口侧膜; 69. 蛋白银制片标本, 示重组后期个体腹面纤毛器, 长箭头示老棘毛; 70. 蛋白银制片标本, 示腹面纤毛器和大核. 比例尺(Scale bars): 图版=100 μm53. Ventral view in vivo, showing body shape; 54, 55. After protargol stained specimens, arrow to show left marginal cirrus; 56. Ventral view in vivo; 57, 58. After protargol stained specimens, arrows to show left marginal cirri, arrowheads to show dorsal kineties; 59. Lateral view in vivo; 60. View in vivo, showing endoplasmic inclusions; 61, 62. After protargol stained specimens, showing ventral ciliature and nuclear apparatus, arrowheads to show dorsal kineties; 63. After protargol stained specimen, arrows to show fronto-ventral-transverse cirral anlagen, double-arrowheads to show dorsal kiney anlagen; 64. After protargol stained specimens, showing ventral ciliature of a later divider; 65. Ventral view in vivo; 66. After protargol stained specimen, arrowheads to show frontal cirri; 67, 68. After protargol stained specimen, arrow to show ventral cirri, arrowheads to show dorsal kineties, double-arrowheads to show dorsal kineties. 69. After protargol stained specimens, showing ventral ciliature of a late reorganizer, arrows to show old cirri; 70. After protargol stained specimen, showing ventral ciliature and macronuclear nodules
Q959.11
A
1000-3207(2017)05-1126-14
10.7541/2017.141
2017-02-06;
2017-05-21
国家自然科学基金(41576134)资助 [Supported by the National Natural Science Foundation of China (41576134)]
吕立平(1995—), 男, 山东淄博人; 本科生; 研究方向为水产养殖。E-mail: lv_liping@foxmail.com; 樊阳波(1989—), 女, 江西赣州人; 研究生; 研究方向为海洋生物学。E-mail: cookies.1989@163.com
胡晓钟(1970—), 男, 安徽桐城人; 博士研究生; 研究方向为原生动物学。E-mail: xiaozhonghu@ouc.edu.cn
