湛江沿海海洋微藻及其多糖、脂类和蛋白藻株多样性研究
2017-09-12黄永梅杨晓红兰柳波詹静婷罗辉江黎明
黄永梅杨晓红兰柳波詹静婷罗 辉江黎明,
(1. 广东医科大学化学教研室, 湛江 524023; 2. 广东医科大学湛江市环北部湾海洋微生物研究开发重点实验室, 湛江 524023; 3. 广东医科大学生物化学与分子生物学研究所, 湛江 524023)
湛江沿海海洋微藻及其多糖、脂类和蛋白藻株多样性研究
黄永梅1,2杨晓红1,2兰柳波3詹静婷1,2罗 辉1,2江黎明2,3
(1. 广东医科大学化学教研室, 湛江 524023; 2. 广东医科大学湛江市环北部湾海洋微生物研究开发重点实验室, 湛江 524023; 3. 广东医科大学生物化学与分子生物学研究所, 湛江 524023)
从硇洲岛和徐闻珊瑚礁自然保护区潮间带采集的海水和沉积物样品中分离培养海洋微藻, 筛选其中富含多糖、脂类或蛋白质的藻株。采用形态学观察、18S rDNA序列比较及其系统发育分析法, 对分离培养的海洋微藻及其富含多糖、脂类或蛋白质的藻株进行分类鉴定和生物多样性分析。分离、培养、鉴定并储藏了189株海洋微藻, 归属于65个种, 分布于硅藻门(Bacillariophyta)、绿藻门(Chlorophyta)、定鞭藻门(Haptophyta)和红藻门(Rhodophyta)的9纲、25目、30个科、38个属; 其中多糖含量较高的46株海洋微藻, 分布于25个种, 20个属; 脂类含量较高的46株海洋微藻, 分布于32个种, 15个属; 蛋白含量较高的46株海洋微藻, 分布于28个种, 18个属。结果表明硇洲岛和徐闻珊瑚礁自然保护区潮间带可培养的海洋微藻及其富含多糖、脂类和蛋白质藻株的物种多样性丰富, 在新型药物、活性天然产物、功能食品和饲料及其添加剂的发掘等方面具有良好前景。
硇洲岛; 徐闻珊瑚礁自然保护区; 海洋微藻; 多糖; 脂类; 蛋白质; 多样性
海洋微藻是生活在海洋环境中的一大类原核或真核微生物。它们可利用太阳能将水和CO2经光合作用转变成多糖、蛋白质和脂类等生物大分子。已知的物种有30000多种, 据估算总数约为200000种[1]。一些在东亚和亚太部分地区长期食用的海洋微藻含有丰富的蛋白质[2]、脂类[3]和多糖[4]等营养物质, 已经或正在被广泛用于新型保健食品、饲料、食品和饲料添加剂及生物能源等的产品的研究和开发[5,6]; 另有一些海洋微藻含有丰富的活性多肽、包括二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)在内的多不饱和脂肪酸、硫酸酯多糖等活性次级代谢产物, 被认为在新型活性天然产物、药物或药物先导物、食品和饲料添加剂、化妆品等的发掘中有巨大潜力[7,8]。
微藻是单细胞或简单的多细胞光合自养微生物, 只要是有阳光和少量营养盐的地方就能够生长繁殖, 可在海水、盐田和营养贫瘠等不利环境下快速生长[9]。获取适合当地环境和气候条件的优良藻种是海洋微藻培养和使用的前提条件[10]。虽然国内外已建有了一些保存微藻种质资源的培养物保藏中心, 但目前公认的24000多种微藻物种中大约只有10%的微藻物种被成功地长期保存[8,11], 而许多自然环境中则存在着很多具有优良生物学特性的藻种有待发掘, 且使用当地藻种已被证明对当地环境和气候条件等具有适应性强等明显的优势并可避免非当地物种入侵[12]。因此, 分析探讨特定区域特定生态环境中海洋微藻, 尤其是富含多糖、脂类和蛋白质藻株的多样性, 不仅有重要的生态学意义而且有良好的应用前景[6,8,13]。
硇洲岛和徐闻珊瑚礁国家级自然保护区地处湛江沿海, 是目前国内受人类活动影响较小的热带、亚热带海岛和珊瑚礁自然保护区, 其潮间带蕴藏着丰富的海洋微生物资源[11,14]。研究的目的是筛选和分析硇洲岛和徐闻珊瑚礁自然保护区潮间带可培养的富含多糖、脂类或蛋白质的海洋藻微的多样性, 为热带和亚热带海洋微藻资源的开发利用奠定基础。
1 材料与方法
1.1 实验材料
用于富含多糖、脂类和蛋白质藻株筛选及其物种多样性分析的海洋微藻共189株, 其中118株为本研究组之前从徐闻珊瑚礁国家自然保护区(20°10′—20°27′N, 109°50′—109°24′E)潮间带分离藻株(GenBank登录号KU561102-KU561219)[11], 70株由本研究从徐闻珊瑚礁自然保护区和硇洲岛(20°52′—20°56′N, 110°33′— 110°38′E)潮间带采样、分离和鉴定(GenBank登录号为KY054925-KY054994), 紫球藻由广东恒兴饲料实业股份有限公司馈赠(GenBank登录号为KY054995, 已在本地作为饵料养殖多年)。
1.2 研究方法
海洋微藻的富集、分离纯化 采用本研究组之前报道的方法[11]进行。简单说就是取2 g泥沙样品悬浮于20 mL灭菌天然海水, 其上清液和海水样品分别用100 μm的滤网过滤去除悬浮颗粒和浮游动物后, 取5 mL滤液转移到装有15 mL f/2-medium液体培养基[15](将f/2-medium营养液[15]与经0.45 μm滤膜过滤的自然海水1∶1000混合, 120℃, 20min高压灭菌后冷却至室温)60 mL的锥形瓶中, 置于光照培养箱中, 在温度(25±2)℃、光照强度3000 lx、光暗比12h∶12h条件下富集培养约7—10d。
富集培养液经细胞计数后分别稀释成1个活细胞/μL, 取1 μL置于96孔培养板各孔的中央, 在倒置显微镜(10×10倍)下观察, 找出并标记仅含有一个藻细胞的孔; 向含2个或2个以上藻细胞的孔中滴加10 μL f/2-medium液体培养基[15], 用微吸管将多余的细胞剔除或转移到无细胞的小孔并标记为仅含1个藻细胞的孔; 各孔加入200 μL f/2-medium液体培养基[15]后, 将96孔板放置于光照培养箱中培养, 温度为(25±2)℃, 光照强度3000 lx, 光暗比12h∶12h条件下培养约1周; 镜检确认单一藻细胞生长的孔, 并将孔中藻液转移至装有40 mL f/2-medium液体培养基[15]的100 mL锥形瓶中, 置入光照培养摇床, 在温度(25±2)℃、光照强度3000 lx、光暗比12h∶12h、摇床转速130 r/min的条件下培养7—10d。
微藻保存 取f/2-medium海水固体培养基[15]倒成试管斜面, 再向斜面内加入f/2-medium海水液体培养基[15](每1000 mL加入2.5 mL的2 mL 8万单位的硫酸庆大霉素注射液), 使其漫过固体斜面形成固液双相斜面培养基。取扩大培养约7d的藻种样品, 8000×g离心5min弃上清, 将沉淀的藻细胞用少量液体培养基吹打均匀, 转移至固液双相斜面培养基中, 于光照培养箱中培养7—10d, 待长成一定量后放入4℃冰箱保存。4℃冰箱要定期开弱光以保证在低温弱光的条件, 半年复苏继代一次[11]。
富含多糖藻株的筛选 采用硫酸蒽酮法[16],以葡萄糖为标准, 以已知多糖含量为12.55%的NZmm2w1藻株为阳性对照, 对所获得的海洋微藻的多糖进行定量分析。取50 μL的新鲜藻液, 加入到96孔板中, 测定OD680值, 然后加入150 μL的0.2%硫酸蒽酮试剂, 在沸水浴中加热3min, 冷却到室温, 用酶标仪在630 nm处测定OD值, 根据标以葡萄糖标准液制作的准曲线计算出多糖的相对浓度。
富含脂类藻株的筛选 采用一种基于96孔板的尼罗红染色法进行。8000×g离心10min收集处于对数生长中晚期的海洋微藻, 用生理盐水洗3次后再悬浮于生理盐水; 测OD680后将微藻悬液调整至A680=0.8; 取各种微藻悬液100 μL, 一式3份, 加入到96孔板的孔中与400 μL 20% DMSO混匀; 各孔加入12 μL 100 μg/mL尼罗红丙酮溶液, 混匀后置暗处35℃温育6min; 微藻细胞中被尼罗红染色的脂质可采用倒置荧光显微镜(Nikon eclipse TE2000-E inverted microscope)进行观察并摄影记录; 各孔的荧光强度采用酶标仪(Varioskan Flash Multimode Reader; Thermo-Fisher, USA), 选用530 nm激发波长和590 nm发射波长进行测定。
富含蛋白藻株的筛选 准确称取2 mg冷冻干燥的微藻藻粉, 于玻璃匀浆器中, 加入100 μL 0.1 mol/L的PBS, 充分研磨藻粉, 使其细胞壁破碎完全后, 吸出置于2 mLEP管, 用900 μL 0.1 mol/L的PBS分3次洗涤玻璃匀浆器, 并吸出置于上述的EP管。在5000 r/min转速下离心10min, 上清液按照BCA法蛋白定量试剂盒的说明进行蛋白质定量分析; 在562 nm波长下用紫外分光光度计测其吸光度值, 并根据标准曲线换算蛋白质的含量[13]。
微藻种属鉴定及多样性分析 取少量藻液滴于载波片并用卢戈式碘液固定, 于50i智能型正置显微镜上用100倍油镜观察微藻细胞的形态学特征并拍照记录。
收集100 mg湿重对数生长中晚期的微藻, 用植物基因组DNA提取试剂盒提取基因组DNA作为模板, 用微藻18S rDNA特异性通用PCR引物对[17]扩增藻株18S rDNA序列, 扩增产物经1.5%琼脂糖凝胶电泳分离后送至上海生工生物工程股份有限公司测序, 测序结果提交GenBank; 采用ClustalW2对测序结果进行两两比对, 排除相同序列; 采用Blast搜索软件(http://www.ncbi.nlm.nih.gov/BLAST/)从GenBank公共数据库中搜索出18S rDNA序列一致性最大的物种从而对藻株做出初步的鉴定; 用MEGA5.10软件按照邻接法聚类法[18](选择Bootstrap检验值≥50%, 1000次重复) 构建藻株18S rDNA序列系统发育树[11]。
2 结果
2.1 海洋微藻的分离纯化
之前研究组已从徐闻珊瑚礁自然保护区潮间带分离鉴定了118株海洋微藻[11], 本研究从徐文珊瑚礁自然保护区采集的样品中分离出了56株微藻,从硇洲岛分离的样品中分离出了14株海洋微藻, 共分离、鉴定和收藏了188株海洋微藻, 加上紫球藻,共收藏了189株海洋微藻。
2.2 海洋微藻的鉴定及多样性分析
各藻株的18S rDNA序列分析比对的结果显示:获得的189株海洋微藻归属微藻的4门, 9纲, 25目, 30科, 38属, 65种; 优势属为双眉藻属(Amphora), 含39株, 占被分离藻种的20.6%, 与研究组之前的报道[11]一致; 其次为褶盘藻属(Entomoneis), 含22株,占被分离藻株的11.6%(表 1)。微藻硅藻门(Bacillariophyta)海洋微藻共有154株45种22属; 其中归属硅藻纲(Bacillariophyceae)的微藻134株, 占分离培养微藻的70.9%, 中鼓藻纲(Mediophyceae)微藻19株, 约占10.1%。绿藻门(Chlorophyta)海洋微藻共有29株15种12属; 其中, 归属共球藻纲(Trebouxiophyceae)的微藻22株, 约占11.6%。定鞭藻门(Haptophyta) 海洋微藻共有5株4种3属。红藻门(Rhodophyta)只有1株(表 1)。65种海洋微藻的代表株在100倍油镜下形态观察见图 1。
2.3 富含多糖海洋微藻分类及多样性
采用硫酸蒽酮法[16]对获得的藻株多糖含量进行分析和对藻株18S rDNA序列进行比对分析及系统进化树构建(图 2)的结果显示: 189株海洋微藻中多糖含量较高(高于作为阳性对照的微拟球藻NZmm2W1的总糖量, 即高于藻体干重的12.55%,相当于0.45 μg/104cells)的46株高产多糖藻株(表1)归属25种, 分布于硅藻门(Bacillariophyta)、绿藻门(Chlorophyta)、定鞭藻门(Haptophyta)和红藻门(Rhodophyta)的6纲、14目、16科、20属; 其中优势属为褶盘藻/翼茧形藻属(Entomoneis), 共8株, 占高产多糖藻株的17.4%; 其次为双眉藻属(Amphora),共7株, 占高产多糖藻株的15.2%。
多糖含量最高的3株微藻为Xmm16W4(克里格辐节藻: Stauroneis kriegeri)、Xmm16S2(小头端菱形藻: Nitzschia capitellata)和DHmm1S3(俄克拉何马绿藻: Picochlorum oklahomensis), 多糖含量依次为(2.57±0.01)、(1.94±0.03)和(1.59±0.03) μg/104cells。
2.4 富含脂类海洋微藻的分类及多样性
采用基于96孔板的尼罗红染色法对获得的藻株脂类含量进行分析和对藻株18S rDNA序列进行比较及系统进化树构建(图 3)的分析结果显示: 在189株海洋微藻中, 中性脂含量较高(高于作为阳性对照的小球藻NZmm3W1的脂含量, 即GC-MS测定值为藻体干重的11.74%, 相当于0.72 μg/104cells)的46株高产脂类藻株(表 1)归属32个种, 分布于硅藻门(Bacillariophyta)、绿藻门(Chlorophyta)和定鞭藻门(Haptophyta)的5纲,14目,11科,15个属; 优势属为双眉藻属(Amphora), 含10株, 占富脂藻株的21.7%。
中性脂含量最高的8株微藻为Xmm16W4、Xmm19W1、Xmm10S2(克里格辐节藻: Stauroneis kriegeri)、Xmm19W2(剑形辐节藻: Stauroneis anceps)、Xmm20S4(纤细辐节藻: Stauroneis gracilior)、 Xmm18W1(新月细柱藻; Cylindrotheca closterium)、Xmm37W1(–: Nanochlorum eucaryotum)和Xmm16W1(–: Dickieia ulvacea)、中性脂含量为(2.11±0.01)—(3.61±0.03) μg/104cells。
2.5 富含蛋白海洋微藻分类及多样性
采用BCA蛋白定量法[13]对获得的藻株蛋白含量进行定量和对藻株18S rDNA序列进行比较及系统进化树构建(图 4)的分析结果显示: 189株海洋微藻中蛋白含量较高(高于作为阳性对照的微拟球藻NZmm2W1的蛋白含量, 即高于藻体干重的10%)的46株高产蛋白藻株(表 1)归属于28个种, 分布于硅藻门(Bacillariophyta)、绿藻门(Chlorophyta)、定鞭藻门(Haptophyta)和红藻门(Rhodophyta)的6纲,14目,15科,18个属; 优势属为双眉藻属(Amphora), 含10株, 占富蛋白质藻株的21.7%。
蛋白含量最高的3株微藻为DHmm1W2(新月细柱藻; Cylindrotheca closterium)、Xmm30W2和DHmm2S4(咖啡型双眉藻; Amphora coffeaeformis),蛋白含量依次为藻体干重的(20.47±0.41)%、(20.38±0.14)%和(19.82±0.20)%。
2.6 富含多糖、脂类和蛋白的海洋微藻
所获得的189株海洋微藻中, 多糖、脂类物质和蛋白质含量相对都较高(同一藻株的多糖、脂肪酸和蛋白质分别高于藻体干重的12.55%、11.74%和10%)的藻株有8株(表 2); 舟形藻属(Navicula)海洋微藻3株, 菱形藻属(Nitzschia)海洋微藻有2株, 辐节藻属(Stauroneis)、微眼藻属(Minutocellus)和-(Nanochlorum)属海洋微藻各1株(表 2)。其中, 藻株
Xmm16W4(克里格辐节藻: Stauroneis kriegeri)不仅蛋白质含量相对较高, 而且多糖和脂类的含量是所获得的微藻中最高的。

表 1 硇洲岛和徐文珊瑚礁自然保护区可培养海洋微藻及其高糖、脂和蛋白藻株的类群分布Tab. 1 Groups distribution of the cultivated marine microalgae and the strains with higher polysaccharide, lipid and protein from Nao Zhou Island and Xuwen coral reef nature reserve

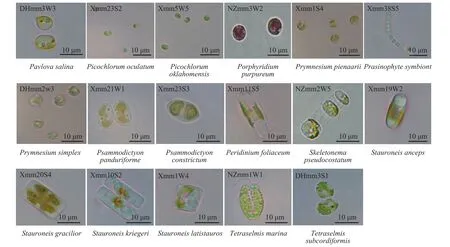
图 1 湛江沿海潮间带可培养海洋微藻Fig. 1 Light microscopic images of the marine microalgae from the intertidal zone along Zhanjiang coast
3 讨论
湛江地区地处热带亚热带地区, 全年日照充足、气温适宜, 并拥有大量的滩涂湿地和适合海洋微藻生长的海水, 具备开展大规模培养海洋微藻进而研发微藻饵料和饲料、保健食品、饲料和食品添加剂、活性天然产物和药物或药物先导物、化妆品及生物燃料等的良好环境。研究表明, 获取适合当地环境和气候条件的优良藻种是海洋微藻培养和使用的前提条件之一[10]。本研究通过分析源自硇洲岛和徐闻珊瑚礁自然保护区潮间带的189株可培养的海洋微藻及其中富含多糖、脂类和蛋白质藻株的多样性, 筛选出了一批富含多糖、脂类和蛋白的海洋微藻。在筛选出多糖含量最高的3株海洋微藻中, 克里格辐节藻(Stauroneis kriegeri)为辐节藻属(Stauroneis)硅藻, 该属已知藻种或藻株的适盐性和适温性都比较高, 多为能生长在盐度和温度变化幅度较大的高中潮区的底栖种类, 已有从中找到一些富含多糖和蛋白聚糖的藻种或藻株的报道[19]; 小头端菱形藻(Nitzschia capitellata)为菱形藻属(Nitzschia)硅藻, 一些藻株已被作为水产养殖的优质饵料使用, 或作为生物能源生产资源的候选藻种加以研发[4]; 俄克拉何马绿藻 (Picochlorum oklahomensis)是一种适盐性很强的单细胞绿藻, 最早是从美国俄克拉何马州西北部的盐平原国家野生动物保护区浅蒸发池的高盐及营养贫瘠的环境分离得到[20], 后来发现一些藻株不仅包括多不饱和脂肪酸在内的脂类和蛋白含量较高, 而且生长快产量高, 已被用于生物能源和其他海洋微藻生物产品的研发[10]。大量研究表明, 海洋微藻多糖具有免疫增强和抗肿瘤、抗病毒、抗凝血、抗衰老、抗辐射及等多生物活性[4]。因此, 分离、培养、鉴定和贮藏这些适盐性和适温性都比较高的富糖海洋微藻, 预期在新型多糖类功能食品、药品和抗辐射化妆品领域都有很好的应用前景。
其次, 在筛选出脂类含量最高的8株海洋微藻中, 3株克里格辐节藻(Stauroneis kriegeri)不仅脂类含量高, 多糖和蛋白质的含量也比较高; 新月细柱藻(Cylindrotheca closterium)是一种底栖硅藻, 其中一些藻株因被发现富含多糖, 包括胞外多糖和胞内多糖而被选用于海洋微藻多糖产品的研发[21,22], 但迄今未见有富脂新月细柱藻藻株的文献报道; 剑形辐节藻(Stauroneis anceps)、纤细辐节藻(Stauroneis gracilior)和Dickieia ulvacea藻也都是硅藻, 但及至投稿前我们都没能检索到有关它们的文献报道。目前, DHA和EPA等ω-3多不饱和脂肪酸已被世界各国批准作为饮料和食品添加剂、功能食品和药物而广泛用于预防和治疗一些慢性疾病[8], 而富脂海洋微藻不仅被普遍认为是替代鱼油作为ω-3多不饱和脂肪酸生产的理想资源, 而且也是替代油料植物用于生物燃料生产的重要资源。

图 2 高产多糖藻株与GenBank数据库中相应藻种的18S rDNA序列系统进化树

图 3 富含脂藻株与GenBank数据库中相应藻种的18S rDNA序列系统进化树
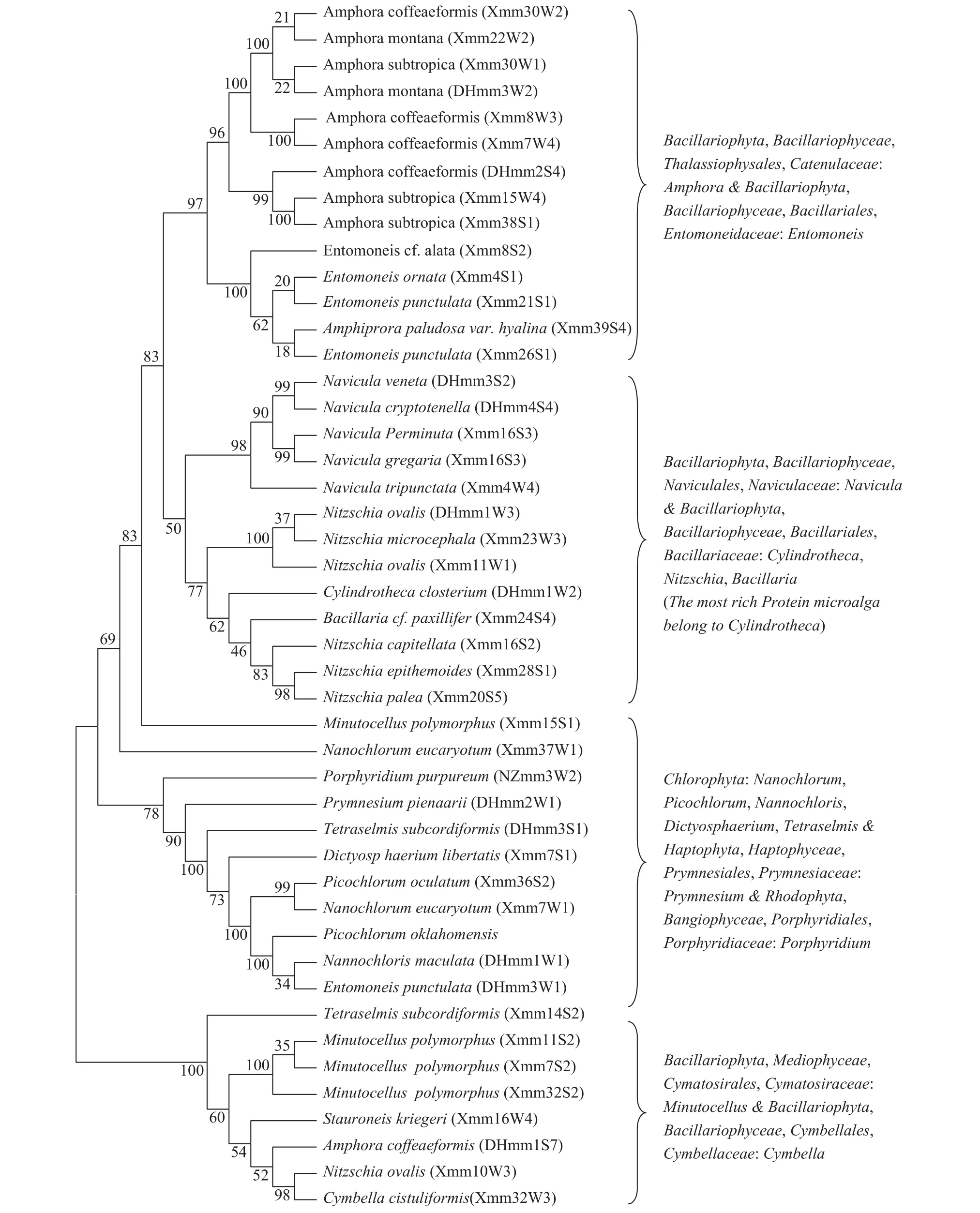
图 4 富含蛋白藻株与GenBank数据库中相应藻种的18S rDNA序列系统进化树
此外, 在筛选出蛋白含量最高的3株海洋微藻中, 除新月细柱藻(Cylindrotheca closterium)外, 2株咖啡型双眉藻(Amphora coffeaeformis)为双眉藻属(Amphora)硅藻, 已发现该属的一些藻种或藻株富含脂类物质, 已被作为热带海参饵料而展开培养技术和营养价值分析, 另一些则作为抗氧化剂活性天然产物资源开展研究[23]。在筛选出多糖、脂类物质和蛋白质含量相对都较高的8株微藻中, 除克里格辐节藻(Stauroneis kriegeri)和小头端菱形藻(Nitzschia capitellata)外, 舟形藻属(Navicula)海洋微藻中的一些藻种或藻株, 如萨利娜舟形藻(Navicula salinarum), 有被作为海洋微藻多糖和抗氧化剂活性天然产物资源研究的报道[4,22,23]; 微眼藻属(Minutocellus)微藻是在渤海海域褐潮期分离到的微型浮游生物之一, 也是在藻类毒性试验中常使用的一种硅藻, 并有作为抗氧化剂活性天然产物资源研究的报道[24]; Nanochlorum eucaryotum藻是19世纪80年代发现的, 在海洋绿藻纲中少见并具有最小真核生物特性的球菌样的物种, 在氮缺乏条件下通气培养可检测到类胡萝卜素、角黄素和虾青素[25]。本研究分离、培养、鉴定和贮藏的这类海洋微藻, 预期不仅可以作用海水水产养殖的优质饵料和饲料添加剂, 而且还可能在功能食品、食品和饲料添加剂、抗氧化剂活性等活性天然产物研发领域有良好的应用前景。

表 2 多糖、脂类和蛋白质含量都较高的海洋微藻藻株Tab. 2 The isolated microalgal strains with higher contents of polysaccharide, lipid and protein
[1]Barra L, Chandrasekaran R, Corato F, et al. The challenge of ecophysiological biodiversity for biotechnological applications of marine microalgae [J]. Marine Drugs, 2014, 12(3): 1641—1675
[2]Samarakoon K, Jeon Y J. Bio-functionalities of proteins derived from marine algae: A review [J]. Food Research International, 2012, 48(2): 948—960
[3]D’Alessandro E B, Antoniosi Filho N R. Concepts and studies on lipid and pigments of microalgae: A review [J]. Renewable and Sustainable Energy Reviews, 2016, 58(11): 832—841
[4]Raposo M F, de Morais R M, Bernardo de Morais A M. Bioactivity and applications of sulphated polysaccharides from marine microalgae [J]. Marine Drugs, 2013, 11(1): 233—252
[5]Suganya T, Varman M, Masjuki H H, et al. Macroalgae and microalgae as a potential source for commercial applications along with biofuels production: A biorefinery approach [J]. Renewable and Sustainable Energy Reviews, 2016, 55(2): 909—941
[6]Pulz O, Gross W. Valuable products from biotechnology of microalgae [J]. Applied Microbiology and Biotechnology, 2004, 65(6): 635—648
[7]Lauritano C, Andersen J H, Hansen E, et al. Bioactivity screening of microalgae for antioxidant, anti-inflammatory, anticancer, anti-diabetes, and antibacterial activities [J]. Frontiers in Marine Science, 2016, 68(3): 68—79
[8]Varfolomeev S D, Wasserman L A. Microalgae as source of biofuel, food, fodder, and medicines [J]. Applied Biochemistry and Microbiology, 2011, 47(9): 789—807
[9]Acreman J. Algae and cyanobacteria: isolation, culture and long-term maintenance [J]. Journal of Industrial Microbiology, 1994, 13(3): 193—194
[10]Zhu Y, Dunford N T. Growth and biomass characteristics of Picochlorum oklahomensis and Nannochloropsis oculata [J]. Journal of the American Oil Chemists’ Society, 2013, 90(6): 841—849
[11]Yiao X H, Huang Y M, Lan L B, et al. The biodiversity of culturable lipid-rich microalgae from Xuwen coral reef nature reserve [J]. Ecological Science, 2016, 35(4): 52—61 [杨晓红, 黄永梅, 兰柳波, 等. 徐闻珊瑚礁自然保护区可培养富脂海洋微藻的生物多样性. 生态科学, 2016, 35(4): 52—61]
[12]Mata T M, Martins A A, Caetano N S. Microalgae for biodiesel production and other applications: A review [J]. Renewable and Sustainable Energy Reviews, 2010, 14(1): 217—232
[13]Duong V T, Ahmed F, Thomas-Hall S R, et al. High protein-and high lipid-producing microalgae from northern australia as potential feedstock for animal feed and biodiesel [J]. Frontiers in Bioengineering and Biotechnology, 2015, 53(3): 1—10
[14]Cui L J, W J, Lü Y N, et al. Biodiversity analysis of marine fungi producing extracellular fibrinolytic activity enzymes from the intertidal zone along Zhanjiang coast [J]. Microbiology China, 2016, 43(7): 1448—1461 [崔丽娇,王洁, 吕应年, 等. 湛江沿海潮间带产胞外纤溶活性酶类海洋真菌的生物多样性分析. 微生物学通报, 2016, 43(7): 1448—1461]
[15]Harrison P J, Berges J A. Marine Culture Media [M]. In: Andersen R A (Eds.), Algal Culture Techniques. London: Elsevier Academic Press. 2005, 21—34
[16]Leyva A, Quintana A, Sanchez M, et al. Rapid and sensitive anthrone-sulfuric acid assay in microplate format to quantify carbohydrate in biopharmaceutical products: method development and validation [J]. Journal of the International Association of Biological Standardization, 2008, 36(2): 134—141
[17]Zhang S, Liu P H, Yang X, et al. Isolation and identification by 18S rDNA sequence of high lipid potential microalgal species for fuel production in Hainan Dao [J]. Biomass and Bioenergy, 2014, 66(7): 197—203
[18]Saitou N, Nei A M. The neighbor-joining method: a new method for reconstructing phylogenetic trees [J]. Molecular Biology and Evolution, 1987, 4(4): 406—425
[19]McConville M J, Wetherbee R, Bacic A. Subcellular location and composition of the wall and secreted extracellular sulphated polysaccharides/proteoglycans of the diatom Stauroneis amphioxys Gregory [J]. Protoplasma, 1999, 206(1—3): 188—200
[20]Annan J N. Growth and photosynthesis response of the green alga, Picochlorum oklahomensis to iron limitation and salinity stress [J]. International Journal of Plant Physiology and Biochemistry, 2014, 6(1): 7—18
[21]Staats N, Stal L J, Mur L R. Exopolysaccharide production by the epipelic diatom Cylindrotheca closterium: effects of nutrient conditions [J]. Journal of Experimental Marine Biology and Ecology, 2000, 249(1): 13—27
[22]Staats N, De Winder B, Stal L, et al. Isolation and characterization of extracellular polysaccharides from the epipelic diatoms Cylindrotheca closterium and Navicula salinarum [J]. European Journal of Phycology, 1999, 34(2): 161—169
[23]Lee S H, Karawita R, Affan A, et al. Potential of benthic diatoms Achnanthes longipes, Amphora coffeaeformis and Navicula sp. (Bacillariophyceae) as antioxidant sources [J]. Journal of Food Science and Nutrition, 2008, 13(3): 166—175
[24]Walsh G E, McLaughlin L L, Yoder M J, et al. Minutocellus polymorphus: A new marine diatom for use in algal toxicity tests [J]. Environmental Toxicology and Chemistry, 1988, 7(11): 925—929
[25]Geisert M, Rose T, Bauer W, et al. Occurrence of carotenoids and sporopollenin in Nanochlorum eucaryotum: a novel marine alga with unusual characteristics [J]. BioSystems, 1987, 20(2): 133—142
STUDIES ON THE DIVERSITY OF MARINE MICROALGAE AND THE STRAINS WITH HIGH POLYSACCHARIDES, LIPIDS AND PROTEINS ALONG ZHANJIANG COASTAL AREAS
HUANG Yong-Mei1,2, YANG Xiao-Hong1,2, LAN Liu-Bo3, ZHAN Jing-Ting1,2, LUO Hui1,2and JIANG Li-Ming2,3
(1. Chemistry Teaching and Research Section, Guangdong Medical University, Zhanjiang 524023, China; 2. The Key Lab of Zhanjiang for R&D Marine Microbial Resources in the Beibu Gulf Rim, Zhanjiang 524023, China; 3. Institute of Biochemistry and Molecular Biology, Guangdong Medical University, Zhanjiang 524023, China)
Marine microalgae were isolated from seawater and sediment samples collected from the intertidal zone of NaoZhou Island and Xuwen Coral Reef Nature Reserve, and identification and diversity of their strains with high contents of polysaccharides, lipids and proteins were analyzed by microalgal morphological observation, and sequence comparison and phylogeny analysis based on microalgal 18S rDNA sequences. A total of 189 strains of marine microalgae were isolated, cultured and identified, which represent 66 species distributed in 38 genera, 30 families, 25 orders, 9 classes, and belong to Bacillariophyta, Chlorophyta, Haptophyta and Rhodophyta of microalgae. Amongst, 46 strains with higher polysaccharide content belong to 25 species, and 20 genera, and 46 strains with higher lipid content represent 32 species belonging to 15 genera; and another 46 strains with higher protein content represent 28 species from 18 genera. It is concluded that the diversity of cultivable marine microalgae species and their strains with high content of polysaccharides, lipids and proteins is high from NaoZhou Island and Xuwen Coral Reef Nature Reserve, which possessed huge potential for exploring new drug or active natural products, functional food and fodder, and additives for food and fodder.
Naozhou Island; Xuwen coral reef nature reserve; Marine microalgae; Polysaccharide; Lipid; Protein; Biodiversity
10.7541/2017.135
2016-10-25;
2017-04-16
湛江市环北部湾海岸特色微藻生物资源产品研发重点实验室(2012E02)资助 [Supported by the Key Lab of Zhanjiang for R&D Marine Microbial Resources in the Beibu Gulf Rim (2012E02)]
黄永梅(1988—), 女, 广东罗定人; 硕士研究生; 研究方向为海洋微藻的开发利用。E-mail: 727148105@qq.com
罗辉, 男, 教授, 研究方向为海洋微生物资源开发与利用。E-mail: gdmuluohui@139.com; 江黎明, 男, 主任技师; 研究方向为海洋微生物资源开发与利用; E-mail: lmjiang@gdmc.edu.cn
Q949.2
A
1000-3207(2017)05-1080-11
