大鳞副泥鳅肠道黏液细胞及消化酶活性分布特征研究
2017-09-12刘亚秋李新辉王志坚
刘亚秋李新辉王志坚
(1. 中国水产科学研究院珠江水产研究所, 广州 510380; 2. 西南大学生命科学学院, 淡水鱼类资源与生殖发育教育部重点实验室, 水产科学重庆市市级重点实验室, 重庆 400715)
大鳞副泥鳅肠道黏液细胞及消化酶活性分布特征研究
刘亚秋1,2李新辉1王志坚2
(1. 中国水产科学研究院珠江水产研究所, 广州 510380; 2. 西南大学生命科学学院, 淡水鱼类资源与生殖发育教育部重点实验室, 水产科学重庆市市级重点实验室, 重庆 400715)
采用阿利新兰-碘酸雪夫氏反应(AB-PAS)染色法及酶学方法研究了大鳞副泥鳅成熟个体肠道各段黏液细胞分布及消化酶活性。结果表明, 大鳞副泥鳅肠道黏液细胞分为Ⅰ、Ⅱ、Ⅲ和Ⅳ 4种类型。前肠至后肠,黏液细胞数量逐渐减少。前肠主要分布Ⅲ和Ⅳ混合型黏液细胞, 后肠则以Ⅱ和Ⅳ型酸性黏液细胞为主。肠道胰蛋白酶活性显著高于淀粉酶和脂肪酶。且后肠消化酶活性显著低于前肠和中肠。根据黏液细胞及消化酶活性分布特点, 表明大鳞副泥鳅属于杂食性鱼类, 前肠为其主要的消化吸收场所, 后肠中性黏液细胞的数量较少以及消化酶活性较低, 表明其对食物的消化吸收功能较弱, 与其为辅助呼吸功能的特点相关。
黏液细胞; 消化酶; 大鳞副泥鳅; 肠道
大鳞副泥鳅(Paramisgurnus dabryanus), 隶属于鲤形目, 花鳅科, 副泥鳅属, 是一种底栖生活的小型经济鱼类。目前广泛分布于东南亚等地区, 在中国主要分布在长江中下游以及珠江流域[1]。其肉质鲜美, 营养丰富, 常出没于沼泽, 水田, 池塘等低氧环境。大鳞副泥鳅、泥鳅(Misgurnus anguillicaudatus)等, 在低氧的情况下, 喜欢吞食气泡, 存在肠道辅助呼吸的特点。刘亚秋等[2]研究表明, 大鳞副泥鳅前中后部肠道组织结构特点差异显著, 后肠为其主要进行辅助呼吸的部位。目前关于大鳞副泥鳅的研究在生长与年龄、遗传多样性以及杂交育种等方面已有文献报道[3—6]。而对于其兼具消化与呼吸功能的肠道黏液细胞及消化酶活性分布特点尚未见报道。因此, 本研究通过对大鳞副泥鳅肠道各段黏液细胞类型、分布密度、黏蛋白分布特点及消化酶活性分布差异进行研究, 结合其生存环境特点, 对其肠道各部组织化学及消化生理特点进行初步探讨, 以期对其肠道各区域结构与功能间关系提供基础资料。
1 材料与方法
1.1 材料
大鳞副泥鳅成熟个体来自于实验室大棚养殖池塘, 暂养鱼实验室循环水缸内驯养2周, 自然光照,不间断充气, 水质参数如下: 21—23℃, 溶氧: (7.15± 0.58) mg/L, pH 7.1—7.8。取大鳞副泥鳅性成熟个体30尾雌雄各半, 测量体长、体重、肠长及肠重。随机选取其中15大鳞副泥鳅, 雌雄根据其特征进行分类(雌雄比例为6:9)。雌雄各随机取3尾, 进行切片观察; 其余15尾中, 随机选取6尾用于肠道各部消化酶活性测定。
1.2 方法
样本制备与显微观察 成鱼肠道的组织学材料用Bouin’s试液固定, 保存于70%酒精。酒精梯度脱水, 常规石蜡包埋, 切片5—7 μm, 分别以横向方式进行切片, 采用阿利新蓝(Alcian blue, AB)、过碘酸-雪夫(Periodicacid-Schiff, PAS)以及阿利新蓝-过碘酸雪夫(AB-PAS)方法染色, 中性树胶封片。
阿利新蓝-过碘酸雪夫(AB-PAS)染色, 将大鳞副泥鳅黏液细胞分为4种类型: Ⅰ型为红色, 阿利新蓝(AB)反应阴性, 过碘酸-雪夫(PAS)反应阳性, 含有中性黏多糖; Ⅱ型为蓝色, 阿利新蓝(AB)反应阳性, 过碘酸-雪夫(PAS)反应阴性, 含有酸性黏多糖;Ⅲ型为紫红色, 阿利新蓝(AB)与过碘酸-雪夫(PAS)反应均为阳性, 主要含有过碘酸-雪夫(PAS)反应阳性的中性黏多糖; Ⅳ型为蓝紫色, 阿利新蓝(AB)与过碘酸-雪夫(PAS)反应均为阳性, 主要含有阿利新蓝(AB)反应阳性的酸性黏多糖[7]。根据阿利新蓝(AB)(pH 2.5和1.0)、过碘酸-雪夫(PAS)染色的深浅表示其黏蛋白组织化学反应的强弱[8]。
制片后采用NIKON ECLIPSE 80i显微摄像系统观察、照相。肠道各段随机取3张切片进行指标测量, 每张切片随机选10个视野, 分别计数每一视野中100 μm×100 μm范围内各类型黏液细胞的总数, 作为该类型黏液细胞的密度; 每项指标采用Image-Pro Plus (IPP)图像分析软件进行测量。
样品采集与酶活性测定 鱼体置于冰盘上,以免消化酶失活。用重物猛击其头部, 迅速处死鱼,分别剪取其前肠、中肠、后肠和肝胰脏等组织块,快速置于液氮固定并置于–80℃超低温冰箱保存,用于进一步消化酶测定。
从冰箱中取出待测样品, 置于冰上解冻。解冻完成后将样品称重, 按质量: 体积为1∶4加入匀浆稀释液, 分别对每尾鱼肝胰脏、前肠、中肠、后肠以匀浆器进行匀浆。所得匀浆液用低温超速离心机4℃, 3000 r/min转速离心20min后取上清液用于消化酶活力测定。实验中的消化酶及可溶性蛋白均使用南京建成公司生产的试剂盒检测。在pH 8.0, 37℃条件下, 每毫克蛋白质中含有的胰蛋白酶每分钟使吸光度变化0.003定义为1个胰蛋白酶活力单位。在37℃条件下, 每克组织蛋白在反应体系中与底物反应1min, 每消耗1 umol底物定义为1个脂肪酶活力单位。组织中每毫克蛋白在37℃与底物作用30min, 水解10 mg淀粉定义为1个淀粉酶活力单位。本实验使用全波长酶标仪(Thermo)和紫外分光光度计(UV-2450)测定吸光度。
数据分析 采用单因子方差分析(ANOVA)检验肠道各部黏液细胞分布密度、肝胰脏以及肠道各部消化酶活性差异显著性。如差异显著, 则采用多重比较方法比较平均数之间的差异。显著性水平为0.05。数据分析采用SPSS 19.0统计软件进行。实验数据均用平均值±标准差(Mean±SD)表示。
2 结果
2.1 大鳞副泥鳅肠道形态及肠道系数
大鳞副泥鳅无胃, 食道较短紧接肠道, 肠道始端膨大, 呈长管状。大鳞副泥鳅肠道整体位于腹腔底部, 头部背肝脏覆盖。肠道可划分为前肠、中肠和后肠三部分, 肠道螺旋弯曲前部称为前肠, 向后至第二处轻微弯曲为中肠, 弯曲至肛门段为后肠。后肠管腔狭窄, 肠壁薄而透明, 且布满血管(图 1)。肠道系数如表 1所示。
2.2 肠道黏液细胞分布情况
肠道各部黏液细胞的分布特点及密度 大鳞副泥鳅肠道上皮为单层柱状上皮, 上皮细胞之间含有丰富黏液细胞。AB-PAS染色结果显示, 肠道黏液细胞形状各异, 呈杯状、囊状、圆球状等不同形态, 有Ⅰ- Ⅳ型4种黏液细胞(图 2)。前肠黏液细胞丰富多为Ⅲ和Ⅳ型黏液细胞, 多呈杯状和囊状,后肠肠壁很薄, 多为Ⅱ型黏液细胞。肠道各段黏液分布密度如表 2所示, 前肠Ⅰ、Ⅲ、 Ⅳ型黏液细胞数量显著多于中肠和后肠(P<0.05), 中肠次之, 后肠缺乏Ⅰ和Ⅲ型黏液细胞。相较之下, 后肠Ⅱ型黏液细胞数量要显著多于前肠和中肠(P<0.05)。
肠道黏蛋白的分布特点 后肠的阿利新蓝(AB) (pH 0.5、1.0和2.5)反应强度高, 表明该部位硫酸基(-SO3H)和羧基(-COOH)的酸性黏液物质丰富。前肠道上皮黏蛋白过碘酸-雪夫(PAS)反应强度高于中肠和后肠, 表明肠道前部内中性黏液物质分泌能力强。且前肠和后肠阿利新蓝(AB)(pH 2.5和1.0)反应强度高于中肠(表 3)。
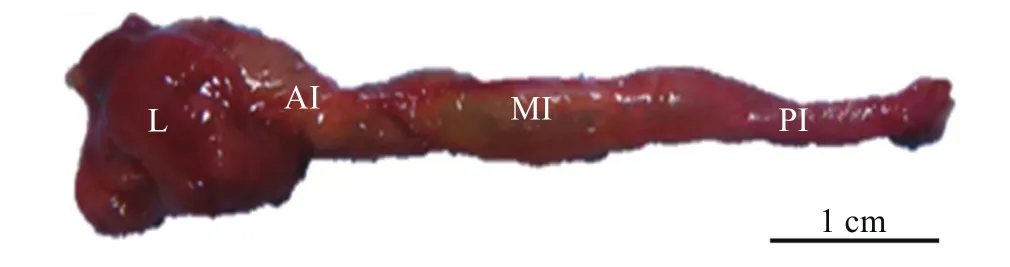
图 1 大鳞副泥鳅肠道

表 1 大鳞副泥鳅肠道形态学基础参数Tab. 1 Basic intestinal tract morphological parameters in P. dabryanus

图 2 大鳞副泥鳅肠道黏液细胞

表 2 大鳞副泥鳅肠道黏液细胞的分布密度(细胞数个/mm2)Tab. 2 Mucous cells distribution density of in the intestine of P. dabryanus (cell/mm2)

表 3 大鳞副泥鳅肠道黏蛋白组织化学反应情况Tab. 3 Mucin histochemistry reaction in the intestinal tract of P. dabryanus
2.3 消化酶活性分布情况
大鳞副泥鳅肠道消化酶活性分布如图 3所示,中肠淀粉酶活性相对最高为(0.45±0.05) U/mg protein, 肠道各段淀粉酶活性差异不显著(P>0.05), 但均显著高于肝胰脏(P<0.05)。大鳞副泥鳅肝胰脏脂肪酶活性相对最低(0.17±0.02) U/mg protein, 显著低于肠道各部(P<0.05)。后肠脂肪酶活性显著低于前肠和中肠(P<0.05), 而前肠与中肠脂肪酶活性差异不显著(P>0.05)。前肠胰蛋白酶活性最高(5089.06± 295.94) U/mg protein, 显著高于肝胰脏以及肠道其他各部(P<0.05)。中肠次之, 其次为肝胰脏。后肠为大鳞副泥鳅胰蛋白酶活性最低的部位。碱性磷酸酶活性在前肠的活性最高(36.13±4.36) U/mg protein (P<0.05), 其次是中肠, 在肝脏以及后肠的活性较低。
3 讨论
组织化学观察发现, 大鳞副泥鳅前肠黏液细胞数量显著多于中后肠, 且含有丰富的I和III型黏液细胞。丰富的黏液物质可以润滑食物, 减少食物对肠黏膜的机械损伤[9]。中性黏液物质可以和碱性磷酸酶共存, 并且具有调节消化道pH以及辅助消化功能[10]。后肠中黏液细胞基本为酸性, 中性黏液细胞显著减少, 导致后肠丧失了吸收部分营养物质的功能。有学者对冈特似鳞头鳅(Lepidocephalichthys guntea)[11]和侧斑兵鲇(Corydoras aeneus)[12]的研究发现, 其肠道后部分泌大量硫酸基(-SO3H) 和羧基(-COOH)的酸性黏液物质的特点与其特殊的肠道辅助呼吸功能相关。Leknes[13]则认为, 呼吸上皮酸性黏液物质更多是对保护频繁充入外界干燥空气的脆弱呼吸上皮的一种保护。觅食期间, 肠呼吸鱼类的肠道处于食物高度充塞情况下, 气体如何到达呼吸上皮进行气体交换生理机制还不明确。有研究表明, 肠辅助呼吸时, 大量空气的吞入促进未消化的食物排出体外[13,14]。Moitra等[11]研究表明分泌的酸性黏液物质起到一定润滑作用, 并能保持呼吸上皮区域的干净。且进行气呼吸时气体交换保持了稳定的酸性环境, 这也是多数具有辅助呼吸功能的鱼类气呼吸器官的共有特征[15—17]。
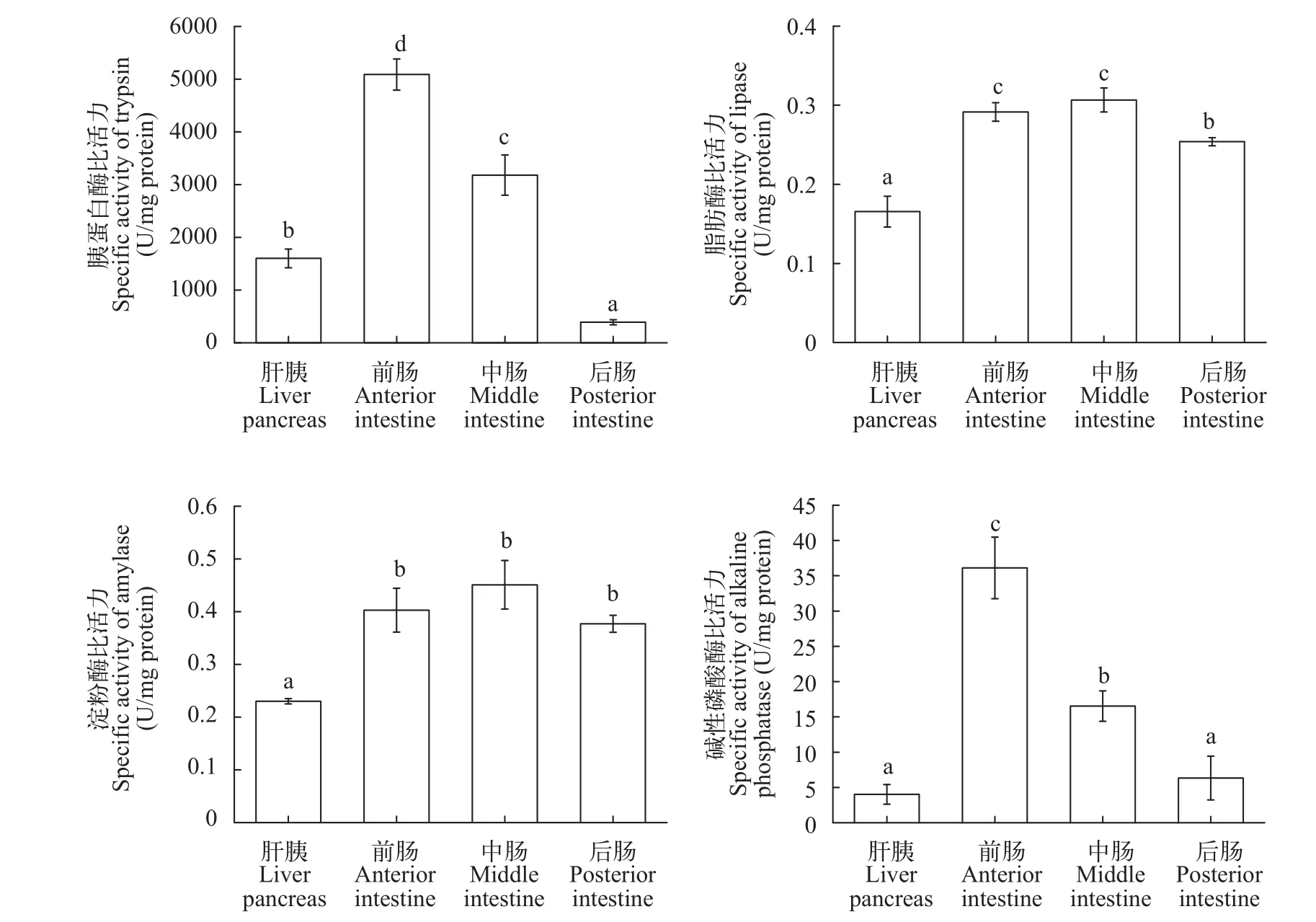
图 3 大鳞副泥鳅肠道消化酶活性分布
研究结果表明, 大鳞副泥鳅前肠和中肠的胰蛋白酶活性较高, 后肠胰蛋白酶活性较低, 这与肉食的欧鲇(Silurus glanis)和杂食性的尼罗罗非鱼(Nile tilapia)类似[18,19]。前肠和中肠的胰蛋白酶高于肝胰脏, 这与鲤形目的草鱼(Ctenopharyngodon idellus)、鲤(Cyprinus carpio)、鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)等相似[20]。这可能是由于肝胰脏主要分泌蛋白酶原, 这种酶原的蛋白酶活性微弱, 当蛋白酶原进入肠道前部后受到肠道分泌的肠激酶的激活才有较强活性, 所以导致肠道的胰蛋白酶的活性要显著高于肝胰脏[21—23]。淀粉酶以及脂肪酶也检测出类似情况。相较而言, 大鳞副泥鳅肠道胰蛋白酶活性显著高于淀粉酶和脂肪酶, 这与大鳞副泥鳅食物饵料来源的成分相关。后肠碱性磷酸酶活性显著低于肠道其他各部。有研究表明, 碱性磷酸酶主要存在于鱼类肠道上皮细胞的浅部和纹状缘上, 是一种可帮助肠上皮细胞吸收的金属酶, 与多种营养物质的吸收存在正相关性,是消化生理的研究的重要指标[19,24,25]。比较肠道各段消化酶活性, 大鳞副泥鳅后肠消化酶要低于肠道其他各部。可能是由于前肠、中肠为其主要的消化与吸收场所, 而后肠对于食物的消化能力很弱,这也与其后肠黏液细胞分布特点一致。
[1]You C, Yu X, Tong J. Detection of hybridization between two loach species (Paramisgurnus dabryanus and Misgurnus anguillicaudatus) in wild populations [J]. Environmental Biology of Fishes, 2009, 86(1): 65—71
[2]Liu Y Q, Gao S T, Hu Y, et al. Histological observation on the post-embryonic development of the digestive system in Paramisgurnus dabryanus [J]. Journal of Chongqing Normal University, 2016, 33(3): 33—39 [刘亚秋, 高胜涛, 胡雨, 等. 大鳞副泥鳅消化系统胚后发育组织学观察. 重庆师范大学学报(自然科学版), 2016, 33(3): 33—39]
[3]Fang L B, Zhou X Y, Cui L, et al. Comparison on karyotypes and relative DNA contents of reciprocal hybrids among diploid, tetraploid loach (Misgurnus anguillicaudatus), and large scale loach (Paramisgurnus dabryanus) [J]. Journal of Huazhong Agricultural University, 2011, 30(4): 500—505 [方礼豹, 周小云, 崔蕾, 等. 二倍体、四倍体泥鳅与大鳞副泥鳅杂交子代DNA相对含量与染色体组型的比较. 华中农业大学学报, 2011, 30(4): 500—505]
[4]Huang S Q, Wang Y K, Zhao T, et al. Age structures and growth characteristics of Paramisgurnus dabryanus and Misgurnus anguillicaudatus in Henan Province [J]. Journal of Huazhong Agricultural University, 2014, 33(5): 93—98 [黄松钱, 王也可, 赵婷, 等. 河南地区大鳞副泥鳅和泥鳅的年龄与生长. 华中农业大学学报, 2014, 33(5): 93—98]
[5]Chen Y, Zhao H, Zhang X, et al. Identification, expression and bioactivity of Paramisgurnus dabryanus β-defensin that might be involved in immune defense against bacterial infection [J]. Fish & Shellfish Immunology, 2013, 35(2): 399—406
[6]Zhou B, Long Y, Song G, et al. Molecular characterization of the lgals1 gene in large scale loach Paramisgurnus Dabryanus [J]. Gene, 2015, 577(1): 65—74
[7]An L G, Meng G X, Yang G W, et al. Mucous cells in the early developmental stage of carp [J]. Acta Hydrobiologica Sinica, 2001, 25(2): 191—194 [安利国, 孟广勋, 杨桂文, 等. 鲤稚幼体早期发育过程中黏液细胞的发生和变化. 水生生物学报, 2001, 25(2): 191—194]
[8]Park J Y, Kim I S. Histology and mucin histochemistry of the gastrointestinal tract of the mud loach, in relation to respiration [J]. Journal of Fish Biology, 2001, 58(3): 861—872
[9]Zhang W N, Lin X, Lin S G, et al. Types and distribution of mucous cells in the digestive tract of Paralichthys olivaceus [J]. Journal of Fujian Agriculture & Forestry University, 2009, 38(3): 280—284 [张伟妮, 林旋, 林树根,等. 褐牙鲆消化道黏液细胞的类型及分布. 福建农林大学学报: 自然科学版, 2009, 38(3): 280—284]
[10]Reifel C W, Travill A A. Structure and carbohydrate histochemistry of the intestine in ten teleostean species [J]. Journal of Morphology, 1979, 162(3): 343—359
[11]Moitra A, Singh O N, Munshi J S. Microanatomy and cytochemistry of the gastro-respiratory tract of an airbreathing cobitidid fish. Lepidocephalichthys guntea [J]. Japanese Journal of Ichthyology, 1989, 36(2): 227—232
[12]Podkowa D, Goniakowska-Witalińska L. Adaptations to the air breathing in the posterior intestine of the catfish (Corydoras aeneus, Callichthyidae). A histological and ultrastructural study [J]. Folia Biologica, 2002, 50(1-2): 69—82
[13]Leknes I L. Goblet cells and mucus types in the digestive intestine and respiratory intestine in Bronze corydoras (Callichthyidae: Teleostei) [J]. Anantomia Histologia Embryologia, 2014, 44(5): 321—327
[14]McMahon B R, Burggren W W. Respiratory physiology of intestinal air breathing in the teleost fish Misgurnus anguillicaudatus [J]. Journal of Experiment Biology, 1987, 133(1): 371—393
[15]Cruz A L D, Pedretti A C E, Fernandes M N. Stereological estimation of the surface area and oxygen diffusing capacity of the respiratory stomach of the air-breathing armored catfish Pterygoplichthys anisitsi (Teleostei: Loricariidae) [J]. Journal of Morphology, 2009, 270(5): 601—614
[16]Zhang J Y, Yang R B, Yang X F, et al. Development of mucous cells in digestive tract of larvae and juvenile of mud loach, Misgurnus anguillicaudatus [J]. Journal of Huazhong Agricultural University, 2014, (4): 93—98 [张建业, 杨瑞斌, 杨学芬, 等. 泥鳅仔稚鱼消化道黏液细胞的发育. 华中农业大学学报, 2014, (4): 93—98]
[17]Park J Y, Kim I S, Kim S Y. Structure and mucous histochemistry of the intestinal respiratory tract of the mud loach, Misgurnus anguillicaudatus (Cantor) [J]. Journal of Applied Ichthyology, 2003, 19(4): 215—219
[18]Jónás E, Rágyanszki M, Oláh J, et al. Proteolytic digestive enzymes of carnivorous (Silurus glanis L.), herbivorous (Hypophthalmichthys molitrix Val.) and omnivorous (Cyprinus carpio L.) fishes [J]. Aquaculture, 1983, 30(83): 145—154
[19]Tengjaroenkul B, Smith B J, Caceci T, et al. Distribution of intestinal enzyme activities along the intestinal tract of cultured Nile tilapia, Oreochromis niloticus L. [J]. Aquaculture, 2000, 182(11): 317—327
[20]Ni S W, Gui Y M. Investigation on the comparison of protease activities in grass crap, common crap, Silver crap, big head crap, Tilapia nilotica [J]. Acta Zoologica Sinica, 1993, 39(2): 160—168 [倪寿文, 桂远明. 草鱼、鲤、鲢、鳙和尼罗罗非鱼肝胰脏和肠道蛋白酶活性的初步探讨. 动物学报, 1993, 39(2): 160—168]
[21]Yang J M, Zhang L Z, Zhuang P, et al. The digestive tube index and the activity distribution of three kinds of digestive enzymes in the digestive organs of cultured [J]. Marine Sciences, 2009, 33(7): 43—50 [杨金海, 章龙珍, 庄平, 等. 人工养殖长鳍篮子鱼消化道指数及3种消化酶活性分布. 海洋科学, 2009, 33(7): 43—50]
[22]Das K M, Tripathi S D. Studies on the digestive enzymes of grass carp, Ctenopharyngodon idella (Va1.) [J].Aquaculture, 1991, 92(1): 21—32
[23]Li F J, Zeng L Q, Huang X M, et al. Studies on the digestive tube index and the activities of digestive enzymes in juvenile Leptobotia elongate [J]. Freshwater Fisheries, 2012, 42(3): 10—13 [李凤杰, 曾令清, 黄小铭, 等. 长薄鳅幼鱼消化道指数和消化酶活性研究. 淡水渔业, 2012, 42(3): 10—13]
[24]Liu Y Q, Guo Z D, Hu Y, et al. Growth and Fluctuations of digestive enzymes activities in Paramisgurnus dabryanus during larval and juvenile stages [J]. Acta Hydrobiologica Sinica, 2015, 39(6): 1236—1240 [刘亚秋, 郭忠娣,胡雨, 等. 大鳞副泥鳅仔稚鱼生长与消化酶活性变化.水生生物学报, 2015, 39(6): 1236—1240]
[25]Chen M Y, Zhang X M, Lian J H. Development of some digestive enzymes and alkaline phosphatase activities in turbot Scophthalmus maximus larvae and juveniles [J]. Journal of Ocean University of Qingdao, 2005, 35(3): 483—486 [陈慕雁, 张秀梅, 连建华. 大菱鲆仔稚鱼期消化酶及碱性磷酸酶活性的变化. 中国海洋大学学报:自然科学版, 2005, 35(3): 483—486]
STUDY ON DISTRIBUTION CHARACTERISTICS OF INTESTINAL MUCOUS CELLS AND DIGESTIVE ENZYME ACTIVITIES IN PARAMISGURNUS DABRYANUS
LIU Ya-Qiu1,2, LI Xin-Hui1and WANG Zhi-Jian2
(1. Pearl River Fishery Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510380, China; 2. Key Laboratory of Freshwater Fish Reproduction and Development, Ministry of Education, the Key Laboratory of Aquatic Science of Chongqing, School of Life Science, Southwest University, Chongqing 400715, China)
Distribution of mucous cells and digestive enzyme activities in the intestinal tract of Paramisgurnus dabryanus were analyzed by AB-PAS histochemical staining and enzymatic testing techniques. The results showed that there were four types of P. dabryanus intestinal tract mucous cells (Ⅰ–Ⅳ). The number of mucous cells decreased from the anterior to posterior intestinal tract. The types of mucous cells in anterior intestinal tract were mainly mixed Ⅲ and Ⅳtypes. The mucous cells, however, consisted of mainly Ⅱ and Ⅳ acidic types in the posterior intestine. Trypsin activity was significantly higher than amylase and lipase activities. Digestive enzyme activities in the posterior intestine were lower than that in the anterior and middle intestine. According to distribution characteristics of the intestinal mucous cells and digestive enzyme activities, P. dabryanus appears to be a type of polyphagic fish. Its intestinal tract has digestion and respiratory functions. Digestion and absorption occur in the anterior intestine. In the posterior intestine, the lack of neutral mucus cells and low digestive enzyme activities indicate that its digestive and absorptive abilities are weak. It may be related to its assistive respiratory function.
Mucous cell; Digestive enzyme; Paramisgurnus dabryanus; Intestine
Q954.6
A
1000-3207(2017)05-1048-06
10.7541/2017.131
2016-11-15;
2017-02-18
公益性行业专项(农业)科研专项(201203086)资助 [Supported by the Special Fund for Agro-scientific Research in the Public Interest (201203086)]
刘亚秋(1990—), 男, 湖北武汉人; 硕士; 主要研究方向为渔业生态与环境。 E-mail: liuyq1990@foxmail.com
王志坚(1969—), 男, E-mail: wangzj1969@126.com
