右美托咪啶对老年胃癌手术患者应激反应与术后认知功能的影响
2017-09-12万小勇涂传刚
万小勇,涂传刚
(进贤县人民医院麻醉科,江西 进贤 331700)
右美托咪啶对老年胃癌手术患者应激反应与术后认知功能的影响
万小勇,涂传刚
(进贤县人民医院麻醉科,江西 进贤 331700)
目的 探讨右美托咪啶对老年胃癌手术患者应激反应与术后认知功能的影响。方法 40例行胃癌手术患者,按随机数字表法分成右美托咪定组(D组)及咪唑安定组(M组),每组20例。常规麻醉诱导和维持,手术结束送PACU。在手术前(T0)、手术开始2 h(T1)、手术结束24 h(T2)抽取静脉血,测定羟自由基、超氧化物歧化酶(SOD)、超氧阴离子、丙二醛,用智能状态检测法(MMSE)来评估患者术前1 d和术后2 d认知状态及术后认知功能障碍(POCD)发生情况。结果 术后2 d时D组MMSE评分高于M组(P<0.05),D组POCD发生率明显低于M组(10%比35%,(P<0.05))。与T0时点相比,2组在T1、T2时点的羟自由基、超氧阴离子、丙二醛值明显增加,SOD值降低(均P<0.05);与T1时点相比,2组在T2时点的羟自由基、超氧阴离子、丙二醛值明显降低,SOD值降低(均P<0.05)。与M组比较,D组在T1和T2时点的超氧阴离子、羟自由基、丙二醛值明显降低,SOD显著增加(均P<0.05)。结论 右美托咪定可降低氧自由基释放,减少POCD的发生并抑制手术的应激反应,应用于老年胃癌手术患者,效果优于咪唑安定。
术后认知功能障碍; 右美托咪定; 咪唑安定; 胃癌手术; 氧化应激
创伤较多的手术可导致机体生理功能紊乱,诱导强烈的氧化应激反应[1]。术中常用镇静药物来减轻患者痛苦,让患者遗忘,消除不良记忆,并抑制应激反应的发生[2]。右美托咪定是高选择性α2肾上腺素能受体激动剂,具有催眠、镇静、抗焦虑作用并能抑制交感活性及维持心血管的稳定性[3-4]。本研究比较右美托咪啶与咪唑安定对老年胃癌手术患者应激反应与术后认知功能的影响,旨在探讨其安全性及有效性。
1 资料与方法
1.1 一般资料
选择进贤县人民医院2015年8月至2016年8月行胃癌根治术患者40例,男22例,女18例,ASAⅡ或Ⅲ级,年龄65~78岁,体质量45~74 kg。所有患者无肝肾功能障碍;凝血功能未见异常;术前无呼吸系统疾病,未行激素治疗,未进行放、化疗及免疫抑制剂治疗。
将40例患者按随机数字表法分成右美托咪定组(D组)及咪唑安定组(M组),每组20例。2组年龄、性别比、体质量、手术持续时间、术中失血量、清醒时间、拔管时间及麻醉后监测治疗室(PACU)观察时间比较差异均无统计学意义(P>0.05),见表1。
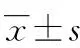
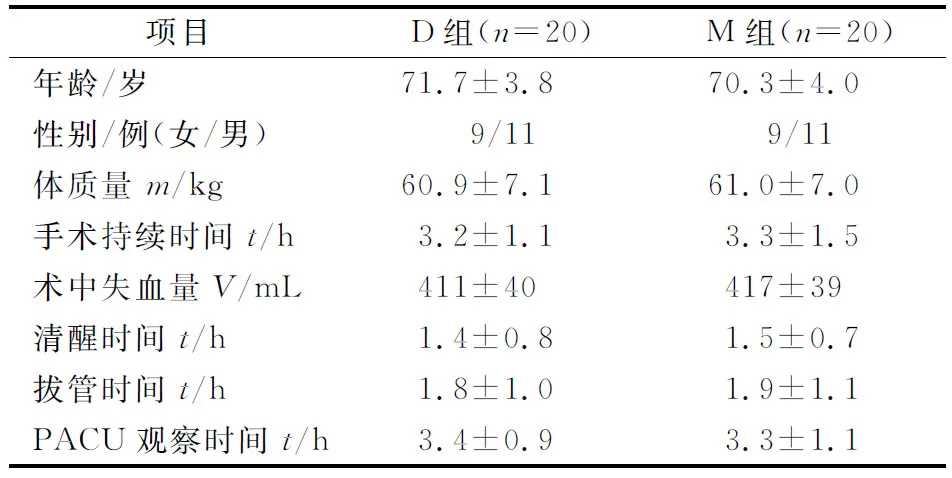
项目D组(n=20)M组(n=20)年龄/岁71.7±3.870.3±4.0性别/例(女/男)9/119/11体质量m/kg60.9±7.161.0±7.0手术持续时间t/h3.2±1.13.3±1.5术中失血量V/mL411±40417±39清醒时间t/h1.4±0.81.5±0.7拔管时间t/h1.8±1.01.9±1.1PACU观察时间t/h3.4±0.93.3±1.1
1.2 麻醉方法
术前常规禁食、禁饮。均未用术前药,入手术室监测收缩压(SBP)、舒张压(DBP)、心电图(ECG)、心率(HR)、脉博血氧饱和度(SpO2),建立有效的静脉通道,面罩给氧。采用A2000脑电监测仪监测脑电双频指数(BIS)值,开放上肢外周静脉补液。
麻醉诱导:D组先给予右美托咪定(恒瑞制药有限公司生产)0.5 μg·kg-1泵入(10 min),M组静脉注射咪唑安定(湖北宜昌人福药有限公司)0.05 mg·kg-1,然后依次静脉注射舒芬太尼0.4 μg·kg-1,丙泊酚2 mg·kg-1,维库溴铵0.1 mg·kg-1,插入气管导管,连接麻醉机行机械通气。呼吸参数:潮气量8~10 mL·kg-1,吸呼比1:2,通气频率12~14次·min-1,术中调节呼吸参数使呼吸末二氧化碳分压(PETCO2)维持在35~45 mmHg(4.655~5.985 kPa)。
麻醉维持:持续输注丙泊酚3~6 mg·kg-1·h-1、顺式阿曲库胺0.1~0.2 mg·kg-1·h-1,维持BIS值40~60,持续吸入七氟烷1%~2%,间断静脉注射舒芬太尼5 μg·次-1。术中所输晶体液与胶体液比例为2:1。
术后带气管导管送PACU监护苏醒。观察术后患者清醒情况、气管拔管时间和患者在PACU苏醒时间。
1.3 观察项目
1)采用智能状态检测法(MMSE)评估患者术前1 d和术后2 d认知状态及术后认知功能障碍(POCD)发生情况。
2)在手术开始前(T0)、手术开始后2 h(T1)、手术后24 h(T2)分别抽静脉血4 mL,血液样本经3000·min-1离心12 min后取血清,放-80 ℃冰箱保存。采用ELLSA法检测羟自由基、超氧阴离子、丙二醛和酶性抗自由基指标(超氧化物歧化酶:SOD),所有检测均使用相应ELLSA试剂盒按说明操作,用分光光度仪读取数据。
1.4 统计学方法
2 结果
2.1 2组MMSE评分比较
2组术前MMSE评分比较差异无统计学意义(P>0.05),术后2 d时D组MMSE评分高于M组(P<0.05),见表2。M组发生POCD 7例(35%),D组发生POCD 2例(10%),2组比较差异有统计学意义(P<0.05)。
表2 2组MMSE评分比较
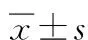
,分
*P<0.05与术前1 d、D组比较。
2.2 2组各项检测指标比较
2组各时点SBP、DBP、HR、SpO2等比较差异均无统计学意义(P>0.05)。与T0时点相比,2组在T1、T2时点的羟自由基、超氧阴离子、丙二醛值明显增加,SOD值降低(均P<0.05);与T1时点相比,2组在T2时点的羟自由基、超氧阴离子、丙二醛值明显降低,SOD值降低(均P<0.05)。
与M组比较,D组在T1和T2时点的超氧阴离子、羟自由基、丙二醛值明显降低,SOD显著增加(均P<0.05)。见表3。
表3 不同时段2组各项指标检测结果 ±s
*P<0.05与T0比较,#P<0.05与M组比较,△P<0.05与T1比较。
3 讨论
POCD是指患者在手术后出现的记忆力下降、言语混沌、注意力不集中、计算力差、逻辑能力降低、谵妄等精神症状以及人格异常、社交活动障碍等慢性表现,是临床常见的手术并发症之一,尤其见于老年全身麻醉手术患者[5]。
胃癌手术创伤大,往往会引起大量的自由基生成,TNF、IL-1等细胞因子增加,儿茶酚胺大量释放,增强自氧化过程。本研究发现,2组患者手术开始2 h时羟自由基、超氧阴离子均升高,术后24 h时显著降低,证实手术应激能导致氧化应激、自由基生成增多,手术结束后因应激源消失而迅速下降。
强烈的应激反应导致机体下丘脑、垂体、肾上腺皮质以及交感-肾上腺素髓质轴的兴奋,引起神经内分泌激素的改变,轻则引起应激性高血压,严重时引起心肌损伤坏死和致命性心律失常等并发症[6]。有研究[2,7]认为蓝斑、交感-肾上腺髓质系统是应激反应发生的途径,蓝斑是右美托咪定的作用部位,右美托咪定是高选择性α2肾上腺素能受体激动剂,可抑制交感神经末梢释放去甲肾上腺素(NE),从而抑制交感神经活性,同时调控儿茶酚胺大量释放,可呈剂量依赖性;随着剂量增加降低儿茶酚胺的作用越明显,从而抑制手术的应激反应。
Taniguchi等[8]认为,右美托咪啶可使炎性细胞的反应性降低,从而使促炎因子的释放及氧自由基的生成减少。姜景卫等[9]研究也发现,右美托咪定超前镇痛使炎性因子释放和氧化应激反应减少。本研究结果显示D组在手术2 h时超氧阴离子、羟自由基明显低于M组。
正常人体内存在抗氧化酶系统,当自由基产生过量时,能及时被清除;超氧阴离子和羟自由基主要由SOD和氧化氢酶与谷胱甘肽过氧化物酶来清除。手术应激能导致机体抗氧化酶能力的下降,本研究2组患者超氧阴离子和羟自由基术后均升高也证明这点,但D组升高值更小,这表明右美托咪定具有自由基清除能力。
有研究[10]提示手术种类、年龄、麻醉等因素会增加POCD的发生。目前对POCD的机制理解主要集中在脑部微栓子形成、低血流灌注、炎症反应和基因的易感性等方面,其中炎症反应在POCD产生起着重要的作用[11]。右美托咪定可调节围术期炎症反应和免疫反应[9]。MMSE是评价认知功能最可靠的工具,敏感度高,操作简单方便,在临床应用很广[12]。本研究2组患者术前MMSE评分均在正常范围,因此排除了术前合并认知功能障碍;术后2 d 时D组MMSE评分高于M组(P<0.05);D组发生POCD发生率明显低于M组(10%比35%,P<0.05)。
总之,右美托咪定可抑制手术的应激反应,降低氧自由基等释放,减少POCD的发生,应用于老年胃癌手术患者,效果优于咪唑安定。
[1] Sulaiman S,Karthekeyan R B,Vakamudi M,et al.The effects of dexmedetomidine on attenuation of stress response to endotracheal intubation in patients undergoing elective off-pump coronary artery bypass grafting[J].Ann Card Anaesth,2012,15(1):39-43.
[2] Kulikov A S,Lubnin A Y.Dexmedetomidine:new opportunities in anesthesiology[J].Anesteziol Reanimatol,2013(1):37-41.
[3] Farag E,Argalious M,Abd Elsayed A,et al.The use of dexmedetomidine in anesthesia and intensive care:a review[J].Curr Pharm Des,2012,18(38):6257-6265.
[4] Ihmsen H,Saari T I.Dexmedetomidine.Pharmacokinetics and pharmacodynamics[J].Anaesthesist,2012,61(12):1059-1066.
[5] 曹君瑜,杨晓斌,汤慧.不同麻醉方式对老年患者术后认知功能影响的比较[J].浙江医学,2007,29(3):244-246.
[6] 刘桂秀,崔超,高玉亮.不同麻醉方法腹腔镜直肠癌根治术患者应激反应的影响研究[J].中医临床研究,2015,7(19):140-142.
[7] 姜景卫,毛美娟,毛桂琴,等.不同剂量右美托咪定辅助用于颈丛麻醉下甲状腺手术的效果比较[J].医药导报,2014,9(33):1179-1182.
[8] Taniguchi T,Kurita A,Kobayashi K,et al. Dose- and time-relatedeffects of dexmedetomidine on mortality and inflammatory responses to endotoxin-induced shock in rats[J].J Anesth,2008,22(3):221-228.
[9] 姜景卫,毛美娟,祝雪芬,等.右美托咪啶超前镇痛对腹腔镜下胆囊切除术患者应激反应与细胞免疫功能的影响[J].海峡药学,2013,25(6):76-78.
[10] Cibelli M,Fidalgo A R,Terrando N,et al.Role of interleukin-1beta in postoperative cognitive dysfunction[J].Ann Neurol,2010,68(3):360-368.[11] Hu Z,Ou Y,Duan K,et al.Inflammation:a bridge betweenpostoperative cognitive dysfunction and Alzheimer's disease[J].Med Hypotheses,2010,74(4):722-724.
[12] 邹磊. 七氟烷和丙泊酚麻醉对老年肺癌患者术后认知功能的影响[J]. 中国实用医刊,2015,42(9):14-15.
(责任编辑:钟荣梅)
2017-03-14
R614.2+4; R619+.9
A
1009-8194(2017)06-0048-03
10.13764/j.cnki.lcsy.2017.06.018
