认知障碍患者血浆集落刺激因子、炎性因子分析
2017-09-12张曦濛蔡晓莹方燕南
张曦濛,蔡晓莹,方燕南
(1.苏州大学附属第一医院 神经内科, 江苏 苏州 215000;2.中山大学附属第一医院 神经内科,广东 广州 510080)
·论著·
认知障碍患者血浆集落刺激因子、炎性因子分析
张曦濛1,蔡晓莹2,方燕南2
(1.苏州大学附属第一医院 神经内科, 江苏 苏州 215000;2.中山大学附属第一医院 神经内科,广东 广州 510080)
目的 通过检测阿兹海默病(AD)和血管性痴呆(VaD)患者血浆中粒细胞集落刺激因子(G-CSF)、巨噬细胞集落刺激因子(M-CSF)及部分炎性因子、β样淀粉蛋白(Aβ)浓度并分析其相互关系,探讨这些因子在AD和VaD的发病中的作用,并为二者的诊断治疗提供新的靶点。方法 收集AD患者24例,VaD患者17例,健康对照32例。收集受试者基本信息,临床资料及血液标本,用芯片法测定血浆G-CSF、M-CSF、白细胞介素(IL)-4、IL-5、IL-6、IL-12p40、IL-12p70、IL-15、IL-16、IL-17,Aβ40, Aβ42浓度。对比各组间各个因子的差异并分析其相关性。结果 AD组血浆G-CSF,M-CSF,IL-4,IL-5,IL-6,IL-12p40,IL-12p70,IL-15,IL-16浓度低于对照组(P<0.05)。VaD组M-CSF,IL-4低于对照组(P<0.05)。AD组及VaD组患者血浆Aβ42水平高于对照组(P<0.05),Aβ40在各组间差异无统计学意义。各因子在AD和VaD组间差异无统计学意义。结论 免疫衰老可能为AD 的发病机制,血管性因素在VaD的发病中至关重要。G-CSF可作为AD和VaD鉴别的标识,也可作为治疗AD的潜在靶点。
阿尔茨海默病;痴呆, 血管性;集落刺激因子;炎性因子
随着人口老龄化的进展,痴呆成为社会突出问题。预计2020年痴呆患者将达到4亿2千万人,2040年将达到8亿1千万人[1],这将给社会、家庭带来沉重的负担。全球范围内,引起痴呆最常见的病因为阿尔茨海默病(Alzheimer’s disease,AD)和血管性痴呆(Vascular dementia,VaD)[2]。据统计,2010年我国的老年人群痴呆发病率约为3%,AD发病率为1.9%,VaD发病率为0.9%[3]。
目前认为,AD是一种以淀粉样蛋白斑、神经纤维缠结、大量神经元丢失为特征的变性疾病,而VaD是以缺血缺氧性或出血性脑疾病造成的病理组织学损伤和进行性智能减退为特征。二者的发病机制有众多假说但仍不明确。炎性机制是近年来的研究热点,有不少研究指出,各种炎性因子介导的炎症以及β样淀粉蛋白(Aβ)的沉积、tau蛋白的磷酸化促进了认知障碍的发展。有动物实验发现,粒细胞集落刺激因子(G-CSF)、巨噬细胞集落刺激因子(M-CSF)有抑制炎症、保护神经、减少Aβ沉积、促进神经细胞新生的作用,可改善AD小鼠的认知功能[4-6]。而这一结论并未得到人体相关试验的证实,部分研究发现,认知功能障碍患者血液中炎性因子升高[7],也有研究指出,炎性因子在AD患者体内是降低的。
本研究将通过检测患者血浆中G-CSF、M-CSF及炎性因子、Aβ浓度并分析其相互关系,进一步探讨这些因子在AD和VaD的发病中的作用,并为AD和VaD的诊断治疗提供新的靶点。
1 资料与方法
1.1 研究对象 2015年3月1日至2015年11月31日于中山大学附属第一医院门诊收集临床诊断为AD、VaD的患者及健康对照。所有数据及样本收集均征得患者及家属同意,签署知情同意书,若为严重认知障碍患者,则由其家属代为签署,研究经过中山大学附属第一医院伦理委员会审批。
1.2 纳入标准 (1)AD组:①年龄50~85岁,符合NINCDS-ADRDA标准诊断为“很可能的阿尔茨海默病”;②简易智力状态检查表(MMSE)评分显示认知功能障碍(文盲组≤17分,小学组≤20分,中学或以上组≤24分);③头颅磁共振显示脑萎缩,颞叶及海马萎缩,无明显脑白质损伤及腔隙性梗死,排除其他脑器质性病变;④Hachinski缺血指数量表<4分。(2)VaD组:①年龄50~85岁,符合DSM-IV-TR诊断血管性痴呆标准;②MMSE评分显示认知功能障碍(文盲组≤17分,小学组≤20分,中学或以上组≤24分),如为脑血管事件后认知功能下降,至少为发病后1年以上者,并且认知功能下降持续超过3个月;③头颅磁共振提示脑白质变性(Fazekas评分>2)或有软化灶;④Hachinski缺血指数量表>7分。(3)对照组:年龄50~85岁,但没有认知障碍及脑血管事件发生,头颅磁共振无明显异常,无控制不佳的重大疾病。
1.3 排除标准 ①因其他原因引起的痴呆,如路易体痴呆、额颞叶痴呆、Pick病、脑积水、颅内肿瘤、舞蹈病、脑外伤、酒精及药物引起的痴呆,及继发于其他内科或神经科疾病如甲状腺功能减退、恶性贫血、叶酸缺乏的痴呆等。②严重的控制不佳的基础病,及炎症性疾病,如肝炎、肿瘤、心力衰竭、慢性阻塞性肺疾病(COPD)等。
1.4 资料收集 详细记录患者的临床资料,包括年龄,性别,文化程度,认知障碍的特点及发病时间,既往病史,吸烟饮酒史,家族史,辅助检查如头颅磁共振等,并完成MMSE量表测评。
1.5 样本收集及检测 所有血浆标本均在14:30~17:30收集完成,抽取血液2~4 ml于枸橼酸钠抗凝管内,常温静置3小时后于4 ℃,3 000 g,取上清液于-80 ℃保存至检测。使用RayBiotec公司人炎症因子抗体芯片3(货号AAH-INF-G3)测定以下因子浓度:G-CSF,M-CSF,白细胞介素(IL)-4,IL-5,IL-6,IL-12p40,IL-12p70,IL-15,IL-16,IL-17,Aβ40,Aβ42。所使用的仪器包括塑料离心管(2~5 ml,50 ml)、摇床、塑料保鲜膜、双蒸馏水、Genepix荧光扫描仪、Thermo Scientific Wellwash Versa芯片洗板机。每个样本测4次,取平均值作为最后结果。
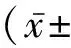
2 结 果
2.1 基本信息 AD组24例,VaD组17例,对照组32例,共73例。各组在年龄、性别、发病时间、吸烟、饮酒、糖尿病、冠心病、肿瘤患病率差异无统计学意义。VaD组高血压(P=0.000)、脑卒中(P=0.041)患病率高于对照组。VaD组高血压(P=0.012)患病率高于对照组,AD组和VaD组各基线信息差异无统计学意义。见表1。
2.2 各因子比较 ①G-CSF及M-CSF:AD组的G-CSF值低于对照组(P=0.002),VaD组的G-CSF值高于对照组(P=0.014),AD组和VaD组间差异无统计学意义。AD组(P=0.000)、VaD组(P=0.001)M-CSF值均低于对照组,AD组和VaD组间差异无统计学意义。②其他炎性因子及Aβ:AD组IL-4(P=0.001),IL-5(P=0.012),IL-6(P=0.004),IL-12p40(P=0.007),IL-12p70(P=0.015),IL-15(P=0.025),IL-16(P=0.010)低于对照组。VaD组IL-4低于对照组(P=0.007)。AD组和VaD组间各炎性因子浓度差异无统计学意义。AD组(P=0.025)及VaD组(P=0.032)患者血浆Aβ42水平高于对照组,AD组和VaD组间Aβ42差异无统计学意义。Aβ40在各组间差异无统计学意义。见表2。
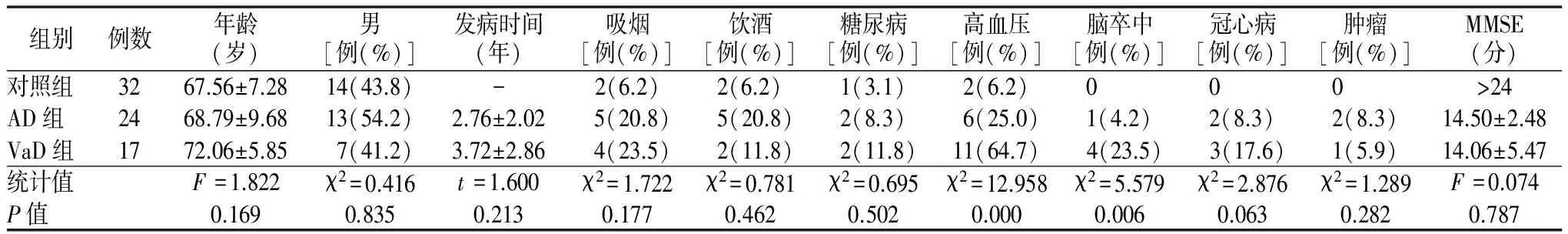
表1 3组基线信息比较
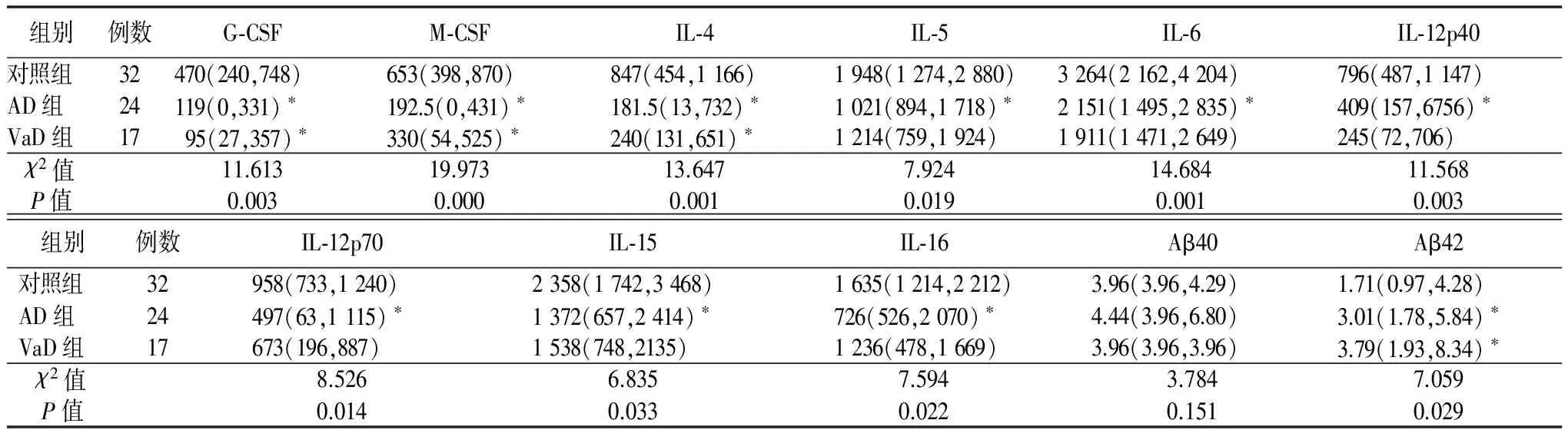
表2 3组炎性因子比较
注:与对照组比较,*P<0.05
2.3 G-CSF、M-CSF和其他因素的相关性分析 G-CSF和M-CSF与年龄、发病时间及Aβ40无显著相关,而和其余炎性因子均呈正相关,G-CSF和Aβ42呈负相关。见表3。
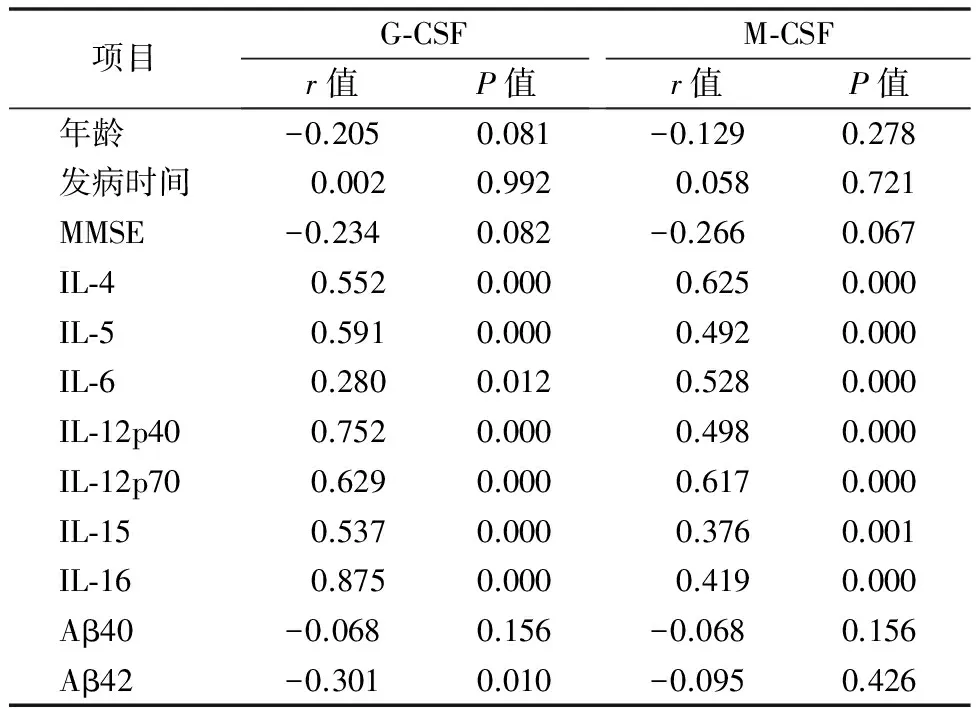
表3 G-CSF、M-CSF和其他因素及炎性因子的相关性
注:在P<0.05的前提下:弱正相关(0.1 很多研究支持认知障碍患者的大脑处于慢性炎症状态,导致老年斑、Aβ沉积、缺血的发生,最终损伤神经元[8-9]。但是炎症因子在AD和VaD中具体发挥怎样的作用仍不明确,各种因子很多时候既表现出神经损伤的功能,也表现出神经保护的功能。中枢神经系统和外周有很多炎性因子交通的渠道,已证实外周血中的炎性因子和中枢神经系统内的炎性因子有一定关联[10]。 有研究发现AD患者中不论是前炎性因子还是抗炎因子都显著降低,提出AD的发生和免疫衰老(immunosenescence)有关[11]。随着年龄的增长,免疫功能会逐渐减弱,老年人也因此更容易感染,对各种病原的应答能力也会降低[12]。免疫衰老的原因包括年龄相关的胸腺萎缩,骨髓造血能力减弱,外周抑制细胞功能增强,这些因素会降低固有免疫和获得性免疫功能[13]。这与我们的研究结果相一致,IL-4和IL-5可抑制IL-1,IL-6,肿瘤坏死因子α(TNF-α)等前炎性因子[14-15],在中枢神经系统中具有抗炎作用。IL-6,IL-12,IL-15,IL-16为前炎性因子,在炎症反应中起到重要作用[16]。而在本研究中,抗炎因子和促炎因子在AD和VaD中均呈降低趋势,并非此消彼长,而是整个免疫系统功能下降,免疫降低可能为认知障碍发生的重要原因。AD和VaD患者多为老年人,且随着年龄的增长患病率明显上升,免疫功能的下降会导致对Aβ或其他神经毒性物质清除能力障碍,无法抵抗外来破坏因素,因此免疫衰老也很可能为认知障碍发生的原因。 无论在脑脊液还是在血浆或血清中,各种因子均有上调、无明显变化或下调的报道,研究结果的异质性非常大。这些差异常被归为使用的检测技术、试剂盒有差异,或是选择的患者和对照组在年龄、种族、疾病阶段等方面具有差异性。也有学者推测,炎性因子研究结果的异质性很可能不仅仅是实验技术和入选患者的差异,认知障碍患者的免疫系统可能处于较大的波动状态,因此得出不同的结果。 本研究中,G-CSF在AD患者血浆中降低的结果和以往文献报道相符[17- 18],但G-CSF和炎性因子均呈正相关关系,不支持G-CSF可以抑制炎症、下调炎性因子的理论,而支持G-CSF可能有增强免疫系统功能,促进炎性因子活动的作用。有研究报道,对AD模型小鼠予G-CSF和SCF治疗后可减少大脑中淀粉样蛋白的含量[4- 5],本研究结果G-CSF和Aβ42呈负相关可以支持这一点。本研究首次发现G-CSF在VaD患者血浆中升高,分析原因可能为脑缺血后,神经元坏死引起G-CSF升高,从而发挥促进神经元新生的作用。根据以上结果推断,G-CSF可能为AD治疗的潜在药物。G-CSF也可作为鉴别AD和VaD的一个标识。 关于M-CSF在痴呆患者中的作用有两种不同理论,一种认为M-CSF作为一种炎性介质在AD患者体内升高,促进炎症导致AD的发生[19];另一种认为M-CSF在AD患者体内降低,从而减弱小胶质细胞的增殖及吞噬功能,导致Aβ累积[20]。根据我们的结果,M-CSF和各炎性因子呈正相关,可佐证M-CSF有促进炎症的功能。我们推测,M-CSF降低可减弱小胶质细胞吞噬功能,同时也减弱了小胶质细胞促进炎症的功能,使得免疫功能下降,最终导致对神经元保护功能的减弱,Aβ的沉积,促进认知障碍的发展。因此M-CSF降低可能为AD及VaD发病的重要因素,M-CSF可能为治疗AD及VaD的认知功能障碍的共同靶点。 在我们的研究中,VaD组炎性因子变化甚少,而通过患者的基线信息分析可得知,VaD患者高血压、脑卒中、冠心病等血管性疾病的发病率显著升高,通过防治心脑血管疾病,可有效预防VaD的发病。 免疫衰老可能为AD 的发病机制,血管性因素在VaD的发病中至关重要。G-CSF可作为AD和VaD鉴别的标识,也可作为治疗AD的潜在靶点。 [1] Lambert MA, Bickel H, Prince M, et al. Estimating the burden of early onset dementia; systematic review of disease prevalence[J]. Eur J Neurol, 2014,21(4):563-569. [2] 韦建武, 方达, 巨喜焕,等. 血管性痴呆与中风后非痴呆患者的脑mri对比研究[J]. 临床荟萃, 2012,27(4): 322-323. [3] Rizzi L, Rosset I,Roriz-Cruz M. Global epidemiology of dementia: alzheimer's and vascular types[J]. Biomed Res Int, 2014:908915. [4] Zhao C, Xie Z, Wang P, et al. Granulocyte-colony stimulating factor protects memory impairment in the senescence-accelerated mouse (sam)-p10[J]. Neurol Res, 2011. 33(4): 354-359. [5] Murphy GM Jr, Zhao F, Yang L, et al. Expression of macrophage colony-stimulating factor receptor is increased in the aβppv717f transgenic mouse model of alzheimer’s disease[J]. Am J Pathol, 2000, 157(3): 895-904. [6] Schneider A, Krüger C, Steigleder T, et al. The hematopoietic factor g-csf is a neuronal ligand that counteracts programmed cell death and drives neurogenesis[J]. J Clin Invest, 2005, 115(8): 2083-2098. [7] 刘增玲, 李文, 李海龙,等. 血管性认知功能障碍非痴呆型患者外周血炎性标记物的临床研究[J]. 中国临床神经科学, 2013,21(1): 32-36. [8] 邬烈铭, 朱文芳, 裴瑜,等. 老年性痴呆患者认知功能与血清炎性细胞因子浓度的相关研究[J]. 中华临床医师杂志:电子版, 2012,6(11): 2970-2973. [9] Minter MR, Taylor JM, Crack PJ. The contribution of neuroinflammation to amyloid toxicity in alzheimer's disease[J]. J Neurochem, 2016, 136(3): 457-474. [10] Huberman M, Shalit F, Roth-Deri I, et al.Correlation of cytokine secretion by mononuclear cells of alzheimer patients and their disease stage[J]. J Neuroimmunol,1994,52(2): 147-152. [11] Richartz E, Stransky E, Batra A, et al. Decline of immune responsiveness: A pathogenetic factor in alzheimer's disease [J]. J Psychiatr Res, 2005,39(5): 535-543. [12] 王敏. 免疫衰老与固有免疫细胞的相关研究进展[J]. 基础医学与临床, 2016,36(1): 125-129. [13] Martorana A, Bulati M, Buffa S, et al. Immunosenescence, inflammation and alzheimer's disease[J]. Longev Healthspan, 2012, 1: 8. [14] 张彤, 台立稳, 赵桂森. 脑出血患者血清和颅内血肿液中白细胞介素4、白细胞介素6含量的研究[J]. 临床荟萃, 2009,24(6): 478-480. [15] Powrie F, Menon S, Coffman RL. Interleukin-4 and interleukin-10 synergize to inhibit cell-mediated immunity in vivo[J]. Eur J Immunol, 1993, 23(11): 3043-3049. [16] Esmaeilzadeh M, Sadeghi M, Galmbacher R,et al. Time-course of plasma inflammatory mediators in a rat model of brain death[J]. Transpl Immunol, 2017, pii: S0966-3274(17)30094-1. [17] Laske C, Stellos K, Stransky E, et al. Decreased plasma levels of granulocyte-colony stimulating factor (g-csf) in patients with early alzheimer's disease[J]. J Alzheimers Dis, 2009, 17(1): 115-123. [18] Barber RC, Edwards MI, Xiao G,et al. Serum granulocyte colony-stimulating factor and alzheimer's disease[J]. Dement Geriatr Cogn Dis Extra, 2012, 2(1): 353-360. [19] Laske C, Stransky E, Hoffmann N, et al. Macrophage colony-stimulating factor (m-csf) in plasma and csf of patients with mild cognitive impairment and alzheimer's disease[J]. Curr Alzheimer Res, 2010, 7(5): 409-414. [20] Boissonneault V, Filali M, Lessard M, et al. Powerful beneficial effects of macrophage colony-stimulating factor on beta-amyloid deposition and cognitive impairment in alzheimer's disease[J]. Brain, 2009, 132(Pt 4): 1078-1092. Analysis of plasma colony stimulating factors and inflammatory factors in patients with cognitive impairment Zhang Ximeng1, Cai Xiaoying2, Fang Yannan2 Objective Detect the concentration of granulocyte colony stimulating factor (G-CSF), macrophage colony stimulating factor (M-CSF) 、some inflammatory factors and β-amyloid (Aβ) in plasma of patients with Alzheimer's Disease (AD) and vascular dementia (VaD). Analyze their relationship, explore the role of these factors in the pathogenesis of AD and VaD, and provide a new target for the diagnosis and treatment of both.Methods 24 AD patients, 17 VaD patients and 32 healthy controls were included. Basic information of them were collected. The concentration of plasma G-CSF, M-CSF, IL-4, IL-5, IL-6, IL-12p40, IL-12p70, IL-15, IL-16, IL-17, Aβ40, Aβ42 were measured by array. Results The concentrations of plasma G-CSF, M-CSF, IL-4, IL-5, IL-6, IL-12p40, IL-12p70, IL-15 and IL-16 in AD group were significantly lower than those in the control group. The concentrations of M-CSF and IL-4 in VaD group were significantly lower than those in control group. The levels of plasma Aβ42 in AD group and VaD group were significantly higher than those in control group. Each factor showed no significant difference between AD and VaD groups.Conclusion Immunosenescence may be the pathogenesis of AD. Vascular factors are important in the pathogenesis of VaD. G-CSF can be used in identification of AD and VaD, and also as a potential target for the treatment of AD. alzheimer disease; vascular dementia; colony stimulating factor; inflammatory factor 方燕南,Email: yannanfang2012@qq.com R745.7;749.16 A 1004-583X(2017)09-0774-04 10.3969/j.issn.1004-583X.2017.09.010 2017-07-31 编辑:张卫国 Correspondingauther:FangYannan,Email:yannanfang2012@qq.com3 讨 论
1.DepartmentofNeurology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou215000,China;2.DepartmentofNeurology,theFirstAffiliatedHospitalofSunYat-SenUniverisity,Guangzhou510080,China
