尿液中铁调素在系统性红斑狼疮中的临床意义
2017-09-12唐代荣谢先达廖湘平
唐代荣 谢先达 廖湘平
·论著·
尿液中铁调素在系统性红斑狼疮中的临床意义
唐代荣 谢先达 廖湘平
目的 通过检测尿液中铁调素在系统性红斑狼疮(systemic lupus erythematosus,SLE)肾脏受累患者中的表达水平,分析其与狼疮肾炎(lupus nephritis,LN)肾脏受累的关系,进一步探讨尿液中铁调素与LN活动性的关系。方法 本实验共纳入38例健康对照者(女性29例,男性9例)和54例SLE患者(女性46例,男性8例),根据其肾脏是否受累将入组的54例SLE患者进一步分为SLE无肾炎组(12例)和LN组(42例),用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测入组者尿液中铁调素的表达水平。将42例LN患者根据肾脏SLEDAI评分(R-SLEDAI)将其分为静止期LN患者组(10例)和活动期LN患者组(32例),比较其尿液中铁调素的表达水平,进一步分析尿液中铁调素与R-SLEDAI评分的相关性。同时根据测得的铁调素值对LN的活动性进行预测,通过受试者工作特征曲线(ROC曲线)分析其敏感性和特异性。结果 尿液铁调素在LN患者组中的表达水平明显高于SLE无肾炎组和健康对照组(P<0.01);尿液铁调素在活动期LN患者组中表达水平显著高于静止期LN组(P<0.01)。LN患者的尿液铁调素与R-SLEDAI评分呈正相关关系(r=0.313,P=0.043),与SLEDAI和肾外RSLEDAI评分均无相关性(P>0.05);尿液铁调素的ROC曲线截值点为7.483 ng/ml(敏感度90.62%,特异度80%),曲线下面积为0.897,大于补体C3、补体C4、血清肌酐和抗ds-DNA抗体的曲线下面积,但小于24h尿蛋白定量的曲线下面积。结论 尿液中铁调素在SLE肾脏受累的患者中表达水平增高,可能是一种新的反映LN活动性的指标。
铁调素;系统性红斑狼疮;狼疮肾炎
狼疮肾炎(lupus nephritis,LN)是系统性红斑狼疮(systemic lupus erythematosus,SLE)肾脏受损后出现的一种免疫复合物性肾炎,LN除累及肾小球外,肾小管、肾间质及肾血管也常累及,是SLE最普遍且严重的并发症[1]。活动性LN患者较静止期LN患者其肾脏受累的形式表现多样,而且肾脏受累的程度也较重,活动期患者的肾小球滤过率也逐渐下降,在短时间内可能迅速发展为肾病综合征和终末期肾病(end stage renal disease,ESRD)[2]。因此,对SLE患者肾脏受损的早期诊断以及对疾病活动性的早期判断,对指导临床医生用药和判断预后至关重要。
铁调素是一种主要由肝脏分泌、维持体内铁稳态的负性调节激素。铁调素也受多种因素的调节,如炎症、促红细胞生成素、血清铁、低氧和氧化应激等[3-4]。Swinkels等[5]发现肾脏是除肝脏外参与铁调素合成的重要器官,同时肾脏是清除铁调素的主要器官,肾脏的近端小管可重吸收超过97%的自由滤过的铁调素。目前,国内外有关铁调素与肾脏损伤有关的研究越来越多,发现在慢性肾脏病(chronic kidney disease,CKD)患者和糖尿病患者体内铁调素都出现表达增加,可能是预测早期肾损害的生物学标志物[6-7]。目前一部分有关SLE肾脏受损发病机制的研究发现,白细胞介素6(interleukin-6,IL-6)可能参与了LN患者肾小球中免疫性复合物的沉积,而且IL-6可上调铁调素 mRNA的表达,使铁调素的表达水平增加。所以,笔者推测铁调素水平与SLE中肾脏受累相关,可能与LN的活动性具有相关性。本研究旨在分析尿液铁调素在LN中的表达水平,进一步发现其与SLE肾脏受累和LN活动性的关系。
资料与方法
一、研究对象与分组
选择2016年1月至2017年2月在郴州市第一人民医院肾内科住院就诊的SLE患者共54例。SLE无肾炎组12例,其中男性2例,年龄20~50岁,平均(28.0±12.4)岁,女性10例,年龄18~50岁,平均(35.0±21.2)岁;LN组42例,其中男性6例,年龄22~47岁,平均(32.5±17.7)岁,女性36例,年龄18~54岁,平均(35.4±11.8)岁。所有入组的SLE无肾炎患者和LN患者均需符合1997年美国风湿病协会(ACR)制定的SLE分类诊断标准,LN患者必须经肾活检确诊。参照SLE疾病活动性指数(SLEDAI)评分对入组的SLE患者进行评分,将LN患者根据肾脏疾病活动性指数(R-SLEDAI)进行评分,包括管型尿、血尿、蛋白尿及脓尿,每项4分,总分0~16分。将其分为静止组(R-SLEDAI<4分或者仅有蛋白尿一项出现阳性或者经肾活检证实)和活动组(R-SLEDAI≥4分),即静止期LN组和活动期LN组。健康对照组来源于郴州市第一人民医院体检中心无器质性疾病的志愿者,且年龄、性别、体质量等均与实验组相匹配,入组健康对照共38例,男性9例,女性29例。本实验符合医院伦理委员会的伦理学标准,得到该委员会的批准,取得入组对象的知情同意,并签署知情同意书。(表1)
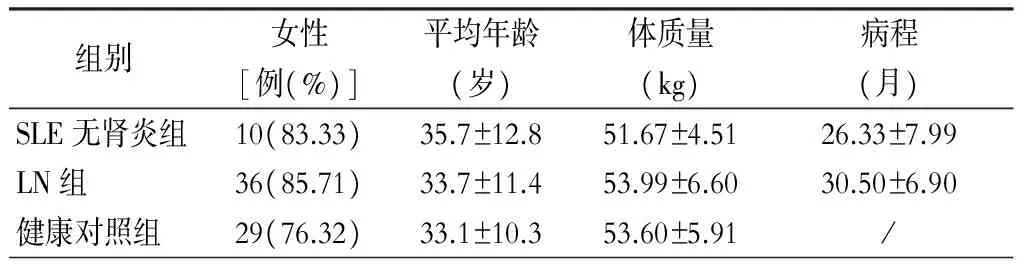
表1 各组患者一般情况

二、实验数据收集
收集患者的基本信息:姓名、性别、年龄、体质量、病程、临床表现等;实验室指标:白细胞(white blood cell,WBC)数目、红细胞(red blood cell,RBC)数目、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)数目、补体C3、补体C4、血尿素氮(BUN)、血肌酐(SCr)、24h尿蛋白定量、尿沉渣、尿铁调素。
三、主要实验仪器及试剂
RT-6100酶标分析仪(深圳雷杜生命科学股份有限公司);电热恒温水浴箱(上海精宏实验设备有限公司);普通离心机(河南宏朗仪器设备有限公司);-80 ℃冰箱(日本SANYO公司);人铁调素酶联免疫吸附测定试剂盒(上海江莱生物科技有限公司)。
四、标本的收集及检测
经伦理委员会及实验对象同意的情况下,用无菌管采集入组者清晨清洁中段尿5~10 ml,在2 h内用离心机以2 000 r/min的速度离心20 min,取上清液于EP管中密封,存放于-80 ℃冰箱中保存,避免反复冻融。统一用ELISA法检测尿液铁调素,其他相关临床及检测指标分别在郴州市第一人民医院检验中心及肾脏风湿免疫科实验室完成。
五、统计学处理
采用SPSS18.0统计软件进行分析。正态分布的计量资料以均数±标准差表示,非正态分布的计量资料以中位数与四分位间距表示。符合正态分布数据两样本均数的比较采用独立样本t检验,相关性分析采用Pearson相关性分析;不符合正态分布及方差齐性计量资料和等级资料的3组间比较釆用Kruskal-Wallis H检验,2组间比较采用Mann-Whitney U检验,相关性分析采用Spearman相关性分析。计数资料采用χ2检验进行检验。采用受试者工作特征曲线(ROC曲线)评价尿液中铁调素和各临床指标对诊断LN活动性时的准确性,并以曲线下面积(AUC)来评价诊断价值。P<0.05为差异有统计学意义。
结 果
一、铁调素水平与SLE患者肾脏受累的关系
检测所有入组者的尿液铁调素的表达水平,经Shapiro-Wilk正态性检验,各组数据均符合正态分布,用F检验进行方差齐性比较,结果提示尿铁调素在SLE无肾炎组、LN组和健康对照组中的表达水平分别为(5.49±0.75) ng/ml,(11.34±5.91) ng/ml和(2.67±0.51)ng/ml。尿铁调素在健康对照组、SLE无肾炎组、LN组3组间表达水平存在差异(H=48.153,P<0.01),进一步进行各两组间相互比较发现,尿铁调素水平在LN组中明显高于SLE无肾炎组(t=-6.231,P<0.01)和健康对照组(t=9.461,P<0.01);SLE无肾炎组尿铁调素水平高于健康对照组(t=14.819,P<0.01)。结果表明,尿液中铁调素表达水平在3组间存在差异(P<0.01),LN患者组中表达水平显著高于SLE无肾炎组(P<0.01)和健康对照组(P<0.01),SLE无肾炎组高于健康对照组(P<0.01)。
二、铁调素水平与LN活动性的关系
根据其R-SLEDAI评分将42例LN患者分为静止期LN组(10例)和活动期LN组(32例),静止期LN组与活动期LN组患者在性别(P=0.308)、年龄(Z=-1.738,P=0.082)、体质量(Z=-0.449,P=0.653)、WBC(Z=-1.447,P=0.148)、Hb(Z=-1.448,P=0.148)、PLT(Z=0.828,P=0.408)、补体C3(t=0.896,P=0.376)、补体C4(Z=-0.948,P=0.343)、血肌酐(Z=-1.951,P=0.051)中差异均无统计学意义(P>0.05),活动期LN患者组中24h尿蛋白定量大于静止期LN患者组(Z=4.467,P<0.01)。尿铁调素的表达水平在活动期LN组中显著高于静止期LN组(P<0.01)。结果表明,活动期LN组尿液中铁调素水平高于静止期LN组(P<0.05)。(表2)

表2 LN患者相关资料
三、铁调素水平与SLEDAI的关系
LN患者的尿铁调素表达水平与SLEDAI评分(r=0.299,P=0.054)和肾外SLEDAI评分(r=0.216,P=0.169)均无相关性,尿铁调素与R-SLEDAI评分呈正相关(r=0.313,P=0.043)。结果表明,LN患者的R-SLEDAI评分值越高,尿液中铁调素的表达水平就越高。
四、尿铁调素与临床指标在判断LN活动性方面的价值比较
为了检验尿铁调素、抗ds-DNA和24h尿蛋白定量对活动性LN的诊断价值,采用受试者特征曲线-曲线下面积(ROC-AUC)对指标准确性进行评价(AUC为0.5时表示诊断方法无意义,AUC为0.5~0.7之间时表示准确性较低,AUC为0.7~0.9之间时表示诊断方法有一定准确性,AUC>0.9时表示准确性较高)。结果显示,尿铁调素的曲线下面积为0.897(95%CI为0.769~0.969,P<0.01),截点值为7.483 ng/ml,此时的特异性为80%,敏感性为90.62%;24h尿蛋白定量的曲线下面积为0.972 (95%CI为0.868~0.999,P<0.01),抗ds-DNA抗体的曲线下面积为0.806(95%CI为0.655~0.912,P=0.004),表明24h尿蛋白定量在判断LN活动性方面的价值高于尿铁调素,而抗ds-DNA抗体在判断LN活动性方面的价值低于尿铁调素,同时进行了与补体C3、补体C4、血肌酐的比较,补体C3曲线下面积为0.381(P=0.262),补体C4曲线下面积为0.400(P=0.345),血肌酐曲线下面积为0.706(P=0.051),均小于尿铁调素的曲线下面积,未在图中表示。(图1)
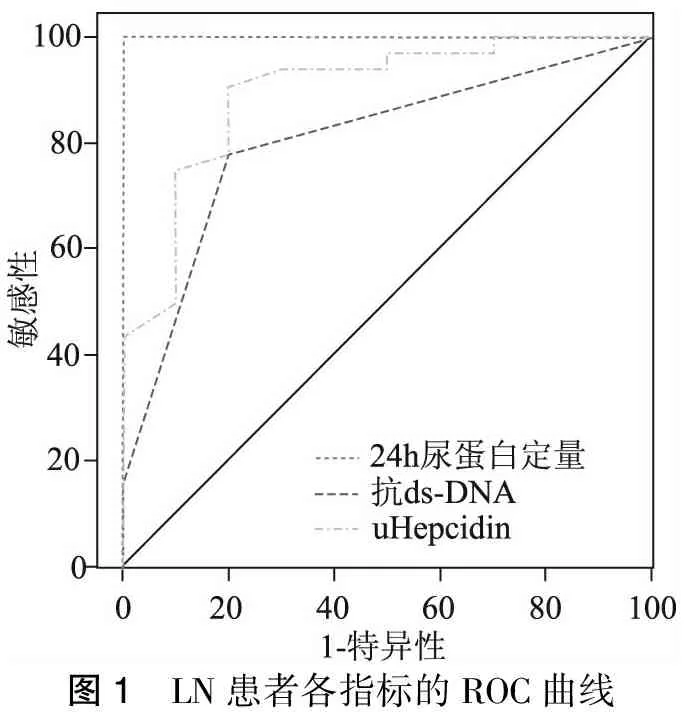
图1 LN患者各指标的ROC曲线
讨 论
SLE是最常见的自身免疫性疾病之一,SLE全球发病率12~39/10万,我国患病率(30~70/10万)位居全球第二位,仅次于黑人(100/10万)[8]。由于患病者多为年轻女性以及患病后长期大量服用激素和价格昂贵的免疫抑制剂,使患者承担了严重的心理负担和经济负担。所以,对SLE患者肾脏受损的早期诊断和对疾病活动性的早期判断,对改善患者疾病的预后至关重要。
目前国内有关铁调素与肾脏疾病的研究大多还仅限于ESRD、维持性腹膜透析、血液透析和肾移植中。而近几年来,国外陆续发现铁调素与LN具有相关性,一项有关LN患者的尿液蛋白质组学研究发现铁调素可能是LN活动性的一种生物学标志物[9]。Zhang等[10]发现尿液中铁调素的表达水平与LN肾组织间质性炎症具有相关性。于是,Mohammed等[9]做了尿液铁调素和单核细胞趋化因子1(monocyte chemotactic protein-1,MCP-1)与LN患者相关性的研究,发现LN患者的尿铁调素和uMCP-1表达水平均明显升高,提示LN患者肾组织中的单核细胞可能与尿铁调素的表达增加相关。同样,Bennett等[11]认为LN患者尿铁调素可能来源于肾组织中浸润的单核细胞。Zhang等[12]在LN患者的肾脏病理组织中发现仅肾脏的间质细胞可表达铁调素,同时发现IL-6参与了LN的发病,IL-6可上调尿铁调素的表达,提示活动期LN患者体内铁调素并不是简单的被肾脏过滤,肾脏本身可能分泌铁调素。在CKD和ESRD疾病患者体内铁调素也出现了高表达,且与IL-6相关[13-14]。综上所述,笔者推测LN患者的肾脏间质中的单核细胞可分泌表达铁调素,而且IL-6可影响尿铁调素的表达。本研究发现LN患者组中尿铁调素表达水平较其他两组显著升高,说明在正常健康人中铁调素也可少量分泌,但SLE出现肾脏受累时尿液中铁调素表达水平增加,提示LN患者的尿铁调素表达水平的增加与肾脏受损具有相关性。Mohammed等[9]发现LN患者组尿铁调素水平较SLE无肾炎组及健康对照组水平高,且差异具有统计学意义,均与本研究结果一致。本研究进一步分析了铁调素与LN活动性的关系,发现尿铁调素在活动期LN患者中明显高表达于静止期LN患者,与R-SLEDAI评分具有正相关,表明尿液中铁调素水平与LN的活动性具有相关性,但目前关于铁调素和LN活动性关系的研究较少,需进一步证实,但本研究提示尿铁调素可能是SLE患者肾脏发生病变和判断活动性的潜在标志物。
基于以上研究,笔者推测LN患者中尿液中铁调素的增加可能并不是简单的被肾脏过滤,肾脏本身可能分泌表达铁调素,铁调素可能来源于肾组织中的间质单核细胞,而在肾实质中则无表达,而且IL-6可诱导尿铁调素的表达[10-12]。目前一部分研究发现在LN患者中IL-6可能参与了肾小球免疫性复合物的沉积,从而使肾脏功能受损而发病,而且IL-6可促进铁调素 mRNA的表达,使铁调素水平增高。LN患者体内B细胞扩增后可产生多种自身抗体,这些抗体可能与肾脏受损具有相关性[15]。而IL-6可通过扩增B细胞产生大量的自身抗体,这些自身抗体不仅参与了炎症反应,还参与了自身免疫性疾病的发病。SLE患者中,IL-6可诱导B细胞成熟,使浆细胞分泌免疫球蛋白增多,也可促进T细胞自身抗体的产生,同时也可抑制抑制性T细胞的活性。研究发现IL-6可通过转录活化因子3途径调节铁调素的转录,而SMAD4能抑制IL-6对铁调素表达[16]。IL-6可调节铁调素 mRNA的转录,使铁调素在机体出现高表达。Nemeth等[17]诱导敲除IL-6基因的小鼠出现炎症,发现肝细胞铁调素的表达无明显变化,然而给参与实验的志愿者注射IL-6后2 h尿铁调素表达水平较前明显升高。这说明由IL-6诱导出现炎症时,尿液中铁调素的表达水平是升高的,IL-6 水平越高,上调尿铁调素表达的作用越强。Indrakanti等[18]研究发现LN在静止期时,IL-6与铁调素具有相关性。所以,LN患者中尿液铁调素的表达增加可能是因为IL-6参与了肾脏受损,从而促进了铁调素 mRNA的表达。
综上所述,关于尿液中铁调素的研究,我们发现尿铁调素可能是预测SLE患者肾脏受累的潜在指标,本研究进一步发现尿液中铁调素水平在活动期及静止期LN患者中表达存在差异,尿铁调素对于评估LN活动性具有一定的价值。
[1] Brugos B, Zeher M. Biomarkers in lupus nephritis[J]. Orv Hetil, 2010, 151(29): 1171-1176.
[2] Balow JE. Clinical presentation and monitoring of lupus nephritis [J]. Lupus, 2005, 14(1): 25-30.
[3] Ashby DR, Gale DP, Busbridge M, et al. Plasma Hepcidin levels are elevated but responsive to erythropoietin therapy in renal disease[J]. Kidney Int, 2009, 75(9): 976-981.
[4] Bennett M, Bruner HI. Biomarkers and updates on pediatrics lupus nephritis[J]. Rheum Dis Clin North Am, 2013, 39(4): 833-853.
[5] Swinkels DW, Girelli D, Laarakkers C, et al. Advances in quantitative Hepcidin measurements by time-of-flight mass spectrometry[J]. PLoS One, 2008, 3(7): e2706.
[6] Jelic M, Cvetkovic T, Djordjevic V, et al. Hepcidin and iron metabolism disorders in patients with chronic kidney disease[J]. Vojnosanit Pregl, 2013, 70(4): 368-373.
[7] Fufaa GD, Weil EJ, Nelson RG, et al. Urinary monocyte chemoattractant protein-1 and Hepcidin and early diabetia nephropathy lesion in type 1 diabetes mellitus[J]. Nephrol Dial Transplant, 2015, 30(4): 599-606.
[8] 袁红, 曾雪曦. 狼疮性肾炎的研究进展[J]. 国际检验医学杂志, 2016, 37(4): 523-526.
[9] Mohammed MF, Belal D, Bakry S, et al. A study of Hepcidin and monocyte chemoattractant protein-1 in Egyptian females with systemic lupus erythematosus[J]. J Clin Lab Anal, 2014, 28(4): 306-309.
[10]Zhang X, Nagaraja HN, Nadasdy T, et al. A composite urine biomarker reflects interstitial inflammation in lupus nephritis kidney biopsies[J]. Kidney Int, 2012, 81(4): 401-406.
[11]Bennett M, Brunner HI.Biomarkers and updates on pediatrics lupus nephritis[J]. Rheum Dis Clin N Am, 2013, 39(4): 833-853.
[12]Zhang X, Jin M, Wu H, et al. Biomarkers of lupus nephritis determined by serial urine proteomics[J]. Kidney Int, 2008, 74(6): 799-807.
[13]Troutt JS, Butterfield AM, Konrad RJ. Hepcidin-25 concentrations are markedly increased in patients with chronic kidney disease and are inversely correlated with estimated glomerular filtration rates[J]. J Clin Lab Anal, 2013, 27(6): 504-510.
[14]Lukaszyk E, Lukaszyk M, Koc-Zorawska E, et al. Iron status and inflammation in early stages of chronic kidney disease[J]. Kidney Blood Press Res, 2015, 40(4): 366-373.
[15]Parodis I, Zickert A, Sundelin B, et al. Evaluation of B lymphocyte stimulator and a proliferation inducing ligand ascandidate biomarkers in lupus nephritis based on clinical and histopathological outcome following induction therapy[J]. Lupus Sci Med, 2015, 2(1): e000061.
[16]常春康, 张曦, 肖超, 等. 铁调素的表达与调节机制研究进展[J]. 中国实验血液学杂志, 2012, 20(4): 1030-1033.
[17]Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing it internalization[J]. Science, 2004, 306(5704): 2090-2093.
[18]Indrakanti DL, Alvarado A, Zhang X, et al. The interleukin-6-Hepcidin-hemoglobin circuit in systemic lupus erythematosus flares[J]. Lupus, 2016: 0, 1-4.
Clinical significance of urine hepcidin in lupus nephritis
TANGDai-rong,XIEXian-da,LIAOXiang-ping.
DepartmentofRheumatologyandImmunology,ChenzhouFirstPeople’sHospital,Chenzhou423000,China
Correspondingauthor:LIAOXiang-ping,E-mail:783702705@qq.com
Objective To test the level of urine hepcidin (Hepc) in systemic lupus erythematosus (SLE) patients with renal damage, study the relationship between the level of urine Hepc and lupus nephritis (LN), and to further investigate the relationship between urine Hepc and active LN. Methods This experiment included 38 healthy subjects (29 females and 9 males) and 54 cases of SLE (46 females and 8 males). According to the renal damage, all SLE patients were divided into SLE non-LN group (12 cases) and SEL LN group (42 cases). The enzyme-linked immunosorbent assay (ELISA) was used to measure the level of urine Hepc. Forty-two cases of LN were divided into inactive LN group (10 cases) and active LN group (32 cases) according to Renal-Systemic Lupus Erythematosus Disease Activity Index (R-SLEDAI). The level of urine Hepc was compared between inactive LN group and active LN group, and the relationship between the R-SLEDAI and urinary Hepc was analyzed. At the same time, the activity of LN was predicted according to the Hepc values, and the sensitivity and specificity were analyzed by receiver operating characteristic curve (ROC curve). Results The level of urine Hepc in SLE LN group was significantly higher than SLE non-LN group and healthy control group (bothP<0.01). The level of urine Hepc in active LN group was significantly higher than that in inactive LN group (P<0.001). The urine Hepc in LN patients was positively correlated with the R-SLEDAI score (r=0.313,P=0.043), and there was no correlation between SLEDAI and renal RSLEDAI score (P>0.05). Cut-off in urine Hepc was 7.483 ng/ml (90.62% for sensitivity, and 80% for specificity). The area under the ROC curve was 0.897, greater than that of complement C3, C4, serum creatinine and serum anti ds-DNA antibody, but less than that of 24-h urinary protein quantity. Conclusions The expression level of urine Hepc in the SLE patients with renal involvement may be a new indicator of LN activity.
Hepcidin; Systemic lupus erythematosus; Lupus nephritis
10.3969/j.issn.1671-2390.2017.08.009
423000 湖南省郴州市第一人民医院肾脏风湿免疫科
廖湘平,E-mail:783702705@qq.com
2017-04-04
2017-07-14)
