颅内胶质母细胞瘤腰椎及椎旁软组织转移1例
2017-09-11张胜平邓兴力郑家礼杨智勇
张胜平邓兴力郑家礼杨智勇
·病例报告·
颅内胶质母细胞瘤腰椎及椎旁软组织转移1例
张胜平*邓兴力*郑家礼**杨智勇*
胶质母细胞瘤 颅外转移 腰椎转移
胶质母细胞瘤 (glioblastoma)又称多形性胶质母细胞瘤(glioblastoma multiforme,GBM),是恶性程度最高的胶质瘤,占神经上皮性肿瘤的20%~25%,占成人颅内肿瘤的12%~15%,好发于大脑半球,主要发生于30~50岁成人。肿瘤呈浸润性生长,大范围的破坏周围脑组织和血管,发展迅速,预后极差。传统观念认为颅外转移比较少见。近年随着诊疗手段的进步,不断有文献报道GBM术后颅外转移的现象。现将我科收治的1例颅内顶叶胶质母细胞瘤术后转移至腰椎及椎旁软组织病例,报告如下。
1 资料
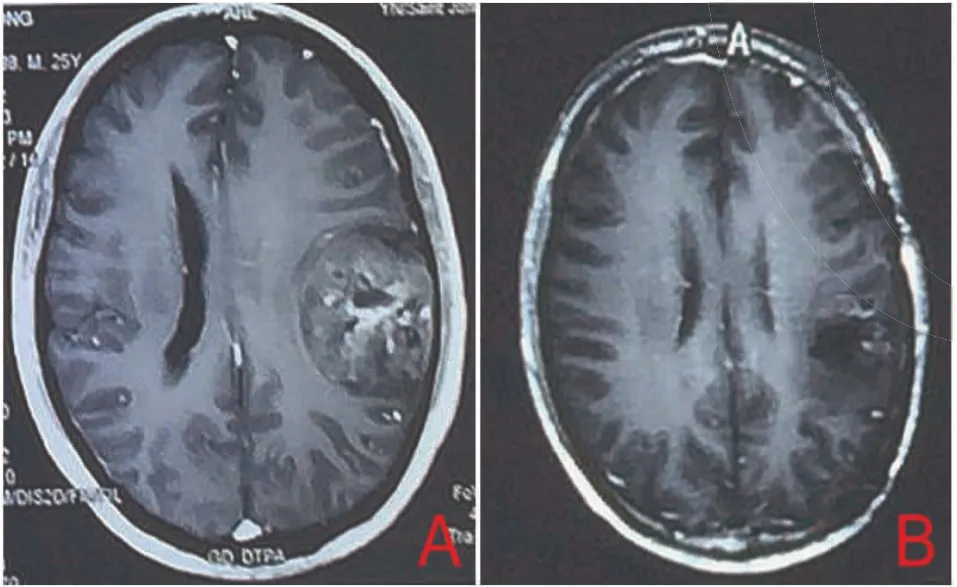
图1 2013年4月手术前后头部M RI图像。A:手术前头颅T1W I增强扫描,左侧顶叶肿瘤强化不均匀;B:手术5个月后头颅T1W I增强扫描,左侧顶叶术区未见明显强化
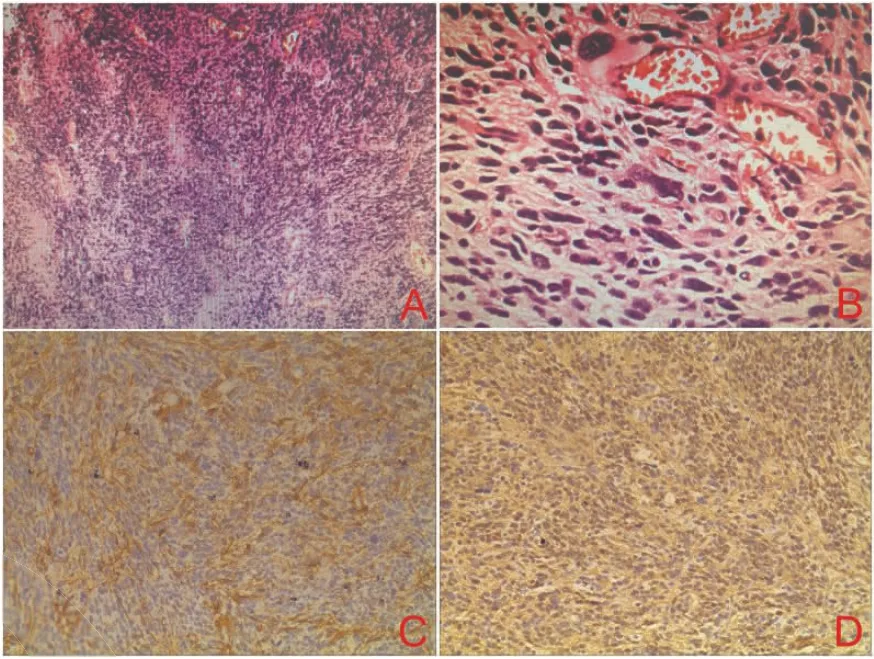
图2 左侧顶叶肿瘤病理结果。A:肿瘤细胞排列紊乱,核异型性明显(H E,20×);B:肿瘤细胞密集,血管增生(H E,40×);C:肿瘤细胞GFAP阳性表达(免疫组化,10×);D:肿瘤细胞Vi m阳性表达(免疫组化,10×)
患者,男,26岁,2013年4月因头痛1月伴喷射性呕吐1d入院。查体:右手痛温觉减退,余无明显神经系统阳性体征。头颅磁共振提示:左侧顶部占位(图1)。手术切除病变,病理提示:CD163(+),MBP(-),CD67(+),CD99(+),CD23(-),CD31(+),Syn(+),CgA(-),CD68(-),CK(-)HMB45(-),Melan-A(-),PR(-),Vim(+),S-100(+),CD34(-),EMA(-),Des(-),GFAP(+),NSE(+),多形性胶质母细胞瘤(WHOⅣ级)(图2)。术后分别于2013年5月、6月进行两次口服替莫唑胺化疗和放射治疗。2014年8月(头部手术后16个月)患者开始出现腰部间歇性疼痛,活动后加重伴双下肢放射性疼痛,并逐渐出现右侧下肢麻木、无力、跛行,双侧臀部酸痛及夜间痛醒。2014年12月头、腰部磁共振:左顶叶术后内侧区域增强后明显强化,考虑复发;腰4椎体异常信号,腰4、腰3椎管内及椎旁软组织肿块影,考虑转移(图3)。查体:腰4椎体棘突、椎旁、臀部压痛,右侧上肢下肢及会阴区痛温觉减退,右侧上肢肌力3级,右侧下肢肌力4级。穿刺活检病理结果提示星形细胞瘤(WHOⅢ级):GFAP(+),Syn(-),NSE(-),CD99(-),CK广(-),LCA(-),CD3(-),S100(+),CD20(-),Myoginin(-), HHF35(-),CD68(-),Ki67+(30%~40%),CKH(-)。在骨科行经后入路椎体、椎管内外病灶清除、椎板切除、椎管神经根管减压、椎体骨水泥填充放射粒子植入钉棒系统内固定术。术后病理结果提示:GFAP(+),CD34血管(+),Ki67+(30%~40%),腰4椎体、椎板病灶胶质母细胞椎体转移;腰 4椎旁软组织见胶质母细胞成分(图4)。2015年1月头颅磁共振平扫增强:左顶镰旁病变较2014年12月对比增大,考虑肿瘤复发(图5)。神经外科行左顶叶占位切除术,病理结果提示:EMA(-),Vim(+),LCA(-),Ki-67(40%+),GFAP(+), NSE(-),CK(-),S-100(+),Syn(-),CgA(-),多形性胶质母细胞瘤(WHOⅣ级)(图6)。术后继续行替莫唑胺化疗和放疗,2015年5月因颅内高压及多器官功能衰竭死亡。
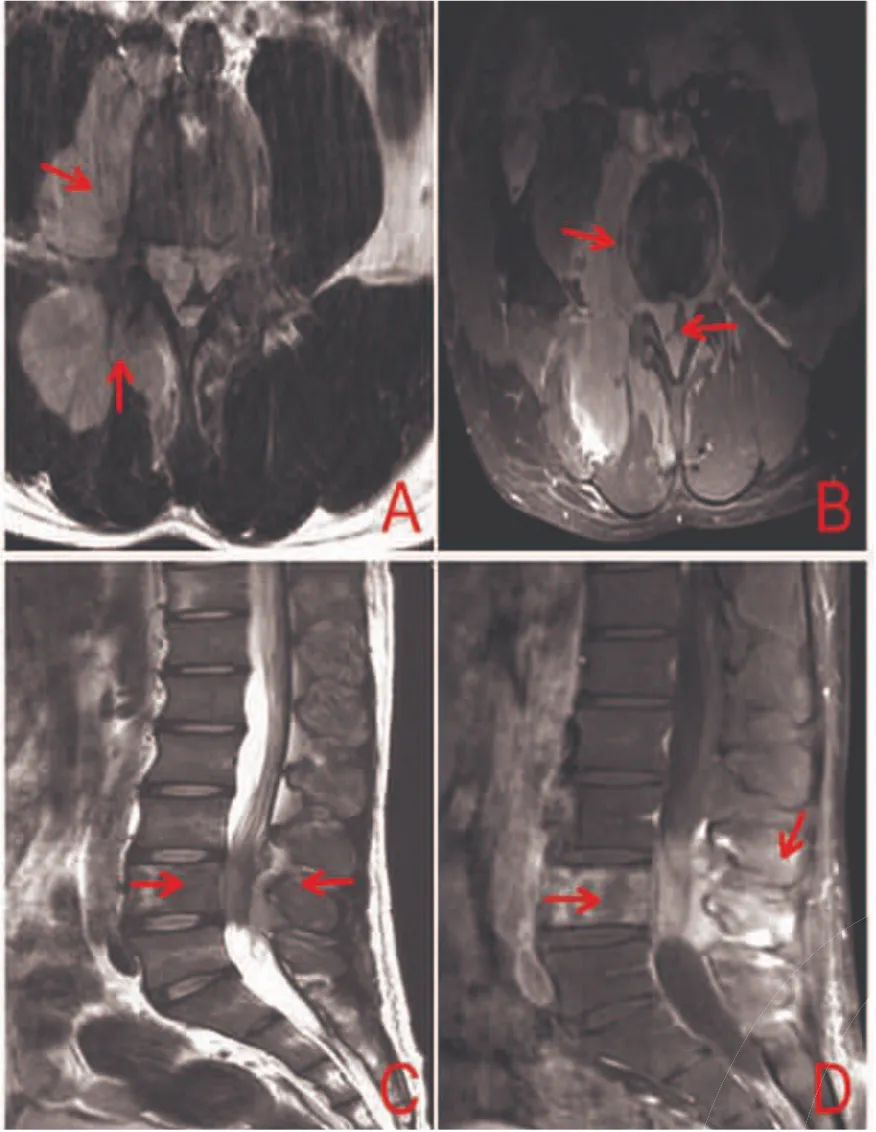
图3 腰骶部M RI图像。A:T2W I平扫;B:T1W I平扫;C:T2W I平扫L4椎体信号减低,L4椎体右侧、后方及L3椎体后方椎管及肌肉内见不规则稍长T2、T1肿块影,蔓延至双侧附件和棘突;D:T1W I增强扫描L4椎体及L4、L3椎体后方软组织片状强化
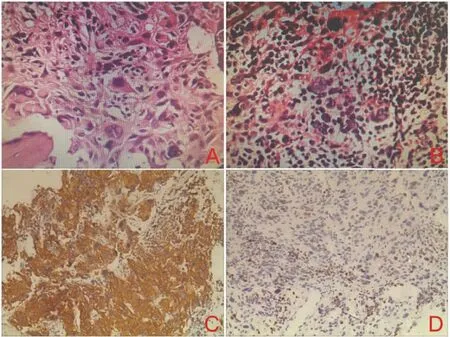
图4 腰4椎体及椎旁病变组织病理结果。A:L4椎体肿瘤细胞弥散分布(H E,40×);B:L4椎旁软组织肿瘤细胞密集,核大,异型性明显(H E,40×);C:L4椎体肿瘤细胞GFAP阳性表达 (免疫组化, 10×);D:L4椎旁软组织肿瘤细胞Ki 67(30%~40%)(免疫组化,10×)
2 讨论
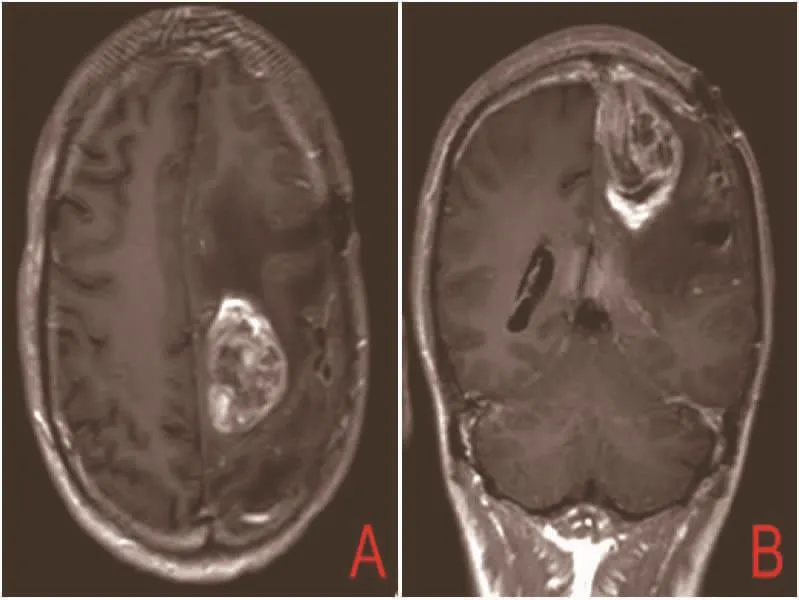
图5 第一次术后21个月头部M RI图像。A、B:T1W I增强扫描左侧镰旁大片明显不均匀强化,其外侧原术区病灶边缘少许强化
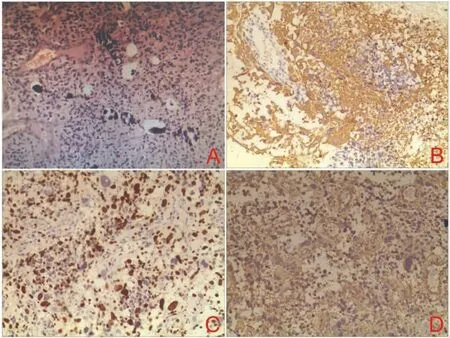
图6 镰旁肿瘤病理结果。A:细胞不规则排列,核大小不一(H E,10×);B:肿瘤细胞GFAP阳性表达(免疫组化,10×);C:肿瘤细胞Ki67(40%+)(免疫组化,10×);D:肿瘤细胞Vi m阳性表达(免疫组化,10×)
多形性胶质母细胞瘤是位于皮质下并具有高度侵袭性的神经上皮肿瘤,容易侵犯深部脑组织甚至可以经胼胝体侵犯对侧大脑半球。手术切除后易复发,也可能通过脑脊液播散。近年关于GBM颅外转移的报道逐渐增多,虽然其转移的具体机制仍然模糊不清,但是以下机制逐渐被公认。首先外科手术被认为与颅外转移有着密切关系。1995年Huang团队报道的GBM颅外转移病例中,96%的患者实施了颅内肿瘤切除术,转移部位包括头皮和颅骨。硬脑膜血管被认为是手术干预患者发生颅外远处转移最有可能的途径,支持这一机制的证据是肺和淋巴结是GBM颅外转移受影响最多的器官,说明血管和淋巴管是转移通路,虽然手术干预不是颅外转移的必然条件,但不可否认外科手术提升了颅外转移的风险。其次,少数未行任何干预措施并存活的颅外转移患者则说明了有其他转移途径的存在,考虑是肿瘤细胞有能力突破血脑屏障并直接进入了血液循环[1]。最近在20%~39%的术前GBM患者的循环血液中发现了肿瘤细胞,也说明肿瘤细胞能够渗出血脑屏障,成功逃避免疫系统在血液中存活流通,颅外肿瘤可以通过这些细胞传播[2,3]。再次肿瘤细胞通过脑脊液种植也有可能,Anand Narayan等报道了28例中枢神经系统肿瘤通过脑室腹腔分流术后播散到腹膜的病例其中包括1例丘脑GBM腹膜转移[4],但因样本量比较少,还有待进一步的研究。不能排除的机制还包括针对肿瘤的局部放射治疗、全身的化学治疗或者是肿瘤周围的慢性炎症可能已经打开了部分血脑屏障,也可能是机体抵抗力下降,为肿瘤细胞的颅外传播创造了条件[5]。基于转移灶的形成必须有肿瘤细胞成功到达转移部位并成活,说明GBM的颅外转移是多种机制相互作用的结果。
在GBM骨骼转移中,最常受累的骨骼依次是脊柱、肋骨、胸骨、头骨、髋臼。脊柱中最常见于胸椎,其次是腰椎、颈椎和骶骨区域。本例患者转移灶位于腰椎和椎旁软组织,颅脑手术开放了硬脑膜血管可能为腰椎转移提供的途径,腰椎周围的Batson静脉丛可能是另外一条途径,因其可以将中线器官的静脉血流逆行性流向脊椎[6]。椎旁软组织受累考虑是椎体受累后直接侵袭所致。值得注意的是,脊柱转移病灶可以没有颅内原发性GBM的特征性表现,多数可以由神经胶质和发育不良的肉瘤成分组成[7],本例患者病变椎体和椎旁软组织都是胶质母细胞成分。
胶质母细胞瘤颅外转移发病率有所增加,可能是基于患者的生存改善和诊断工具、手术技术、放射治疗技术以及化学疗法和靶向治疗等方面的进展和整合。目前对GBM颅外转移病灶的治疗尚缺乏有效的手段,如果能够增加循环系统中肿瘤细胞的表观遗传、翻译后修饰以及能够从原发部位渗出并在循环系统中存活的因素或者表型的理解,有可能能够改进GBM的检测方法和疗法,会给治疗带来一定的曙光。亟待在脑胶质瘤治疗新进展的情况下,颅外转移灶也可以得到有效的控制。
[1]王兵,钟东,汤为学,等.Syntenin基因促进胶质瘤侵袭和迁移的分子机制[J].中国神经精神疾病杂志,2015,41(5):293-298.
[2]SEOANE J,DE MATTOS ARRUDA L.Escaping out of the brain[J].Cancer Discovery,2014,4(2):1259-1261.
[3]CRANE CA,AUSTGEN K,HABERTHUR K,et al.Immune evasion mediated by tumor-derived lactate dehydrogenase induction of NKG2D ligands on myeloid cells in glioblastoma patients[J].Proceedings of the Nationgal Academy of Sciences of the United States of America,2014,111(6):12823-12828.
[4]NARAYAN A,JALLO G,HUISMAN TA.Extracranial peritoneal seeding of primary malignant brain tumors through ventriculoperitoneal shunts in children:Case report and review of the literature[J].Neuroradiol,2015,28(5):536-539.
[5]GOODWIN CR,LIANG L,ABU-BONSRAH N,et al.Extraneural GlioblastomaMultiformeVertebral Metastasis[J].World Neurosurg, 2016,89(6):578-582.
[6]MUJTABA SS,HAROOM S,FARIDI N.Cervical metastatic glioblastoma multiforme[J].Journal of the College of Physicians and surgeons pakistan,2013,23(2):160-161.
[7]FABI A,VIDIRI A,CARAPELLA C,et al.Bone metastasis from glioblastoma multiforme without central nervous system relapse: a case report[J].Anticancer Research,2004,24(7):2563-2565.
R739.41 (
2016-09-20)
A (责任编辑:甘章平)
10.3969/j.issn.1002-0152.2017.07.011
* 昆明医科大学第一附属医院神经外一科(昆明 650032)
**昆明医科大学第一附属医院运动医学科
