芒果叶中总黄酮提取工艺优选
2017-09-11侯文浩邓国文刘小幸周程艳
张 帆,陈 越,侯文浩,邓国文,刘小幸,周程艳
(河北大学药学院,河北 保定 071000)
·实验研究·
芒果叶中总黄酮提取工艺优选
张 帆,陈 越,侯文浩,邓国文,刘小幸,周程艳
(河北大学药学院,河北 保定 071000)
目的 选取总黄酮最优提取工艺,为芒果叶的进一步开发研究提供科学依据。方法 以百色芒果叶为原料,分别采用普通醇提法和超声提取法,进行单因素试验和正交试验,分析乙醇浓度、液固比、提取时间和提取温度对总黄酮提取效果的影响,并以总黄酮得率为评价指标,优化提取工艺。结果 乙醇加热回流法的最佳工艺为温度100℃,时间2 h,液固比10,提取次数3次;超声提取法的最佳工艺为温度50℃,时间35 min,液固比10,提取次数3次。结论 芒果叶中总黄酮的最佳提取工艺为乙醇加热回流法。
总黄酮;单因素试验;正交试验;提取工艺
芒果叶为漆树科植物芒果 Mangifera indica L.的叶[1],其味酸、甘,性凉、平,具有行气疏滞、祛痧积的功效,主要用于治疗热滞腹痛、气胀、小儿疳积、消渴[2]等症。芒果叶中含有大量总黄酮,包括芒果苷、高芒果苷、异芒果苷、槲皮素等多种化学成分,主要成分芒果苷具有抗炎[3]、解热镇痛[4-7]、抗菌[8-11]、免疫调节[12-15]、降血糖[16-18]、抗氧化[19-22]等广泛的药理作用。芒果苷为一种四羟基吡酮碳糖苷,是氧杂蒽酮类化合物,目前对于芒果叶的研究主要是针对于其主要有效成分的得率测定和药理作用,对其提取工艺的研究较少,因其提取效果不佳。本研究中以百色芒果叶为原料,采用乙醇加热回流法和超声提取法,结合单因素试验和正交试验,进一步优化提取工艺,为进一步研究芒果叶提供科学依据。
1 仪器与试药
1.1 仪器
Bio TEK型多功能酶标仪(基因有限公司);SBB20002型电子天平(盛博电子衡器有限公司);赛多利斯分析天平(赛多利斯科学仪器<北京>有限公司);YL-060S型语路超声清洗器,RE 52-99型旋转蒸发仪(上海亚荣生化仪器厂);ZDHW电热套(北京中兴伟业有限公司)。
1.2 试药
无水乙醇(天津市风船化学试剂科技有限公司,批号为20160229);超纯水、亚硝酸钠(北京康普汇维<广州>科技有限公司,批号为20151223);硝酸铝(常州市海拓实验仪器有限公司,批号为20161115);氢氧化钠(天津市博迪化工有限公司,批号为20160709)。百色芒果叶采自广西百色市,经周程艳副教授鉴定为漆树科植物芒果 Mangifera indica L.的叶。芦丁对照品(天津力生制药股份有限公司,批号为1502001,含量为每片200 mg)。
2 方法与结果
2.1 总黄酮得率的测定
2.1.1 芦丁标准曲线绘制
选择芦丁为对照品,参照2015年版《中国药典(一部)》和文献[23-25]制备标准曲线。将芦丁对照品干燥至恒重,称取1.300 8 mg,精密称定,置100 mL容量瓶中,用体积分数为70%的乙醇溶液定容,制得芦丁标准溶液(0.013 008 g/L),分别取芦丁标准溶液0,1.0,2.0,3.0,4.0,5.0 mL,置10 mL容量瓶中,各加入0.30 mL体积分数为5%的亚硝酸钠水溶液,静置6 min,分别加入0.30 mL体积分数为10%的硝酸铝水溶液,静置6 min,然后加入4.00 mL体积分数为4%的氢氧化钠溶液,再加入体积分数为70%的乙醇定容,静置15 min,以空白试剂作对照,用酶标仪于506 nm波长处测定吸光度,以芦丁标准溶液的质量浓度、吸光度分别为横、纵坐标,作标准曲线,得标准曲线方程 Y=7.113 8 X+0.053 3,r2=0.999 4(n=6)。
2.1.2 总黄酮得率测定
称取10.00 g百色芒果叶于体积分数为70%的乙醇中加热回流提取,经旋转蒸发仪浓缩后,置250 mL容量瓶中定容。精密量取20.00 mL稀释至100 mL,再精密量取8.00 mL,置100 mL容量瓶中,加体积分数为70%的乙醇溶液至40 mL,摇匀,随之加入4 mL体积分数为5%的亚硝酸钠溶液,使混匀,静置6 min,加入4 mL体积分数为10%的硝酸铝水溶液,使混匀,按2.1.1项下操作,测定吸光度值,根据标准曲线方程计算芒果叶提取液的总黄酮含量 Q(g/L),利用提取液中总黄酮得率计算百色芒果叶中总黄酮得率 T(%)。
总黄酮得率 T(%)=Q×V/1 000 W×100%
其中,Q为芒果提取液总黄酮含量(g/L),V为提取液体积(mL),W为百色芒果叶质量(g),总黄酮得率 T(%)为提取所得总黄酮与所用百色芒果叶的质量之比。
2.2 乙醇加热回流法工艺条件优选
2.2.1 提取条件单因素试验
液固比:称取百色芒果叶3份,每份10.00 g,精密称定,分别加入液固比 5,8,10,15,20的体积分数为70%的乙醇,100℃下热回流提取2次,每次提取1 h,用酶标仪于506 nm波长处测定吸光度值,计算芒果叶中总黄酮得率(%)。结果见图1 A。可见,随着液固比增大,总黄酮得率增加,当液固比达到10以上时,提取液总黄酮得率增速减缓,提示在液固比为10时,芒果叶中总黄酮提取已较充分,考虑节约溶剂,以降低经济成本选取液固比为10。
提取温度:称取百色芒果叶3份,每份10.00 g,精密称定,使用体积分数为70%的乙醇作为提取液,选取最优固液比10,提取温度设计60℃,80℃,100℃,120℃4个水平,加热回流提取2次,每次提取2 h,用酶标仪于506 nm波长处测定吸光度值并计算芒果叶中总黄酮得率(%)。结果见图1 B。可见,总黄酮得率随提取温度的升高而增大,但在提取温度超过100℃以后,得率迅速下降,因此选择提取温度为100℃左右较适宜。
提取时间:称取百色芒果叶3份,每份10.00 g,精密称定,使用体积分数为70%的乙醇作为提取液,液固比10,提取温度100℃,加热回流提取2次,每次提取时间设计1,2,3 h共3个水平,用酶标仪于506 nm波长处测定吸光度值并计算芒果叶中总黄酮得率(%)。结果见图1 C。可见,随着提取时间的延长,总黄酮得率逐渐升高,超过2 h后,总黄酮得率降低,因此提取时间确定在2 h左右。
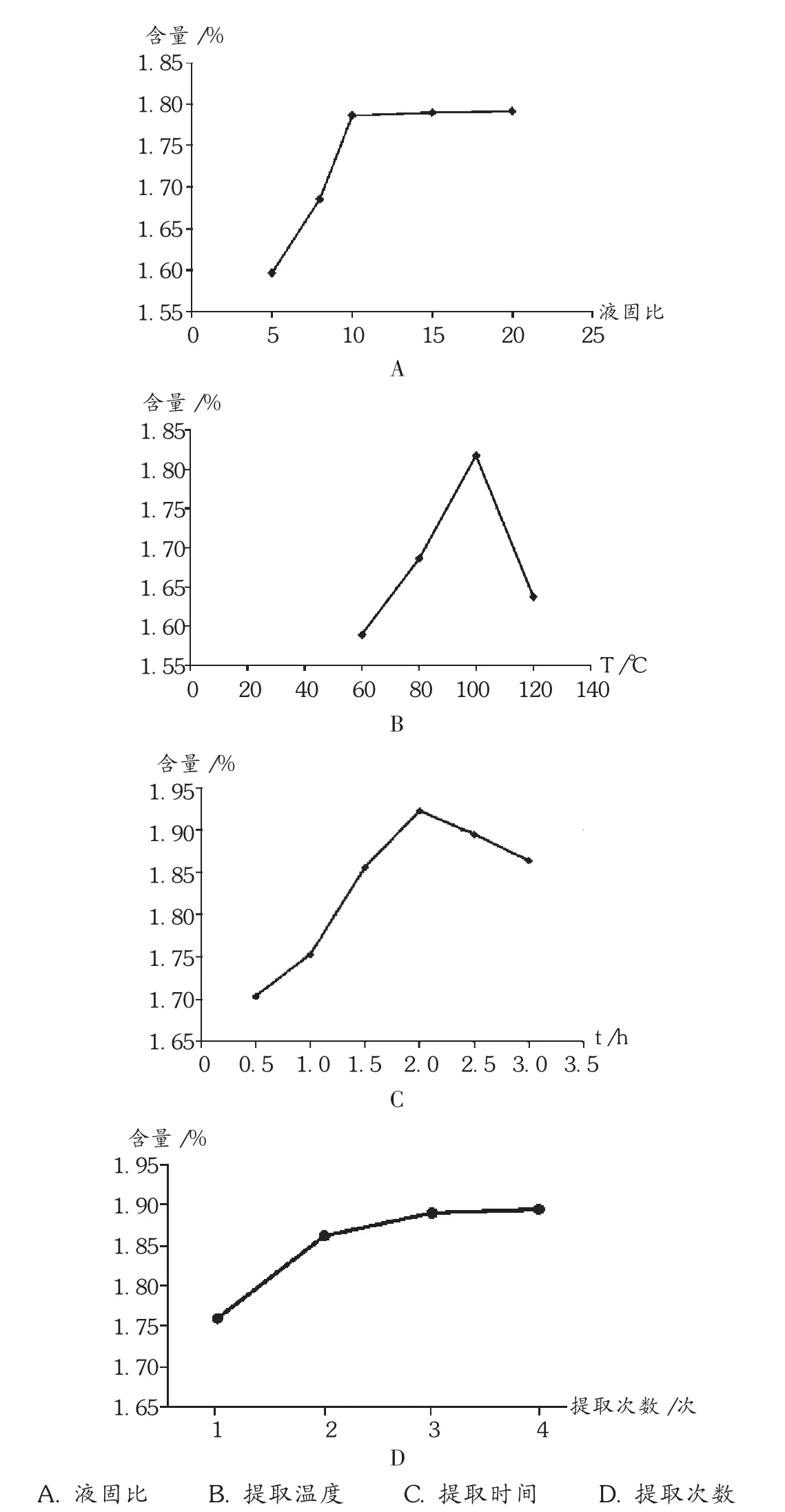
图1 加热回流法提取条件单因素试验结果
提取次数:称取百色芒果叶3份,每份10.00 g,精密称定,使用体积分数为70%的乙醇作为提取液,液固比、提取时间及提取温度按以上试验结果确认,提取次数设计1,2,3共3个水平,测定吸光度并计算芒果叶中总黄酮得率(%)。结果见图1 D。可见,总黄酮得率随着回流次数的增加而提高,在回流处理3次时,总黄酮的得率达到最高值,继续增加回流次数,总黄酮得率增速减缓,考虑节约溶剂,以降低经济成本,并增加回流次数,使芒果叶杂质过少,为后续的过滤操作增加了困难,所以综合考虑,选择3次为最佳提取次数。
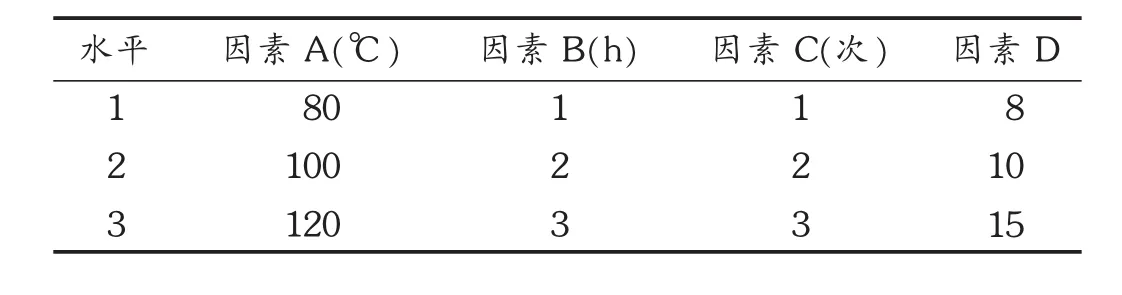
表1 乙醇加热回流法工艺优选因素水平表
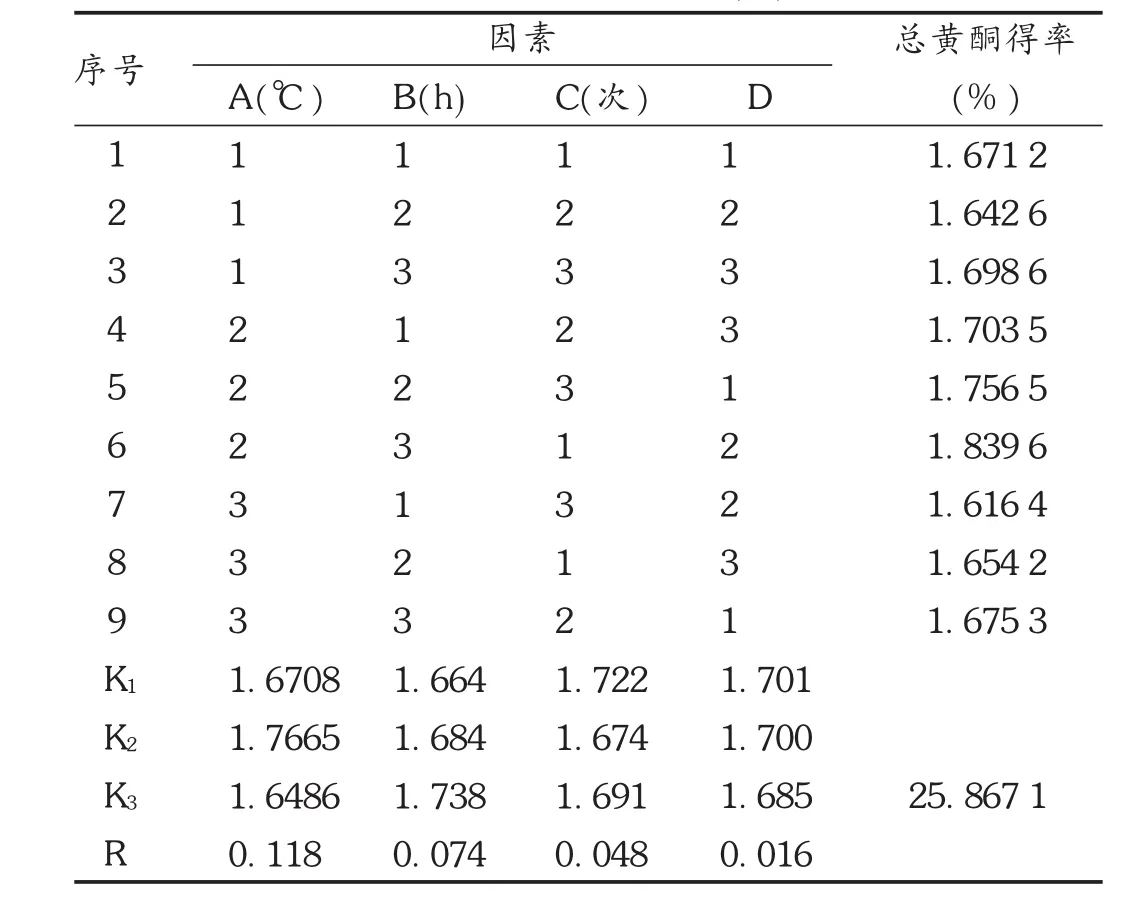
表2 乙醇加热回流法工艺优选 L9(34)正交试验结果
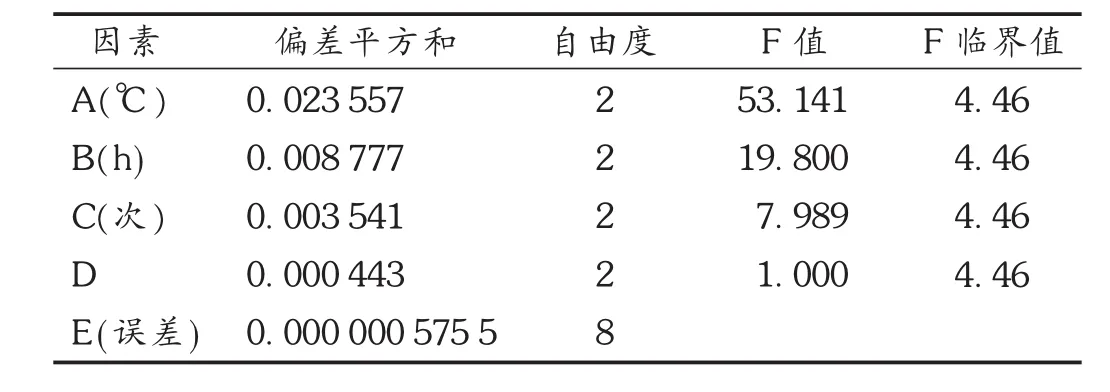
表3 乙醇加热回流法工艺优选方差分析结果
2.2.2 正交试验设计
根据单因素试验结果,选取提取温度(A)、提取时间(B)、提取次数(C)、液固比(D)4个因素进行 L9(34)正交试验,以总黄酮得率(%)为指标,利用正交试验确定乙醇加热回流法的最佳提取条件。因素水平表见表1,正交试验结果及分析见表2和表3。由极差的大小可将影响大小依次排列为提取温度>提取时间>提取次数>液固比,经方差分析发现,提取温度、提取时间、提取次数对提取效果的影响均呈极显著性差异。提取温度为100℃时为最佳温度,同理提取时间2 h,提取次数3次,而液固比无显著性影响,因此以节约成本考虑,选择液固比10,最优化方案为A2B2C3D2。
2.2.3 验证试验
为了考察最优提取工艺的重复性,同时具有工业化生产的意义,因此选取了同一批芒果叶样品100 g模拟工业化生产,并平行重复3次,测定吸光度,计算总黄酮得率。结果得率分别为1.821 4%,1.813 5%,1.816 9%,平均值为1.8173%,RSD=0.396%(n=3),表明该提取工艺稳定、可行。
2.3 超声提取法工艺条件优选
2.3.1 单因素试验
液固比:称取百色芒果叶3份,每份10.00 g,精密称定,分别加入液固比8,10,15的蒸馏水,50℃超声提取2次,每次提取35 min,依法测定吸光度,并计算芒果叶中总黄酮得率(%)。结果见图2 A。可见,随着液固比增大,总黄酮得率增加,当液固比超过10时,提取液总黄酮得率增速减缓,提示在液固比为10时,芒果叶中总黄酮提取已较充分,考虑节约溶剂,为降低经济成本,选择液固比为10。
提取温度:称取百色芒果叶3份,每份10.00 g,精密称定,使用蒸馏水作为提取液,液固比为10,提取时间为35 min,提取温度设计20℃,30℃,50℃,70℃ 等4个水平,超声提取2次,依法测定吸光度并计算芒果叶中总黄酮得率(%)。结果见图2 B。可见,总黄酮得率随提取温度的升高而增大,但在提取温度超过50℃后,得率迅速下降,因此选择提取温度为50℃较适宜。
提取时间:称取百色芒果叶3份,每份10.00 g,精密称定,液固比为10,提取温度为50℃,每次提取时间设计10,20,35,50 min共4个水平,依法测定吸光度并计算芒果叶中总黄酮得率(%)。结果见图2 C。可见,增加超声处理时间,总黄酮得率随提取时间先升高后下降,总黄酮在超声35 min时达到最高,继续增加超声时间,总黄酮得率开始下降,故选择超声时间为35 min最佳。
提取次数:称取百色芒果叶3份,每份10.00 g,精密称定,使用蒸馏水作为提取液,液固比为10,提取时间为35 min,提取温度为50℃,提取次数设计1,2,3,4共4个水平,依法测定吸光度并计算芒果叶中总黄酮得率(%)。结果见图2 D。可见,总黄酮得率随着超声次数增加而提高,在超声处理3次时,总黄酮的得率达到最高值,继续增加超声次数,总黄酮得率增速减缓,考虑节约溶剂,以降低经济成本,选择3次为最佳超声次数。
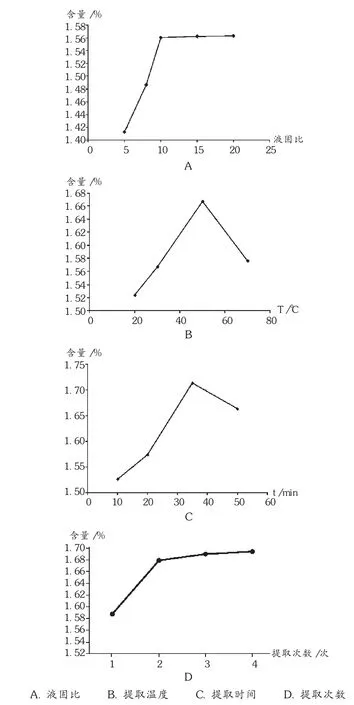
图2 超声提取法工艺条件单因素试验结果
2.3.2 正交试验设计
根据单因素试验结果,选取提取温度(A)、提取时间(B)、提取次数(C)及液固比(D)4个因素进行 L9(34)正交试验,以总黄酮得率(%)为指标,利用正交试验确定乙醇加热回流法的最佳提取条件。因素水平表见表4,正交试验结果及分析见表5和表6。由极差的大小可将影响大小依次排列为提取温度>提取时间>提取次数>液固比,经方差分析发现,提取温度、提取时间对提取效果的影响均呈极显著性差异。可知,提取温度为50℃时为最佳温度,同理提取时间为35 min,提取次数为3次时,液固比无显著性影响,因此以节约成本考虑,选择液固比10,最优化方案为A2B2C3D2。

表4 超声提取法工艺优选因素水平表
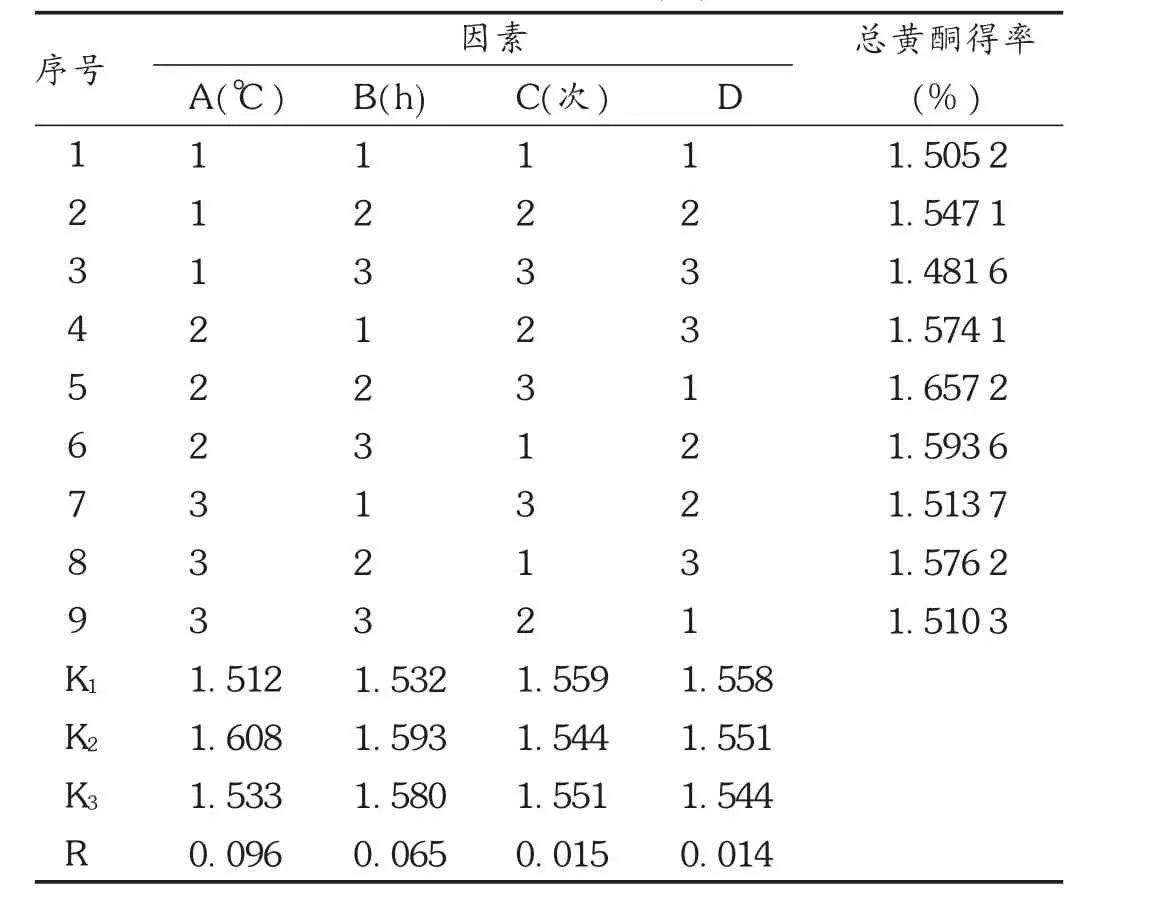
表5 超声提取法工艺优选 L9(34)正交试验结果
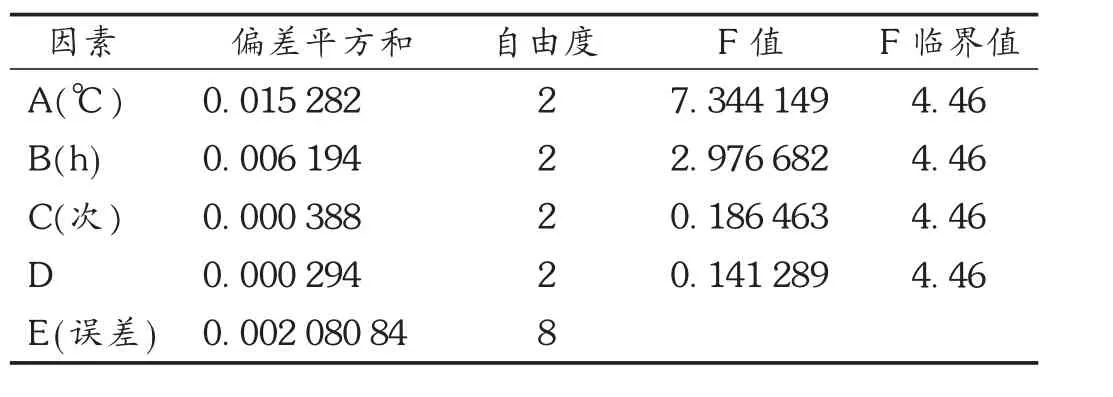
表6 超声提取法工艺优选方差分析结果
2.3.3 验证试验
为了考察最优提取工艺的重复性,以及具有工业化生产的意义,本研究中取同一批芒果叶样品100 g模拟工业化生产,平行重复3次,测定吸光度,计算总黄酮得率。结果得率分别为1.652 6%,1.659 6%,1.651 4%,平均值为1.654 5%,RSD=0.443%(n=3),表明该提取工艺稳定、可行。
2.4 两种提取方法比较
乙醇加热回流法、超声波提取法最佳工艺条件下,从芒果叶中提取总黄酮得率分别为(1.84±0.02)%和(1.66±0.02)%,乙醇加热回流法提取总黄酮得率最高,超声波提取法工艺简单,但提取得率低于乙醇加热回流法,且不易控制其温度。综合考虑,选用乙醇加热回流法为提取总黄酮的最佳方法。
3 讨论
我国是芒果主要产地之一,主要分布于台湾、广东、广西、海南、福建、云南、四川等地区,资源丰富,分布地域广,原料易得,价格低廉,甚至四季可采[26]。以往芒果叶中总黄酮的提取方法存在耗时、耗料、提取率低、有效成分易被破坏等诸多缺点。超声提取法有诸多优点,可大大缩短提取时间,节约溶剂,提高提取率[27-28];采用乙醇回流法对总黄酮进行提取虽耗时,但提取率高。本研究中应用正交试验分析上述2种方法的最佳工艺,分析结果表明,采用乙醇回流法提取芒果叶中总黄酮得率最高,超声提取法提取效率较低。各因素对提取率变化的影响原因分析如下。
液固比:在单因素试验中,2种方法随着提取液固比的升高,总黄酮得率均呈先升后平缓趋势。原因可能是,液固比较低时液体量不够,不能充分浸润芒果叶,产生的蒸气量不够,导致总黄酮提取不完全;而当继续增大液体的比例时,可能提取已较为完全,所以上升较为平缓。
提取温度:在单因素试验中,2种方法随着提取温度的升高,总黄酮得率均呈先升后降趋势。原因可能是,温度升高加快了分子的扩散速度,有助于溶质扩散,芒果叶中醇溶性杂质随着温度升高溶出速度明显升高,不利于芒果苷溶出;此外,温度升高对芒果叶中的芒果苷产生不同程度的破坏,直接降低了提取质量及效率。
提取时间:在单因素试验中,2种方法随着提取时间的延长,总黄酮得率均呈先升后降趋势。原因可能是,提取时间过长芒果苷含量降低,长时间的提取破坏了芒果苷分子结构。
提取次数:在单因素试验中,2种方法随着提取次数的升高,总黄酮得率均呈先升后平缓趋势。提取次数是利用溶液的浓度差增加溶液的得率,其得率平缓的原因可能是因为由于次数增多,提取较完全。
综上所述,芒果叶中总黄酮的最佳提取工艺为乙醇加热回流法;以百色芒果叶为原料,乙醇加热回流法的最佳工艺为温度100℃,时间2 h,液固比10,提取次数3次,该提取工艺稳定、可行。
[1]江苏新医学院.中药大辞典(上册)[M].上海:上海人民出版社,1977:1040.
[2]广西壮族自治区卫生厅.广西中药材标准[M].南宁:广西科学技术出版社,1990:54.
[3]Carvalho AC,Guedes MM,De Souza AL,et al.Gastroprotective effect ofmangiferin,a xanthonoid from mangifera indica,against gastric injury in-duced by ethanol and indomethacin in rodents[J].Planta Med,2007,73(13):1372-1376.
[4]Izquierdo T,Espinosa de los Monteros-Zuniga A,Cervantes- Duran C,et al.Mechanisms underlying the antinociceptive effect of mangiferin in the for-malin test[J].Eur J Pharmaco,2013,718(1-3):393-400.
[5]Lopes SC,Da Silva AV,Arruda BR,et al.Periphe ral antinociceptive action of mangiferin in mouse models of experimental pain: role of endoge-nous opioids,K(ATP)-channe-channels and adenosine[J].Pharmacol Biochem Behav,2013(110):19-26.
[6]邓家刚,郑作文,杨 柯.芒果苷对内毒素致热家兔体温的影响[J].中国实验方剂学杂志,2006,12(2):72-73.
[7]Kant Singh S,Sinha SK,Prasad SK,et al.Synthesis and evaluation of no-vel analogues of mangiferin as potent antipyretic[J].Asian Pac J Trop Med,2011,4(11):866-869.
[8]邓家刚,覃骊兰.芒果苷近5年研究进展[J].长春中医药大学学报,2008,24(4):463-464.
[9]王志萍,邓家刚,谭珍媛.芒果苷片体外抑菌杀虫作用的实验研究[J].时珍国医国药,2009,20(9):2167.
[10]刘雪萍,蒋伟哲,黄兴振,等.芒果叶提取物体外抗菌作用研究[J].中国药业,2007,16(9):12-13.
[11]叶海洪,农朝赞,黄婵娟,等.芒果甙对痤疮主要致病菌的抑菌作用研究[J].右江民族医学院学报,2010,32(5):668-670.
[12]邓家刚,邓 静,周文强,等.芒果苷对 Hep G2.2.15细胞-arrestins信号通路影响的研究[J].中药药理与临床,2011,27(2):22-24.
[13]Muruganandan SL,Gupta PK.Immunotherapeutic effects of mangiferinmediated by the inhibition of oxidative stress to activated lymphocytes,neutro-phils and macrophages[J].Toxicology,2005,215(1-2):57-68.
[14]邓家刚,杨 柯,阎 莉,等.芒果苷对免疫抑制小鼠T淋巴细胞增殖的影响[J].中药药理与临床,2007,23(5):64-65.
[15]Rajendran P,Jayakumar T,Nishigaki I,et al.Immunomodulatory effect of mangiferin in experimental animals with benzo(a) pyrene-induced lung car-cinogenesis[J].Int J Biomed Sci,2013,9(2):68-74.
[16]张富东,高丽辉,冯国华,等.h SGLTs-CHO-K1稳定转染细胞株的建立及芒果苷对SGLTs转运蛋白表达的影响[J].中国药理学通报,2013,29(4):553-556.
[17]Mahali SK,Manna SK.Beta-D-glucoside protects against advanced glyca-tion end products(AGEs)-mediated diabetic responses by suppressing ERKand inducing PPAR gamma DNA binding[J].Biochem Pharmacol,2012,84(12):1681-1690.
[18]Lin H,Chen R,Liu X,et al.Study on interaction of mangiferin to insulin and glucagon in ternary system[J].Spectrochim Acta A Mol Biomol Spectrosc,2010,75(5):1584-1591.
[19]Malherbe CJ,Willenburg E,De Beer D,et al.Iriflophenone-3-C-gluco-side from cyclopia genistoides:isolation and quantitative comparison of an-tioxidant capacity w-ith mangiferin and isomangiferin using on-line HPLC an-tioxidant assays[J].J Chromattogr B Analyt Technol Biomed Life Sci,2014(951-952):64-171.
[20]程建文,赵劲民.芒果苷抗氧化应激损伤作用的研究进展[J].医学综述,2013,19(23):4233-4235.
[21]吴 雪,杨 东,葛红岩,等.总黄酮对过氧化氢诱导的晶状体氧化损伤的保护作用[J].中华临床医师杂志,2011,5(15):4438-4444.
[22]He L,Peng X,Zhu J,et al.Mangiferin attenuate sepsis-induced acute kidney injury via antioxidant and anti-inflammatory effects[J].Am J Nephrol,2014,40(5):441-450.
[23]宋浩铭,容 庭,刘志昌,等.响应曲面法优化芒果叶中总黄酮的超声提取工艺[J].广东农业科学,2016,43(2): 116-122.
[24]邓东明,刘文得,刘小星,等.不同采收期的芒果叶中总黄酮的变化规律研究[J].中国当代医药,2013,20(6):74-75.
[25]唐玉莲,黎海妮,刘海花,等.芒果叶中总黄酮的提取及含量测定[J].右江民族医学院学报,2006,28(1):8-10.
[26]邓家刚,曾春晖.芒果叶及芒果苷30年研究概况[J].广西中医学院学报,2003,6(2):44-49.
[27]吴素仪,丘泰球,范晓丹.超声波在中草药有效成分提取应用中的研究进展[J].江苏中医药,2008,40(7):93-94.
[28]万水昌,王志祥,乐 龙,等.超声提取技术在中药及天然产物提取中的应用[J].西北药学杂志,2008,23(1):60-62.
Optimization of Extraction Technology of Total Flavonoids from Mangifera Indica Leaves
Zhang Fan,Chen Yue,Hou Wenhao,Deng Guowen,Liu Xiaoxing,Zhou Chengyan
(Department of Pharmacy,Hebei University,Baoding,Hebei,China 071000)
Objective To optimize the extraction process of total flavonoids,and provide a scientific basis for further development and utilization ofMangifera Indica leaves.M ethods Baise Mangifera Indica leaves as raw materials,the common ethanol extraction and ultrasonic extraction method were used,single factor test and orthogonal test were used,the effects of alcohol concentration,liquid-solid ratio,extraction temperature and extraction time on the extraction of total flavonoids were analyzed,and the yield of total flavonoids as index,the extraction process optimization.Results The optimum ethanol refluxing method for temperature was 100℃,the time was 2 h, the ratio of liquid to solid was 10,the times of extraction was 3.The optimum ultrasonic extraction method for temperature was 50℃, the time was 35 min,the ratio of liquid to solid was 10,the times of extraction was 3.Conclusion The best extraction process of total flavonoids from Mangifera Indica leaves is ethanol refluxing method.
total flavonoids;single factor experiment;orthogonal test;extraction technology
2017-04-10)
10.3969/j.issn.1006-4931.2017.15.002
2016年“挑战杯”河北大学课外学术科技作品竞赛项目[ZR038];2016年河北大学大学生创新创业训练计划项目[2016182]。
张帆(1993-),女,大学本科在读,研究方向为中药提取分离和制剂,(电子信箱)1935373658@qq.com。
周程艳(1976-),女,博士研究生,副教授,研究方向为中草药新药开发与研究,(电话)0312-5971107(电子信箱)893927534@qq.com。
TQ460.6;R284.2
A
1006-4931(2017)15-0005-06
