HPLC测定双向固体发酵过程中人参皂苷成分的变化
2017-09-11杨慧萍李轩
杨慧萍,李轩
(1.新疆伊犁哈萨克自治州伊宁市友谊医院药剂科,新疆 伊宁 835000;2.新疆伊犁哈萨克自治州中医院药剂科,新疆 伊宁 835000)
HPLC测定双向固体发酵过程中人参皂苷成分的变化
杨慧萍1,李轩2
(1.新疆伊犁哈萨克自治州伊宁市友谊医院药剂科,新疆 伊宁 835000;2.新疆伊犁哈萨克自治州中医院药剂科,新疆 伊宁 835000)
目的:研究人参在双向固体发酵过程中,不同发酵时间下人参菌质中人参皂苷Re、Rg1、Rh1、Rb1、Rf、Rd及人参总皂苷的含量变化情况。方法:采用高效液相色谱法测定各发酵时间下人参菌质中人参总皂苷以及上述6种人参皂苷的含量。结果:随着发酵时间的延长,人参皂苷Re、Rg1、Rb1的含量总体呈降低趋势,人参皂苷Rd、Rh1的含量总体呈上升趋势,人参总皂苷的含量有所减少。结论:随着发酵时间的延长,人参皂苷含量发生变化,人参皂苷发生了转化。
人参皂苷;高效液相色谱法;双向固体发酵
人参为五加科植物人参的干燥根和根茎,首见《神农本草经》中,列为上品,具补五脏、定魂魄、除邪气、安精神、明目益智等功效[1]。人参在现代临床上对疾病防预和人体滋补强壮方面具有很好效果,可用其治疗四肢冰冷、心力衰竭、脉象虚弱以及休克等疾病[2]。随着人们对人参不断地深入研究,人参中的活性成分及其药理作用逐渐地被发现[3]。研究表明,人参中主要有效成分为人参皂苷,约占4%,且到目前,已分析鉴定出的人参皂苷单体达40余种[4]。通过国内外的学者们对人参皂苷药理活性的研究,发现其药理作用主要集中于抑制癌细胞的转移、诱导细胞的凋亡、抗突变、保护心脑血管和增强免疫功能等[5],通常对于二醇组皂苷来说药理活性的不同是由于皂苷分子结构中的糖基侧链不同所致[6]。然而,野生人参药用资源极为稀少,采用人工栽培技术的周期较长且成本高,其药材价格不断升高等因素极大地限制了对人参的研发和应用[7]。近年来,采用一些新技术,如微生物转化、化学合成、组织培养等,能更高更快地获取目标化合物,成为一种有效的获取资源途径[8]。对于人参皂苷来说,利用生物体外转化则能有效地改变其糖链结构,从而提高稀有活性皂苷的含量,具有一定的经济价值[9]。固体发酵是人参皂苷体外转化的一种常用方法,该过程是双向发酵的过程,一方面人参药材作为基质为菌体提供营养,另一方面菌体代谢产生的酶将原有的人参皂苷进行结构修饰转化为活性更高的稀有人参皂苷,此方法工艺比较简单,质量易控制,产率较高,适合于工业大生产[10]。
本实验采用高效液相色谱法测定不同发酵时间下人参菌质中人参皂苷Re、Rg1、Rh1、Rb1、Rd、Rf及人参总皂苷的含量。此方法测定人参皂苷含量具有快速、简单、特征性良好等特点[11],可作为人参药材质量控制的重要指标[12]。为人参药材生物转化的质量控制提供实验依据和参考。
1 材料与仪器
人参产自吉林长白山地区,主要试剂:人参皂苷标准品(Re、Rg1、Rh1、Rb1、Rf、Rd购于中国药品生物制品检定所);甲醇、乙腈为色谱纯,水为蒸馏水,其余试剂为分析纯。HH-4型数显恒温水浴锅(金坛市江南仪器厂);十万分之一电子天平(德国Sartorius公司);万分之一天平(梅特勒-托利多仪器公司);立式压力蒸汽菌器HYXQ-LS-50A(上海博迅实业有限公司);KQz3200E型超声波清洗机(天鹏电子新技术有限公司);安捷伦-1260高效液相色谱仪(美国安捷伦公司);色谱柱InertsilODS-SP(5 μm,4.6 mm×250 mm,GL Sciences lnc);DIF-6090型真空干燥箱(上海一恒实验仪器总厂);SZ-97型自动纯水蒸馏器(上海亚蓉仪器厂)。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 精密称取对照品人参皂苷Re、Rg1、Rh1、Rb1、Rf、Rd,加甲醇制成每1 mL各含0.2 mg的混合溶液,摇匀,即得。
2.1.2 供试品溶液 取本品粉末(过四号筛)约1 g,精密称定,置索氏提取器中,加三氯甲烷加热回流3 h,弃去三氯甲烷液,药渣挥干溶剂,连同滤纸筒移入100 mL锥形瓶中,精密加水饱和正丁醇50 mL,密塞,放置过夜,超声处理(功率250 W,频率50 kHz)30 min,滤过,弃去初滤液,精密量取续滤液25 mL,置蒸发皿中蒸干,残渣加甲醇溶解并转移至5 mL量瓶中,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得[13]。
2.2 色谱条件
以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以水为流动相B,按表1中的规定进行梯度洗脱;检测波长为203 nm;柱温30℃;流速1.0 mL/min。理论板数按人参皂苷Rg1峰计算应不低于6 000[13]。
2.3 线性关系试验
精密吸取对照品人参皂苷Rg1、Re、Rb1溶液2,5,7,10,13 μL;精密吸取对照品人参皂苷Rh1、Rf、Rd溶液2,4,8,10,12,20 μL,按上述色谱条件测定峰面积值。以峰面积的积分值为纵坐标Y,以标品人参皂苷Rg1、Re、Rb1、Rh1、Rf、Rd的进样量为横坐标X,绘制标准曲线,见表1。
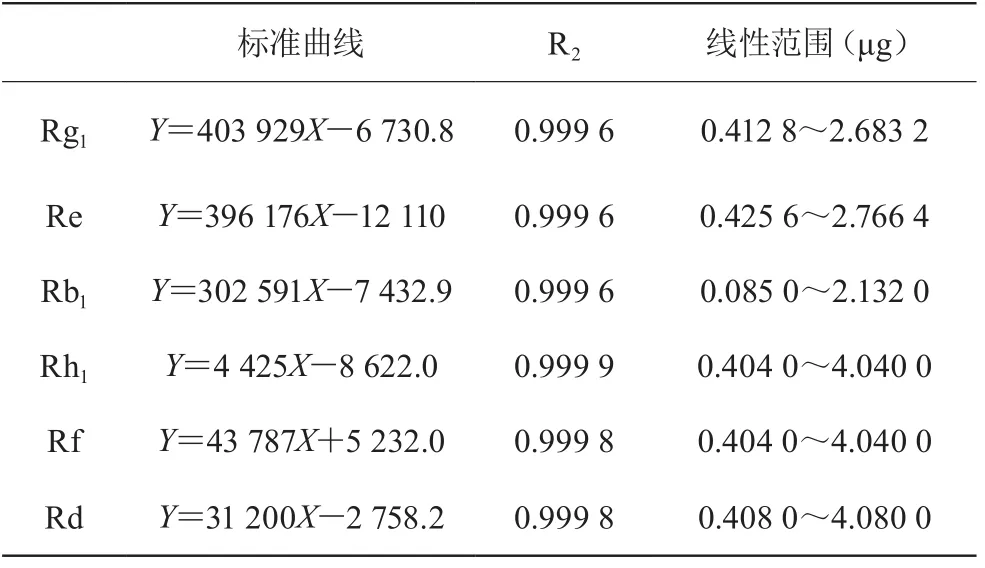
表1 人参皂苷Rg1、Re、Rb1、Rh1、Rf、Rd标准曲线
2.4 精密度试验
精密吸取对照品溶液10 μL,按上述色谱条件重复进样6次,得其峰面积。结果为人参皂苷Rg1、Re、Rb1、Rh1、Rf、Rd对照品的RSD分别为0.95%,0.73%,0.98%,1.97%,1.71%,1.74%,表明精密度良好。
2.5 稳定性试验
精密吸取人参皂苷Rh1、Re、Rg1、Rb1、Rf、Rd对照品溶液与供试品溶液各10 μL,按上述色谱条件,测定24 h内峰面积值,对照品中人参皂苷Re、Rg1、Rb1、Rh1、Rf、Rd的RSD为0.87%,0.59%,1.57%,2.94%,2.42%,2.30%;供试品中人参皂苷Re、Rg1、Rh1、Rb1、Rf、Rd的RSD为0.99%,1.40%,1.70%,2.80%,2.22%,2.73%,表明稳定性良好。
2.6 重复性试验
取发酵粉末6份,每份1 g,精密称定,按供试品溶液项下依法测定,取10 μL,按上述色谱条件,测定峰面积,并代入相应标准曲线,计算人参皂苷Re、Rg1、Rh1、Rb1、Rf、Rd的含量。试验结果为人参皂苷Rg1、Re、Rb1、Rh1、Rf、Rd精密度的RSD为 2.71%,2.68%,2.97%,0.77%,2.30%,2.57%,表明重复性好。见表2。
2.7 回收率试验
精密称取样品0.5 g,加入适量人参皂苷Rh1、Re、 Rg1、Rb1、Rf、Rd对照品,依法制备及测定,并计算加样回收率。试验结果为人参皂苷Re、Rg1、Rh1、Rb1、Rf、Rd平均加样回收率的为100.4%,102.66%,96.83%,96.4%,98.94%,99.29%;其RSD%分别为2.15%,1.52%,1.01%,1.46%,2.47%,2.84%表明准确性良好。见表3。
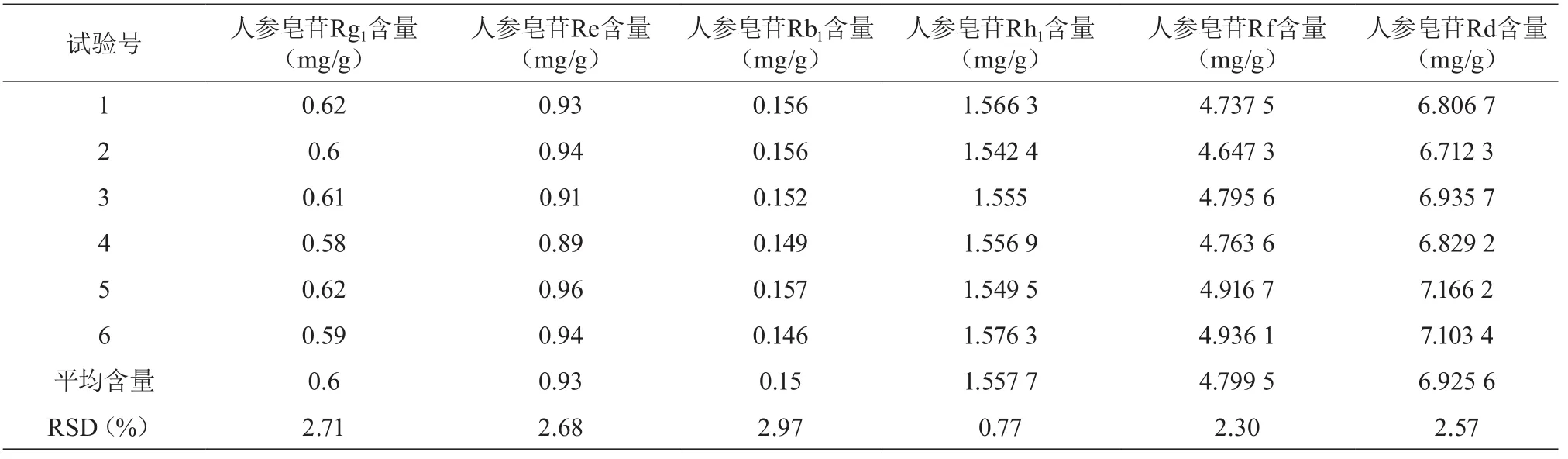
表2 重复性试验
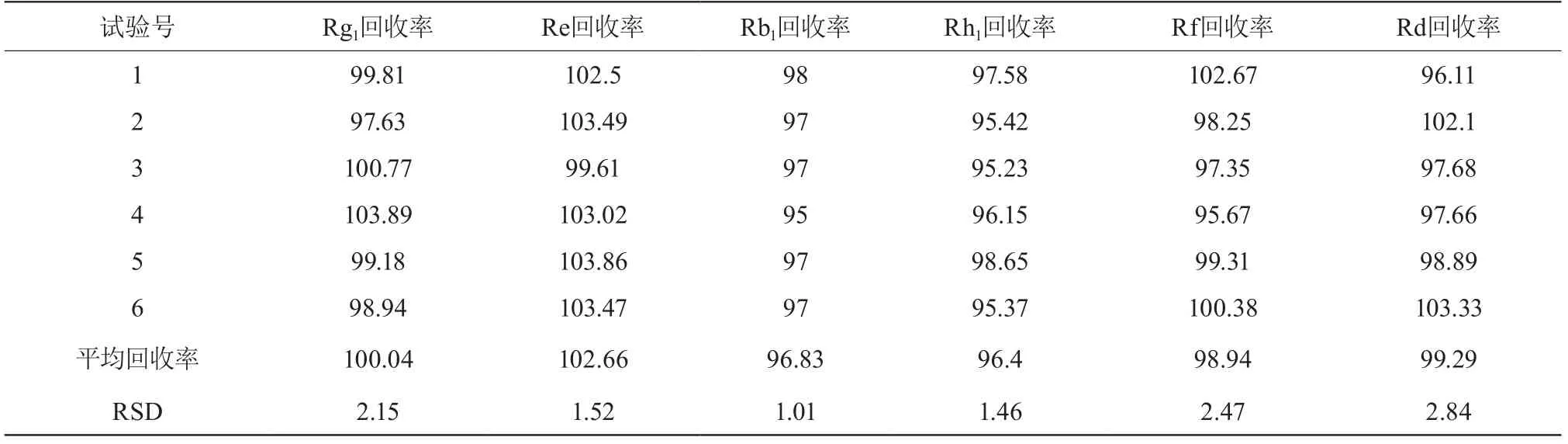
表3 回收率试验 (%)
2.8 人参总皂苷的含量测定
2.8.1 对照品溶液的制备 取人参皂苷Re对照品适量,精密称定,加甲醇制成每1 mL含1 mg的溶液,即得。
2.8.2 标准曲线的制备 标准品溶液的制备:取人参皂苷Re对照品适量,精密称定,加甲醇制成每1 mL含0.1 mg的溶液,即得。
2.8.3 人参药材供试品溶液的制备 取人参粉末(过60目筛)约1 g,精密称定,置索氏提取器中,加三氯甲烷回流3 h,弃去三氯甲烷液,药渣挥干溶剂,连同滤纸筒放入锥形瓶中,精密加入50 mL水饱和正丁醇液,超声处理30 min,冷却,过滤,精密吸取续滤液25 mL,蒸干。残渣加10 mL水溶解,通过已处理好的D101大孔树脂柱(12 cm×1.5 cm),吸附1 h,先用100 mL蒸馏水洗脱,弃去水液,再用70%乙醇100 mL洗脱,收集洗脱液蒸干。残渣加甲醇溶解,定容于50 mL量瓶中,即得。
2.8.4 发酵产物供试品溶液的制备 取发酵产物粉末(过60目筛)1 g,置于索氏提取器中,加三氯甲烷回流3 h,弃去三氯甲烷液,药渣挥干溶剂,连同滤纸筒放入锥形瓶中,精密加入50 mL水饱和正丁醇液,超声处理30 min,冷却,过滤,精密吸取续滤液25 mL,蒸干。残渣加10 mL水溶解,通过已处理好的D101大孔树脂柱(12 cm×1.5 cm),吸附1 h,先用100 mL蒸馏水洗脱,弃去水液,再用70%乙醇100 mL洗脱,收集洗脱液蒸干。残渣加甲醇溶解,定容于50 mL量瓶中,即得。
2.8.5 测定方法 精密吸取本品0.6 mL,按“2.8.2”项下的方法,自“置于具塞试管中”起依法操作,测定吸光度,从标准曲线上读出供试品溶液中人参皂苷Re的量,计算结果乘以0.84,即得[13]。 2.8.6 实验结果 各发酵终点时人参皂苷Re、Rg1、Rh1、Rb1、Rf、Rd及人参总皂苷含量,见表4。
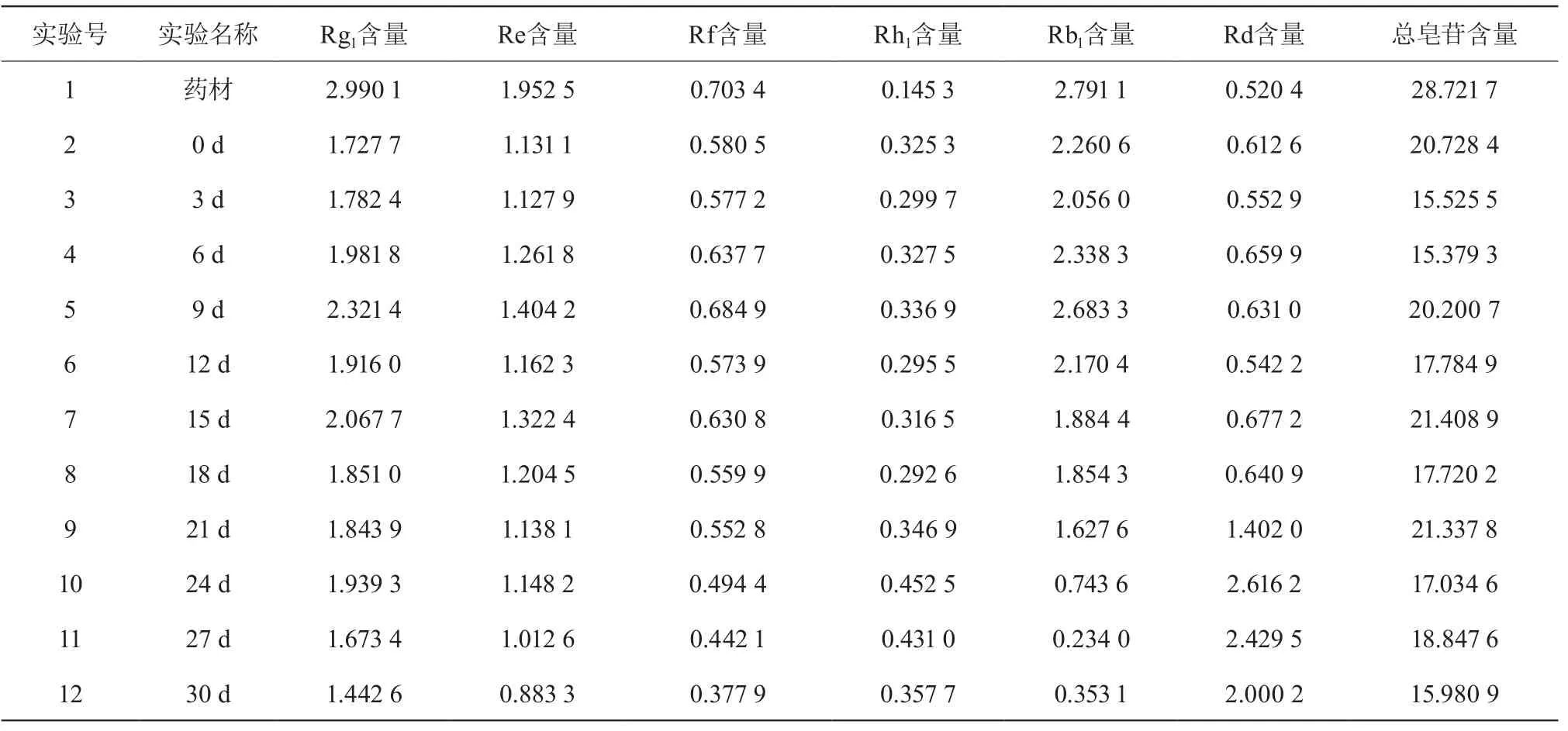
表4 人参皂苷及其总皂苷含量 (mg/g)
3 结论
3.1 实验数据表明:人参在双向固体发酵的过程中,人参皂苷的含量发生了变化,人参皂苷Rd发酵9 d后含量明显升高,发酵24 d时含量达到最高;人参皂苷Rh1含量总体有所升高;人参皂苷Re、Rf、Rg1、Rb1的含量总体呈下降趋势,其中Rb1下降趋势较明显,Rf含量无明显变化;人参总皂苷的含量总体有所减少;发酵过程中人参皂苷有部分发生转化。
3.2 近年来,人参的体外转化技术越来越受到人们的关注,然而相比细菌、酶催化的方法,使用真菌进行发酵具有操作简单、成本低廉的优势[14]。本实验采用高效液相色谱法来测定人参在固体真菌发酵的过程中,不同发酵时间下人参菌质中人参皂苷的含量情况,总结出人参双向发酵后6个人参皂苷及人参总皂苷的含量变化,为人参药材生物转化研究的质量控制提供实验依据,为人参产品的研发和使用提供参考。
从实验数据上可以看出,经过不同的发酵时间,人参皂苷的含量发生了变化,这种转化有利于获取更高含量的目标产物。其中值得特别关注的是人参皂苷Rd在发酵的过程中含量不断升高,24 d时含量达到最高,这说明在此发酵条件下有利于提高人参皂苷Rd的含量。Rd为稀有人参皂苷,其在植物体内含量较低,肠道酶可以将Rb1代谢为Rd[15]。其药理作用广泛,除与其他人参皂苷相似之处之外,还具有一些独特的药理作用。其主要药理作用有保护心脑血管、清除自由基、抗衰老、调节免疫、抗肿瘤等方面。
从数据还可发现,人参皂苷Rb1的含量明显下降,可以推测,在此发酵过程中在菌体代谢产生的酶的作用下人参皂苷Rb1转化为了Rd。
[1] 张均田.人参研究的最新进展[J].江苏大学学报(医学版),2009,19(3):185-191.
[2] 范莎莎,王楠.人参的药用研究[J].长春中医药大学学报,2014,30(5):825-826.
[3] 黎阳,张铁军,刘素香,等.人参化学成分和药理研究进展[J].中草药,2009,40(1):164.
[4] 石楸鸣.人参皂苷的药理作用研究进展[J].中国药房,2010,21(31):2967-2969.
[5] 刘欣,杨凌,崔昱.人参皂甙的活性综述[J].中国微生态学杂志,2005,17(1):76.
[6] Chen X,Zhou QL,Wang BX. The metablisim of ginsenoside Rb1 by intestinal Bacteria[J].Acta Pharm Sin, 1999,34(6):410-414.
[7] 张瑜,陈照宇,都晓伟.真菌固体发酵提高人参药材中皂苷含量的研究[J].中医药学报,2015,43(2):85-87.
[8] 杨金玲,高丽丽,朱平.人参皂苷生物合成研究进展[J].药学学报,2013,48(2):170-178.
[9] 崔玉娜,张怡轩,赵余庆.利用生物转化法制备稀有人参皂苷的研究进展[J].中草药,2009,40(5):676-680.
[10] 张洋婷,郗艳丽,白春燕,等.人参皂苷体外转化和分析方法的研究进展[J].吉林医药学院学报,2015,36(2):121-124.
[11] 郑重,宋凤瑞,刘淑莹,等.人参、红参皂苷类成分指纹图谱研究[J].质谱学报,2012,33(6):327-333.
[12] 胥秀英,郑一敏,傅善权,等.HPLC同时测定人参药材中12种人参皂苷的含量[J].中国中药杂志,2011,36(11):1463-1465.
[13] 国家药典委员会.中华人民共和国药典(2010年版)一部[S].北京:中国医药科技出版社,2005:20.
[14] 杨元超,王英平,闫梅霞,等.人参皂苷compound K转化菌株的筛选[J].中国中药杂志,2011,36(12):1596-1598.
[15] Odani T,Tanizawa H,Takino Y.Studies on the absorption,distribution, excretion and metabolism of ginseng saponins. Ⅳ.Decomposition of ginsenoside-Rgland-Rb1in the digestivetract of rats[J].Chem Pharm Bull,1983,31(10):3691-3697.
本文编辑:鲁守琴
Determine Changes of Ginsenoside Components During Bidirectional Solid Fermentation Course by HPLC-ELSD
Yang Hui-ping1, Li Xuan2
(1.Department of Pharmacy, The Friendship Hospital of Yining City, Kazak Autonomous Prefecture of Yili in Xinjiang, Xinjiang Yining 835000, China; 2. Department of Pharmacy, the Chinese Medicine Hospitall of Yining City, Kazak Autonomous Prefecture of Yili in Xinjiang, Xinjiang Yining 835000,China)
Objective:Study the influence on ginsenosides Re, Rg1, Rh1, Rb1, Rf, Rd and the content of total saponins of Panax ginseng under different fermentation time during the bidirectional solid fermentation course. Methods:Using HPLC to measure the content of total saponins of panax ginseng and above 6 ginsenosides which under different fermentation time. Results:With the extension of the fermentation time, the content of ginsenosides Re, Rg1, Rb1were overall gradually decreasing, the content of ginsenoside Rd, Rh1were overall gradually increasing, and the content of total saponins of panax ginseng was decreased. Conclusion:With the prolongation of fermentation time, the content of ginsenosides was changed, and the transformation was happened.
Ginsenoside; HPLC; Bidirectional Solid Fermentation
R284.1
A
10.3969/j.issn.2096-3327.2017.07.021
2017 - 04 - 19
杨慧萍,女,主管药师。研究方向:临床药学。E-mail:yhp6222@163.com
李轩,女,药师。研究方向:临床药学。E-mail:yhp6222@163.com
