猪肝脏体外劈离过程中常温机械灌注保存装置的建立及评价
2017-09-08张志斌高伟史源陈静郑虹沈中阳天津市第一中心医院器官移植中心天津市器官移植临床医学研究中心天津30092天津市器官移植重点实验室天津30092卫生部危重病急救医学重点实验室天津30092
张志斌 ,高伟 ,史源 ,2,3,陈静 ,2,3,郑虹 ,2,3,沈中阳 ,2,3(.天津市第一中心医院器官移植中心,天津市器官移植临床医学研究中心,天津 30092;2.天津市器官移植重点实验室,天津 30092;3.卫生部危重病急救医学重点实验室,天津30092)
肝病是我国人群高发疾病之一,肝病患者基数庞大,肝移植目前已经成为治疗终末期肝病的唯一有效手段。但随着肝脏移植患者数量的不断增加,供体短缺问题越来越严重,已成为世界性难题。美国器官分配网络(United Network for Organ Sharing,UNOS)及欧洲肝脏移植注册登记系统显示,约有20%的患者在等待移植过程中死亡[1-2]。中国肝移植注册系统(China Liver Transplant Registion,CLTR) 统计显示,我国每年因肝病死亡的患者数量约为50万,供体缺乏是制约肝移植发展的最主要问题之一,如何扩大供体来源是目前亟需解决的问题。
劈离式肝移植是基于肝脏奎诺功能性分段的理论,将完整的供肝分割成2个或2个以上的解剖功能单位分别移植给不同受者,达到“一肝两受”或“一肝多受”,是扩大供体来源的主要手术方式之一[3]。理论上讲,86%的供肝可用于劈离式肝移植手术,而我国只有0.4%的供肝用于劈离式肝移植手术。随着技术的不断进步,长期随访结果显示,劈离式肝移植与尸体全肝移植存活率差异无统计学意义[4]。积极开展劈离式肝移植手术,必然可使有限的供体资源得到充分的利用。1988年,Pichlmayr等[3]首次报道了劈离式肝移植手术,随后这一术式在欧洲、美洲、亚洲的各大移植中心相继开展,并且取得了与全肝移植相似的生存效果[5]。与尸体全肝移植相比,劈离式肝移植供肝体外劈离过程延长了供肝冷保存时间,加重了缺血/再灌注损伤,研究表明,供肝的冷热缺血时间严重影响肝移植的预后,冷缺血时间过长与移植物原发无功和术后胆道并发症直接相关,且冷缺血时间会对肝再生产生影响[6]。美国UNOS数据显示,缺血时间大于6小时与小于6小时差异有统计学意义[7]。而小体积移植肝损伤所致小肝综合征的主要原因为供肝缺血/再灌注损伤以及供肝体积偏小所致移植术后门静脉超灌注以及肝脏再生功能降低。
本研究利用体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)的原理,构建自己的常温机械灌注(normothermic machine perfusion,NMP)体系,并通过对巴马小型猪肝脏灌注保存过程中进行劈离,验证其效果及稳定性。
1 材料和方法
1.1 实验动物及方法:健康巴马小型猪4只,雌雄不限,12个月龄以上,体重30~35 kg,由解放军军事医学科学院实验动物中心提供。
本实验中动物处置方法符合动物伦理学标准。
1.2 供肝切取手术:麻醉后将小型猪取仰卧位固定于手术台上,取上腹部正中纵行切口,长度30~35 cm,上端达剑突水平,逐层切开皮肤、皮下组织及腹白线入腹,放置腹腔自动拉钩,充分暴露手术野。以电刀游离切断肝镰状韧带、肝胃韧带、左三角韧带、右三角韧带以及下腔静脉与后腹壁之间的韧带。解剖肝十二指肠韧带,于肝十二指肠韧带下缘以电刀切开其表面腹膜,游离、切断胆总管,近肝侧插入胆管引流管。切断结扎肝十二指肠韧带内的神经结缔组织,解剖出肝动脉及门静脉,向近心端游离肝动脉至腹主动脉根部,游离门静脉至脾静脉与肠系膜上静脉汇合处。向下游离下腔静脉达肾静脉水平。切除胆囊。经颈静脉快速补液,经颈动脉采血约1 000 ml备用。向肝动脉、门静脉近肝端分别插入肝动脉、门静脉灌注管路,然后常温下迅速离断肝动脉、门静脉、肝上下腔静脉及肝下下腔静脉,快速切取肝脏,连接NMP装置开始灌注保存。NMP保存液的成分见表1。
1.3 NMP保存装置的连接及运行:NMP装置连接示意图见图1,实物图见图2。开始灌注之前,灌注管路内用灌注保存液预充,排除管路中的气泡,调节数显控温水浴箱温度在40~42℃之间。肝脏切取之后快速连接灌注管路开始进行NMP,氧气流量控制在1~2 L/min,通过蠕动泵和限流阀调节门静脉灌注压力在8~10 mmHg(1 mmHg=0.133 kPa),肝动脉灌注压力在80~100 mmHg。以微量注射泵持续向灌注液中泵入肝素1 000 U/h,胰岛素6~10 U/h,每小时向灌注液中加入5%葡萄糖10 ml及复合氨基酸10 ml,根据灌注液中葡萄糖水平调节胰岛素及葡萄糖用量。每小时监测血气及电解质水平,根据结果调节酸碱平衡及电解质紊乱。在劈离过程中,监测门静脉、肝动脉流量及压力,通过调整总的灌注流量及压力比例调节器以保证门静脉、肝动脉压力维持稳定。

表1 NMP保存液的成分
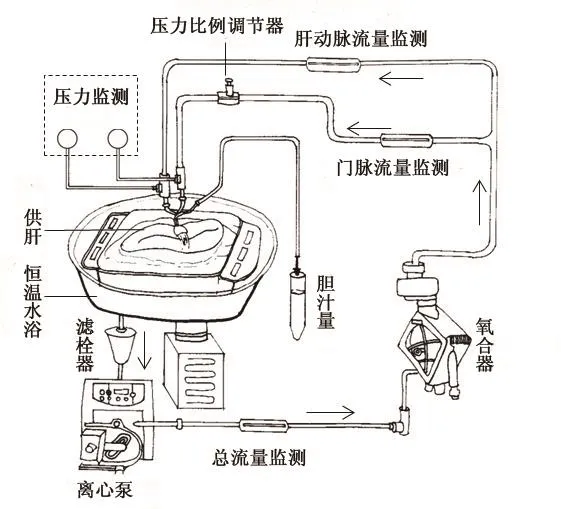
图1 NMP装置连接示意图(箭头方向代表血流方向)
1.4 供肝NMP过程中劈离(图3):将肝脏平铺于灌注容器内,暴露肝脏膈面、肝上下腔静脉。沿肝正中裂劈离。沿切开线用刀片锐性切开肝包膜,依次结扎管道组织,门静脉左外侧支采用粗线结扎,直至断面剩下肝左静脉,门脉钳子钳夹肝左静脉起始部,于钳子左侧切断肝左静脉,移除左半肝,5-0 Prolene线连续缝合。5-0 Prolene线继续缝合肝脏断面撕裂小血管处,采用双极电凝对肝组织止血。仔细检查劈离面,确保无渗血、胆瘘。

图2 NMP装置
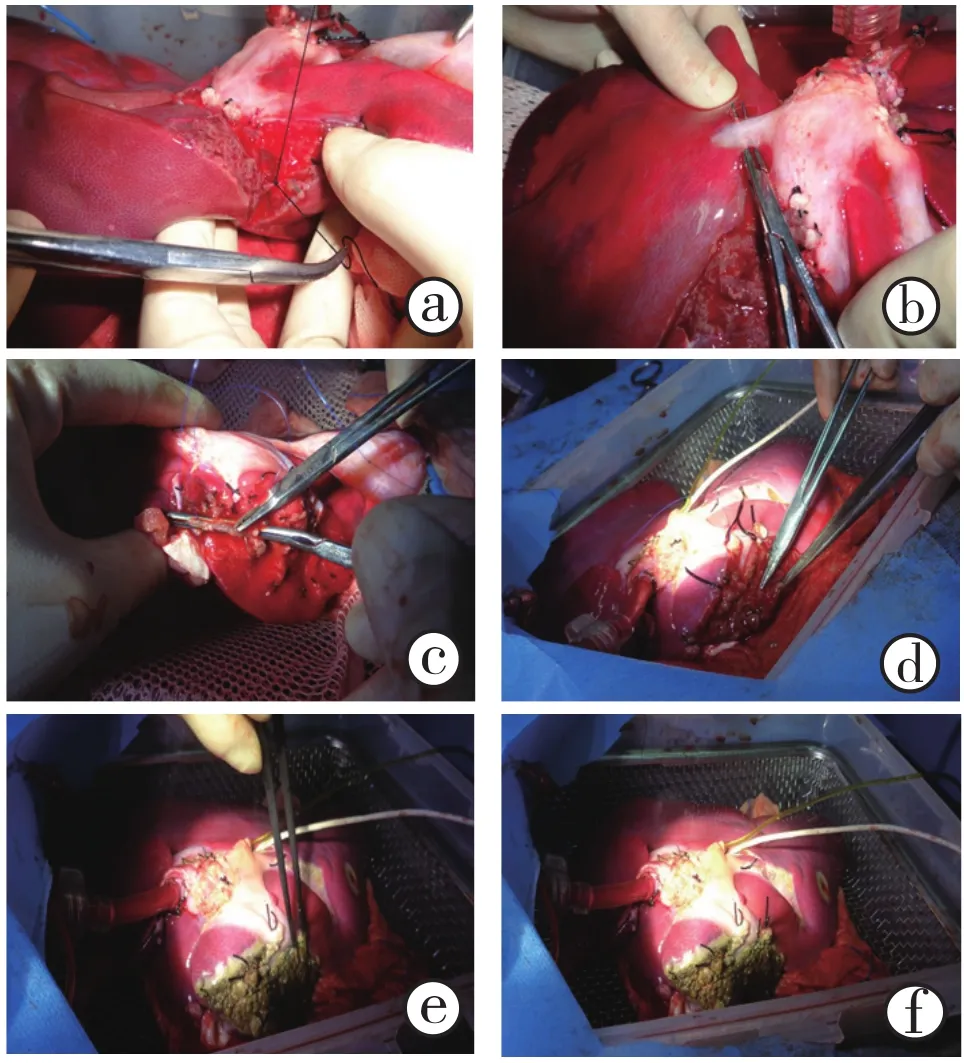
图3 供肝常温机械灌注过程中劈离
1.5 观察指标及方法:通过压力传感器、温度传感器和多导生理记录仪测量灌注期间门静脉和肝动脉的压力以及肝脏保存温度(图4),通过超声血流仪测量门静脉和肝动脉的血流量(图5);分别于供体下肝前、劈离前、劈离中、劈离后取保存液检测pH值、PO2、乳酸、HCO3-、Na+、K+等血气及电解质指标,检测采用GEM Premier 3 000血气电解质分析仪进行;记录供体下肝前、劈离前、劈离中、劈离后每小时胆汁分泌量;分别于供体下肝前、劈离前、劈离中、劈离后取灌注液检测丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、乳酸脱氢酶(lactate dehydrogenase, LDH)、乳酸等生化指标,评价肝脏损伤程度及功能,检测方法采用常规生化学方法,由天津市第一中心医院检验科使用LWC-320全自动生化分析仪协助完成;肝组织常规病理检查:分别于NMP保存前及保存后劈离前、劈离后取1 cm×1 cm×0.5 cm大小的肝脏组织置于10%中性甲醛溶液固定,经组织脱水、常规石蜡包埋、切片、HE染色等步骤,进行阅片。
图4 压力和温度监测

图5 门静脉和肝动脉血流量监测
1.5 统计分析:使用SPSS 20.0统计软件进行分析。计量资料数据以均数±标准差(±s)表示,各组样本均数比较使用t检验及方差分析。计数资料比较使用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 保存劈离期间门静脉和肝动脉的压力和流量及保存温度(表2):供肝灌注保存劈离期间持续监测门静脉和肝动脉的压力和流量及肝脏保存温度发现,随着劈离的进行,门静脉压力升高但仍控制在8.75~9.75 mmHg,肝动脉压力变化不明显,维持在92.00~92.75 mmHg;在劈离过程中,随着调整后总灌注流量的降低,门静脉及肝动脉流量均降低,门静脉流量从劈离前的(455.00±107.55) mmHg降至劈离后的(392.50±125.27)mmHg,肝动脉流量从劈离前的(180.75±59.46)mmHg降至劈离后的(126.25±6.99)mmHg;肝脏保存温度劈离前相对较低(37.45±0.33)℃,随着劈离的进行,持续的加温,稳定控制在38.83~38.93℃。
2.2 保存劈离期间的血气及电解质等指标变化(表3):劈离前,保存液的pH值(7.24±0.10)较基础值(7.50±0.08)降低,随着劈离的进行,pH值逐渐升高,劈离结束后pH值(7.60±0.13)略高于基础值;PO2在保存劈离过程中相对稳定,维持在482.25~521.00 mmHg,较基础值明显增高;HCO3-劈 离 前(10.10±5.04) mmol/L较 基 础 值(24.05±0.31)mmol/L明显降低,随着劈离的进行,HCO3-逐渐升高(16.15±13.22 mmol/L),劈离结束后,HCO3-为(14.55±13.14)mmol/L;Na+在保存劈离过程中相对稳定;K+在保存劈离过程中逐渐升高,从基础值(3.45±0.33)mmol/L升高至劈离结束后的(4.98±1.12)mmol/L;乳酸在劈离前(2.86±1.77) mmol/L较基础值(3.85±2.58) mmol/L有所降低,随着劈离的进行直到劈离结束后,乳酸逐渐升高至(6.00±3.73)mmol/L。
2.3 每小时胆汁分泌量(表4):经胆管引流管引流胆汁,分别记录供体下肝前、劈离前、劈离中、劈离后的胆汁量,记录每小时胆汁分泌量。保存劈离期间随着劈离的进行,胆汁分泌量逐渐减少,劈离前(16.75±3.30)ml/h,劈离中(10.55±1.83) ml/h,劈离后(6.53±1.33) ml/h。
2.4 保存劈离期间灌注液ALT、AST、LDH、ALP等生化指标(表4):灌注保存的开始,ALT处于较基础值 (48.93±12.40) U/L的低水平(17.40±7.47)U/L,随着劈离的进行,ALT水平逐渐增高,劈离结束后ALT维持在(70.48±22.41) U/L;AST在灌注保存开始时的水平(89.28±56.59) U/L和基础值(74.10±30.30) U/L接近,随着劈离的进行,AST水平逐渐增高,劈离中(444.55±258.03)U/L,劈离后(647.50±221.89) U/L;LDH与ALT的变化趋势相似,基础值维持在(452.04±115.52)U/L,劈离前、劈离中、劈离后分别为(149.13±52.89)U/L、(361.75±142.70)U/L、(493.98±110.62)U/L。ALP在劈离前(14.80±4.05) U/L处于较基础值的低水平(62.00±14.69) U/L,在劈离进行的过程中,ALP始终维持在一个较低的水平,劈离中(17.33±3.95)U/L,劈离后(14.85±2.61) U/L。
2.5 肝组织常规病理检查:NMP保存前和保存劈离后分别取肝组织。光镜下见保存劈离后肝组织汇管区结构正常,未见粒细胞、淋巴细胞浸润(图6a),肝组织结构基本正常,肝窦内无淤血及血栓形成,肝细胞无明显空泡变性及坏死(图6b)。与保存前比较(图6c、图6d),NMP保存劈离后肝组织细胞结构无明显改变。
表2 NMP保存劈离期间的压力、流量和温度变化(±s)
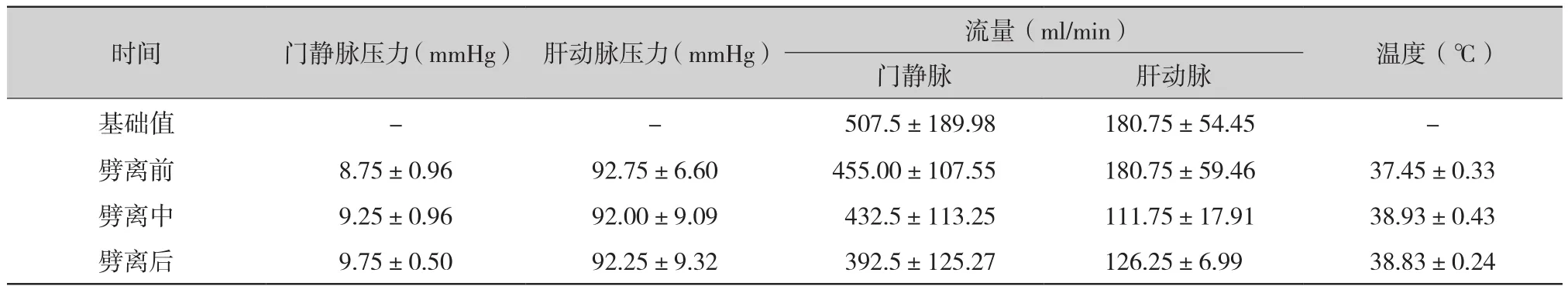
表2 NMP保存劈离期间的压力、流量和温度变化(±s)
时间 门静脉压力(mmHg) 肝动脉压力(mmHg) 流量(ml/min) 温度(℃)门静脉 肝动脉基础值 - - 507.5±189.98 180.75±54.45 -劈离前 8.75±0.96 92.75±6.60 455.00±107.55 180.75±59.46 37.45±0.33劈离中 9.25±0.96 92.00±9.09 432.5±113.25 111.75±17.91 38.93±0.43劈离后 9.75±0.50 92.25±9.32 392.5±125.27 126.25±6.99 38.83±0.24
表3 NMP保存劈离期间保存液的血气、电解质等指标变化(±s)
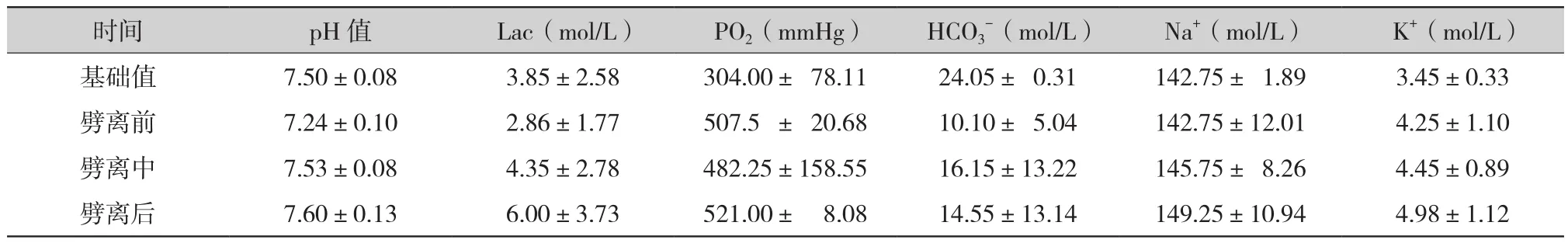
表3 NMP保存劈离期间保存液的血气、电解质等指标变化(±s)
时间 pH 值 Lac(mol/L) PO2(mmHg) HCO3-(mol/L) Na+(mol/L) K+(mol/L)基础值 7.50±0.08 3.85±2.58 304.00± 78.11 24.05± 0.31 142.75± 1.89 3.45±0.33劈离前 7.24±0.10 2.86±1.77 507.5 ± 20.68 10.10± 5.04 142.75±12.01 4.25±1.10劈离中 7.53±0.08 4.35±2.78 482.25±158.55 16.15±13.22 145.75± 8.26 4.45±0.89劈离后 7.60±0.13 6.00±3.73 521.00± 8.08 14.55±13.14 149.25±10.94 4.98±1.12
表4 NMP期间每小时胆汁分泌量和保存液的生化指标变化(±s)

表4 NMP期间每小时胆汁分泌量和保存液的生化指标变化(±s)
注:ALT为丙氨酸转氨酶;AST为天冬氨酸转氨酶;LDH为乳酸脱氢酶;ALP为碱性磷酸酶;NMP为常温机械灌注
时间 胆汁分泌量(ml/h) ALT(U/L) AST(U/L) LDH(U/L) ALP(U/L)基础值 19.00±4.55 48.93±12.40 74.10± 30.30 452.04±115.52 62.00±14.69劈离前 16.75±3.30 17.40± 7.47 89.28± 56.59 149.13± 52.89 14.80± 4.05劈离中 10.55±1.83 51.35±26.73 444.55±258.03 361.75±142.70 17.33± 3.95劈离后 6.53±1.33 70.48±22.41 647.50±221.89 493.98±110.62 14.85± 2.61
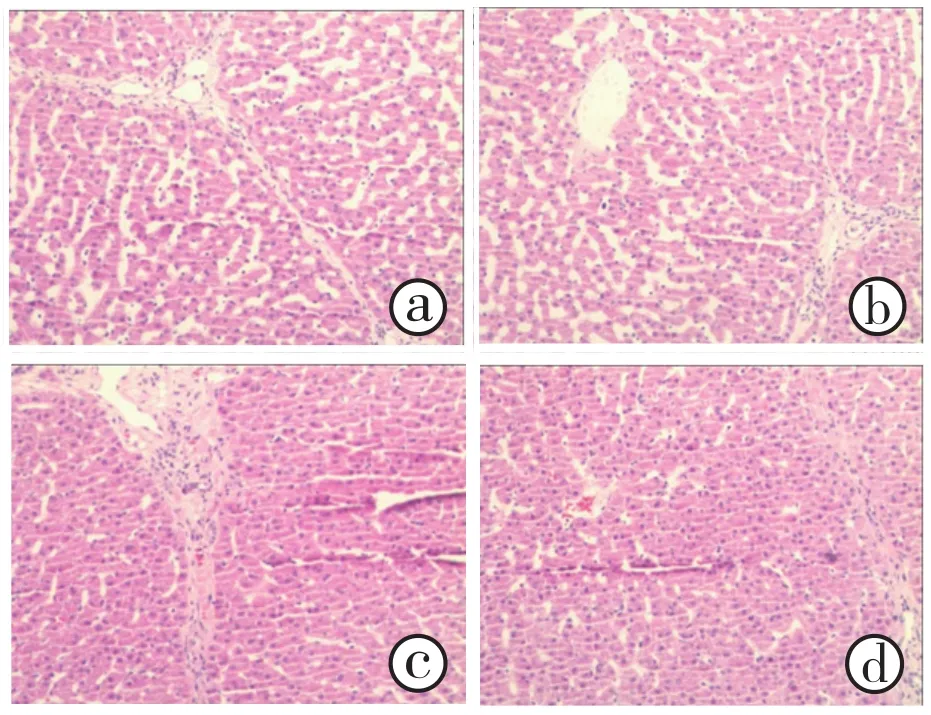
图6 NMP保存前及保存劈离后肝脏组织结构正常a为保存劈离后汇管区结构;b为保存劈离后肝细胞结构;c为NMP保存前汇管区结构;d.NMP保存前肝细胞结构(HE 低倍放大)
3 讨 论
肝脏移植已经成为治疗终末期肝病的唯一方式。然而,随着这项技术的在该领域的日趋成熟与完善,可获得的供体数量无法赶上日益增长的受体数量。为了克服逐渐增长的不平衡,移植中心通过各种方法扩大供肝池,其中包括劈离式肝移植。Nesher等[8]认为与活体肝移植相比,劈离式肝移植胆管及血管并发症的发生率较相对较低,而且劈离式肝移植另一个优点是排除了同活体肝移植相关的潜在的供体并发症和死亡风险。劈离式肝移植分体外劈离和体内劈离[9]。体内劈离同体外劈离相比,具有如下优势:① 减少冷缺血时间;② 更好地辨认胆管和血管组织,确切处理肝断面,减少断面出血及胆瘘的发生;③ 同体外劈离相比减少复温时的损伤[8];④ 可观察肝脏劈离后各肝段的血液供应及回流,以便更合理地分配供肝血管;⑤ 劈离过程中断面止血彻底,当在受体体内再灌注后减少劈离断面的出血[5]。在NMP下劈离模拟体内劈离的方式,可以充分发挥体内劈离的优势。
3.1 NMP保存下劈离灌注液的配置:NMP的灌注液可分为含血液成分和不含血液成分的灌注液,前者又可分为全血和经稀释后的血液。共同点为都具有极好的运输氧气和其他营养物质的能力,并且具有适当的胶体渗透压能够阻止机械灌注期间间质水肿的进展[10]。多数动物实验采用全血或稀释的血液为灌注液。Butler等[11]研究表明,用全血作为机械灌注液灌注狗的肝脏72小时,结果发现没有明显的肝脏损伤。Xu等[12]在猪的DCD肝脏模型中使用的灌注液共2 000 ml,其中包含全血、血浆、激素、胰岛素、抗菌药物及肝素,但该研究并未提及营养物质,保肝药物及其他一些必需物质的添加。Fondevila等[10]在研究中同样使用猪的自体血,另外加入了甘露醇、碳酸氢钠、万汶和乳酸林格液。另外,Perk等[13]在大鼠的DCD肝脏模型中使用了与Fondevila等[10]类似的灌注液,不同的是灌注液中添加了L-谷氨酰胺。然而,在既往研究中并没有完整地提到在生理状态下肝脏所需的全部营养物质、各种物质所占的比例以及确切的用量。Op den Dries等[14]在临床研究中,首次明确提出了灌注液所需的主要成分以及各种成分在灌注液中所占的比例,包括满足一个正常肝脏代谢所需的全部营养物质、氧气和保护性物质,这是一个突破性的进展。究竟哪一种灌注液的效果更佳,目前尚无定论,在既往多数研究中,血液被广泛应用以达到携带氧气的目的,同时在灌注过程中可以在灌注液中加入必要的营养物质(糖、氨基酸)、促进胆汁排泄、预防血栓形成及抗感染等相关药物。
本研究中参考既往的文献报道,将血液稀释后(全血800 ml+0.9氯化钠注射液750 ml),加入抗菌药物 (注射用头孢呋辛钠1.5 g)、水溶性维生素1支、10%氯化钙注射液20 ml、肝素钠注射液5 000 U、10%氯化钾注射液10 ml、胰岛素10 U、地塞米松10 mg、5%碳酸氢钠注射液20 ml、前列地尔注射液10 μg,注射用还原型谷胱甘肽钠600 mg,配制成灌注保存液,并在灌注保存过程中持续泵入肝素(12 500 U+50 ml 0.9氯化钠注射液,4 ml/h)、胰岛素(100单位胰岛素+ 47.5 ml 0.9氯化钠注射液,6~10 U/h,3~5 ml/h),每小时加入10%葡萄糖注射液5 ml和氨基酸5 ml等营养底物。在灌注劈离过程中,实时根据血气分析结果,调整保存液中的电解质浓度和酸碱平衡。对猪肝进行体外常温机械灌注保存过程中劈离,肝脏持续有胆汁分泌,随着劈离的进展,有功能肝细胞的减少,胆汁每小时分泌量逐渐减少。病理提示肝组织汇管区及肝细胞结构正常,无明显水肿、坏死,取得了良好的保存效果。
3.2 劈离过程中参数的控制:NMP时灌注压力应该为生理压力,但是目前的文献对常温机械灌注时门静脉和肝动脉的灌注压力报道各不相同,波动较大,肝动脉灌注压力选择在40~100 mmHg,门静脉的灌注压力选择在5.0~29.5 mmHg;而对常温机械灌注时的肝动脉流量及门静脉流量的控制波动也较大,肝动脉流量一般控制在100~400 ml/min,门静脉流量一般控制在 250 ~ 1 750 ml/min[10,14-21]。Gravante等[16]的研究认为,灌注的速度应该根据即时获得的动静脉血气结果调整,灌注应该通过调节泵的速度及改变灌注管路的阻力来维持生理状态下动脉、静脉的流量及压力。op den Dries等[14]的研究认为在灌注过程中,应当通过调整流经肝脏的血流,从而维持恒定的压力(即变动的流量,恒定的压力)同Brockmann等[22]的研究结果一致。
我们通过测量生理状态下巴马小型猪供体的门静脉和肝动脉的流量,并根据既往实验NMP对DCD供肝修复的实验研究经验,门静脉灌注压力控制在8~10 mmHg,肝动脉灌注压力控制在80~100 mmHg,门静脉流量控制在(455±107.5)ml/min,肝动脉流量控制在(180.75±59.5)ml/min。在劈离过程中,随着血管的离断,门静脉压力会逐渐升高,我们通过减小总的灌注流量及调整压力比例调节器来保证门静脉压力的稳定,劈离结束后门静脉流量控制在(392.5±125.3)ml/min。而在此过程中,肝动脉压力及流量变化不明显,取得了良好的保存效果。猪的正常体温为38.7~39.7℃,劈离前,肝脏保存温度仅为(37.45±0.33)℃,在实验初始阶段,我们考虑同灌注液加温时间短,灌注液温度未能达到猪的正常体温有关,但在我们将灌注液温度维持在猪的正常体温后开始灌注,肝脏保存温度仍低于正常。最终考虑同肝脏离体后,整个肝脏温度下降(虽然离体时间较短,一般小于5分钟)有关,即使灌注液温度正常,但低于正常体温的肝脏最终使整个灌注液温度下降,导致肝脏保存温度的下降。若在灌注前将灌注液温度升高至正常体温以上(以减少开始灌注后低于正常体温的肝脏对灌注液造成的温度下降),则可能对肝脏造成一定程度的损伤。因此,实验中仍坚持灌注前灌注液温度维持在正常体温之内,虽然劈离前灌注液温度低于正常,但肝脏灌注后,保存温度逐渐升高直至正常,在整个劈离过程中及劈离后,肝脏保存温度维持稳定。
NMP劈离过程中定时监测血气分析。整个过程中Na+基本保持稳定;pH值和HCO3-变化趋势相似,劈离前均低于基础值,通过在灌注液中加入5%碳酸氢钠注射液,HCO3-逐渐升高,pH值也逐渐接近生理范围,甚至在劈离后高于基础值,但HCO3-始终未达到基础值水平。乳酸在劈离过程中呈缓慢上升趋势,考虑同肝脏代谢过程中产生酸性物质,而整个灌注系统没有血液透析系统,无法清除代谢产物有关,这可能是HCO3-始终未达到基础值水平的另一个原因。K+在灌注劈离期间也呈逐渐升高趋势,考虑与劈离期间肝细胞破坏,细胞内钾释放,整个灌注系统没有血液透析系统,无法清除有关。高钾血症导致细胞内H+和细胞外K+交换增加,导致灌注液中H+增多,这可能是HCO3-始终维持在低水平的另一个原因。Ca2+灌注开始劈离前一过性降低,通过添加葡萄糖酸钙注射液,将其逐渐稳定在基础值水平;PO2在劈离过程中通过持续给予1~2 L/min的氧气而保持基本稳定。
3.3 NMP下劈离保存效果的评价:肝脏血流动力学的稳定和良好的肝脏微循环状态密切相关。本研究所构建的NMP保存系统,在进行肝脏劈离保存期间,门静脉和肝动脉的压力自始至终均十分恒定,随着劈离过程的结束,逐渐减少总流量以保证压力的稳定,因为肝动脉的流量所占总流量比重较小,所以变化不明显。这说明在常温条件下,选择适当的压力进行门静脉以及肝动脉的双重灌注,对肝脏的微循环没有明显的损伤。
胆汁形成是一个极其复杂的肝脏细胞内物质的代谢转化和胆管系统排泌的过程,胆汁的分泌和引流情况是反映肝脏、胆道功能的重要指标,因此常用来衡量和观察NMP保存系统的效果[23]。既往研究报道,胆汁分泌量能够评价肝功能[24],肝移植后大鼠胆汁分泌量的多少是评价移植肝脏术后肝功能的一个重要指标,胆汁分泌量的减少可能预示着肝功能的损害[25]。因此,在NMP保存下劈离的研究中观察胆汁的分泌量是评价劈离过程中肝脏功能的重要指标之一。在本实验中自体外灌注开始,肝脏胆汁分泌的速度比较恒定,随时劈离的进行,分泌胆汁的有效肝细胞数量逐渐减少,胆汁量逐渐下降至稳定值,胆汁的持续分泌较直观地反映了劈离过程中供肝的生理活性和功能状态。
肝细胞或线粒体膜损伤的时候会引起血液中许多有关肝脏酶学的变化。在肝细胞中,ALT主要存在于非线粒体中,而约80%的AST存在于线粒体内。当肝细胞受损时,肝细胞膜通透性增加,胞浆内的ALT与AST释放入血浆,使血清ALT与AST的酶活性升高,在中等程度肝细胞损伤是,ALT漏出率远大于AST,但在严重肝细胞损伤时,线粒体膜亦损伤,可导致线粒体内AST的释放,血清中AST/ALT升高。一部分LDH也存在于肝脏组织中,肝细胞损伤时LDH水平也会明显升高。ALP主要分布在肝脏中,胆道疾病时可能由于ALP生成增加而排泄减少,引起血清中ALP升高。本研究在肝脏NMP保存下劈离期间,分段取灌注液检测上述酶学指标,发现在灌注开始时ALT、LDH、ALP出现一定程度的下降,考虑与血液稀释有关,与Xu等[12]的研究结果一致。随着劈离的进行直至劈离结束,ALT、LDH逐渐升高,可能与劈离过程对肝组织造成损伤,细胞内酶大量释放入血有关;而ALP则持续维持在低水平,表明在灌注劈离过程中胆道引流通畅,无胆道梗阻出现;但AST水平在劈离前没有明显降低,随着劈离的进行直至劈离结束,AST水平逐渐升高,也考虑同劈离过程对肝组织造成的严重损伤有关。
肝组织病理学检查是从形态学上评价肝脏损伤的客观指标。本研究在NMP保存劈离后留取肝脏组织行常规病理检查。与保存前相比,NMP保存劈离后常规病理示肝脏组织结构正常、汇管区正常,肝窦内无淤血、血栓形成,小叶中央静脉内无血栓形成,肝窦、血管内皮细胞、汇管区内无粒细胞及淋巴细胞浸润。常规病理在形态学上提示本研究构建的NMP装置用于肝脏保存劈离期间,未造成明显肝细胞损伤。本研究构建的NMP装置可用于供体肝脏保存下劈离,而且保存劈离期间对保存的肝脏无明显的损伤。
