新型常温机械灌注装置保存猪DCD供肾的实验研究
2017-09-08史源宋文利陈静郑虹沈中阳天津市第一中心医院器官移植中心天津市器官移植临床医学研究中心卫生部危重病急救医学重点实验室天津300192
史源,宋文利,陈静,郑虹,沈中阳(天津市第一中心医院器官移植中心,天津市器官移植临床医学研究中心,卫生部危重病急救医学重点实验室,天津 300192)
目前,肾脏移植已成为治疗终末期肾病的主要手段,由于供体的严重短缺,在现有的法律法规条件下,越来越多的心脏死亡器官捐献(donation after cardiac death,DCD)应用于临床[1-3]。但是,对于经历了较长热缺血时间的DCD供肾而言,肾移植术后原发性移植物无功能(primary graft nonfunction,PNF)、移植物功能延迟恢复(delayed graft function,DGF)等发生率均明显增加[3-7],目前常用的UW液单纯低温保存方法已不能满足临床需求,而活力判断主要依靠临床评分、活检组织学检查、低温机械灌注参数等[7-10]。常温机械灌注(normothermic machine perfusion,NMP)可以更好地模拟供肾的生理条件,维持肾脏组织正常的生理机能及代谢环境。常温机械灌注潜在的器官修复能力引起了许多人的关注[11]。本研究拟构建新型NMP系统,利用猪自体肾移植模型,探讨NMP对猪DCD供肾活力评估、减轻热缺血损伤,改善供肾保存质量的意义及其机制。
1 材料和方法
1.1 实验动物与分组:10只雄性巴马小型猪(天津蓟县实验动物基地提供),年龄8~12个月,体重30~40 kg,清洁饲养。术前24小时禁食,12小时禁水;随机将实验动物分为两组:A组(NMP组,n=5):原位阻断肾动脉模拟热缺血,30分钟后切取右侧供肾,连接NMP保存装置常温保存8小时后,以4℃的HTK液冲洗后行自体肾移植术;B组(UW液组,n=5):原位阻断肾动脉模拟热缺血,30分钟后切取右侧供肾, 4℃UW低温保存8小时,HTK液冲洗后行自体肾移植术。
本实验所有过程中对巴马小型猪的处置符合《关于善待实验动物的指导性意见》要求。
1.2 实验方法
1.2.1 麻醉方法:麻醉开始前15分钟臀部肌肉注射氯胺酮10 mg/kg、地西洋0.4 mg/kg、阿托品0.03 mg/kg,进行基础麻醉。基础麻醉后称重,仰卧位固定,备皮,猪尾连接血氧饱和度探头,胸前连接5导心电监护,耳缘静脉套管针建立静脉通路。面罩吸纯氧5分钟,其后通过耳缘静脉麻醉诱导;气管插管,麻醉机维持麻醉,潮气量10~12 ml/kg,呼吸频率18~20次/分钟,吸呼比(I/E)1:2,间断静脉注射维库溴铵维持肌肉松弛。
1.2.2 术中监护:麻醉成功后猪尾连接血氧饱和度探头,胸前连接5导心电监护,监测心率(heart rate,HR)、脉搏、血氧饱和度(SpO2)及呼气末二氧化碳分压(PETCO2)。双侧颈部铺巾,沿右锁骨上3 cm,气管旁3 cm纵行切口分离颈动外静脉,解剖置管,分别建立有创动脉压(invasive arterial blood pressure,IABP)、中心静脉压(central venous pressure,CVP)监测及补液通路。术中间断监测动脉及静脉血气分析。置入气囊导尿管计尿量。
1.2.3 供肾获取及修整:取右侧肋缘下切口,长度15~20 cm,逐层切开皮肤、皮下组织及肌层,注意避免损伤尿道,放置腹腔自动拉钩,充分暴露手术野。开腹后以湿纱布垫保护肠管,钝性分离肾周脂肪囊,插管引流后切断,解剖出肾动脉及肾静脉,注意变异肾动、静脉保护。肾脏游离完毕后经中心静脉导管行全身肝素化(12 500 U),10分钟后阻断右肾动脉及肾静脉, 4℃乳酸林格液快速灌注供肾,肾周置入冰屑协助肾脏快速降温。待流出液清亮无血后换用4℃UW液(200 ml)继续灌注。
1.2.4 受体手术:切口选择和游离过程与供体手术基本一致。以阻断钳贴近肾门依次阻断左侧肾动脉、肾静脉。修剪各血管断端以备吻合。将供肾置入受体腹膜外,以肾袋及冰屑包裹,以6-0 Prolene线连续吻合肾动脉(图1a),其后以6-0 Prolene线连续吻合肾静脉(图1b),打结时注意保留生长因子,严密监测学流动力学变化,适当补液以维持平均动脉压(mean arterial pressure, MAP)不低于60 mmHg(1 mmHg=0.133 kPa),一般情况下不需加用血管活性药物。以7-0 Prolene线端端吻合重建输尿管(图1d)。确切止血并放置肾周引流管,逐层关腹。
1.2.5 术后管理:受体术后禁食48小时,自由进水。术后第1天开始每天静脉给予头孢呋辛钠(0.75 g每12小时给药一次)预防细菌感染治疗3天,根据每天尿量调整补液量,术后第3天开始停止补液,实验动物自由进食进水。
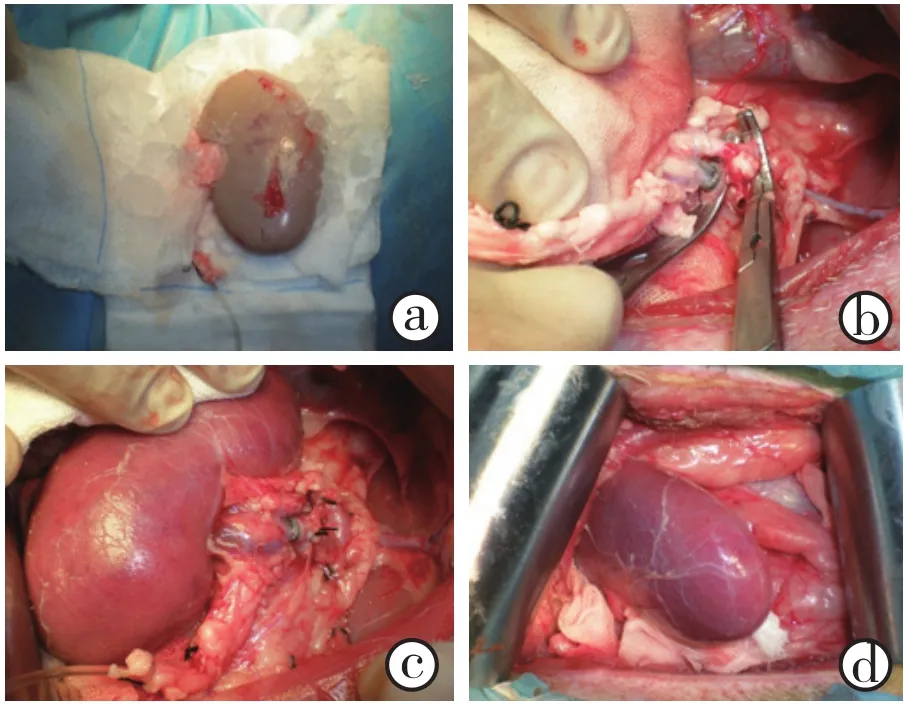
图1 供肾灌注后(a)、肾动脉重建(b)及血流开放(c、d)
1.3 统计学分析:采用SPSS 20.0软件进行统计分析,所有定量资料数据以均数±标准差(±s)表示,各组样本均数比较使用t检验及方差分析。计数资料比较使用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 手术基本情况及术后存活率(表1):供体猪体重、受体猪体重、肾脏重量、实际热缺血时间、实际保存时间、手术时间等各项指标,两组之间差异无统计学意义(均P>0.05)。

表1 两组小型猪自体肾移植的基本情况
经过30分钟热缺血后灌注,供肾颜色变深变暗且灌注不均匀(图2a), NMP保存的开始肾脏灌注亦不均匀,尤其外周部分颜色较暗,随时间延长灌注效果很快改善,约60分钟后肾脏颜色均匀一致,经NMP保存8小时后以乳酸林格液冲洗供肾,肾脏颜色均匀一致(图2b),行自体肾移植再灌注后肾脏颜色红润,灌注均匀(图2c、图2d)。
B组动物全部于术后72小时内死亡,其中3只于术后48小时内死亡,1只于术后70小时后死亡,1只存活超过5天,术后5天存活率为20%。A组动物存活均超过5天,术后5天存活率为100%,与B组相比存在显著性差异(P<0.05)。
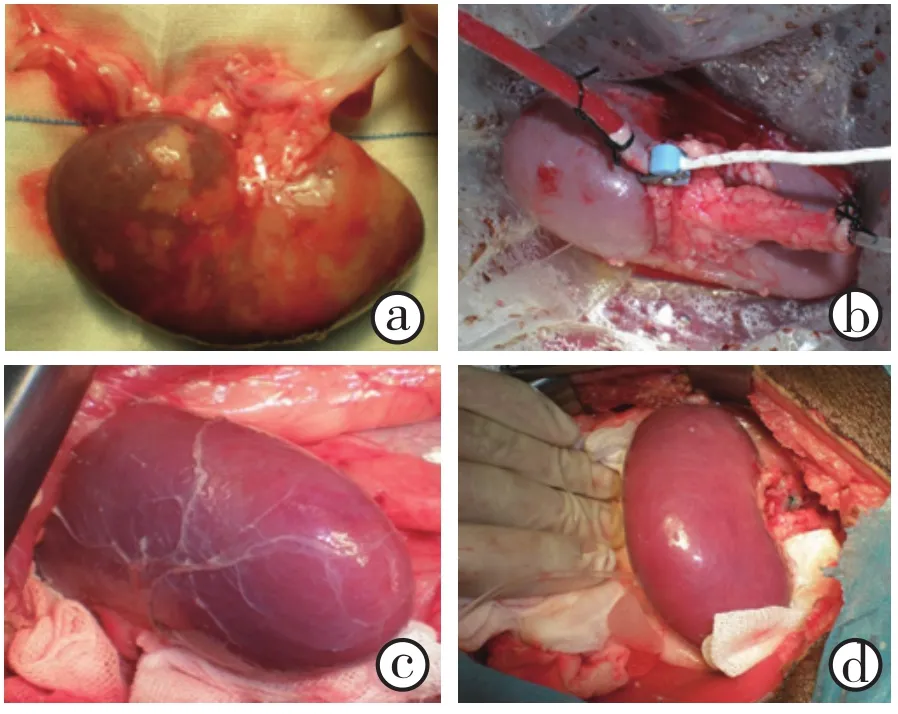
图2 a为热缺血30分钟后灌注的肾脏;b为NMP8小时的肾脏;c和d为A组再灌注后的肾脏
2.2 血清学检查(表2):开腹前,A组与B组动物血清肌酐(serum creatinine, SCr)水平均无统计学差异(P>0.05)。自体移植肾动脉开放后,两组动物SCr水平均升高,而B组SCr水平较A组明显升高,两组之间差异有统计学意义(均P<0.05)。

表2 两组之间Scr水平的比较
2.3 病理结果(图3,图4):供肾热缺血前呈正常组织结构,热缺血30分钟后,肾小管呈中度水样及空泡变性,可见肾小管灶性凝固性坏死。NMP组1~2小时后水样及空泡变性明显减轻,有一定程度恢复。3~8小时损伤加重不明显,空泡变性轻度加重,肾小管无明显改变。UW液低温保存组1~2小时后水样及空泡变性加重。3~8小时损伤加重明显,出现弥漫性空泡变性及滴状变性,出现肾小管扩张。

图3 a为开腹后的肾脏;b为热缺血30分钟的肾脏(HE染色 低倍放大)

图4 NMP修复(1~8 h)及UW低温保存(1~8 h)病理结果(HE染色 低倍放大)
表3 肾动脉开放后1h肾组织TNF-α、Caspase-3、ET-1表达情况及TUNEL法凋亡检测凋亡细胞阳性表达率(±s)

表3 肾动脉开放后1h肾组织TNF-α、Caspase-3、ET-1表达情况及TUNEL法凋亡检测凋亡细胞阳性表达率(±s)
注:与B组相比,aP<0.05;TNF-α为肿瘤坏死因子-α;Caspase-3为天冬氨酸特异性半胱氨酸蛋白酶-3;ET-1为内毒素-1
组别 动物数(只) TNF-α(%) Caspase-3(%) ET-1(%) 凋亡细胞阳性表达率(%)A 组 5 18.1±4.3a 16.1±4.0a 15.3 ±3.9a 21.9±5.8a B 组 5 31.2±6.5 27.3±5.8 20.91±6.4 33.5±9.6
2.4 肾组织免疫组化(表3):B组肾动脉开放后1小时肿瘤坏死因子(tumor necrosis factor-α,TNF-α)的阳性表达率为(31.2±6.5)%,A组开放后1小时阳性表达率为(18.1±4.3)%,较B组明显降低,两组之间相比差异也有统计学意义(P<0.05)。B组肾动脉开放后1小时天冬氨酸特异性半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase-3, Caspase-3) 阳 性 表 达 率 为(27.3±5.8)%,A组开放后1小时阳性表达率为(16.1±4.0)%,较B组明显降低,两组之间相比差异有统计学意义(P<0.05)。B组肾动脉开放后1小时内毒素(endotoxin-1, ET-1)阳性表达率为(20.91±6.40)%,A组开放后1小时阳性表达率(15.3±3.9)%,较B组明显降低,两组差异也有统计学意义(P<0.05)。肾动脉开放后1小时肾组织TUNEL法凋亡检测再灌注后1小时肾组织TUNEL法凋亡检测结果如表3所示, B组开放后1小时凋亡细胞阳性表达率为(33.5±9.6)%,A组开放后1小时凋亡细胞阳性表达率为(21.9±5.8)%,较B组明显降低,两组之间相比差异有统计学意义(P<0.05)。
2.5 血清细胞因子检测(表4):再灌注后血清中TNF-α、Caspas-3含量,A组均低于B组,两组之间差异有统计学意义(P<0.05)。

表4 开放后6 h血清细胞因子的含量
3 讨 论
3.1 DCD供肾活力评估:供肾质量的判断是DCD供肾肾移植的一个重要前提。判断供肾质量的方法主要包括:临床评分、活检组织学检查、体外机器灌注的灌注参数和灌注液中肾脏损伤标志物水平。临床评分主要根据危险因素的多少来判断,如年龄、高血压病史、糖尿病病史、SCr水平等判断。组织学检查主要评估有无血栓形成、皮质坏死和慢性病变,包括肾小球硬化、间质纤维化、肾小管萎缩、动脉内膜增厚和小动脉玻璃样变。导致DCD供肾损伤的原因复杂,包括基础疾病、脑死亡相关的器官损伤、心脏死亡后的热缺血损伤、住院期间的肾损伤,如血容量不足引起的肾前性肾损伤、甘露醇肾损害和肌红蛋白导致的肾小管阻塞等,各种肾损伤原因的叠加使得器官质量判断比较困难。而组织学检查又经常因为器官捐献时间的不确定性变得难以常规进行。根据机器体外灌注的灌注参数判断供肾质量显得很有价值。
3.2 NMP对DCD供肾的保护作用:NMP是在正常体温的条件下保存供体器官,彻底改变了传统低温保存的理论[12]。与单纯低温保存不同,NMP在保存期间模拟器官的生理环境,维持细胞代谢,避免了缺血性损伤。实验表明,NMP通过连续提供氧气、营养物质恢复供能量储备,逆转热缺血过程中ATP供应中断引起的损伤,而且可避免保存过程中细胞的进一步损伤。动物实验表明,NMP对于DCD供肾具有明显的修复作用,但是对供肾修复效果较差[13-16]。
本研究结果与文献报道一致,相对于常规低温保存,NMP对DCD供肾的保存具有明显的优势。经过30分钟热缺血和8小时保存后,NMP组和UW液组术后5天存活率分别为100%和20%,具有显著差异。肾脏再灌注后NMP组SCr水平明显低于UW液组,常规病理、免疫组化及TUNEL凋亡检测也都表现出同样的结果。上述结果说明,NMP可减轻猪DCD供肾的热缺血损伤。
NMP技术不仅能改善能量供应,提高三磷酸腺苷(adenosine triphosphate, ATP)含量,减轻肾组织水肿,而且可避免低温导致肾脏损伤,减少TNF-α以及Caspas-3等炎症因子的产生,改善微循环。从而减轻肾脏缺血/再灌注损伤。
