肾和肺的去细胞器官支架体外灌注制备方法的优化
2017-09-08陈翩翩朱群燕赵应征
陈翩翩 林 倩 朱群燕 赵应征
(温州医科大学药学院,浙江 温州 325025)
肾和肺的去细胞器官支架体外灌注制备方法的优化
陈翩翩 林 倩 朱群燕 赵应征*
(温州医科大学药学院,浙江 温州 325025)
研究采用体外灌注法制备肾和肺去细胞器官支架的最优方法。将10只成年SD雄鼠作为器官支架供体,进行去细胞器官支架制备,不同器官采用不同血液循环方法进行体外大气压灌注(基于大气压力往循环体系中注入)0.75% SDS、1% Triton X-100、0.1% H2O2制备器官去细胞支架,通过HE染色、DAPI荧光染色方法检测去细胞程度,通过扫描电镜观察其结构脉络网和去细胞程度,通过阿利新蓝- 过碘酸雪夫氏染法(AB- PAS)、Masson染色、免疫组化染色方法检测去细胞器官支架的成分保留。结果表明,采用体外大气压灌注法制备的去细胞器官支架能有效去除细胞,且糖原、胶原、纤连蛋白(Fibronectin)、弹性蛋白(Elastin)、层粘连蛋白(Laminin)、IV 型胶原(Collagen IV)等有效保留,同时支架能保持良好的结构脉络网。通过大气压注入去细胞化试剂,能有效保留良好的结构脉络网,同时达到有效的去细胞程度(去细胞程度大于99%),且营养成分能有效保留。
体外灌注;去细胞化;器官支架
引言
在临床上,器官原位移植已经成为脏器不可逆性损伤、衰竭的唯一治疗手段,而每年急需移植的人数大幅上升,许多患者在等待器官的过程中失去生命[1],移植供体缺乏成为器官移植技术的瓶颈。同时,移植术后的排斥反应也存在很大障碍。
近些年,组织器官工程学的快速发展为克服器官移植术后的排斥问题提供了解决思路。具有功能的器官移植替代物已经在体外被创造,并且成功地被移植入受体[2]。本课题意在制备有效的器官支架材料,去细胞支架拥有良好的结构脉络网,且保留许多的营养成分,相对于其他的支架材料,去细胞器官支架的成分和结构更加接近于活体器官,同时,它的低免疫原性以及高生物相容性使它更适用于移植,成为一种最具优势的移植替代物。
1 材料与方法
1.1 材料
1)实验动物:Sprague Dawley成年雄性大鼠(SD大鼠),10只,体重(300±20)g,温州医科大学实验动物中心。
2)试剂:Triton X- 100(阿拉丁,中国),SDS(阿拉丁,中国),Fibronectin(abcam,英国),Elastin(abcam,英国),Laminin(abcam,英国),Collagen IV(abcam,英国)。
3)仪器: IX71 倒置研究型显微镜(Olympus公司,日本),扫描电镜(Hitachi, H- 7500, 日本)。
1.2 方法
1.2.1灌注法制备去细胞支架过程
基于器官的血液循环,以肾和肺支架制备为代表,优化灌注方法,目前大多数的去细胞支架的灌注法采用蠕动泵等外力压入各种去细胞试剂[3],其去细胞程度和成分保留均能达到效果,但是结构脉络网的完整性会因灌注时蠕动泵的压力过强而在一定程度上产生破碎,而本研究的体外灌注法是通过大气压导入去细胞试剂,最大程度缓和了压强过大导致的结构脉络网的破坏。制备过程如下:首先构建脏器的闭合血液循环通路,接着进行去细胞化过程:1% Triton X- 100灌注3个循环→PBS灌注3个循环→0.75% SDS灌注3个循环→PBS灌注3个循环→0.1% H2O2灌注3个循环→PBS灌注3个循环。以上每次循环使用250 mL试剂。
1% Triton X- 100用于破细胞膜,0.75% SDS能有效去除细胞成分,笔者采用的Triton X- 100和SDS是较为温和的洗涤剂,其对细胞外基质的破坏可以降到最低[4],0.1% H2O2用于杀菌,PBS用于清除残留的细胞碎片。整个过程器官都处于悬空,上面接着留置针,其针连着25 mL针筒,试剂都加入针筒,通过大气压,试剂缓慢通过器官进行去细胞化过程。通过大气压力把试剂导入器官,相对于手动导入试剂或蠕动泵导入试剂,能更完整地保持血管脉络网,避免其由于过强的压力而破碎、渗漏。
灌注法制备大鼠肾和肺去细胞化支架:制备肾去细胞化支架时,从单侧肾动脉插入留置针,伴行的肾静脉剪开切口,形成单肾循环,手术线结扎固定留置针,注入生理盐水冲洗血液后,移出体外,将肾悬挂在简易装置中;而肺的灌注采取心肺循环灌注,先从下腔静脉注入肝素抗凝,再结扎心脏主动脉弓,将留置针从右心室插入、结扎固定,灌注生理盐水冲洗血液后,最后将心肺一起移出体外,悬挂在简易装置中。接着分别加入去细胞试剂进行去细胞化处理(见图1、2)。经过上述处理获得去细胞化肾支架(dKECM)和去细胞化肺支架(dLECM)。

图1 大鼠肺组织去细胞化过程。(a)箭头处表示大鼠下腔静脉;(b)往大鼠下腔静脉打入肝素;(c)结扎大鼠心脏主动脉弓,再将留置针从右心室插入、结扎固定;(d)将肺组织移入装置;(e)组织去细胞化前近观;(f)组织去细胞化后;(g)组织去细胞化后近观Fig.1 The preparation of rat lung decellularization. (a) Arrow represents the inferior vena cava of rats; (b) Inject heparin to the inferior vena cava of rats; (c) Ligate rat cardiac aortic arch and insert the detained needle to the right ventricle and fasten it; (d) Move the tissue to appliance; (e) Amplification of tissue before decellularization; (f) The final decellularization; (g) Amplification of final decellularized tissue

图2 大鼠肾组织去细胞化过程。(a)往大鼠单侧肾动脉插入留置针,伴行的肾静脉剪开切口,形成单肾循环; (b)将组织移入装置;(c)组织去细胞化后近观;(d)组织去细胞化过程中的形态变化Fig.2 The preparation of rat kindey decellularization. (a) Insert the detained needle into the unilateral renal artery and cut the following renal vein with an incision, developing a single renal circulation; (b) Move the tissue to appliance; (c) Amplification of final decellularized tissue; (d) The tissue changes during decellularized process.
1.2.2 去细胞程度检测
通过HE染色和DAPI荧光染核,对去细胞化程度进行检测。
1.2.3 去细胞化器官支架的成分保留
通过Masson染色检测其胶原纤维的保留;AB- PAS染色检测其糖原的保留;免疫组化染色检测纤连蛋白(Fibronectin)、弹性蛋白(Elastin)、层粘连蛋白(Laminin)、IV 型胶原(Collagen IV)的保留。
1.2.4去细胞化器官支架结构的完整性
通过扫描电镜可以看出去细胞器官支架的脉络网的完整性。
1.2.5 去细胞化器官支架免疫原性检测
通过皮下埋植去细胞肺支架以及脑内填充去细胞化肾支架,于第7 d处理老鼠后,肉眼观察组织的炎症情况以及RT- PCR检测埋植物周围组织的CD68的表达量。
1.2.6 统计学处理
采用 SPSS 13.0软件进行统计学分析。计量数据以 (x±s) 表示,两组间差异比较行t检验,P<0. 05 表明差异有统计学意义。
2 结果
2.1 肾和肺去细胞程度评价
通过HE染色和DAPI染色显示出dLECM(见图3)、dKECM(见图4)和正常肺、肾组织相比,没有细胞核的表达,从扫描电镜结果能观察到其保留了器官完整的结构脉络网。
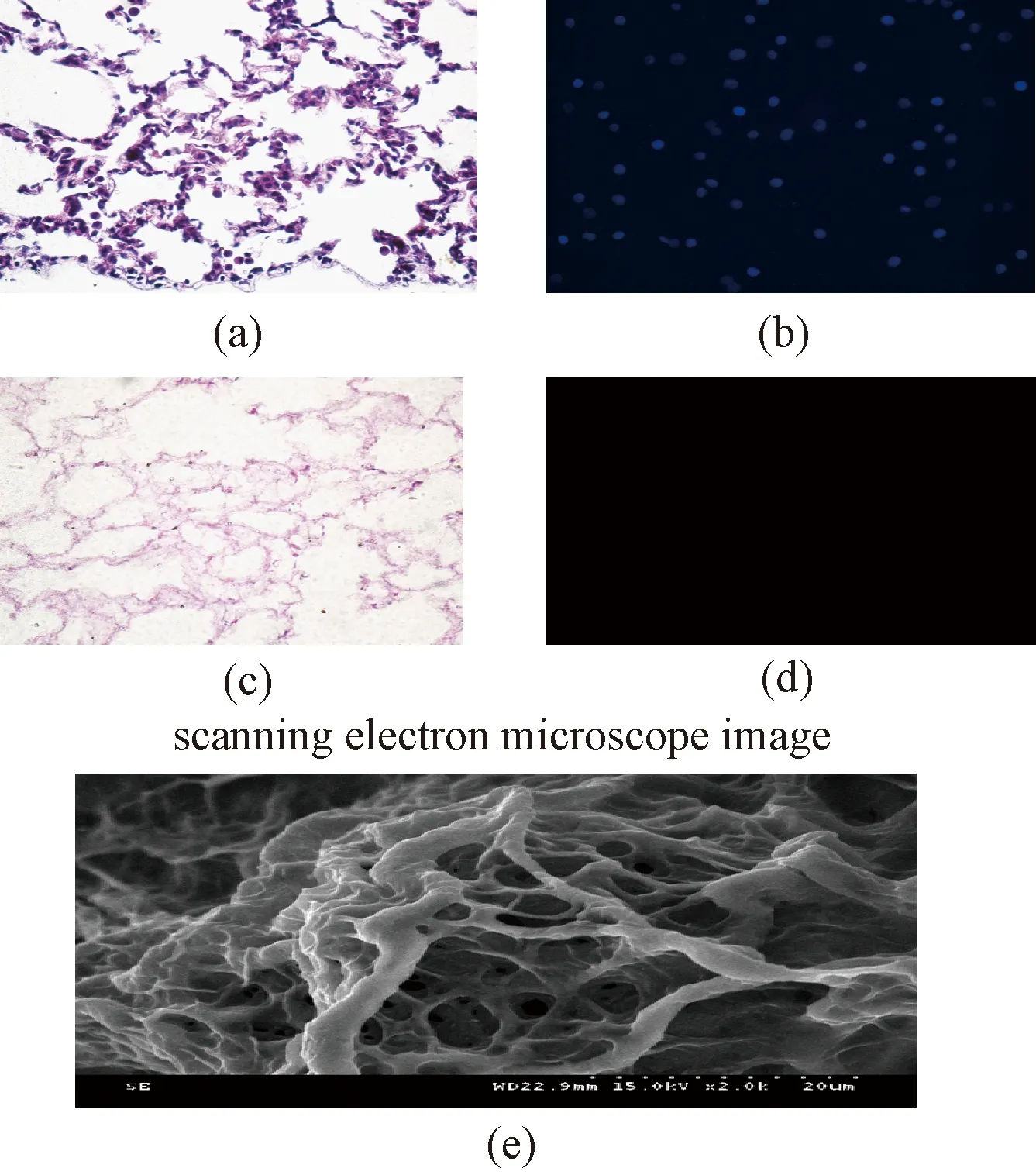
图3 肺去细胞程度评价。(a)肺组织的HE染色;(b)肺组织的DAPI染色;(c) 肺去细胞支架的HE染色;(d)肺去细胞支架的DAPI染色;(e)肺去细胞支架的扫描电镜图Fig.3 Evaluation of the decellularized lung. (a) HE stain of normal lung; (b) DAPI stain of normal lung; (c) HE stain of decellularized lung; (d) DAPI stain of decellularized lung; (e) SEM result of decellularized lung.

图4 肾去细胞程度评价。(a)肾组织的HE染色;(b)肾组织的DAPI染色;(c)肾去细胞支架的HE染色;(d)肾去细胞支架的DAPI染色;(e)肾去细胞支架的扫描电镜图Fig.4 Evaluation of the decellularized kindey. (a) HE stain of normal kindey; (b) DAPI stain of normal kindey; (c) HE stain of decellularized kindey; (d) DAPI stain of decellularized kindey; (e) SEM result of decellularized kindey.
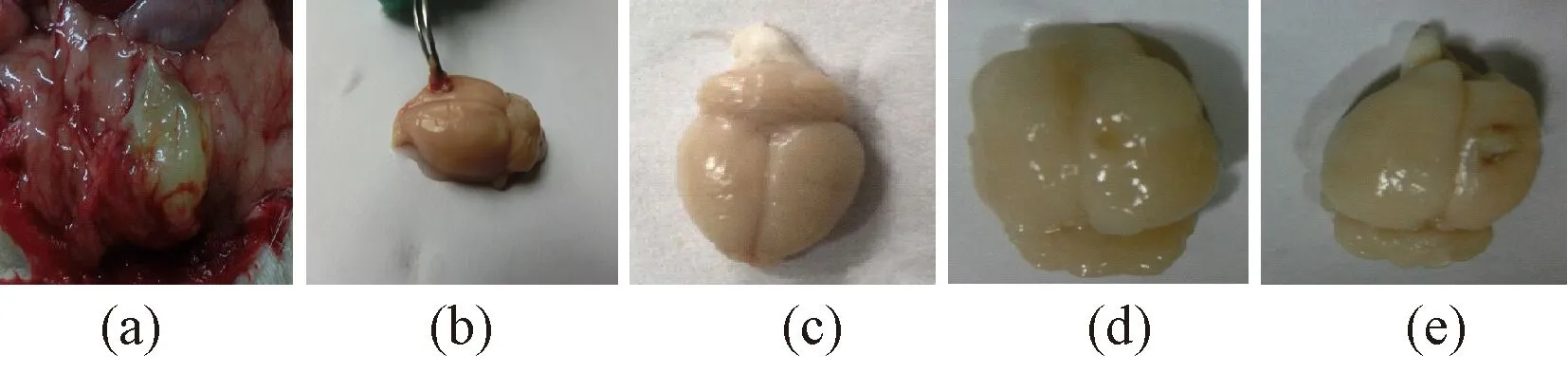
图5 去细胞肾和肺支架的免疫原性检测。(a)肺去细胞支架大鼠皮下埋植7 d;(b)肾去细胞支架埋入大鼠脑;(c)正常大鼠大脑;(d)假手术组;(e)肾去细胞支架埋入大鼠脑7 dFig.5 Immunogenicity detection of decellularized kidney and lung. (a) Lung scaffolds subcutaneous embedment in normal rat for 7 days; (b) Lung scaffolds embedded in rat brain. (c) Normal rat brain; (d) Control group; (e) Lung scaffolds embedded in rat brain for 7 days
2.2 去细胞肾和肺支架的免疫原性检测
肺去细胞支架埋植入大鼠皮下7 d后(见图5(a)),可以看出,埋植物与周围组织并没有发生炎症。而肾去细胞支架埋植入脑的示意图(见图5(b))以及7 d后状况(见图5(e)),对比与正常大脑(见图5(c))和假手术组大脑(见图5(d))可观察出其没有明显的炎症,并且组织相容性良好。取移植后的脑组织周围组织进行RT- PCR检测CD68含量的表达,结果显示(见图6),埋植物周围组织没有炎症发生,说明本课题组制备的去细胞化肺、肾支架有良好的免疫原性。
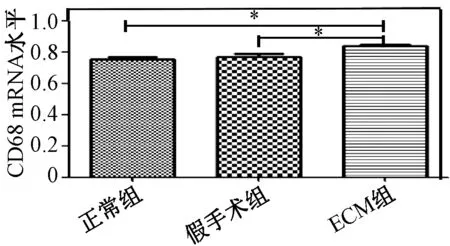
图6 经去细胞组织移植后脑周围组织的CD68 mRNA水平Fig.6 Relative CD68 mRNA levels in surrounding brain tissues after decellularized tissue transplantation.
2.3 去细胞肾和肺支架的成分保留
从AB- PAS染色看出dLECM(见图7)、dKECM(见图8)的糖原、中性黏蛋白等各种糖蛋白的保留(呈紫红色)、Masson染色看出胶原纤维的保留(呈蓝色)、免疫组化染色结果可看出支架能有效保留Fibronectin、Elastin、Laminin、Collagen IV(呈棕色阳性点)。
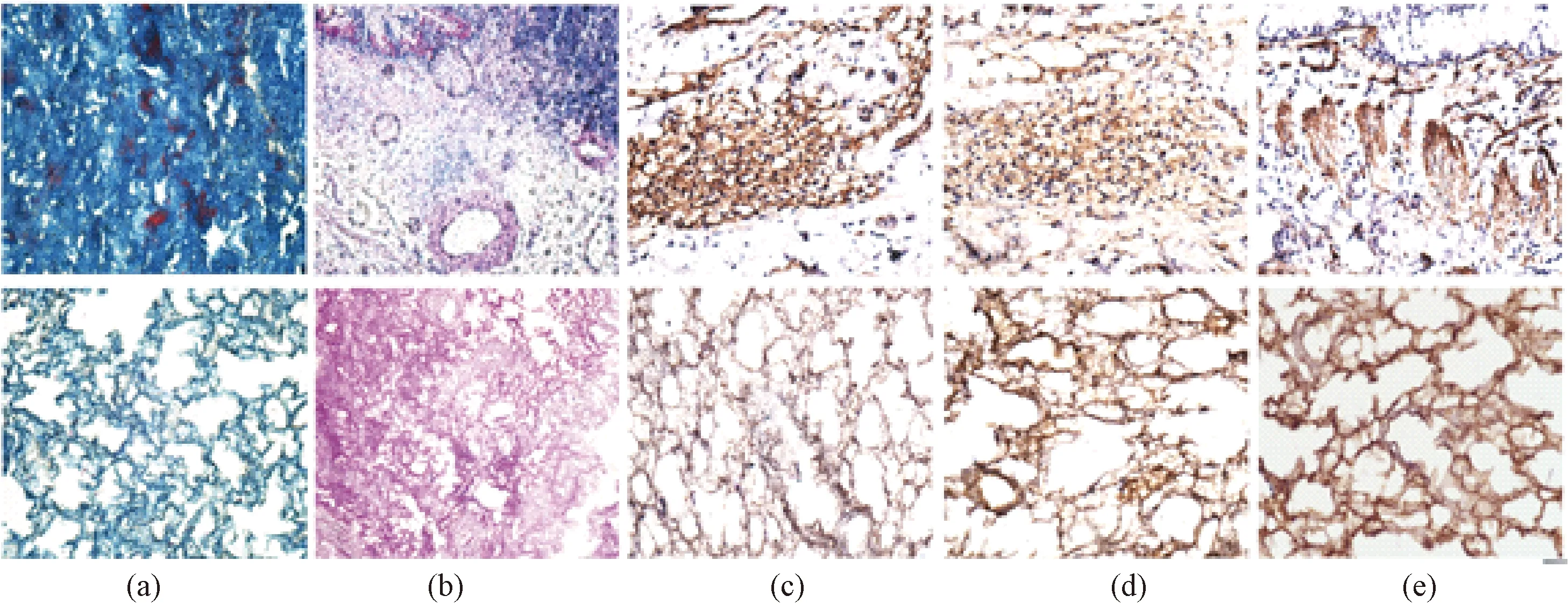
图7 肺支架成分保留(上为肺组织、下为肺去细胞支架)。(a) Masson染色;(b) AB- PAS染色;(c) Elastin免疫组化染色; (d) Fibronectin免疫组化染色; (e) Collagen Ⅳ免疫组化染色Fig.7 Composition retaining in lung scaffold(The above is fresh lung, below is the decellularized lung). (a) Masson stain; (b)AB- PAS stain; (c) Elastin stain; (d) Fibronectin stain; (e) Collagen Ⅳ stain
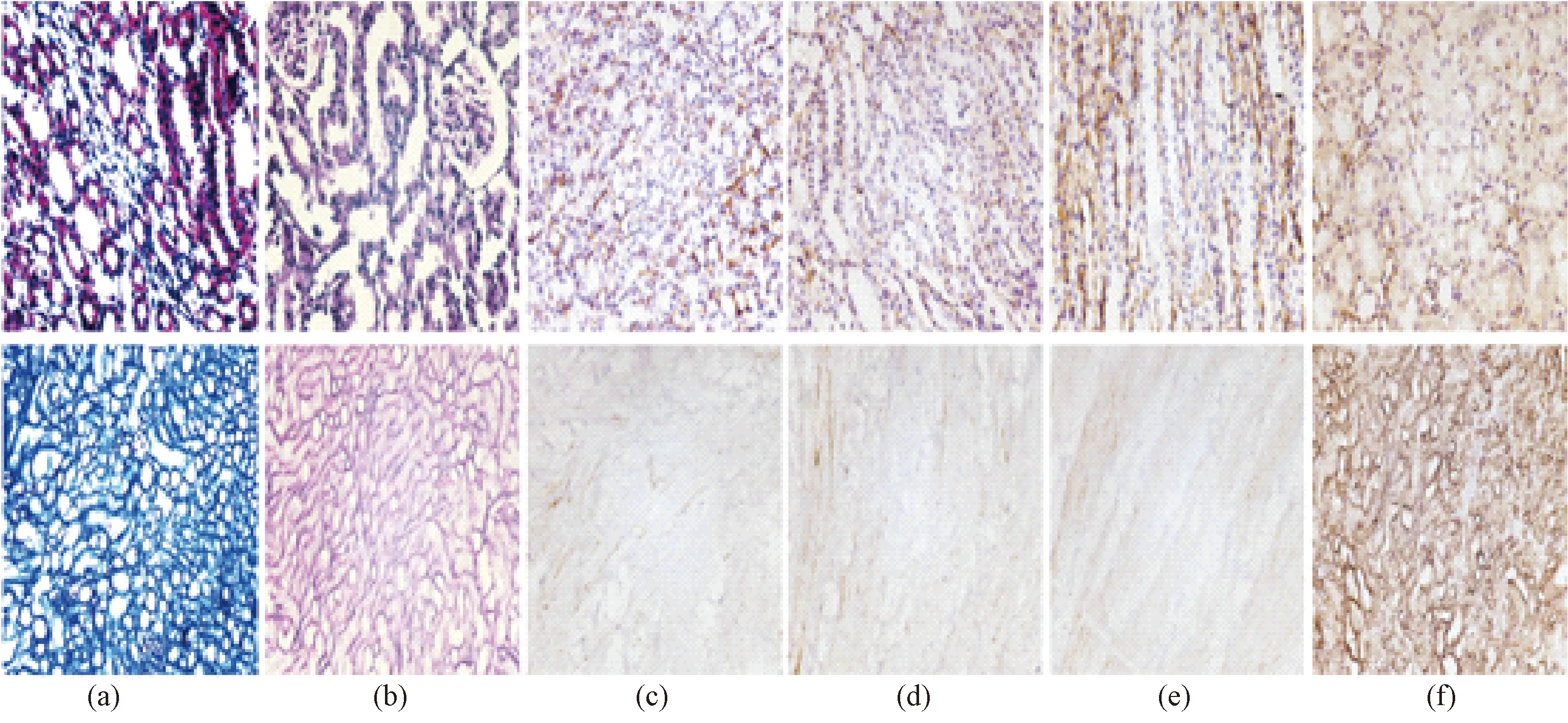
图8 肾支架成分保留(上为肾组织、下为肾去细胞支架)。(a) Masson染色;(b) AB- PAS染色;(c)肾组织Elastin免疫组化染色; (d)肾组织Fibronectin免疫组化染色; (e)肾组织Laminin免疫组化染色; (f)肾去细胞支架Collagen Ⅳ免疫组化染色Fig.8 Composition Retaining in kidney scaffold. The above is fresh kidney, below is the decellu.larized kidney(a) Masson stain; (b) AB- PAS stain; (c) Elastin stain; (d) Fibronectin stain; (e) Laminin stain;(f)Collagen Ⅳstain
3 讨论
去细胞支架是通过不同方法去除组织或者器官的细胞以及可溶性蛋白,使其达到低免疫原性、高生物相容性的天然生物支架材料。对比于现有的体外灌注方法,大多数都是采用蠕动泵等额外的压力往器官中注入试剂,这额外的压力在一定程度上会破坏支架的结构脉络网,而本实验主要采取大气压灌注导入试剂,最大程度地避免由于过强的压力导致结构脉络网的破碎,在保留完整的结构脉络网的同时,去细胞化程度也达到要求。
目前,在血管、膀胱以及气管等组织的工程化已经取得可喜的进步。而整个器官重建要求在移植后血液能迅速支持,这就增加了支架制备和再细胞化的难度。因此,植入性生物人工器官发展的障碍之一,是缺乏能重现整个组织功能的生物学相适应的器官支架器官[5]和适合组织形成的生长环境[6]。
在过去的几年里,去细胞支架已经成功地用于修复各种损伤或病变的器官[7],比如皮肤[8]、气管[9- 10]、食道[11- 12]、心[13- 15]等。
为了有效去除器官的细胞,保留超微结构和细胞外基质成分[16],大多数实体器官的去细胞化过程都采用灌注法[3, 17],基于它通过脉络循环来清除所有的细胞成分,并维持器官细胞外基质的完整性[18- 19],同时保留了其原始的血管脉络系统,这种能保持完整结构脉络的去细胞化支架能被用于种植培养多种细胞[20]。而采取的灌注法能有效去除细胞成分并保留完整的结构脉络网,同时保留胶原、糖原以及各种营养蛋白,相对于传统意义上的灌注法,采取了依靠大气压导入去细胞化试剂,能最大程度地保留器官的血管脉络网,有效地避免其由外界压力过强导致的血管破裂。在移植替代物中,可以看到去细胞化器官支架的低免疫原性排除了传统移植的免疫排斥反应,同时其保留的营养成分和结构脉络网又是一般生物支架材料所不具备的,并且由于其完整的结构脉络网能让接种的细胞黏附、爬行、增殖,有效实现去细胞支架的再细胞化。
本研究证明,基于血循环通路的体外大气压自然灌注法能有效制备去细胞化器官支架,同时确立了一个有效且快速的大鼠器官去细胞方法,为以后支架的再细胞化及体内移植奠定基础。
4 结论
本课题的体外灌注法制备的去细胞器官支架相对于大多数通过蠕动泵灌注制备的去细胞支架,不仅有效去除细胞,保留营养成分,消除免疫原性,且最大程度地保存了器官的结构脉络网的完整性,这为开发组织工程支架带来新的机遇,开拓了良好前景,是组织工程学进展的关键一步。
[1] 王小军. 去细胞化的肝脏支架在细胞移植中的应用研究[D]. 重庆: 第三军医大学, 2013.
[2] 王康华. 选择适宜的灌注去细胞方法应用于全肝脏去细胞支架的制备[D]. 广州: 南方医科大学, 2015.
[3] 黑飞龙. 灌注法大鼠全肺脏脱细胞基质支架的建立[J]. 北京生物医学工程, 2013, 32(1) :17- 21.
[4] Vavken P, Joshi S, Murray MM, et al. TRITON- X is most effective among three decellularization agents for ACL tissue engineering[J]. Journal of Orthopaedic Research, 2009, 27(12):1612- 1618.
[5] 孙赳. 肝素修饰改善去细胞化猪肝脏支架材料的生物相容性[D]. 泸州: 泸州医学院, 2014.
[6] Mallick KK, Cox SC, et al. Biomaterial scaffolds for tissue engineering[J]. Frontiers in Bioscience (Elite edition), 2013, 1(5):341- 360.
[7] Piccoli M, Urbani L, Alvarez- Fallas ME, et al. Improvement of diaphragmatic performance through orthotopic application of decellularized extracellular matrix patch[J]. Biomaterials, 2016, 1(74):245- 255.
[8] Chen RN, Ho HO, Tsai YT, et al. Process development of an acellular dermal matrix (ADM) for biomedical applications[J]. Biomaterials, 2004, 25(13):2679- 2686.
[9] Sjoqvist S, Lim ML, et al. Experimental orthotopic transplantation of a tissue- engineered oesophagus in rats[J]. Nature Communications, 2014, 5(15):3562.
[10] Koch H, Graneist C, Emmrich F, et al. Xenogenic esophagus scaffolds fixed with several agents: comparative in vivo study of rejection and inflammation[J]. Journal of Biomedicine & Biotechnology, 2012, 2012: 948320.
[11] Elliott MJ, De Coppi P, et al. Stem- cell- based, tissue engineered tracheal replacement in a child: a 2- year follow- up study[J]. Lancet, 2012, 380(9846):994- 1000.
[12] Macchiarini P, Jungebluth P, Go T, Asnaghi MA, et al. Clinical transplantation of a tissue- engineered airway[J]. Lancet, 2008, 372(9655):2023- 2030.
[13] Atluri P, Trubelja A, Fairman AS, et al. Normalization of postinfarct biomechanics using a novel tissue- engineered angiogenic construct[J]. Circulation, 2013, 128(11 Suppl 1):S95- S104.
[14] Badylak SF, Kochupura PV, Cohen IS, et al. The use of extracellular matrix as an inductive scaffold for the partial replacement of functional myocardium[J]. Cell transplantation, 2006, 15 Suppl 1:S29- S40.
[15] Kochupura PV, Azeloglu EU, Kelly DJ, et al. Tissue- engineered myocardial patch derived from extracellular matrix provides regional mechanical function[J]. Circulation, 2005, 112(9 Suppl):I144- I149.
[16] Jang JU, Lee SH, Choi CU,et al. Effects of heme oxygenase- 1 inducer and inhibitor on experimental autoimmune uveoretinitis[J]. Korean Journal of Ophthalmology, 2007, 21(4):238- 243.
[17] 陈捷. 灌注法制备大鼠全肾脏脱细胞基质的细胞相容性研究[D]. 广州: 南方医科大学, 2010.
[18] Crapo PM, Gilbert TW, Badylak SF, et al. An overview of tissue and whole organ decellularization processes[J]. Biomaterials, 2011, 32(12):3233- 3243.
[19] Song JJ, Ott HC, et al. Organ engineering based on decellularized matrix scaffolds[J]. Trends in Molecular Medicine, 2011, 17(8):424- 432.
[20] Agrawal V, Kelly J, Tottey S, et al. An isolated cryptic peptide influences osteogenesis and bone remodeling in an adult mammalian model of digit amputation[J]. Tissue Engineering Part A, 2011, 17(23- 24):3033- 3044.
The Advanced Method of Kidney and Lung De- Cellularized Scaffold through in vitro Perfusion
Chen Pianpian Lin Qian Zhu Qunyan Zhao Yingzheng*
(School of Pharmaceutical Sciences, Wenzhou Medical University, Wenzho 325035u, Zhejiang, China)Key words:in vitro perfusion; de- cellularized; organ scaffold
10.3969/j.issn.0258- 8021. 2017. 03.019
2016- 07- 26, 录用日期:2016- 01- 25
国家自然科学基金(81571392);浙江省卫生高层次创新人才和温州市551高层次人才创新技术项目。
R318
D
0258- 8021(2017) 03- 0380- 05
*通信作者(Corresponding author),E- mail: pharmtds@163.com
