白蛋白测定试剂(盒)技术审评要点
2017-09-07吴丹李平匡佩琳帅明珠鄢峰江西省药品审评中心江西南昌330008
吴丹 李平 匡佩琳 帅明珠 鄢峰 江西省药品审评中心 (江西 南昌 330008)
白蛋白测定试剂(盒)技术审评要点
吴丹 李平 匡佩琳 帅明珠 鄢峰 江西省药品审评中心 (江西 南昌 330008)
本文概述了白蛋白测定试剂(盒)技术审评要点,包括原材料研究、生产工艺及反应体系研究、分析性能评估、临床评价、产品技术要求、使用说明书六个方面的要求。为规范白蛋白测定试剂(盒)注册申报和技术审评工作提供指导。
白蛋白测定试剂(盒) 技术审评
血清白蛋白在肝脏合成,血清白蛋白浓度升高常由于严重失水,血浆浓缩所致,并非蛋白质绝对量的增加。临床上尚未发现单纯白蛋白浓度增高的疾病。白蛋白浓度降低的原因与血清总蛋白浓度降低原因相同。但有时总蛋白的浓度接近正常,而白蛋白的浓度降低,同时伴有球蛋白浓度的增高。急性白蛋白浓度降低,主要由于急性大量出血或严重烫伤时血浆大量丢失。慢性白蛋白浓度降低主要由于肝脏合成白蛋白功能障碍、腹水时白蛋白的丢失和肾病时白蛋白从尿液中的丢失。严重时,白蛋白浓度可低于10g/L。白蛋白浓度低于20g/L时,由于血浆胶体渗透压的下降,常可见到水肿等现象。另外存在极少数先天性白蛋白缺乏症患者,由于白蛋白合成障碍,血清中几乎没有白蛋白,但患者并不出现水肿[1]。
白蛋白测定试剂(盒)使用溴甲酚绿法(BCG)、溴甲酚紫法(BCP)对血清、血浆中白蛋白进行定量检测。包括手工试剂和在半自动、全自动生化分析仪上使用的试剂。截止2015年底,全国已获证产品约70个(含国产和进口)。
为了规范该类产品的注册申报和技术审评工作,2015年本单位承担了国家食品药品监督管理总局关于白蛋白测定试剂(盒)注册技术审查指导原则的课题研究。《白蛋白测定试剂(盒)注册技术审查指导原则》[2]已于2016年3月正式发布。下面就该产品的审评重点进行概述。
1.主要原材料研究
应提供原辅料信息、供应商证明文件、质量标准及检验合格证明文件。包括试剂盒所用与白蛋白结合的染料(如溴甲酚绿或溴甲酚紫)的详细资料。如外观、纯度或试剂等级。
应提供企业内部参考品(白蛋白标准液)的原料选择、制备、定值过程及试验资料;白蛋白标准液的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。白蛋白已具备有证参考物质(如CRM470、ERM/IFCC),生产企业内部白蛋白标准品(液)应通过建立自己的参考品体系并溯源。
2.生产工艺及反应体系研究
应对生产工艺进行详细介绍,绘制完整和清晰的流程图,明确关键工序的控制要求,并简要说明主要生产工艺的确定依据。
反应体系研究主要为样本采集及处理方式、样本要求(血清、血浆)、加样方式(如采取稀释或其他处理方式)、样本用量、试剂用量、反应条件(时间、温度、仪器型号、实验参数等的最佳组合)、校准方法等,应明确反应体系确定依据[3]。
3.分析性能评估
性能评估应采用临床样本,并尽量采用异常人群(低蛋白血症、肝硬化患者)样本,如果线性范围低端样本不足,可以考虑补充低风险患者样本或健康人群。应选择多批产品进行分析性能评估,包括具体研究方法、实验数据、质控标准、统计分析等详细资料。主要研究分析灵敏度、线性范围、精密度、准确度等分析性能[3]。
对于适用多个机型的产品,应提供所有机型的性能评估资料及其实验参数。如包含不同包装规格,需对不同包装规格之间的差异进行分析和验证[3]。
4.临床评价
依据《体外诊断试剂临床研究技术指导原则》进行临床评价,执行的原则至少包括下列几个方面[4]:
4.1 临床机构
承担临床试验的医疗机构应是省级医疗卫生单位。
4.2 对比试剂
尽量选择方法学相同、线性范围及精密度等性能接近的同类试剂作为对比试剂,证明本品与已上市产品等效或优于已上市产品。
4.3 样本量
申请人或临床研究者应根据产品临床使用目的,与该产品相关疾病的临床发生率确定临床研究的样本量。在符合指导原则有关最低样本要求的前提下,还应符合统计学要求。临床研究的总样本数至少为200例。应考虑样本量的分布。样本量的选择应符合统计学及相关指导原则的要求。样本浓度应覆盖考核试剂检测范围,尽可能均匀分布。不少于30%样本的测定值处于参考区间以外,但在测量范围内。如果考核试剂同时适用于血清或血浆样本类型,可完成一个样本类型(血清或血浆)不少于200例的临床研究,同时可选至少100例血清或血浆同源样本进行比对研究。建议在临床试验中选择部分含干扰物质的标本进行对比研究,包括高脂、溶血、黄疸的样本。血清中多种蛋白成分如a1-球蛋白、转铁蛋白、触珠蛋白也会和BCG或 BCP反应,应从临床角度验证对试剂的影响。
5.产品技术要求
本产品性能指标主要参照YY/T 1228—2014《白蛋白测定试剂(盒)》制定[5]。
5.1 外观
试剂(盒)各组分应齐全、完整、液体无渗漏、无破损;中英文包装标签、标识字迹应清晰。
5.2 装量
应不少于标示量。
5.3 试剂空白吸光度
应符合生产企业宣称的要求。
5.4 分析灵敏度
用已知浓度或活性的样品进行测试,记录在试剂(盒)规定参数下产生的吸光度改变。换算为n单位吸光度差值(ΔA)或吸光度变化(ΔA/min)。应符合生产企业给定范围。
5.5 线性范围
用达到线性区间下限的低浓度样本稀释达到线性区间上限的高浓度样本,混合成至少5个稀释浓度(xi)。用试剂(盒)分别测试以上样本,每个稀释浓度测试3次,分别求出每个稀释浓度检测结果的均值(yi)。以稀释浓度(xi)为自变量,以检测结果均值(yi)为因变量求出线性回归方程y=a+bx。计算线性回归的相关系数(r)。

稀释浓度(xi)代入求出线性回归方程,计算yi的估计值及yi与估计值的相对偏差或绝对偏差。
试剂(盒)线性在[10.0,60.0]g/L区间内:(1)相关系数r值≥0.990。(2)[10.0,20.0]g/L区间内,线性偏差应不超过±4.0g/L;[20.1,60.0]g/L区间内,线性偏差应不超过±10%。
5.6 精密度
5.6.1 重复性
在重复性实验条件下,同一批次试剂对检测范围内某个浓度的白蛋白样本进行重复检测10次,变异系数CV(%)≤2.0%。
5.6.2 批间差
三个批次的检测试剂对检测范围内某个浓度的白蛋白样本进行重复性检测,其变异系数CV(%)值应≤5.0%。检测结果计算公式如下:
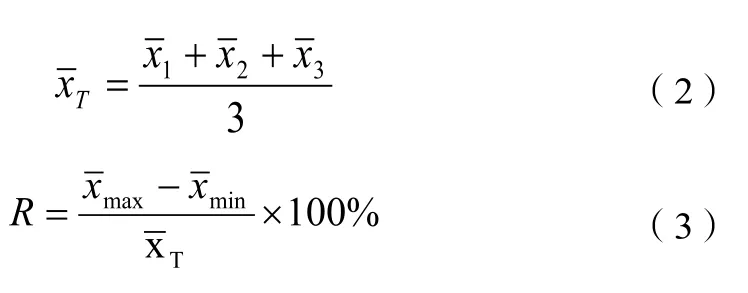
式中:

5.7 准确度
用可用评价常规方法的有证参考物质(CRM)对试剂(盒)进行测试,重复检测3次,取测试结果均值(M),按公式(4)计算相对偏差(B%)。相对偏差应不大于±6.0%。

式中:M为测试结果均值;
T为标准物质标示值,或各浓度人血清定值。
5.8 稳定性
5.8.1 开瓶稳定性
试剂(盒)在规定的贮存条件下保存至规定的时间,产品的性能应至少符合线性、准确度和重复性的要求。
5.8.2 复溶稳定性(干粉或冻干试剂适用)
干粉试剂开瓶后(复溶后)在规定的贮存条件下保存至预期时间内,产品的性能应至少符合线性、准确度和重复性。
5.8.3 效期稳定性
试剂(盒)在规定的贮存条件下保存至有效期末,产品的性能应至少符合线性、重复性和准确度的要求。
5.9 校准品和质控品(如适用)
若试剂盒配套校准品和质控品,应参照GB/T 21415-2008《体外诊断医疗器械 生物样品中量的测量 校准品和控制物质赋值的计量学溯源性》的要求溯源至国家或国际标准物质,并提供校准品溯源性文件及质控品定值说明。溯源性文件中应有赋值程序、溯源链和不确定度及其评定要求。
6.产品使用说明书
产品说明书的格式应符合《关于发布体外诊断试剂说明书编写指导原则的通告》(国家食品药品监督管理总局通告2014年第17号)的要求[6]。产品说明书的所有内容均应与申请人提交的注册申报资料中的相关研究结果保持一致,下面对白蛋白测定试剂(盒)说明书的重点内容进行详细说明,以指导注册申报人员更合理地完成说明书编制。
6.1 预期用途
白蛋白测定试剂盒用于体外定量检测血清和/或血浆中白蛋白浓度,适用的样本类型应结合实际的临床研究情况进行确认。临床上主要用于肝脏功能及营养状况等疾病的辅助评价等。
6.2 检测原理
白蛋白在一定pH值缓冲液中(pH4.2~5.2)带正电荷,在有非离子型表面活性剂存在时,可与带负电荷的染料(溴甲酚绿或溴甲酚紫)结合产生有色(蓝绿色或绿色)复合物,在一定波长(600~630nm)处比色,颜色的深度与白蛋白浓度成正比。与同样处理的白蛋白标准比较,可求得白蛋白含量。
6.3 主要组成成分
应明确主要成分:①说明试剂包含主要组分的名称、数量、比例或浓度等信息;②试剂中不包含但对该项检测必须的组分,企业应列出相关试剂/耗材的名称、货号及其他相关信息;③试剂盒中不包含质控品或其他耗材,应说明经验证后推荐配合使用的商品化质控品、校准品或其他耗材的生产企业、产品名称以及产品货号等详细信息;如包含校准品和/或质控品,应说明其主要组成成分及其生物学来源,校准品应注明其定值及溯源性,质控品应明确靶值范围。
6.4 储存条件及有效期
试剂的开封稳定性、效期稳定性、运输稳定性等信息做详细介绍。并对开封后未使用产品允许暴露于空气中的温度、湿度及有效期等条件予以明确。
6.5 样本要求
①样本采集:采集时间点是否受临床症状、用药情况等因素的影响,具体采集部位及类型,详述具体的操作方法或列出相关操作指南文件以指导使用者(最好能够给出具体图示),尽量减少由于样本采集或处理不当对实验造成的影响;②若待测样本为血浆应说明所采用的抗凝剂类型;③样本处理及保存:样本的保存条件及期限(短期、长期)、运输条件等。冷藏/冷冻样本检测前是否须恢复室温,冻融次数限制。
6.6 适用仪器
所有适用的仪器型号,并提供与仪器有关的重要信息以指导用户操作。
6.7 检验方法
详细说明实验操作的各个步骤,包括:①实验条件:实验环境的温度、湿度等注意事项,检验试剂及样本复温等要求;②试剂使用方法(手工/半自动/全自动)、注意事项;③详述待测样品的预处理方法、步骤及注意事项;④明确样本检测加样量及反应时间;⑤详述配套仪器设置过程;⑥质量控制过程以及注意事项。
6.8 检验结果的解释
结合质控品对所有可能出现的结果进行合理的解释。本试剂的检测结果仅供临床参考,对患者的临床诊治应结合其症状/体征、病史、其他实验室检查及治疗反应等情况综合考虑。明确有可能存在的数值升高因素及数值降低因素,说明对何种条件下需要进行重复检测,以及在重复检测时对待测样本可能采取的优化条件等进行详述。
6.9 检验方法的局限性
说明检验方法的局限性:①明确干扰物质及浓度范围对检测结果的影响;②操作时必须严格按照操作规程,精心操作才能得到正确结果,对操作程序作任何修改都可能影响结果;③检测结果超出试剂盒线性范围的处理方法;③不同方法pH值要求对测定结果的影响
6.10 产品性能指标
说明该产品主要性能指标,应至少包括:外观、装量、试剂空白吸光度、分析灵敏度、线性范围、精密度、准确度和稳定性等。产品性能指标应不低于YY/T 1228—2014《白蛋白测定试剂(盒)》标准要求。
6.11 注意事项
应至少包括以下内容:①有关人源组分(如有)的警告,如:试剂内校准品或其他可能含有人源物质的组分,虽已经通过了HBs-Ag、HIV1/2-Ab、HCV-Ab等生物传染性项目的检测,但截至目前,没有任何一项检测可以确保绝对安全,故仍应将这些组分作为潜在传染源对待;②建议实验室的环境要求,如环境温度、湿度等;③对采集样本的要求,建议使用新鲜血清或血浆,勿使用溶血样本,明确样本的处理办法;④对所有样本和反应废弃物都视为传染源进行处理;⑤不同方法应说明对检测结果的影响因素;使用不同生产商的试剂对同一份样本进行检测可能会存在差异;⑥本试剂盒的检测结果仅供临床参考,对患者的临床诊治应结合其症状/体征、病史、其他实验室检查及治疗反应等情况综合考虑。
6.12 参考文献
注明引用的参考文献。
6.13 基本信息
应注明注册申请人、生产企业的基本信息。
[1] 尚红,王毓三,申子瑜.全国临床检验操作规程(第4版)[M].北京:人民卫生出版社,2015:340-341.
[2] 白蛋白测定试剂(盒)注册技术审查指导原则[Z].国家食品药品监督管理总局,2016.
[3] 关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告[Z].国家食品药品监督管理总局第44号公告,2014.
[4] 体外诊断试剂临床研究技术指导原则[Z].国家食品药品监督管理总局,2014.
[5] 中国国家标准化管理委员会.YY/T 1228—2014,白蛋白测定试剂(盒)[S].北京:中国质检出版社,2014.
[6] 关于发布体外诊断试剂说明书编写指导原则的通告[Z].国家食品药品监督管理总局第17号通告,2014.
Key Points for Technical Evaluation of Albumin Assay Kit
WU Dan LI Ping KUANG Pei-lin SHUAI Ming-zhu YAN Feng Jiangxi Provincial Center for drug evaluation (Jiangxi Nanchang 330008)
This paper gives an overview of the technical review of albumin assay kit . Including raw materials research, production process and reaction system research, analysis of performance evaluation, clinical evaluation, product technical requirements and operating manual. To provide guidance for the specifcation of albumin test kits (boxes) for registration and technical review.
albumin assay kit, technical evaluation
1006-6586(2017)13-0055-03
R446.6
A
2017-02-23