硝酸性质实验的一体化设计
2017-09-06马东张贤金
马东+张贤金
摘要:设计了铜与浓、稀硝酸一体化实验的改进装置。此装置还可用于二氧化氮溶于水的性质实验、一氧化氮的检验、硝酸的检验、尾气零排放等多个实验。巧妙借助三通玻璃管,该实验装置可以实现浓硝酸到稀硝酸的转化,以及模拟制备硝酸的工业流程,且符合环保理念。
关键词:硝酸性质实验;三通玻璃管;硝酸制备工业流程;一体化设计;实验改进
文章编号:1005–6629(2017)7–0060–04 中图分类号:G633.8 文献标识码:B
1 问题的提出
铜和浓硝酸、稀硝酸反应的实验是高中化学非常重要的性质实验,其在苏教版教材[1]中使用的装置如图1所示,实验中先从分液漏斗中注入1mL浓硝酸,实现铜与浓硝酸反应,再注入5mL水,稀释浓硝酸,完成铜与稀硝酸反应,继而达到性质检验的实验目的。该装置存在一些不足:(1)随着气体的不断生成,具支试管内压强增大,导致分液漏斗中的水无法顺利滴下;(2)无法验证铜与稀硝酸反应生成的无色气体是NO;(3)无尾气吸收装置,反应产生的一氧化氮最终保留在集气瓶及具支试管中。随着装置的拆卸一氧化氮释放到室内,污染了环境,所以导致很多教師常以“看视频”的形式代替做实验。
部分教师针对铜和浓硝酸反应或铜和稀硝酸反应实验进行了改进和创新,如谭云生老师[2]在铜与浓硝酸反应的改进中,将铜片改为可抽动的铜丝,可以控制反应的发生与停止,使用胶头滴管挤入水,水倒流到圆底烧瓶中,可以产生喷泉,增强了实验的趣味性,实现了一套装置的多种用途(见图2)。该装置存在的不足是:虽然在密闭条件下进行,但实验过程产生的NO并未得到处理,随着装置的拆卸,势必释放到空气中,污染环境。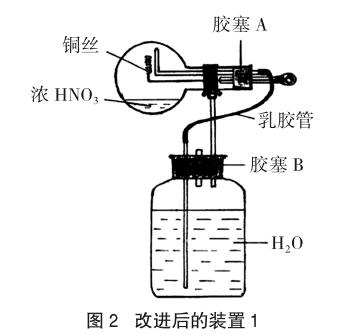
蒋重凯老师[3]在铜和稀硝酸反应的改进中,选择氢氧化钠溶液吸收尾气,但鉴于一氧化氮不能与氢氧化钠溶液直接反应,所以要在反应过程中打开左侧止水夹,使用洗耳球鼓入空气,使装置中的NO转化为NO2(见图3),解决了NO尾气吸收的问题,但该装置也有一定的缺陷即不能观察到一氧化氮的无色状态。
经过文献查阅与比较,笔者发现教师解决难点的方式大同小异:如观察一氧化氮的无色,大多教师采取的是先制取二氧化碳,利用其排出空气后观察一氧化氮的无色,并配合使用洗耳球鼓入空气,观察气体颜色的变化,从而证明生成的无色气体为一氧化氮。尾气吸收环节则采取气囊收集或者鼓入空气后用碱液吸收。鼓入空气环节往往使用洗耳球,借助洗耳球鼓入空气需要鼓入一次再重新吸入空气后再鼓入,操作有些不便。此外有些装置功能单一,药品用量大,尾气处理也并不恰当。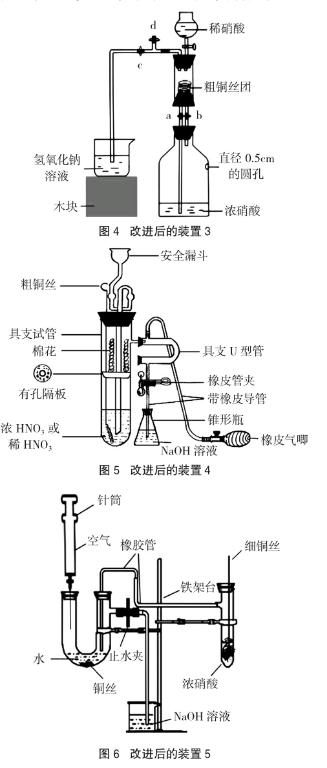
也有不少教师将铜和浓、稀硝酸反应的实验融合在一起,进行了铜和浓、稀硝酸的一体化实验,如改进装置图4[4]、图5[5]、图6[6],实现了全封闭的环境,也能观察到NO的颜色,但往往有NO残留,无法实现NO的零排放,且装置较为复杂,操作不方便,耗时长。郑长龙教授曾经指出,演示实验所采用的仪器和实验装置应力求简易、快速按时完成,这样做是为了把学生的注意力吸引到实验装置的主要部位上来,以减少因仪器过多装置复杂而分散学生的注意力[7]。
2 本实验装置的改进
2.1 设计灵感的来源
苏教版教材在介绍硝酸性质的同时,提供了工业制硝酸的流程图(见图7[8]),该过程本质上是采用水和氧气共同吸收氮氧化物制备硝酸。因此,铜与浓、稀硝酸产生的尾气除了可以常用碱液吸收,也可以在实践中选择氧气与水吸收以获得硝酸,实现“变废为宝”,同时为工业制硝酸提供实验支撑。笔者集合教材和文献中的装置的优点和不足,经反复的修改和尝试,进行了实验的创新设计。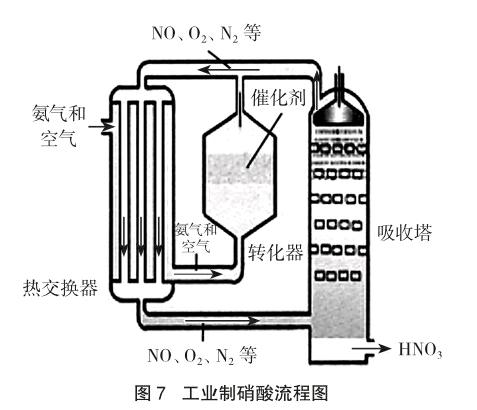
2.2 装置的改进和创新
2.2.1 制作方法
取双孔大橡胶塞、单孔小橡胶塞各一只,三通玻璃管上端接加压球(也称气唧),下端左侧的玻璃管穿过大小两个橡胶塞,通入小玻璃瓶(内装铜片),在小玻璃瓶上加10mL注射器一支(内装1mL浓硝酸),作为反应的发生装置如图8所示。最后把大橡胶塞和装满水的大塑料瓶连接起来,将20mL注射器(内装2mL紫色石蕊指示剂)针头穿过橡胶塞通入大塑料瓶,组装完成后的装置如图10、图11所示(部分仪器零部件见图9)。
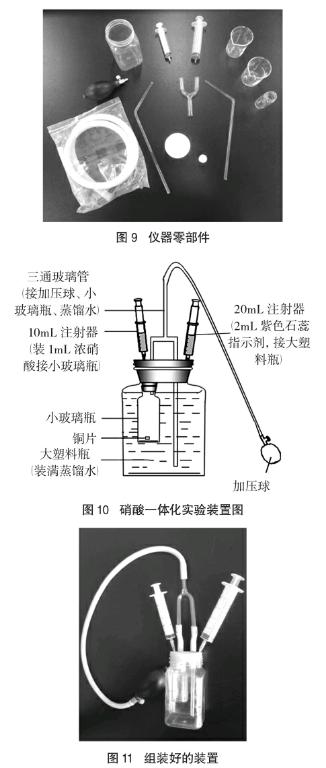
2.2.2 药品的选择
反应物的选择:浓硝酸的浓度为12mol·L-1,浓度大反应速率快,现象明显;铜片的规格为2cm×2cm。
2.2.4 实验步骤、现象和结论
(1)实验前准备:按图11所示组装装置,并检验装置的气密性。在2支注射器中分别加入1mL浓HNO3(左)和2mL石蕊指示剂(右),接好针头。大塑料瓶中加满蒸馏水,把上部装置连接好,注意小玻璃瓶(反应器)勿进水。
(2)铜与浓硝酸反应:用左侧注射器向小玻璃瓶中加入1mL浓硝酸,反应开始;小玻璃瓶中会立即产生红棕色气体,溶液开始显绿色,三通管中气体也逐渐变红棕色,大塑料瓶中的导气管放出气泡,先快后慢,产生均匀的气泡。
(3)铜与稀硝酸反应制取NO:向外拉动左侧注射器然后回位,小玻璃瓶中压强减小,促使水经过三通管倒吸进入小玻璃瓶,使浓硝酸被稀释,溶液颜色变为蓝色,同时产生无色气体,说明稀硝酸也能与铜发生反应。
(4)NO的检验:轻轻挤压加压球,空气进入,玻璃瓶中气体颜色变为红棕色,证明前一反应生成的气体为NO。
(5)NO的吸收:继续挤压加压球,注入空气,同时抽动左侧注射器,水倒流到小玻璃瓶中,重复该操作数次,就像“呼吸”一样,瓶中气体反复反应,直至注射器及瓶中气体为无色为止。此时装置中的氮氧化合物在氧气和水的作用下完全转化为硝酸。
(6)硝酸的检验:用20mL注射器向大塑料瓶中注入2mL紫色石蕊,溶液变红,证明最后溶液应为硝酸溶液。
(7)NO吸收完全的检验:右侧注射器抽少量气体后拔出并抽入空气,注射器内气体颜色无变化,进一步验证氮氧化合物已被吸收完全。
3 实验创新点
(1)“全封闭”無需更换浓、稀硝酸。利用三通玻璃管实现浓稀硝酸的转化,无需拆卸装置,直观对比铜与浓稀硝酸反应现象的差异,加压球代替洗耳球也使操作更加简便。
(2)装置集合了铜与浓、稀硝酸一体化实验、二氧化氮溶于水的性质实验、一氧化氮溶解性及一氧化氮与氧气反应的实验、生成硝酸的检验、尾气彻底被吸收的检验等多个实验,药品用量少,操作简单,反应快速,整个实验在7分钟左右完成,适合课堂演示。
(3)“会呼吸”氮氧化合物、氧气与水反应转化为硝酸,硝酸从哪里来,回到哪里去,变废为宝。此过程为工业生产流程中氮氧化物循环制硝酸提供了实验支撑,也实现了绿色环保的要求。
(4)本装置为“多功能”密闭装置,可适用于固液混合不加热型制取气体,并进行气体性质的检验。如二氧化硫的制取和性质实验、氯气的制取和性质实验、硫化氢的制取和性质实验等。
4 结语
实验的改进和创新应回归教材,能体会实验的功能和价值,理解实验背后所蕴涵的意义,承载知识的传递作用,更重要的是观念的渗透,最大程度地发挥实验的多重功能属性。在改进和创新中,不但能使学生感受化学的设计之美,同时也能带来视觉上的震撼,激发学生进一步改进实验装置的兴趣,培养创新意识。
参考文献:
[1][8]王祖浩主编.普通高中课程标准实验教科书·化学1(必修)[M].南京:江苏教育出版社,2011:100~102.
[2]谭云生.铜与浓硝酸反应演示器[J].教学仪器与实验,2006,(1):45~46.
[3]蒋重凯.教材中铜与稀硝酸反应实验设计的缺陷[J].化学教学,2004,(12):16~17.
[4]齐俊林.铜与浓稀硝酸一体化实验[J].中国教育技术装备,2006,(1):26~27.
[5]黄先碧,招业葵.铜和硝酸反应演示装置的改进[J].教学仪器与实验,2001,(4):33.
[6]陈静琼,倪晓添.浓稀硝酸与铜反应一体化微型实验再改进[J].江西化工,2013,(4):141~142.
[7]郑长龙.化学实验课程与教学论[M].北京:高等教育出版社,2009:112.
