运用数字实验探究氯水中化学平衡的存在
2017-09-06马善恒夏建华姚如富
马善恒+夏建华+姚如富
摘要:使用pH传感器、氯离子传感器、温度传感器、氧气传感器等仪器,测定了温度、c(Cl-)、c(H+)等的改变对于氯水中pH、氯离子浓度的影响,表征了氯水中平衡的存在。对氯水加热过程中pH和c(Cl-)同时减小的现象进行了分析,指出体系中HClO2和HClO3的生成是导致氯离子和pH减小的原因。
关键词:数字实验;传感器;氯水;化学平衡;实验探究
文章编号:1005–6629(2017)7–0071–03 中图分类号:G633.8 文献标识码:B
1 问题提出
2.3 实验仪器及药品
电脑(带有威尼尔软件)、数据采集器、氯离子传感器、pH传感器、温度传感器、氧气传感器、磁力搅拌器;饱和氯水、0.1mol/L NaOH溶液、浓H2SO4、0.1mol/L NaCl溶液等
2.4 实验装置图
2.5 设计思路及实验方案
根据勒夏特列原理,当改变一个平衡体系的外界条件时,平衡将向着减弱這种改变的方向移动。笔者依次向饱和氯水中滴加浓硫酸、氯化钠溶液、氢氧化钠溶液,测定溶液中c(Cl-)与pH变化,以验证勒夏特列原理。特设计如下3个实验。
实验1 在饱和氯水中滴加1mL浓硫酸,测c(Cl-)与pH;
实验2 在饱和氯水中滴加1mL 0.1mol/L NaCl溶液,测c(Cl-)与pH;
实验3 在饱和氯水中滴加1mL 0.1mol/L NaOH溶液,测c(Cl-)与pH;
对饱和氯水进行加热,会出现氯气挥发、次氯酸分解等现象,为弄清楚加热最终对溶液中c(Cl-)与pH造成什么影响,特设计实验4:加热饱和氯水,同时测溶液中c(Cl-)、pH及温度的变化。
2.6 实验步骤及数据分析
实验1 向20mL饱和氯水中滴加1mL浓硫酸,测c(Cl-)与pH变化如图2所示。
现象与分析:c(H+)增大、c(Cl-)减小,与预期现象相同。说明加入浓硫酸,增加了c(H+),pH降低,使得氯气与水反应的平衡逆向移动,c(Cl-)降低。
实验2 向20mL饱和氯水中滴加1mL 0.1mol/L NaCl溶液,测c(Cl-)与pH变化如图3所示。
现象与分析:c(Cl-)增大、c(H+)减小,与预期现象相同。说明加入氯化钠溶液,增加了c(Cl-),使得氯气与水反应的平衡逆向移动,c(H+)减小,pH增大。
实验3 向20mL饱和氯水中滴加1mL 0.1mol/L NaOH溶液,测c(Cl-)与pH变化如图4所示。
现象与分析:c(H+)减小、c(Cl-)增大,与预期现象相同。说明加入氢氧化钠溶液,增加了c(OH-), pH升高,使得氯气与水反应的平衡正向移动,c(Cl-)增加。
实验4 对20mL饱和氯水加热,测c(Cl-)、pH及温度变化如图5所示。
现象与分析:随着温度的升高,c(Cl-)减小,c(H+)升高,与预期现象不符合,为什么会出现这种情况?氯气与水的反应是放热还是吸热过程,是不是反应产物HClO在加热过程中发生了分解,升高温度是否带来什么新的化学变化?
为了探究这种反常现象出现的原因,笔者又设计了如下两个实验来探究氯水制备过程中的热效应以及加热过程中HClO是否会分解。
实验5 测定氯水制备过程的热效应。
实验步骤:在通风橱内向装有80mL蒸馏水的锥形瓶(瓶口塞上棉花团)中鼓入氯气,至溶液中pH没有明显变化停止通入氯气,使用数据采集器,测定在此过程中溶液内温度及pH变化。具体数据如图6所示。
分析:由实验数据可知,氯气与水的反应是放热反应。因此加热过程中氯气与水的反应向着逆反应方向移动,这可以解释为什么氯离子浓度降低。
实验6 测定加热过程中HClO是否分解。
实验步骤:取30mL饱和氯水注入三颈瓶内,并插入氧气传感器和温度传感器,密闭容器,再将三颈瓶置于热水中。使用数据传感器测定随着温度的升高,三颈瓶内氧气含量的变化。具体数据如图7所示。
分析:从图中可知,加热过程中,随着温度的升高,氧气的含量逐渐增大,说明加热也促进了次氯酸的分解,生成了HCl与O2。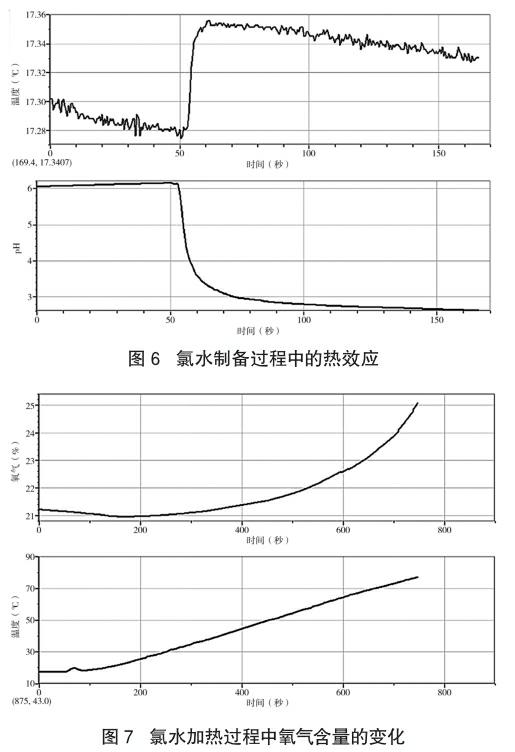
3 结果与讨论
从以上实验数据可知,氯气与水的反应是可逆反应,存在化学平衡。当改变平衡体系中某种组分的浓度时,化学平衡向着减弱这种改变的方向移动,符合勒夏特列原理。
至于为什么升高温度c(Cl-)减小的同时c(H+)增大?结合实验5和实验6,笔者又查阅了相关资料发现,次氯酸在水溶液中能同时发生以下反应:
在加热过程中c(Cl-)减小、c(H+)升高,这种现象是多个反应同时进行带来的结果,即:温度升高使氯气与水的反应(放热反应)逆向进行,此外加热带来氯气的挥发,同样促使该反应向逆反应方向移动,因此氯离子的浓度减少;但同时HClO分解产生 HCl和O2,以及HClO歧化生成HCl和HClO3这两个过程都生成强酸,电离程度大大增强,因此溶液中氢离子浓度也应该是增大的,这两者之间并不矛盾。《无机化学丛书》第六卷中也对反应③的反应机理进行了解释,认为该反应分两步进行:
4 结语
化学平衡的存在之前更多地停留在教师的口头讲解上,本文使用pH传感器、氯离子传感器、温度传感器、氧气传感器等仪器,在学生面前直观地展现出平衡的存在,让平衡移动变得“摸得着、看得见”,对于学生理解勒夏特列原理非常有帮助。氯水加热过程中呈现出pH、c(Cl-)同时减小,对一系列平衡移动导致结果不同进行了分析,可促使学生综合分析问题及实验探究能力的提升。
参考文献:
[1]张映明.氯气与水的歧化反应是可逆反应[J].化学教学,2015,(2):92~94.
[2]段昌平,江岚.细说氯水[J].化学教学,2009,(6):78~80.
[3]吴民生.光照氯水实验新设计[J].化学教学,2014,(8):52~54.
[4]韩竹海.“氯水的成分探究”同题异构的课堂教学分析[J].化学教育,2016,(13):16~19.
[5]于永民.采用自制教具演示氯水光解实验[J].化学教育,2016,(11):71~72.
[6]《无机化学丛书》编写组.无机化学丛书·第六卷[M].北京:科学出版社,1995:290~344.
