钠离子电池正极材料Na0.44MnO2的研究进展
2017-09-06史文静燕永旺徐守冬陈良刘世斌张鼎
史文静,燕永旺,徐守冬,陈良,刘世斌,张鼎
(太原理工大学化学化工学院,山西 太原 030024)
钠离子电池正极材料Na0.44MnO2的研究进展
史文静,燕永旺,徐守冬,陈良,刘世斌,张鼎
(太原理工大学化学化工学院,山西 太原 030024)
钠离子电池的研究开发在国内外处于迅速发展的浪潮中,而具有隧道结构的Na0.44MnO2作为正极材料具有既可以支持高能量密度和长循环寿命的非水电解质电池,也可以支持安全和高倍率的水溶液电解质电池的优点,成为一个重要的研究热点。本文比较系统地综述了Na0.44MnO2作为钠离子电池正极材料的研究现状,从晶体结构和充放电机理等方面进行了讨论,重点阐述了Na0.44MnO2材料的合成方法以及不同的合成方法对其结构形貌和电化学性能的影响,同时,也介绍了Na0.44MnO2材料在全电池和水系电池中的应用现状和前景以及对Na0.44MnO2正极材料掺杂和表面包覆等改性方面的研究进展,并且总结分析了改性工艺对其结构与电化学性能的影响,认为Na0.44MnO2材料对于钠离子电池仍具有极大的科研价值和应用前景。
钠离子电池;正极材料;锰酸钠;电化学;合成;纳米材料
近年来,锂离子电池因其高的能量密度、长的循环寿命[1-2]等优点已被广泛应用在手机、计算机等便携电子设备上,并且逐步应用在电动汽车以及一些储能电站上,这极大地增加了锂资源的需求。然而锂资源储量有限且分布不匀,其工业用途广泛,作为电池材料使用时价格昂贵[3]。钠与锂都处于第Ⅰ主族,电化学性质相似,而且地壳中钠资源丰富,价格低廉、无毒[4-9],除此之外,钠离子电池的半电势要比锂离子电池高出0.3V左右,这表明钠离子电池可以利用分解电势更低的电解质溶剂和电解质盐[10],而且钠离子电池有相对比较稳定的电化学性能,使用更加安全[11],所以可以用钠离子电池替代锂离子电池来满足其规模化和可持续发展的需求。
正极材料是钠离子电池的重要组成部分之一,主要包括过渡金属氧化物、聚阴离子化合物等类型,其中过渡金属氧化物的相关研究源于对多种结构的锰氧化物的探索,如层状的NaMnO2、Na0.67MnO2和隧道结构的Na0.44MnO2等材料[12-15]。在这些锰氧化物中,具有三维隧道结构的Na0.44MnO2材料表现出优异的电化学性能,不仅可以应用在有机电解液中,还可以作为水溶液钠离子电池的正极材料使用[16],具有较好的应用前景和科研价值。由于电极材料的电化学性能往往与其制备方法和工艺条件有着密切的关系,本文较为系统地总结分析了国内外学者对隧道型Na0.44MnO2材料的制备方法和不同制备方法对其电化学性能的影响,以及研究者为了进一步改善材料的性能而开展的掺杂、表面包覆等改性方面的研究工作。
1 Na0.44MnO2材料的结构与充放电机理
根据DOEFF等[17]早期的研究结果,Na0.44MnO2与Na4Mn4Ti5O18是同构体,都是正交晶系,属于Pbam群,其结构框架是由MnO5四方锥和两个或三个一组的MnO6八面体连接成链形成的隧道结构,在这种隧道结构中,Na1位于小S型隧道中,几乎全部占满,而Na2和Na3位于大S型隧道中,其中Na2约占2/3,Na3约占1/3。KIM等[18]提出锰有5种晶体学位置,其中Mn1、Mn3和Mn4位置主要是Mn4+,而Mn2和Mn5位置主要是Mn3+。ZHAN等[19]提出所有的Mn4+和一半的Mn3+处于MnO6的八面体碱金属离子位置,另一半的Mn3+处于四方锥碱金属离子位置。结构如图1所示。
SAUVAGE等[21]提出Na+在x=0.22~0.66的范围内能够可逆地脱嵌,对应的理论比容量为121mA·h/g,还指出只有位于大隧道的Na+具有电化学活性,能够可逆的脱嵌,而位于小隧道的Na+几乎没有电化学活性。DAI等[22]提出了Na0.44MnO2充放电过程中的电极反应,如式(1)。
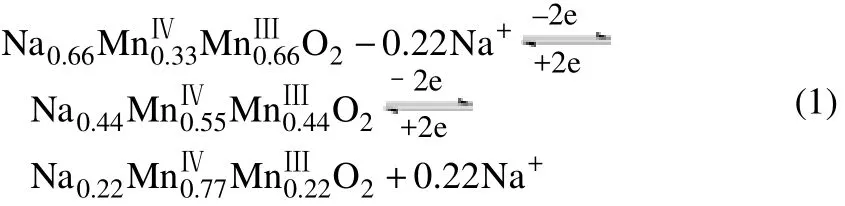
PARANT等[23]给出Na0.44MnO2材料的晶胞参数为:a=9.10ű0.02Å,b=26.34ű0.08Å,c=2.821ű0.005Å(α=β=γ=90°,1Å=01nm),其他学者给出的晶胞参数基本与此相近[22,24-26]。SAUVAGE等[21]研究了Na+的脱嵌机制,认为在2~3.8V(vs.Na+/Na)的电压范围内进行充放电时,主要发生的是多个两相转变机制,同时提出Na+从Na0.44MnO2的脱出过程中主要影响参数b,而嵌入过程主要影响参数a和c,这表明在充放电过程中,晶格参数的变化是非对称的。KIM等[18]研究了Na0.44MnO2在充放电过程中中间相的转变机制,他们认为Na+从Na0.22MnO2到Na0.44MnO2的嵌入过程中,晶格参数仅仅沿着b轴方向增大,Na+从Na0.44MnO2到Na0.66MnO2嵌入过程中,晶格参数沿着a和c轴方向增大,而在b轴上几乎没有变化。这种晶格参数的非对称性变化主要是因为在充放电过程中锰八面体发生了Jahn-Teller效应造成的。文章中提出对其进行掺杂可以有效地降低锰八面体的Jahn-Teller效应。但就目前来讲,对于隧道型结构的Na0.44MnO2材料,其充放电反应机理尚未明确。在材料的实际研究过程中,不同制备条件下得到的材料的电化学性能差异较大,由于制备条件对于容量和循环性能有着重大的影响,所以对于相关工作的总结分析具有较为重要的意义。
2 Na0.44MnO2材料的通用制备方法
作为电极活性材料使用时,不同的制备方法得到的材料在形貌和结构上会存在一定的差异,因此制备方法的不同也可能会对电化学性能产生一定的影响。目前Na0.44MnO2材料的制备方法主要有高温固相法(solid-state method)、水热法(hydrothermalmethod)、溶胶-凝胶法(sol-gel method)和熔盐法(flux synthesis method)等,其中溶胶-凝胶法又可细分为聚合物热解法(polymer-pyrolysis method)、燃烧法(combustion processes method)和有机酸Pechini法等。不同方法制备的材料的形貌如图2所示。
2.1 高温固相法
高温固相法通常是固相物质经过机械混合后转移到高温炉中,在一定的气氛下经过结晶过程冷却后得到产物。该制备工艺在操作方面相对比较简单,易于工业化处理。但由于反应物机械混合过程中涉及微粒之间的碰撞,因此团聚问题较为突出,不利于材料的均一性。
ZHAO等[29]以MnCO3和Na2CO3为原料(其中Na/Mn=0.46∶1),先在300℃焙烧8h以分解碳酸盐,再在800℃焙烧9h得到Na0.44MnO2材料,随后与少量的CNTs球磨混合得到Na0.44MnO2-CNTs复合物。电化学测试表明,在2.0~4.0V电压范围内,0.1C下首周放电比容量为113mA·h/g,0.5C下经过40周循环后容量保持率为98%,这可能是因为Na0.44MnO2与CNTs的复合得到了导电性较好的复合材料。SAUVAGE等[21]也采用上述固相法制备了Na0.44MnO2。在2~3.8V电压范围内,0.1C下首周放电比容量为80mA·h/g,循环50周之后容量只剩下一半左右,表明该方法制备的Na0.44MnO2材料的循环性能较差。DEMIREL等[25]以Na2O2和MnO2为原料,使其混合均匀后在750℃焙烧24h,得到Na0.44MnO2,EDX分析表明,Na/Mn=0.576∶1。在2.5~3.8V电压范围内,1C下首周充放电比容量分别为200mA·h/g、100mA·h/g,但随着循环次数的增加,容量衰减比较严重,循环到75周,放电比容量只有50mA·h/g左右。
2.2 水热法
水热法通常是在100~200℃的温度下,将可溶性或部分可溶性的反应物放在密闭容器中,通常是以聚四氟乙烯容器为内衬的不锈钢反应釜,在加热条件下依靠水溶液或水蒸气以及其他流体作为反应介质,由于水热条件下离子扩散速率增大,能够获得均一反应物形成的前体,然后经过高温处理得到目标产物,但缺点是反应时间比较长。

图2 不同合成方法样品的扫描电镜图
HOSONO等[27,30]将一定量的商品Mn3O4粉末分散在NaOH水溶液中,将其转移到反应釜中在205℃反应4天,通过洗涤干燥得到均相的Na0.44MnO2纳米线,在50mA/g电流密度下,第二周的放电比容量为120mA·h/g;在0.42C、0.83C、8.3C下,放电比容量分别为115mA·h/g、110mA·h/g、103mA·h/g,8.3C下的容量损失仅为10%,这表明水热法制备的单晶Na0.44MnO2纳米线具有很好的倍率性能。LI等[31]采用的水热法含有两步工艺,第一步是将Mn2O3粉末分散到NaOH水溶液中,搅拌10min中后转移到反应釜中,在200℃反应2天,然后进行离心、洗涤等处理;第二步是将第一步中得到的产物再与等量的NaOH水溶液混合以保证Mn2O3反应完全,转移到反应釜中在200℃再反应2天,将离心、洗涤、干燥得到的产物再在600℃焙烧2h得到Na0.44MnO2,SEM图片显示,形貌为纳米线结构,长度在10μm左右,直径小于100nm。
2.3 溶胶-凝胶法
溶胶-凝胶法是利用金属阳离子与有机物螯合形成均匀溶胶,然后经过加热蒸发溶剂形成干凝胶,再经过高温反应得到产物。此方法的优点在于金属离子在凝胶中可以达到原子级别的均匀分散,产物粒径分布较窄,缺点是工艺过程较为复杂,同时需要消耗大量的有机酸类物质。
XU等[32]以NaNO3(过量10%)和MnNO3为原料,柠檬酸为螯合剂,90℃加热搅拌4h形成凝胶,在120℃干燥12h得到前体,经研磨后在450℃焙烧6h以分解硝酸盐,再在900℃焙烧15h得到Na0.44MnO2。电化学测试表明,在2~4V电压范围内,0.1C下首周放电比容量高于120mA·h/g,循环100周后,容量保持率为100%,这是因为该方法缩短了Na+扩散路径,从而提高了容量保持率。LIU等[4]以Na(CH3COO)·3H2O和Mn(CH3COO)2·4H2O为原料(其中Na/Mn=1∶5),柠檬酸为螯合剂,并用氨水调节pH=7,在80℃加热搅拌4h形成沉淀,再在60℃过夜干燥得到前体、将其先在300℃焙烧10h,再在750~850℃焙烧2h得到Na0.44MnO2。SEM图片显示,其形貌为棒状,直径在0.2~1μm之间。
2.3.1 聚合物热解法
聚合物热解法是先将金属盐溶解到聚合物的溶液中,利用聚合物极性单元的络合作用形成金属离子均匀分布的前体,然后经过高温处理得到目标产物的一种方法,一般容易制备出形貌良好的纳米线[33-34]。CAO等[33]以NaNO3和Mn(NO3)2为原料,将其按照化学计量比溶解在丙烯酸溶液中,在80℃加入5% (NH4)2S2O8的水溶液引发聚合制备前体,将其在120℃干燥24h后分别在不同温度焙烧24h得到Na0.44MnO2。电化学测试表明,在2~4V电压范围内,0.1C下750℃合成的Na0.44MnO2材料的首周放电比容量为128mA·h/g,0.5C下循环1000周容量为84.2mA·h/g,保持率为77%。
2.3.2 燃烧法
燃烧法可以视为一种改进的聚合物热解法,从实验过程来看该方法也是溶胶-凝胶法的一种,与传统的溶胶-凝胶法不同的是,此反应过程一般伴随大量气体的释放,抑制了产物颗粒的长大[35]。DAI等[22]采用聚乙烯吡咯烷酮(PVP)辅助凝胶燃烧的方法合成Na0.44MnO2,以NaHCO3和Mn(OAc)2·4H2O为原料(Na/Mn=0.44∶1,物质的量比),PVP为螯合剂,用HNO3调节pH=3,混合均匀后在120℃干燥得到凝胶,再在400℃热处理2h后分别在不同温度焙烧6h得到Na0.44MnO2。XRD数据表明,在850℃合成的材料中含有Mn2O3杂相,900℃制备Na0.44MnO2结晶度最高。电化学测试表明,在2~4V电压范围内,0.2C下,900℃制备的Na0.44MnO2具有最高的放电比容量,可以达到122.9mA·h/g,经过0.2C、1C、5C、10C、20C和1C不同的倍率充放电之后仍能恢复到初始容量的99.8%,这表明900℃合成的Na0.44MnO2具有合适的尺寸,有利于Na+可逆地脱嵌,因此具有良好的电化学性能。
2.3.3 Pechini法
Pechini法[36]也可以视为一种特殊的溶胶-凝胶法,一般是利用了弱酸可以和阳离子反应生成螯合物的原理,而这种螯合物在受热过程中可以和多羟基醇聚合发生酯化反应生成固态聚合树脂,从而使金属阳离子均匀分散在整个树脂内。KIM等[37]以Na2CO3和Mn(OAc)2·4H2O为原料,柠檬酸为螯合剂,经过加热处理后形成凝胶,再在800℃焙烧9h后得到Na0.44MnO2。在2~3.8V电压范围内,以0.1C、0.2C、0.5C、1C不同的倍率测试,结果表明:在有机电解液中放电比容量分别为65mA·h/g、59mA·h/g、47mA·h/g、32mA·h/g,在水系电解液中放电比容量分别为40mA·h/g、39mA·h/g、36mA·h/g、33mA·h/g;同时,该材料在水系电解液中的扩散系数(1.08×10–13~9.15×10–12cm2/s)高于在有机电解液中的扩散系数(5.76×10–16~2.14×10–14cm2/s)。RUFFO等[38]也采用上述修饰的Pechini法制备了Na0.44MnO2材料,电压范围为2~3.5V,电流密度为11mA/g(C/25),首周放电比容量为115mA·h/g,循环20周之后容量为105mA·h/g,循环过程中容量衰减比较严重。不同合成方法材料的充放电曲线如图3所示。
2.4 熔盐法
熔盐法是将熔融盐作为反应物或熔剂,利用高温下固液态之间的反应特点,可以增加反应物之间的接触面积,从而有效地降低热处理温度,缩短反应时间,有利于得到形貌良好、粒径均匀的产物。

图3 不同合成方法制备的Na0.44MnO2样品的充放电曲线
ZHAO等[24]以Na2CO3、MnCO3和NaCl为原料(其物质的量比为0.44∶1∶10),在850℃焙烧5h,然后用去离子水和乙醇洗涤以除去多余的NaCl,再在60℃干燥过夜得到Na0.44MnO2。结果表明,在2~4V电压范围内,0.1C下首周放电比容量为106mA·h/g,以0.1C、0.5C、1C和2C不同的倍率充放电,放电比容量分别为106mA·h/g、97mA·h/g、90mA·h/g、76mA·h/g,在0.5C下经过40周循环后容量保持率为94%。AKIMOTO等[39]以Na2CO3和Mn2O3为原料(其中Na/Mn=0.5∶1),将其混合后置于铝坩埚中,在1173K焙烧12h,将得到的产物和NaCl混合(物质的量比为1∶5)置于铂坩埚中,再在1173K焙烧15h,以5K/h的冷却速率冷却到973K,最终得到黑色针状的Na0.44MnO2,其最大体积为0.2mm×0.02mm×0.01mm。
CHU等[40]以Na2CO3、Mn2O3和NaCl为原料(其物质的量比为0.44∶1∶20),经过研磨混合后置于铝坩埚中,在1023K焙烧24h,用去离子水洗涤以除去多余的NaCl,再在333K过夜干燥后得到Na0.5MnO2材料,SEM图片显示,其形貌为棒状结构,直径在500nm左右,长度在3~20μm之间。YU等[41]以Mn3O4、Na2C2O4和NaCl为原料,研磨30min,在900℃焙烧2h,经过洗涤干燥得到Na0.44MnO2,SEM图片显示其形貌为纳米带状,长度达到几十微米,表明该合成方法能够增大产物的尺寸。不同合成方法材料的循环伏安曲线如图4所示。
3 基于有机电解液的锰酸钠全电池
锰酸钠材料不仅可以作为半电池的正极材料,也可以作为全电池的正极材料,而且表现出良好的电化学性能。LI等[42]研究了Na0.44MnO2作为全电池正极材料的电化学性能。他们采用固相法制备Na0.44MnO2,将其作为全电池的正极材料,硬碳作为全电池的负极材料,先将Na0.44MnO2正极材料和硬碳负极材料分别组装成半电池,经过几周循环后再组装成全电池,电化学测试表明:在1.5~4.1V电压范围内,1C下首周放电比容量可以达到116mA·h/g,比能量为313W·h/kg,库伦效率和能量效率分别为99.2%和93%,循环1000周之后容量保持率为75%左右;在0.1C、0.2C、0.5C、1C、2C、4C、0.5C下,放电比容量分别为114mA·h/g、111mA·h/g、109mA·h/g、106mA·h/g、102mA·h/g、95mAh/g、107mAh/g,这表明经过不同的倍率循环后,全电池的容量仍然能恢复到初始容量,其电化学性能如图5所示。
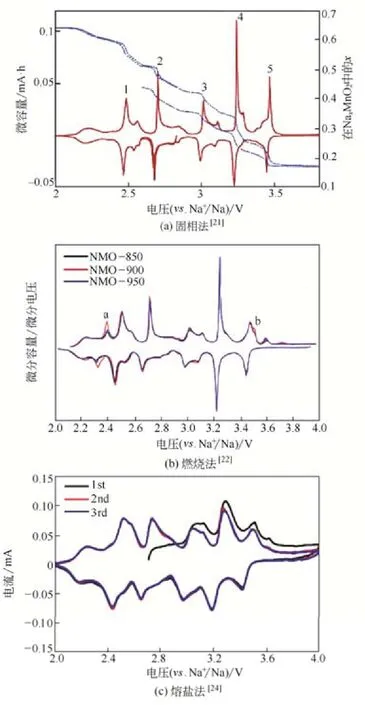
图4 不同合成方法制备的Na0.44MnO2样品的循环伏安曲线

图5 全电池在倍率1C下的电化学性能[42]
4 锰酸钠正极材料在水系电池中的应用
锰酸钠作为正极材料不仅可以应用在有机电解液体系中,还可以应用于水系电解液体系中,而且与有机电解液体系相比,水系钠离子电池更为安全,也具有广泛的应用价值。WHITACRE等[16]采用固相法合成了Na4Mn9O18。电化学测试采用三电极和两电极体系,所用的电解液为1mol/L的Na2SO4水溶液。在–0.4~0.25V(相对于饱和甘汞电极)电压范围内,C/8下放电比容量为45mA·h/g,10C下的比容量为20mA·h/g。
LIU等[4]采用溶胶-凝胶法制备了Na4Mn9O18材料,研究了该材料在超级电容器中的应用。800℃焙烧的Na4Mn9O18材料在200mA/g的电流密度下,0.8V的电压范围内首周放电比容量为44.5mA·h/g。将其作为正极,活性炭作为负极来测试非对称超级电容器的性能。结果表明,在0~1.7V电压范围内,500mA/g电流密度下循环4000周后容量保持率为83%,库伦效率为100%,这表明该材料在水系电解液中很稳定,具有广大的应用前景。
TEVAR等[43]采用固相法制备了Na0.44MnO2材料,研究了不同的Na/Mn比对材料的影响,并进一步研究了该材料在水系电池中的应用。XRD数据表明,当Na/Mn=0.55时可以获得相对比较纯的Na0.44MnO2产物,当Na/Mn<0.55时会有较多的α-Mn2O3杂质相,当Na/Mn>0.55时会有较多的β-Na0.70MnO2杂质相。在0~0.8V(相对于饱和甘汞电极)电压范围内,25mA/g的电流密度下,当Na/Mn=0.60和0.55时具有较高的放电比容量,分别为35mA·h/g和30mA·h/g,而且当Na/Mn(0.55~0.7)较高时的循环稳定性要好于Na/Mn(0.33~0.50)较低时的循环稳定性。Na0.44MnO2材料在水系电池中的电化学性能如图6所示。
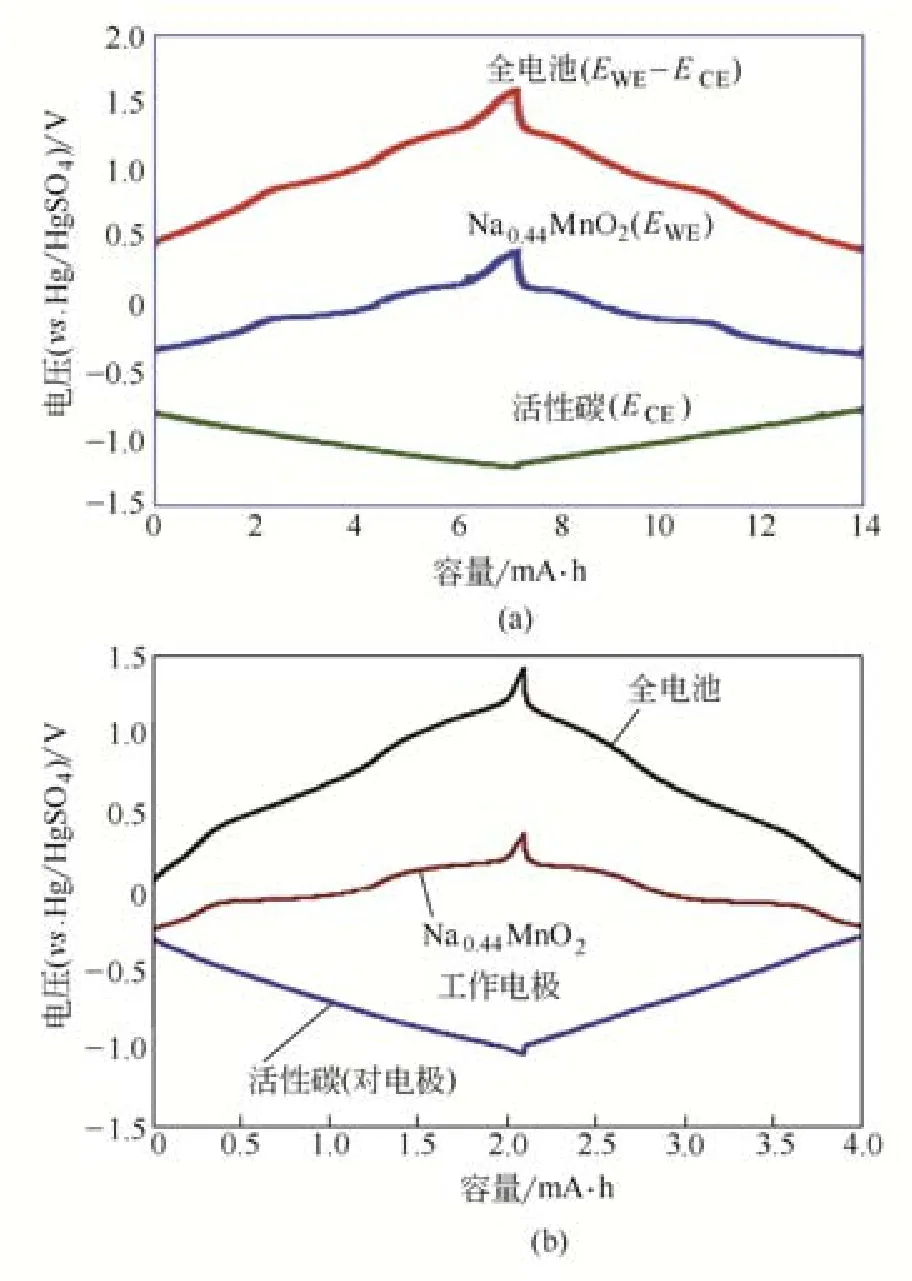
图6 水系钠离子电池Na0.44MnO2正极材料的充放电曲线[16,43]
5 锰酸钠正极材料的改性
大多数锰氧化合物在应用过程中存在的最大问题就是在循环过程中有较大的容量衰减,而造成这一问题的主要原因有以下两点:①锰的溶解。Mn3+在循环过程中发生歧化反应生成Mn2+和Mn4+,造成Mn逐渐被腐蚀溶解[44],使Na+脱嵌变得更困难,从而降低容量;②Jahn-Teller效应[45]。Mn3+t2g或eg中各轨道上电子数不同出现简并态,使一个轨道能级降低,从而导致配位离子变形,为了消除这种简并态,就会产生Jahn-Teller畸变。这种畸变会导致氧离子的移动而产生氧空位,从而阻碍了Na+脱嵌,降低比容量[46]。针对以上问题,很多学者提出了对Na0.44MnO2材料进行改性研究,主要方法是离子掺杂和氧化物表面包覆。
5.1 掺杂改性
钛离子的半径和价态与锰离子相近,通过Ti元素的掺杂可以有效地降低锰离子的Jahn-Teller效应,提高材料的循环稳定性。GUO等[47]通过固相法合成了Na0.61Ti0.48Mn0.5O2材料。电化学测试表明,在1.5~4V电压范围内,0.2C下首周充放电比容量分别为46mA·h/g、86mA·h/g,循环100周后放电比容量为70mA·h/g,容量保持率为81%。JAYAKUMAR等[48]采用固相法制备了Na4Mn4Ti5O18材料,电化学测试表明,在1.5~3.95V电压范围内,0.1C下放电比容量为102mA·h/g,以0.1C、0.2C、0.5C、1C不同的倍率充放电,放电比容量分别为102mA·h/g、86mA·h/g、75mA·h/g、60mA·h/g。ZHAN等[49]采用溶胶-凝胶法合成了Na0.44TixMn1–xO2材料。测试结果表明,在2~4.5V电压范围内,电流密度为20mA/g时,Na0.44TixMn1–xO2(x=0.11、0.22、0.33、0.44)的放电比容量分别为70.9mA·h/g、118.2mA·h/g、119.4 mA·h/g、68.2mA·h/g,可见x=0.22和0.33的样品的容量高于x=0.11和0.44的容量。
Fe、K等元素也被应用在Na0.44MnO2材料的掺杂改性中。如XU等[50]采用固相法制备了Na0.61[Mn0.27Fe0.34Ti0.39]O2,电化学测试表明,在2.6~4.2V电压范围内,0.1C下首周放电比容量为98mA·h/g,以0.1C、0.2C、0.5C和1C不同的倍率进行测试,比容量分别为96mA·h/g、77mA·h/g、58和43mA·h/g,在0.2C循环100周后容量保持率为90%。WU等[51]采用共沉淀方法对Na0.44MnO2进行了K掺杂,制备了Na0.5K0.1MnO2材料。电化学测试表明,在1.5~4.3V内,0.1C下最高可逆比容量为142.3mA·h/g,循环100周后容量为94.7mA·h/g,以0.1C、0.5C、1C、2C、4C和0.1C不同的的倍率进行充放电,放电比容量分别为129.4mA·h/g、106.7mA·h/g、98.9mA·h/g、89.9mA·h/g、71.1mA·h/g、120mA·h/g。这是因为钾的掺杂得到了Na0.44MnO2和KMn8O16的两相复合结构,从而提高了比容量。不同掺杂材料的电化学性能如图7所示。
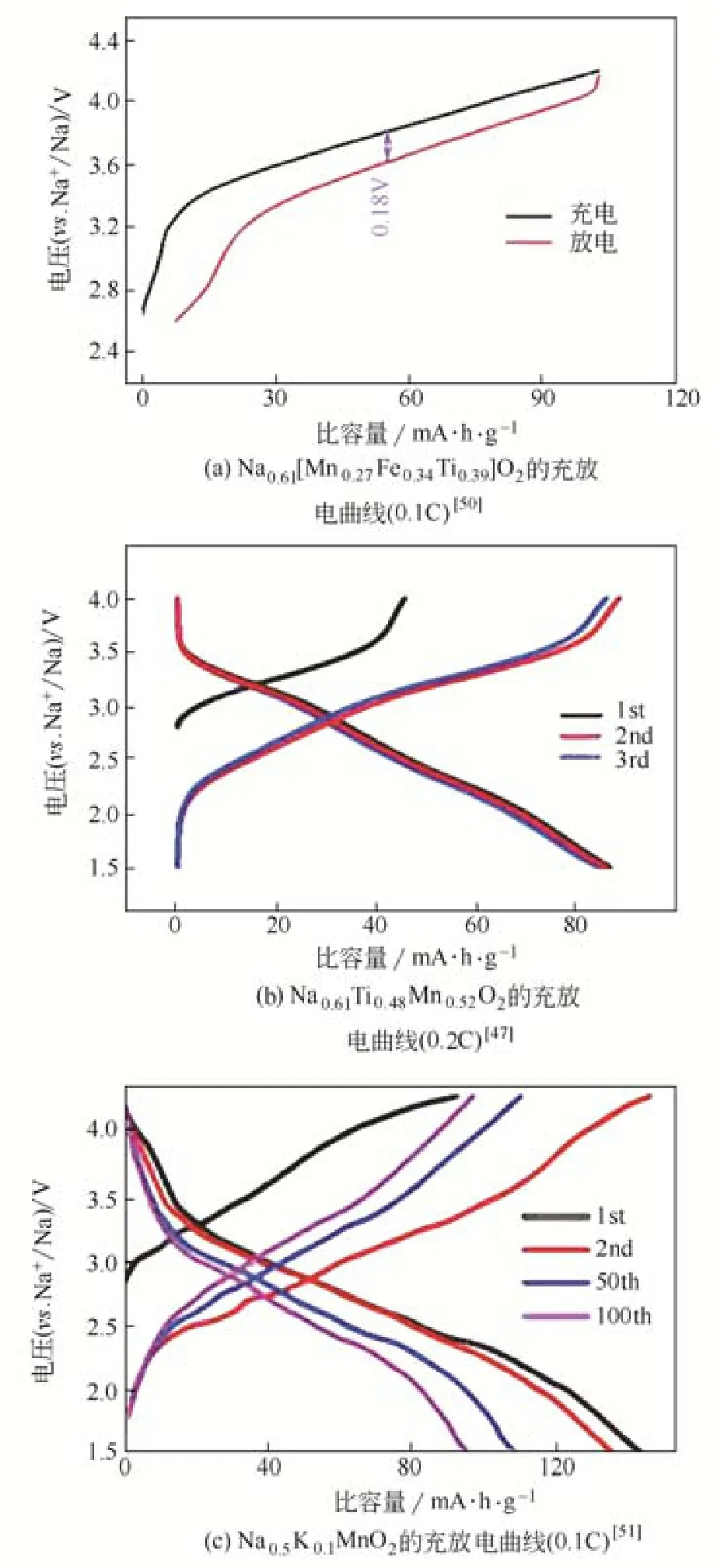
图7 不同掺杂材料的充放电曲线
5.2 包覆改性
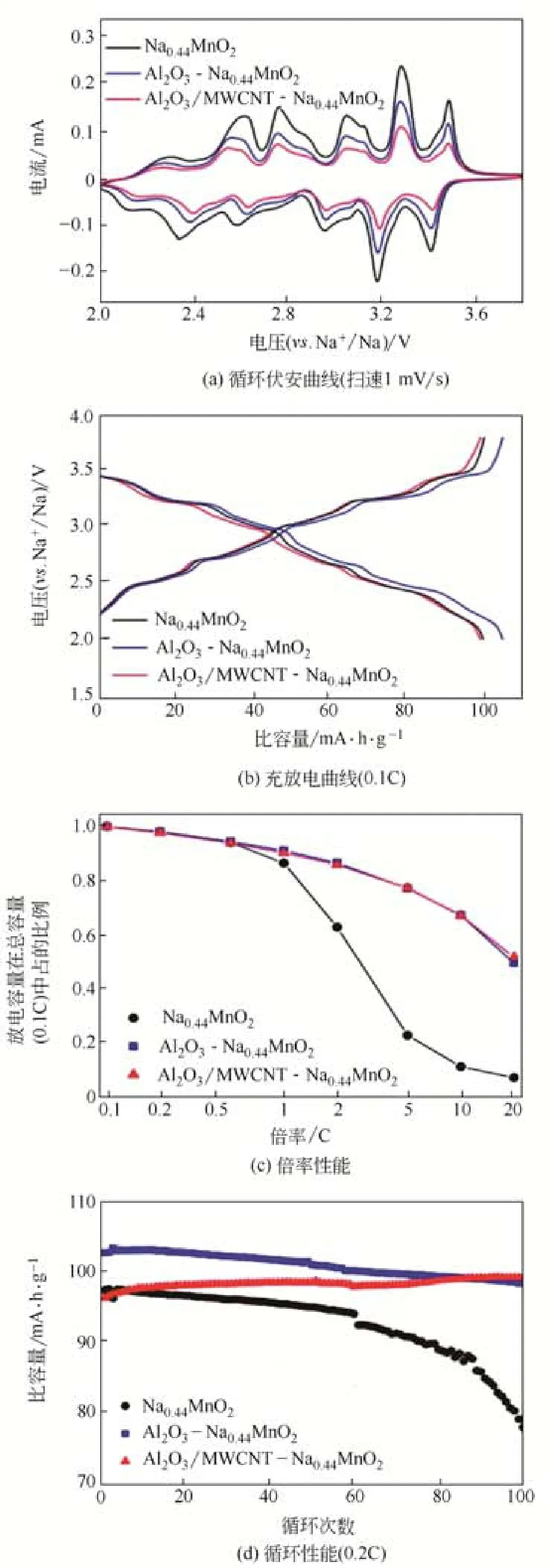
图8 未包覆和经过表面包覆的Na0.44MnO2材料在2~3.8V(vs. Na+/Na)电压范围内的电化学性能[52]
除了掺杂之外,对Na0.44MnO2材料进行表面包覆改性也是改善其电化学性能的有效手段。PARK等[52]采用固相法制备了Na0.44MnO2材料,然后采用Nobilta机械融合系统将Al2O3纳米粉末和MWCNTs(多壁碳纳米管)与Na0.44MnO2材料进行混合,从而实现对Na0.44MnO2材料的包覆改性。充放电测试表明,在0.1C下Na0.44MnO2材料放电比容量为100.2mA·h/g,经过Al2O3包覆得到的Al2O3-Na0.44MnO2材料和经过Al2O3/MWCNT包覆得到的Al2O3/MWCNT-Na0.44MnO2材料放电比容量分别为105.3mA·h/g和100.2mA·h/g;倍率性能测试表明,在较低的电流密度下(≤0.5C),Al2O3和Al2O3/MWCNT对抑制容量的衰减无明显影响,但在较高的电流密度下(≥1C),Al2O3和Al2O3/MWCNT能够明显抑制容量的衰减。从循环性能上来看,Na0.44MnO2材料在0.2C下循环60周之后放电比容量大幅度地衰减,Al2O3-Na0.44MnO2材料循环100周之后容量为98.2mA·h/g,保持率为95.8%,而Al2O3/MWCNT-Na0.44MnO2材料循环100周之后,放电比容量为99.0mA·h/g,这表明Al2O3和Al2O3/MWCNT对Na0.44MnO2材料进行包覆之后提高了其循环稳定性。其电化学性能如图8所示。
6 结语
隧道型锰酸钠材料是一种综合性能优异的钠离子电池正极材料。其优点集中体现在:①钠和锰都是非贵金属元素,可以实现规模化储能的应用;②充放电过程中结构稳定,循环性能优异;③在水系电解液中能稳定存在,具有广大的应用前景。
目前,研究者已通过固相法、水热法、溶胶-凝胶法等制备了Na0.44MnO2材料,其中通过水热法、溶胶-凝胶法等“软化学”方法制备的材料表现出了较高的可逆比容量和良好的循环稳定性以及倍率性能,但是仍然需要改进产量低、耗时长的“软化学”方法来达到材料性能优异和制备效率高并重的要求。通过电极材料的一般改性方法如离子掺杂和表面包覆能够降低Na0.44MnO2材料在充放电过程中产生的Jahn-Teller效应,从而抑制了容量的衰减,但是离子掺杂和表面包覆对于材料结构的影响以及掺杂和包覆后材料的反应机理仍然不明确,需要进一步研究。另外,Na0.44MnO2材料虽然在水系电池中具有良好的循环稳定性,但是电池能量密度相对较低,因此需要通过改进材料和优化电池体系等策略来进一步提高Na0.44MnO2材料在水系电池中的能量密度。
[1] MIN J W,YIM C J,IM W B.Facile synthesis of electrospun Li1.2Ni0.17Co0.17Mn0.5O2nanofiber and its enhanced high-rate performance for lithium-ion battery applications[J].ACS Applied Materials & Interfaces,2013,5(16):7765-7769.
[2] PAN H L,HU Y S,CHEN L Q.Room-temperature stationary sodium-ion batteries for large-scale electric energy storage[J].Energy& Environmental Science,2013,6(8):2338-2360.
[3] MINAKSHI M,MEYRICK D.Electrochemical energy storage device for securing future renewable energy[J].Electrochimica Acta,2013,101:66-70.
[4] LIU X,ZHANG N,NI J F,et al.Improved electrochemical performance of sol-gel method prepared Na4Mn9O18in aqueous hybrid Na-ion supercapacitor[J]. Journal of Solid State Electrochemistry,2013,17(7):1939-1944.
[5] PALOMARES V,SERRAS P,VILLALUENGA I,et al.Na-ion batteries,recent advances and present challenges to become low cost energy storage systems[J].Energy & Environmental Science,2012,5(3):5884-5901.
[6] MASQUELIER C,CROGUENNEC L.Polyanionic(phosphates,silicates,sulfates) frameworks as electrode materials for rechargeable Li (or Na) batteries[J].Chemical Reviews,2013,113(8):6552-6591.
[7] ISLAM M S,FISHER C A J.Lithium and sodium battery cathode materials:computational insights into voltage,diffusion and nanostructural properties[J].Chemical Society Reviews,2014,43:185-204.
[8] YABUUCHI N,KUBOTA K,DAHBI M,et al.Research development on sodium-ion batteries[J].Chemical Reviews,2014,114(23):11636-11682.
[9] KUNDU D,TALAIE E,DUFFORT V,et al.The emerging chemistry of sodium ion batteries for electrochemical energy storage[J].Angew.Chem.Int.Ed.,2015,54(11):3431-3448.
[10] 张传香,何建平,赵桂网,等.掺碳的钠离子电池正极材料NaVPO4F的电化学性能[J].无机化学学报,2007,23(4):649-654.ZHANG C X,HE J P,ZHAO G W,et al.Electrochemical characteristics of C-doped NaVPO4F cathode material for sodium-ion battery[J].Chinese Journal of Inorganic Chemistry,2007,23(4):649-654.
[11] 叶飞鹏,王莉,连芳,等.钠离子电池研究进展[J].化工进展,2013,32(8):1789-1795.YE F P,WANG L,LIAN F,et al.Advance in Na-ion batteries[J].Chemical Industry and Engineering Progress,2013,32(8):1789-1795.
[12] YUAN D D,HE W,PEI F,et al.Synthesis and electrochemical behaviors of layered Na0.67[Mn0.65Co0.2Ni0.15]O2microflakes as a stable cathode material for sodium-ion batteries[J].Journal of Materials Chemistry A,2013,1(12):3895-3899.
[13] XU J,LEE D H,CLEMENT R J,et al.Identifying the critical role of Li substitution in P2-Nax[LiyNizMn1–y–z]O2(0<x,y,z<1)intercalation cathode materials for high-energy Na-ion batteries[J].Chemistry of Materials,2014,26(2):1260-1269.
[14] YOSHIDA H,YABUUCHI N,KUBOTA K,et al.P2-type Na2/3Ni1/3Mn2/3-xTixO2as a new positive electrode for higher energy Na-ion batteries[J].Chem.Commun.,2014,50(28):3677-3680.
[15] ZHU H L,LEE K T,HITZ G T,et al.Free-standing Na2/3Fe1/2Mn1/2O2@graphene film for a sodium-ion battery cathode[J].ACS Applied Materials & Interfaces,2014,6(6):4242-4247.
[16] WHITACRE J F,TEVAR A,SHARMA S.Na4Mn9O18as a positive electrode material for an aqueous electrolyte sodium-ion energy storage device[J].Electrochemistry Communications,2010,12(3):463-466.
[17] DOEFF M M,RICHARDSON T J,KEPLEY L.Orthorhombic NaxMnO2as a cathode material for secondary sodium[J]. J.Electrochem.Soc.,1996,143(8):2507-2516.
[18] KIM H,KIM D J,SEO D H,et al.Ab initio study of the sodium intercalation and intermediate phases in Na0.44MnO2for sodium-ion battery[J].Chemistry of Materials,2012,24(6):1205-1211.
[19] ZHAN P,WANG S,YUAN Y,et al.Facile synthesis of nanorod-like single crystalline Na0.44MnO2for high performance sodium-ion batteries[J].Journal of the Electrochemical Society,2015,162(6):A1028-A1032.
[20] WANG Y S,LIU J,LEE B,et al.Ti-substituted tunnel-type Na0.44MnO2oxide as a negative electrode for aqueous sodium-ion batteries[J].Nature Communications,2015,6:6401-6410.
[21] SAUVAGE F,LAFFONT L,TARASCON J M,et al.Study of the insertion/deinsertion mechanism of sodium into Na0.44MnO2[J].Inorganic Chemistry,2007,46(8):3289-3294.
[22] DAI K H,MAO J,SONG X Y,et al.Na0.44MnO2with very fast sodium diffusion and stable cycling synthesizedviapolyvinylpyrrolidone-combustion method[J]. Journal of Power Sources,2015,285:161-168.
[23] PARANT J P,OLAZCUAGA R,DEVALETTE M,et al.Sur quelques nouvelles phases de formule NaxMnO(2x≤1)[J]. Journal of Solid State Chemistry,1971,3:1-11.
[24] ZHAO L W,NI J F,WANG H B,et al.Flux synthesis of Na0.44MnO2nanorbbons and their electrochemical properties for Na-ion batteries[J].Functional Materials Letters,2013,6(2):1350012.
[25] DEMIREL S,OZ E,ALTIN E,et al.Growth mechanism and magnetic and electrochemical properties of Na0.44MnO2nanorods as cathode material for Na-ion batteries[J].Materials Characterization,2015,105:104-112.
[26] MA G Y,ZHAO Y,HUANG K S,et al.Effects of the starting materials of Na0.44MnO2cathode materials on their electrochemical properties for Na-ion batteries[J].Electrochimica Acta,2016,222:36-43.
[27] HOSONO E,MATSUDA H,HONMA I,et al.Synthesis of single crystalline electro-conductive Na0.44MnO2nanowires with high aspect ratio for the fast charge-discharge Li ion battery[J].Journal of Power Sources,2008,182(1):349-352.
[28] QIAO R M,DAI K H,MAO J,et al.Revealing and suppressing surface Mn(II) formation of Na0.44MnO2electrodes for Na-ion batteries[J].Nano Energy,2015,16:186-195.
[29] ZHAO L W,NI J F,WANG H B,et al.Na0.44MnO2-CNT electrodes for non-aqueous sodium batteries[J].RSC Advances,2013,3(18):6650-6655.
[30] HOSONO E,SAITO T,HOSHINO J,et al.High power Na-ion rechargeable battery with single-crystalline Na0.44MnO2nanowire electrode[J].Journal of Power Sources,2012,217:43-46.
[31] LI Y G,WU Y Y.Formation of Na0.44MnO2nanowiresviastress-induced splitting of birnessite nanosheets[J].Nano Research,2009,2(1):54-60.
[32] XU M W,NIU Y B,CHEN C J,et al.Synthesis and application of ultra-long Na0.44MnO2submicron slabs as a cathode material for Na-ion batteries[J].RSC Advance,2014,4:38140-38143.
[33] CAO Y L,XIAO L F,WANG W,et al.Reversible sodium ion insertion in single crystalline manganese oxide nanowires with long cycle life[J].Adv.Mater.,2011,23(28):3155-3160.
[34] YU L H,YANG H X,AI X P,et al.Structural and electrochemical characterization of nanocrystalline Li[Li0.12Ni0.32Mn0.56]O2synthesized by a polymer-pyrolysis route[J]. J.Phys.Chem.,2005,109:1148-1154.
[35] 程永亮,宋武林,谢长生.燃烧法制备氧化物纳米材料的研究进展[J].材料导报,2013,17(7):70-72.CHENG Y L,SONG W L,XIE C S.Advances in preparation of oxide nanoparticles by combustion method[J].Materials Herald,2013,17(7):70-72.
[36] 陶菲,沈俊,张昭.溶胶-凝胶-酯化法制备锂离子电池正极材料尖晶石LiMn2O4[J].四川有色金属,2003(3):18-21.TAO F,SHEN J,ZHANG Z.Synthesis of spinel LiMn2O4for lithium-ion batteries as electrode material by sol-gel-ester method[J].Sichuan Nonferrous Metals,2003(3):18-21.
[37] KIM D J,PONRAJ R,KANNAN A G,et al.Diffusion behavior of sodium ions in Na0.44MnO2in aqueous and non-aqueous electrolytes[J].Journal of Power Sources,2013,244:758-763.
[38] RUFFO R,FATHI R,KIM D J,et al.Impedance analysis of Na0.44MnO2positive electrode for reversible sodium batteries in organic electrolyte[J]. Electrochimica Acta,2013,108:575-582.
[39] AKIMOTO J,HAYAKAWA H,KIJIMA N,et al.Single-crystal synthesis and structure refinement of Na0.44MnO2[J].Solid State Phenomena,2011,170:198-202.
[40] CHU Q X,WANG X F,LI B X,et al.Flux synthesis and growth mechanism of Na0.5MnO2whiskers[J].Journal of Crystal Growth,2011,322(1):103-108.
[41] YU J Y,HONG M,WANG L,et al.Synthesis and gas-sensing properties of P-type Na0.44MnO2nanoribbons[J].Materials Letters,2016,164:440-443.
[42] LI X L,YAN P F,ENGELHARD M H,et al.The importance of solid electrolyte interphase for mation for long cycle stability full-cell Na-ion batteries[J].Nano Energy,2016,27:664-672.
[43] TEVAR A D,WHITACRE J F.Relating synthesis conditions and electrochemical performance for the sodium intercalation compound Na4Mn9O18in aqueous electrolyte[J].Journal of the Electrochemical Society,2010,157(7):A870-A875.
[44] THACKERAY M M.Manganese oxides for lithium batteries[J].Program Solid State Chemistry,1997,25:l-71.
[45] 周公度.结构化学基础[M].3版.北京:北京大学出版社,1989:28.ZHOU G D.The foundation of structural chemistry[M].3rd ed.Beijing:Peking University Press,1989:28.
[46] 赵铭姝,张国范,翟玉春,等.锂离子蓄电池正极材料尖晶石型锰酸锂的制备[J].电源技术,2011,25(3):246-250.ZHAO M S,ZHANG G F,ZHAI Y C,et al.Preparation of spinel-structure lithium manganese oxides,the positive materials for lithium-ion battery[J].Chinese Journal of Power Sources,2011,25(3):246-250.
[47] GUO S H,YU H J,LIU D Q,et al.A novel tunnel Na0.61Ti0.48Mn0.52O2cathode material for sodium-ion batteries[J].Chem.Commun.,2014,50(59):7998-8001.
[48] JAYAKUMAR M,HEMALATHA K,RAMESHA K,et al.Framework structured Na4Mn4Ti5O18as an electrode for Na-ion storage hybrid devices[J].Phys.Chem.Chem.Phys.,2015,17(32):20733-20740.
[49] ZHAN P,JIAO K L,WANG J X,et al.Titanium-substituted Na0.44MnO2nanorods as cathode materials for high performance sodium-ion batteries[J].Journal of the Electrochemical Society,2015,162(12):A2296-A2301.
[50] XU S Y,WANG Y S,BEN L B,et al.Fe-based tunnel-type Na0.61[Mn0.27Fe0.34Ti0.39]O2designed by a new strategy as a cathode material for sodium-ion batteries[J].Advanced Energy Materials,2015,5(22):1501156.
[51] WU Z G,ZHONG Y J,LI J T,et al.Synthesis of a novel tunnel Na0.5K0.1MnO2composite as a cathode for sodium ion batteries[J].RSC Adv.,2016,6(59):54404-54409.
[52] PARK J H,PARK K,KIM R H,et al.Improving the kinetics and surface stability of sodium manganese oxide cathode materials for sodium rechargeable batteries with Al2O3/MWCNT hybrid networks[J].J.Mater.Chem.A,2015,3(20):10730-10737.
Research progress of sodium manganate oxide Na0.44MnO2as cathode for sodium-ion batteries
SHI Wenjing,YAN Yongwang,XU Shoudong,CHEN Liang,LIU Shibin,ZHANG Ding
(College of Chemistry and Chemical Engineering,Taiyuan University of Technology,Taiyuan 030024,Shanxi,China)
Sodium-ion secondary batteries have attracted global attentions nowadays,and the tunnel-structure-crystalized Na0.44MnO2,as one of the main cathode materials,not only well provides the non-aqueous batteries with high energy density and outstanding cyclic stability,but also applies promisingly in the safe and high rate aqueous batteries. To summarize the relevant progress,the crystal structure,principles of charging and discharging of Na0.44MnO2are discussed with the focus on the synthesis methods and their effects on the structure and electrochemical properties of Na0.44MnO2. In addition,the applications of Na0.44MnO2material in the full-cells and the aqueous batteries and the recent research progress on the doping and coating modification of this material are also briefly introduced. It is concluded that Na0.44MnO2material has great scientific value and application prospects as sodium-ion battery cathode material in the future.
sodium ion battery;cathode material;Na0.44MnO2;electrochemistry;synthesis;nanomaterials
TM912.9
:A
:1000-6613(2017)09-3343-10
10.16085/j.issn.1000-6613.2017-0015
2017-01-04;修改稿日期:2017-04-17。
国家自然科学基金(21506141)及山西省青年基金(2015021131)项目。
史文静(1990—),女,硕士研究生,主要从事钠离子电池正极材料的研究。联系人:张鼎,讲师,博士,主要从事钠离子电池和锂离子电池的研究。E-mail:zhangding@tyut.edu.cn。
