FeCl2·4H2O晶体流态化煅烧过程实验研究
2017-09-06王玲郑燕萍程榕杨阿三孙勤张许力
王玲,郑燕萍,程榕,杨阿三,孙勤,张许力
(浙江工业大学化学工程学院,浙江省生物燃料利用技术研究重点实验室,浙江 杭州310014)
FeCl2·4H2O晶体流态化煅烧过程实验研究
王玲,郑燕萍,程榕,杨阿三,孙勤,张许力
(浙江工业大学化学工程学院,浙江省生物燃料利用技术研究重点实验室,浙江 杭州310014)
在φ44mm的流化床反应器中用空气对FeCl2·4H2O晶体进行流态化煅烧,采用氯离子选择电极测定尾气吸收液中氯离子浓度,得到FeCl2·4H2O煅烧反应转化率随反应时间的变化关系,考察表观气速、晶体平均粒径和床层温度对流态化煅烧过程的影响。研究结果表明,FeCl2·4H2O晶体煅烧生成的Fe2O3质地疏松,在流化状态下自颗粒表面剥落随气流带出煅烧炉,类似缩粒反应过程。FeCl2·4H2O晶体流态化煅烧,表观气速增大,反应速率加快,煅烧时间缩短,表观气速达0.64m/s外扩散影响基本消除,再增大表观气速对煅烧反应影响不明显,过程为表面反应控制。FeCl2·4H2O晶体初始平均粒径越小,反应速率随时间的变化越明显,完成煅烧反应的时间越短。床层温度对煅烧反应影响显著,煅烧反应与颗粒表面积成正比。
四水氯化亚铁;流态化;煅烧
冶金行业存在一个非常重要的酸洗工序,即用盐酸清除钢材表面氧化物,该工序将产生大量含FeCl2的酸性废液,酸性废液直接排放会对环境造成严重污染[1-3]。
自20世纪70年代,我国陆续自国外引进了Lurgi-Keramchemie和Ruthner两种废盐酸再生工艺。Lurgi-Keramchemie废盐酸再生工艺[4]是将浓缩到一定浓度的FeCl2酸性废液用酸枪喷入流化床层,进行煅烧造粒,得到具有一定粒度的Fe2O3颗粒。Ruthner废盐酸再生工艺[5-7]是将浓缩到一定浓度的FeCl2酸性废液用酸枪喷入喷雾煅烧室,进行煅烧,得到Fe2O3粉体。两种废盐酸再生工艺生成的HCl气体经水吸收生成盐酸循环利用。FeCl2·4H2O晶体煅烧反应方程式如式(1)。

国内目前多用Ruthner废盐酸再生工艺,由于该工艺采用液体直接煅烧,存在设备体积大、运行能耗高等问题[8]。
如果将FeCl2酸性废液进一步浓缩,结晶得到FeCl2·4H2O晶体,可去除溶液中非铁金属离子杂质;对该晶体进行流态化高温煅烧生成HCl气体和Fe2O3粉体,能降低蒸发母液所需热能,降低煅烧过程能耗;同时可增大尾气中HCl气体含量,提高再生盐酸浓度,减小Fe2O3粉体中杂质含量。
本文以FeCl2·4H2O晶体为原料,采用流态化高温煅烧,考察表观气速、晶体平均粒径、床层温度对流态化煅烧过程的影响,为进一步工程应用研究提供基础数据。
1 实验部分
1.1 实验装置及流程
流态化煅烧实验装置如图1所示,流化床煅烧炉为内径44mm、长530mm的石英玻璃管。管子中间设置有分布板,分布板下方为气室,上方为煅烧床层,管子顶部设有加料口。石英玻璃管置于管式炉内以保证床层温度。
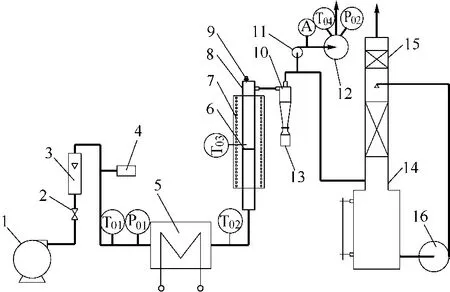
图1 流态化煅烧实验装置图
实验过程中,空气由鼓风机输送,经电加热器加热进入流化床煅烧炉,使物料在流化状态下进行煅烧反应,尾气经旋风分离器收尘、取样分析,送尾气吸收塔,用浓度为0.2mol/L的NaOH溶液吸收HCl气体后排入大气。物料是在床层达到设定温度后自流化床煅烧炉顶部加料口加入。物料加入床层后在热空气作用下迅速流化升温,反应生成Fe2O3粉体。Fe2O3粉体自颗粒表面脱落随气流带出,由旋风分离器收集。实验过程采用热电偶测定系统各点温度,系统内各点压力由U形差压计测定。
1.2 实验原料
实验用原料为西陇化工股份有限公司生产的FeCl2·4H2O晶体,颜色为蓝绿色,颗粒密度为1.93 g/cm3,经筛分,实验选用晶体的初始平均粒径分别为0.387mm、0.561mm、0.652mm、0.777mm。
1.3 实验方法及分析
实验时分别开启鼓风机、电加热器、管式炉、湿式流量计及循环泵,通过调节阀控制进流化床煅烧炉气体流量。当流化床煅烧炉床层温度达到设定温度后,自加料口加入实验用物料,同时在取样点进行连续取样,定时记录各点温度、压力。
加料同时打开取样泵抽取反应尾气,经0.2mol/L的NaOH溶液吸收,湿式流量计计量后排入大气。反应前期每吸收5min为一个样品,反应后期每吸收15min为一个样品。
将样品定容,用氯离子选择电极PCl-1-01测定溶液中氯离子浓度[9-10],由氯离子浓度得到FeCl2·4H2O转化率X,计算如式(2)。
式中,V为样品定容后溶液体积;C为定容后溶液中氯离子浓度;Q为进风体积流量;t1为取样时间;M为FeCl2·4H2O晶体相对分子质量;m0为FeCl2·4H2O晶体原料质量;Vm为气体摩尔体积;V湿为取样时间内湿式气体流量计记录体积。数据处理过程中所有体积示数都经温度、压力校核。
实验过程中发现有Cl2生成,计算转化率时已计入其中。
2 结果与讨论
2.1 FeCl2·4H2O晶体煅烧颗粒变化
控制床层温度500℃、表观气速0.73m/s,将初始平均粒径为2mm的FeCl2·4H2O晶体置入流化床内,物料处于未流化状态,反应2min,关闭加热系统停止加热,待床层温度降至200℃,打开管式炉观察。床层中物料变成红褐色,即FeCl2·4H2O已反应生成Fe2O3,颗粒大小形状基本保持原始状态,颗粒表层质地由原先的密实状变为疏松状。轻轻触碰颗粒,表层物料脱落成粉体状。用刀切开,颗粒内部仍为较密实状,切口断面色泽由外向内从红褐色、红色至灰白色渐变。
控制床层温度500℃、表观气速0.73m/s,将初始平均粒径为0.652mm的FeCl2·4H2O晶体置入流化床内,观察流态化煅烧过程的实验现象,随着反应的进行,红色的Fe2O3粉体随气流自流化床出口排出,由旋风分离器收集,至无粉尘带出,停止操作,床层内已无物料。旋风收集的粉体颜色呈红色,经粒度分析,平均粒径为0.061mm。这是因为FeCl2·4H2O晶体在流态化煅烧过程中,颗粒表层反应生成的Fe2O3粉体因颗粒间摩擦、碰撞自表面脱落,随气流离开床层,反应过程颗粒粒径逐渐缩小直至消失。由此可以认为FeCl2·4H2O晶体流态化煅烧过程近似为缩粒过程。
控制微机差热天平HCT-2的进风体积流量为40mL/min,炉温由25℃升高至580℃,升温速率分别为5℃/min、10℃/min,将初始平均粒径为0.652mm的FeCl2·4H2O晶体置入微机差热天平坩埚内进行煅烧,得到DTA-TG曲线分别如图2、图3所示。
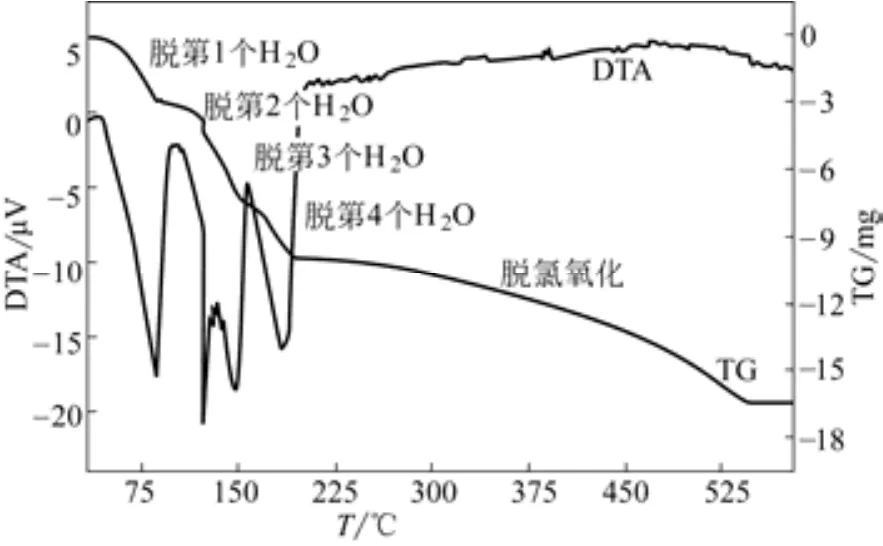
图2 升温速率为5℃/min时DTA-TG曲线(m0=25.0mg,dp=0.652mm)
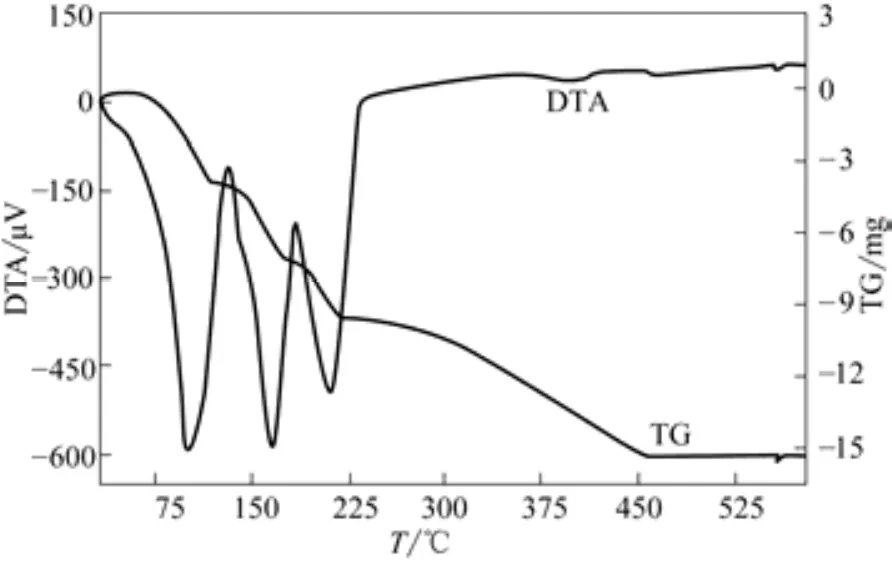
图3 升温速率为10℃/min时DTA-TG曲线(m0=26.5mg,dp=0.652mm)
从图2中可以看出,FeCl2·4H2O晶体煅烧分为两个阶段,第一个阶段为晶体脱水,第二个阶段为脱氯氧化生成氧化铁。晶体在33℃时开始脱水,脱除4个结晶水对应4个吸热峰,峰温分别为80℃、125℃、150℃、185℃,脱第2、第3两个结晶水温度接近,两个吸热峰大部分重叠。从图3中可以发现,升温速率增大吸热峰后移,造成脱第2个结晶水对应的吸热峰消失,可以认为脱第2、第3两个结晶水基本上是同时进行的。晶体脱水完成后进入脱氯氧化阶段,在此阶段FeCl2反应生成Fe2O3,质量有所减少。从图2、图3可以看出,其反应速率相比脱结晶水阶段要慢得多,反应为吸热反应,但热效应不明显。
2.2 表观气速对流态化煅烧过程的影响
采用初始平均粒径为0.652mm的FeCl2•4H2O晶体,控制流化床床层温度500℃,研究不同表观气速(室温)下床层温度、反应转化率随煅烧时间的变化。
在图4中可以看出,表观气速≥0.64m/s时,物料加入5min左右床层温度达到设定值;表观气速<0.64m/s时,床层温度达到设定值需10min左右。这是因为表观气速较大时,物料流化状态良好,传热效果好,床层升温较快;表观气速较小时,由于流化状态较差,需较长时间达到设定值床层温度。
图5为床层温度500℃、初始平均粒径0.652mm的FeCl2·4H2O晶体在相同煅烧时间下,反应转化率随表观气速的变化曲线。从图5中看出,相同煅烧时间,表观气速较小时,反应转化率较小;随着表观气速增大,反应转化率提高;表观气速≥0.64m/s时,反应转化率基本不随表观气速发生变化。
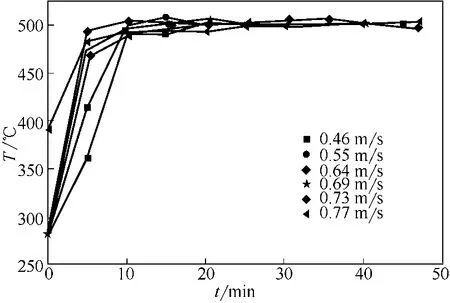
图4 不同表观气速下床层温度随煅烧时间变化曲线(T=500℃,dp=0.652mm)
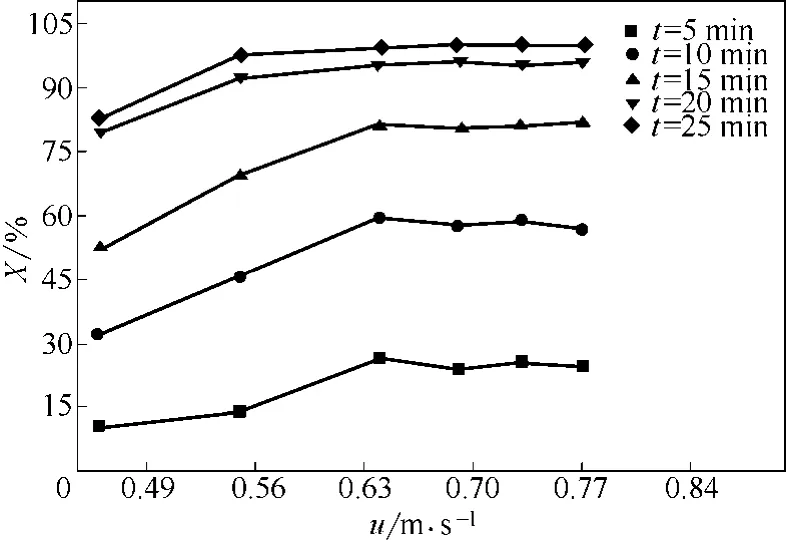
图5 不同反应时间下反应转化率随表观气速的变化曲线(T=500℃,dp=0.652mm)
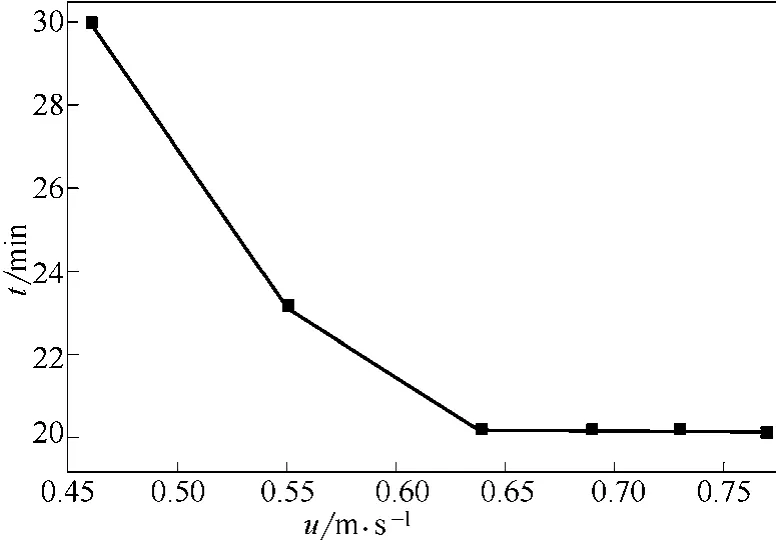
图6 不同表观气速下反应转化率达95%所需煅烧时间(T=500℃,dp=0.652mm)
图6是不同表观气速下,反应转化率达到95%所需煅烧时间。从图6中看出,表观气速较小时,达到95%转化率所需煅烧时间较长;随着表观气速增大,达到95%转化率所需煅烧时间减少;表观气速≥0.64m/s时,达到95%转化率所需煅烧时间基本不随表观气速发生变化。这是因为表观气速较小时,反应速率受外扩散影响显著,增大表观气速,颗粒表面气膜层变薄,降低外扩散对反应的影响,相同煅烧时间反应转化率提高明显,达到95%转化率所需煅烧时间减少;当表观气速达到0.64m/s,外扩散对反应的影响已经很小,再提高表观气速,相同煅烧时间达到反应转化率及达95%转化率所需煅烧时间基本保持不变,已属于表面反应控制。
2.3 颗粒粒径对流态化煅烧过程的影响
设定床层温度500℃,选用4种初始平均粒径的FeCl2·4H2O晶体,其粒径及相应的表观气速列于表1,保证颗粒流化状态良好,研究不同初始平均粒径下反应转化率随煅烧时间的变化。
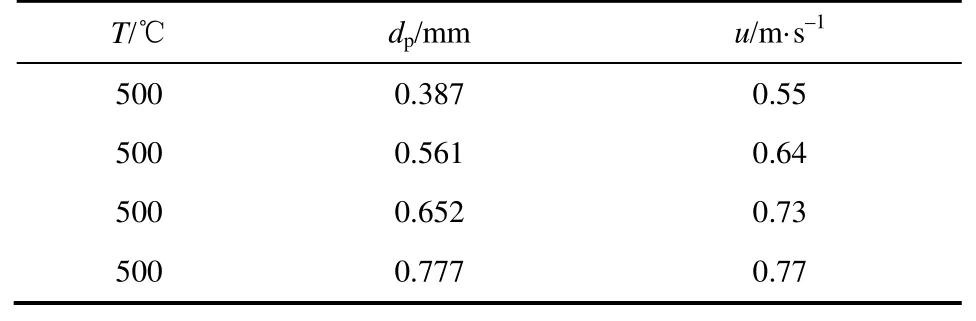
表1 FeCl2·4H2O晶体初始平均粒径及表观气速
图7为床层温度500℃、FeCl2•4H2O晶体不同初始平均粒径在相应表观气速下反应转化率随煅烧时间变化曲线。从图7中可以看出,反应前期,随煅烧时间增加反应转化率增大较快,之后趋于平缓;颗粒初始粒径越小,相同煅烧时间达到的反应转化率越高。
图8为相应条件下反应速率随煅烧时间变化曲线。从图8中可以看出,反应初期,反应速率较大,随着反应的进行,逐渐趋于平缓;颗粒初始粒径越小,初期反应速率越快。
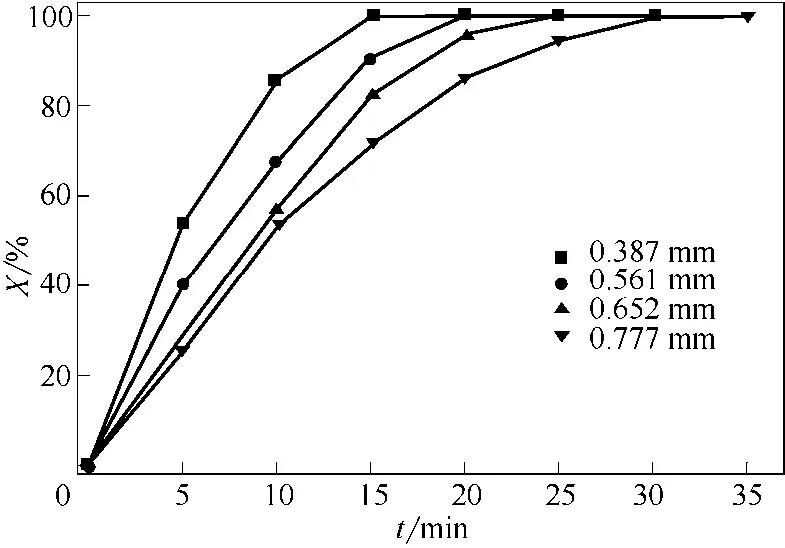
图7 不同初始平均粒径下反应转化率随煅烧时间变化曲线(T=500℃)
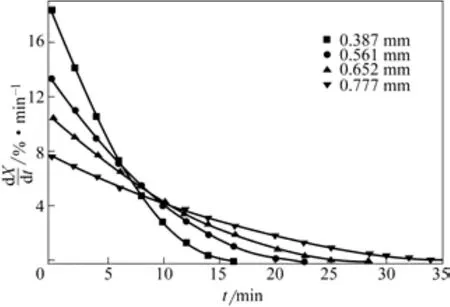
图8 不同初始平均粒径下反应速率随煅烧时间变化曲线(T=500℃)
这是因为反应初期,颗粒平均粒径大,反应表面积大,反应速率大,反应转化率随煅烧时间增大较快;随着反应进行,颗粒粒径逐渐变小,反应表面积随之缩小,反应速率减小,转化率随煅烧时间增大慢慢趋于平缓。颗粒原始平均粒径越小,单位质量物料表面积越大,气固反应物接触反应面积越大,煅烧初期反应速率越大,对应煅烧时间下转化率越高。
图9为相同床层温度下反应速率与颗粒粒径平方的关系曲线。从图9中看出,相同床层温度下,颗粒粒径平方与反应速率之间几乎呈线性关系,即反应速率与颗粒表面积成正比。反应初期,颗粒外表面积最大,即气固接触面积大,反应速率快,随着反应的进行,颗粒粒度越来越小,气固接触面积越来越小,反应速率越来越小。
2.4 床层温度对流态化煅烧过程的影响
选用初始平均粒径0.652mm的FeCl2·4H2O晶体,控制表观气速0.73m/s,研究不同床层设定温度下反应转化率随煅烧时间的变化。

图9 反应速率与颗粒粒径平方的关系曲线(T=500℃)
图10为颗粒平均粒径0.652mm、表观气速0.73m/s、不同床层温度下反应转化率随煅烧时间变化曲线,图11为相应条件下反应速率随煅烧时间变化曲线。从图10、图11看出,反应初期,床层温度越高,反应速率越大,相同反应时间转化率越大;床层温度越高,反应速率随时间衰减越快。根据阿伦尼乌斯方程[11],温度越高,速率常数越大;床层温度越高,反应速率越大,相同时间转化率越高,颗粒粒径缩小较快,反应表面减小,导致反应速率随时间衰减较快;床层温度较低,反应速率相对小,相同时间转化率低,颗粒粒径缩小缓慢,反应速率随时间衰减较平缓。
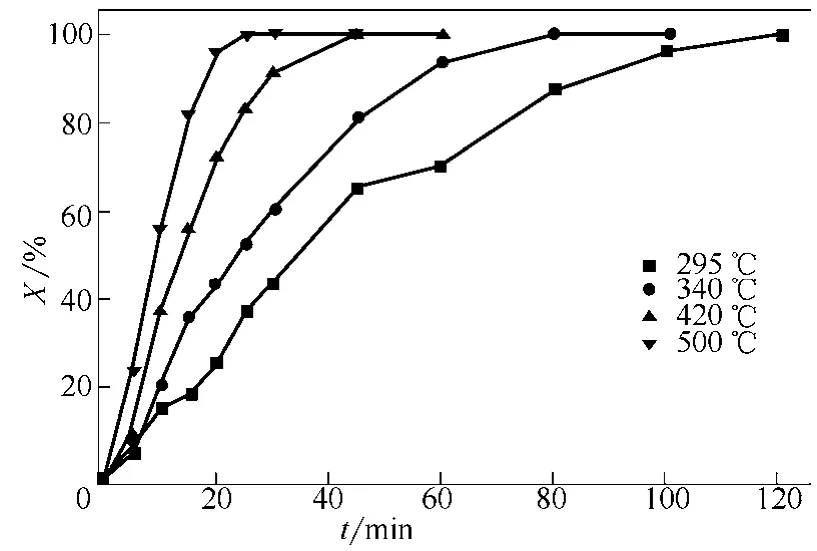
图10 不同床层温度下反应转化率随煅烧时间变化曲线(dp=0.652mm,u=0.73m/s)
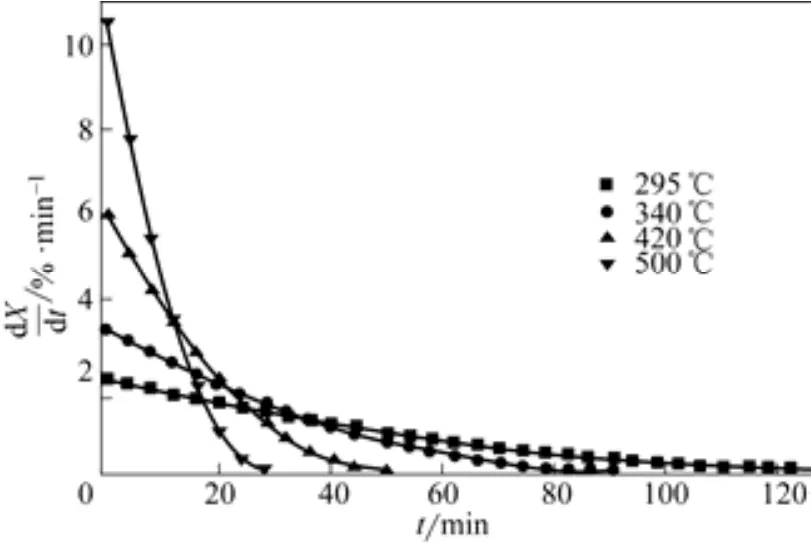
图11 不同床层温度下反应速率随煅烧时间变化曲线(dp=0.652mm,u=0.73m/s)
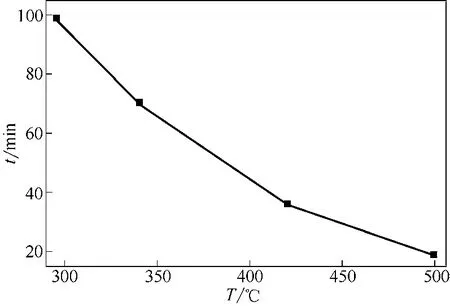
图12 不同床层温度下反应转化率达95%所需煅烧时间(dp=0.652mm,u=0.73m/s)
图12看到床层温度越高,转化率达到95%所需煅烧时间越短,床层温度由295℃提高到500℃,转化率达95%所需煅烧时间自99min减少至20min。这是因为反应温度越高,速率常数越大,则反应速率越大,达到一定转化率所需时间短。
3 结论
(1)FeCl2·4H2O晶体煅烧反应发生在颗粒外表面,反应生成的Fe2O3在流化状态下容易自颗粒表面脱落,近似为缩粒反应过程。
(2)FeCl2·4H2O晶体煅烧反应分为晶体脱水和脱氯氧化生成氧化铁两个阶段,晶体脱水吸热显著,而脱氯氧化为热效应较小的放热反应。
(3)FeCl2·4H2O晶体流态化煅烧,在表观气速较小时,外扩散影响显著,增大气速可以加快反应,缩短煅烧时间;表观气速达0.64m/s,外扩散影响基本消除,过程为表面反应控制。
(4)FeCl2·4H2O晶体初始平均粒径越小,反应速率随时间的变化越明显,完成煅烧反应的时间越短。
(5)床层温度对煅烧反应影响显著,温度越高,反应速率随时间的变化越明显,反应速率与颗粒表面积成正比。
符号说明
C—— 样品定容后溶液中氯离子浓度,mol/L
M—— FeCl2·4H2O晶体相对分子质量,g/mol
m0—— FeCl2·4H2O晶体原料质量,g
Q—— 进风气量,L/min
Rp—— 晶体特征粒径,mm
rc—— 晶体任意时刻粒径,mm
t1—— 取样时间,min
V—— 样品定容后溶液体积,L
V湿—— 取样时间内湿式气体流量计的计量,L
Vm—— 气体摩尔体积,L/mol
X—— 转化率,%
[1] KLADNIG W F. A review of steel pickling and acid regeneration an environmental contribution[J]. International Journal of Materials& Product Technology,2003,19(6):550-561.
[2] 李小明,李文锋,王尚杰,等. 不锈钢酸洗废液的处理与回收技术综述[J]. 化工环保,2012,32(6):511-515.LI X M,LI W F,WANG S J,et al. Review of treatment and recovery technologies of waste stainless steel pickling liquor[J]. Environmental Protection of Chemical Industry,2012,32(6):511-515.
[3] 徐军来. 废盐酸再生工艺浅析[J]. 南方金属,2013(3):36-39.XU J L. Discuss of acid regeneration process[J]. Southern Metals,2013(3):36-39.
[4] 朱桂平,郭合理,周兵. 流化床法废盐酸再生技术在钢丝绳行业的应用[J]. 金属制品,2013(4):47-50.ZHU G P,GUO H L,ZHOU B. Application of fluidized bed waste hydrochloric acid regeneration technology in wire rope industry[J].Metal Products,2013(4):47-50.
[5] 郑雅杰,刘昭成. 氧化铁的制备方法及其应用[J]. 粉末冶金材料科学与工程,2007(4):197-204.ZHENG Y J,LIU S C. Preparation and application of iron oxide[J].Materials Science and Engineering of Powder Metallurgy,2007(4):197-204.
[6] 邹海平,邱祖民,邱俊明. 利用“三废”制备氧化铁的研究进展[J]. 化工进展,2007,26(2):173-179.ZOU H P,QIU Z M,QIU J M. Progress in preparation of iron oxide by using three-wastes[J]. Chemical Industry and Engineering Progess,2007,26(2):173-179.
[7] 何苏萍,高倩,余晓婷,等. 氧化铁红的制备方法及其在涂料中的应用[J]. 化工生产与技术,2011(1):29-32.HE S P,GAO Q,YU X T,et al. Preparation and application in coatings of iron oxide red[J]. Chemical Production and Technology,2011(1):29-32.
[8] 林宣精. 当今废盐酸再生工艺的评析[J]. 化工环保,1998(4):16-22.LIN X J. Analysis on the regeneration process of waste hydrochloric acid[J]. Environmental Protection of Chemical Industry,1998(4):16-22.
[9] 杨懂艳,陈圆圆,丁萌萌,等. 氯气共存时氯化氢监测分析方法研究[C]//中国环境科学学会学术年会论文集(第四卷),云南,2013.YANG D Y,CHEN Y Y,DING M M,et al. Study on monitoring and analysis method of hydrogen chloride in coexistence of chlorine[C]//Proceedings of the Chinese Society for Environmental Scienceannual Meeting(the Fourth Volumes),Yunnan,2013.
[10] 李美蓉,刘娜,周海刚,等. 氯离子选择电极法测定原油中的总氯含量[J]. 石油炼制与化工,2016,47(3):103-108.LI M R,LIU N,ZHOU H G,et al. Determination of tatal chlorine content in crude oil by chloride ion selective electrode method[J].Petroleum Processing and Petrochemicals,2016,47(3):103-108.
[11] 许贺卿.气固反应工程[M]. 北京:原子能出版社,1993.XU H Q. Gas-solid reaction engineering[M]. Beijing:Atomic Energy Press,1991.
Experimental study on the fluidized calcinations of FeCl2•4H2O crystals
WANG Ling,ZHENG Yanping,CHEN Rong,YANG Asan,SUN Qin,ZHANG Xuli
(Zhejiang Key Laboratory of Bio Fuel Utilization Technology,School of Chemical Engineering and Technology,Zhejiang University of Technology,Hangzhou 310014,Zhejiang,China)
The FeCl2·4H2O crystals were fluidizely calcinated by air in aφ44mm fluidized bed reactor.The process of producing Fe2O3by FeCl2·4H2O using fluidzed calcination was studied. The conversion of FeCl2·4H2O crystals with reaction time was obtained by measuring the chloride ion concentration in tail gas absorption solutions with chloride ion selective electrode,and process influence factors was investigated,including superficial gas velocity,average grain diameter and bed temperature. The result indicated that the fluidzed calcination was surface reaction controlled process. Apparent gas velocity was increased,the reaction rate was accelerated,the calcination time was shortened. When the apparent gas velocity at 0.64m/s,the external diffusion was eliminated,and the reaction was controlled by surface reaction. Then,increasing the apparent gas velocity had no obvious effect on the calcination reaction. The generated Fe2O3was loose,and it was peeled off the surface of the particles as well as flowing out of the furnace with air by calcining FeCl2·4H2O crystals in fluidization state,which was similar to the shrinking reaction process. The FeCl2·4H2O crystals’ temperature rising rate and calcination reaction rate speed were accelerated with the increase of apparent gas velocity in the environment of fluid-bed calcination.However,the increasing of superficial gas velocity has no obvious effect on the calcination reaction in the environment of good fluidization. The smaller of the FeCl2·4H2O crystals’ initial average particle size,the variation of reaction rate with time was more obvious,and the completing time of the calcination reactionwas shorter. The bed temperature has a significant effect on the calcination reaction,and the calcination reaction is proportional to the particle surface area.
ferrows chloride(FeCl2·4H2O);fluidization;calcination
TQ138.1+1
:A
:1000-6613(2017)09-3189-06
10.16085/j.issn.1000-6613.2017-0020
2017-01-04;修改稿日期:2017-03-28。
王玲(1990—),女,硕士研究生,从事反应工程方向研究。E-mail:396878335@qq.com。联系人:郑燕萍,副教授,从事反应工程方向、干燥技术方向研究。E-mail:zhengyp@zjut.edu.cn。
