独行菜属植物种子总蛋白4种提取方法的比较
2017-09-06丁金鹏张娜李群
丁金鹏,张娜,李群
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
独行菜属植物种子总蛋白4种提取方法的比较
丁金鹏,张娜,李群
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
【目的】研究适用于抱茎独行菜和独行菜种子SDS-PAGE电泳和双向电泳的蛋白样品提取方法,为研究两种独行菜种子蛋白组学奠定基础。【方法】采用4种蛋白质提取方法提取种子总蛋白,测定和分析蛋白产量和SDS-PAGE电泳图谱。【结果】TCA/丙酮提取法获得蛋白量较多,杂质少,电泳条带多且清晰;裂解液提取法蛋白的产量最高,有拖尾且杂质多;Tris-HCl提取法和苯酚提取法的蛋白产量低,杂质少;裂解液提取法和苯酚提取法获得的蛋白在SDS-PAGE电泳时易产生高丰度蛋白的干扰。对比TCA/丙酮提取法和苯酚提取法获得的两种独行菜种子总蛋白SDS-PAGE图谱,发现有6条蛋白差异条带。【结论】TCA/丙酮提取法提取两种独行菜种子总蛋白效率高,纯度高且杂质少,可用于SDS-PAGE电泳和双向电泳分析;两种独行菜种子蛋白SDS-PAGE电泳的差异谱带可为甄别两种独行菜种子提供参考依据。
独行菜;抱茎独行菜;种子总蛋白;蛋白质提取; SDS-PAGE
0 引 言
【研究意义】抱茎独行菜和独行菜为十字花科草本植物,种子可入药[1,2],植株能作为新疆早春转场的优质牧草,因两种独行菜能够利用融雪水在早春低温环境下萌发生长,故具有一定的抗寒能力,研究其耐寒分子机制能为植物耐寒机制提供理论依据,蛋白质是生命活动的主要承担着,研究植物在低温条件下差异表达的蛋白,能够更好地找出与抗低温相关的关键基因和调控机制,故研究探讨适用于两种独行菜种子蛋白的提取方法,为后续两种独行菜种子蛋白组学研究奠定基础。【前人研究进展】抱茎独行菜(LepfdiumperforatumL.)和独行菜(LepidiumapetalumWild)均为独行菜属草本,在新疆主要生长在荒漠和半荒漠地带。对两种独行菜耐受早春低温的萌发机制和差异性进行了一系列的研究:孟君等[3]发现,在4℃低温条件下,抱茎独行菜种子能够萌发,独行菜不能萌发。赵惠新等[4]研究发现,独行菜种子在露白前经常温刺激后可在4℃低温下萌发,通过cDNA- AFLP技术筛选了独行菜幼苗与低温胁迫相关的18个基因,但未能揭示两种独行菜种子在低温萌发过程中的分子调控机制。此外,李萍萍等[5]采用了TCA/丙酮提取法对独行菜萌发阶段的蛋白表达进行了双向电泳分析,获得了独行菜种子常温处理后萌发的蛋白表达图谱,但目前两种独行菜种子对低温的差异性响应的调节机制仍不清楚。【本研究切入点】对两种独行菜种子低温下萌发进行差异蛋白组学分析可为阐明种子萌发的温度调控机制提供线索。抱茎独行菜和独行菜种子均为粘液种子[6~8],吸水膨胀后种皮外包裹大量多糖,极大影响种子蛋白的提取,研究两种独行菜种子蛋白提取方法进行筛选和优化。【拟解决的关键问题】采用4种蛋白提取方法,提取两种独行菜种子蛋白,并对获得的蛋白进行含量测定和SDS-PAGE电泳分析,以期找到适用于两种独行菜种子SDS-PAGE和双向电泳的蛋白样品提取方法。
1 材料与方法
1.1 材 料
1.1.1 抱茎独行菜和独行菜种子
2016年6月,抱茎独行菜种子采自新疆乌鲁木齐雅玛里克山;独行菜种子采自新疆大学校园。装于种子袋内置4℃冰箱贮存。称取适量种子,按10∶1的比例加入PVPP,加入液氮研磨成粉,每2.5 mL离心管中分装0.1 g,-80℃冰箱保存备用。
1.1.2 仪器
722型分光光度计(上海光学仪器厂),离心机(Thermo公司),Mini-PROTEAN、凝胶成像系统 Gel Doc XR+(BIO-RAD公司)。
1.1.3 试剂
40%丙烯酰胺/甲叉双丙烯酰胺(29∶1)购自上海生工有限公司,考马斯亮蓝R-250快速染色液(天根生化科技公司),Tris-平衡酚(北京索莱宝公司),Tris-HCl缓冲液和β-巯基乙醇购于鼎国昌盛公司,三氯乙酸(TCA)、醋酸铵等为国产分析纯,苯甲基磺酰氟(PMSF)、(PVPP)、二硫苏糖醇(DTT)等购于biosharp公司。
1.2 方 法
1.2.1 蛋白提取
1.2.1.1 TCA/丙酮提取法
参照Damerval C等[9]的方法并作调整,分别取两种独行菜种子粉末各0.1 g,加入1.5 mL预冷(-20℃)的TCA/丙酮溶液(10% TCA,0.07% DTT,1 mM PMSF,100%丙酮),置-20℃沉淀1 h;4℃,12 000 r/min离心30 min,得沉淀混悬于1.5 mL预冷的丙酮溶液(0.07% DTT,1 mM PMSF),-20℃静置1 h;4℃,12 000 r/min离心30 min,弃上清,重复洗涤三次后将沉淀放置冰上,通风至干粉,-80℃保存备用。
1.2.1.2 苯酚提取法
参照Hurkman和Tanaka[10]的苯酚提取法加以改进。两种独行菜种子粉末各0.1 g,各加入1 mL苯酚提取缓冲液(0.7 M蔗糖,0.5 MTris-HCl(pH 8.8),50 mM EDTA,0.1 M KCl,2% β-巯基乙醇,2 mM PMSF),冰上震荡10 min,加入预冷1 mL Tris-平衡酚颠倒混匀,冰上静置10 min,室温震荡10 min;4℃,12 000 r/min离心20 min吸取酚相,加入等体积Tris-平衡酚再提取一次;向二次得到的酚相中加入5倍体积的0.1 M预冷醋酸铵甲醇溶液,匀浆后置于-20℃过夜;4℃,12 000 r/min离心20 min,收集沉淀,分别用等体积预冷甲醇和丙酮洗涤两次,置于冰上通风吹干-80℃保存备用。
1.2.1.3 裂解液提取法
参照李晓琳等[11]的方法并加以调整。取两种独行菜种子粉末各0.1 g,分别加入1 mL蛋白质裂解液(7M尿素,2M 硫脲,4% CHAPS,50 mM DTT,1mM PMSF),混悬后置于冰上匀浆3 h(每1 h加入10 μL 100 mM PMSF),4℃下12 000 r/min离心30 min,取上清液于-80℃冰箱保存。
1.2.1.4 Tris-HCl提取法
参考杨柳等[12]方法并部分修改。各取两种独行菜种子粉末0.1 g,加0.9 mL蛋白质提取缓冲液(0.1 M Tris-HCl(pH 6.8),0.5%SDS,10% 甘油,0.07% β-巯基乙醇),置冰上匀浆1 h,4℃,12 000 r/min离心15 min,转移上清后加入5倍体积的预冷10% TCA/丙酮,-20℃静置2 h(每1 h加入10 μL 100 mM PMSF),4℃,12 000 r/min离心15 min,去上清,沉淀悬浮于2 mL冷丙酮(0.07% β-巯基乙醇),-20℃静置20 min,4℃,12 000 r/min离心15 min,重复洗涤沉淀两次,收集沉淀加入2 mL 80% 冷丙酮,-20℃静置20 min,4℃,12 000 r/min离心20 min,将沉淀置于冰上通风至丙酮挥发,-80℃保存。
1.2.2 蛋白干粉裂解及含量
蛋白质干粉裂解参考梁丛敏等[13]的方法并加以调整。向两种独行菜种子蛋白质干粉,加入适量蛋白质裂解液溶解(7 M尿素,2M硫脲,4%CHAPS,50 mM DTT,1 mM PMSF),于36℃恒温水浴2 h(每1 h加入10 μL 100 mM PMSF),室温12 000 r/min离心15 min,取上清液用于蛋白质定量和电泳分析。采用Bradford法[14]绘制标准曲线对4种提取方法的蛋白进行定量。
1.2.3 SDS-PAGE凝胶电泳及染色
SDS-PAGE凝胶电泳参考张富春等[15]方法,12%分离胶,5%浓缩胶,浓缩胶电压80 V,分离胶电压160 V。考马斯亮蓝G-250快速染色液进行染色,凝胶成像系统Gel Doc XR+(美国伯乐公司)拍照并进行分析。
2 结果与分析
2.1 4种蛋白提取方法获得的种子总蛋白产量
研究表明,从4种提取方法获得抱茎独行菜种子蛋白产量来看,裂解液提取法的蛋白产量是最高的(60.42±3.34) mg/g,其次为TCA/丙酮提取法(56±5.01) mg/g、苯酚提取法(11.07±1.54) mg/g,Tris-HCl提取法最低(6.92±1.85);4种蛋白提取方法获得独行菜种子蛋白含量从高到低为依次为裂解液提取法(43.73±2.83) mg/g、TCA/丙酮提取法(43.57±5.01) mg/g、苯酚提取法(20.53±3.09) mg/g、Tris-HCl提取法(5.18±0.52) mg/g。抱茎独行菜种子在苯酚提取法中获得的蛋白低于独行菜种子,在另外3种提取法的蛋白产量均高于独行菜种子。图1

注:1.苯酚提取法;2.TCA/丙酮提取法;3.Tris-HC1提取法;4.裂解液提取法
Note: 1.Phenol method; 2.TCA/actone method; 3. Tris-HClmethod; 4.Lysis buffer extraction method
图1 不同提取方法蛋白产量比较
Fig.1 Comparison of different extraction method of protein yield
研究表明,4种蛋白提取方法中,除了裂解液提取方法获得的蛋白溶液外,其他3种方法均获得蛋白干粉,不能很好的测量蛋白纯度。根据颜色进行蛋白纯度的初步判断,4种方法提取的蛋白裂解液颜色由黄色到无色排列依次为,裂解液提取法、TCA/丙酮提取法、苯酚提取法、Tris-HCl提取法,认为Tris-HCl提取法和苯酚提取法的蛋白纯度较高,TCA/丙酮提取法中等,裂解液提取法最低。苯酚提取法和Tris-HCl提取法操作步骤繁琐,费时较长,导致部分蛋白降解影响蛋白产量;裂解液提取法直接溶解种子粉末,无离心沉淀及洗涤步骤,故杂质含量高,蛋白溶液显黄色。
2.2 4种蛋白提取方法的SDS-PAGE电泳结果
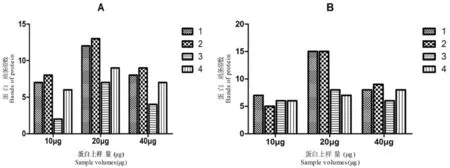
4种提取法获得蛋白SDS-PAGE电泳上样量参考杨柳等[13]的20 μg,再设置了10和40 μg两个上样量梯度作为比较。研究两种独行菜种子蛋白的SDS-PAGE电泳图谱,统计电泳蛋白条带数。
研究表明,两种独行菜种子蛋白条带主要分布97.2~14.3 KDa,高丰度蛋白主要分布在66.4~44.3 KDa和29~20.1 KDa。当样品蛋白上样量为10 μg时蛋白条带最少,泳道背景最浅;当上样量从10 μg增加至20 μg时,蛋白条带数明显增多;当上样量上升到40 μg时,蛋白条带数没有增加,电泳背景加深。据此,认为适合两种独行菜种子SDS-PAGE蛋白上样量应为20 μg(图2A)。
比较分析4种蛋白提取方法的蛋白电泳图谱(图2B、图3)可知,Tris-HCl提取法的蛋白条带最少背景干扰低,此结果与蛋白含量测定的结果一致(蛋白产量低);其他3种方法均有多条蛋白条带,主要集中在66.4~20.1 KDa,其中裂解液提取法的蛋白缺失97.2~66.4 KDa的蛋白(或是因为泳道背景较深掩盖了低丰度蛋白),有拖带,背景较深,与蛋白含量测定的结果相同,蛋白产量最高,杂质含量也高;TCA/丙酮法与苯酚提取法的蛋白条带较多,杂质少无较多背景干扰;苯酚提取法在44.4~20.1 KDa的蛋白条带比TCA/丙酮提取法宽,不宜观察分子量相近的蛋白。综上所述,认为TCA/丙酮法适合用于提取两种独行菜种子蛋白进行SDS-PAGE和双向电泳分析。图2,图3

注:M:Maker;1.苯酚提取法;2.TCA/丙酮提取法;3.Tris-HCl提取法;4.裂解液提取法
Note: M:Maker;(A)每条泳道蛋白上样量为10 μg;(B)每条泳道蛋白上样量为20 μg;(C)每条泳道蛋白上样量为40 μg
1. phenol method; 2.TCA/acetone method; 3. Tris-HCL method; 4.lysis buffer extraction method
(A)Each Lane-10 μg protein;(B)Each Lane-20 μg protein;(C)Each Lane-40 μg protein
图2 4种提取方法的两种独行菜种子蛋白SDS-PAGE分析
Fig.2 SDS-PAGE analysis of four kinds of extraction methods of two species ofLepidiumL seed protein
注:A.独行菜种子;B.抱茎独行菜种子
Note: A.LepidiumapetalumWild seed; B.LepidiumperfoliatumLinnaeus seed
图3 不同方法及不同上样量的两种独行菜种子蛋白SDS-PAGE分析蛋白质条带数
Fig.3 Bands of two species ofLepidiumL. seed protein with different methods and different sample volumes
2.3 两种独行菜种子总蛋白SDS-PAGE电泳比较
研究表明,在这两种蛋白提取方法中,共发现有6条稳定的差异条带。抱茎独行菜种子有2条,标记为3和5,大小在44.4~20.1 KDa;独行菜种子有4条,标记为4和6,位于29.0~20.1 KDa,以及97.2~44.3 KDa的1和2。两种独行菜为独行菜属草本植物,亲缘关系较近,但两种独行菜种子蛋白的SDS-PAGE电泳图谱间有稳定的差异。图4
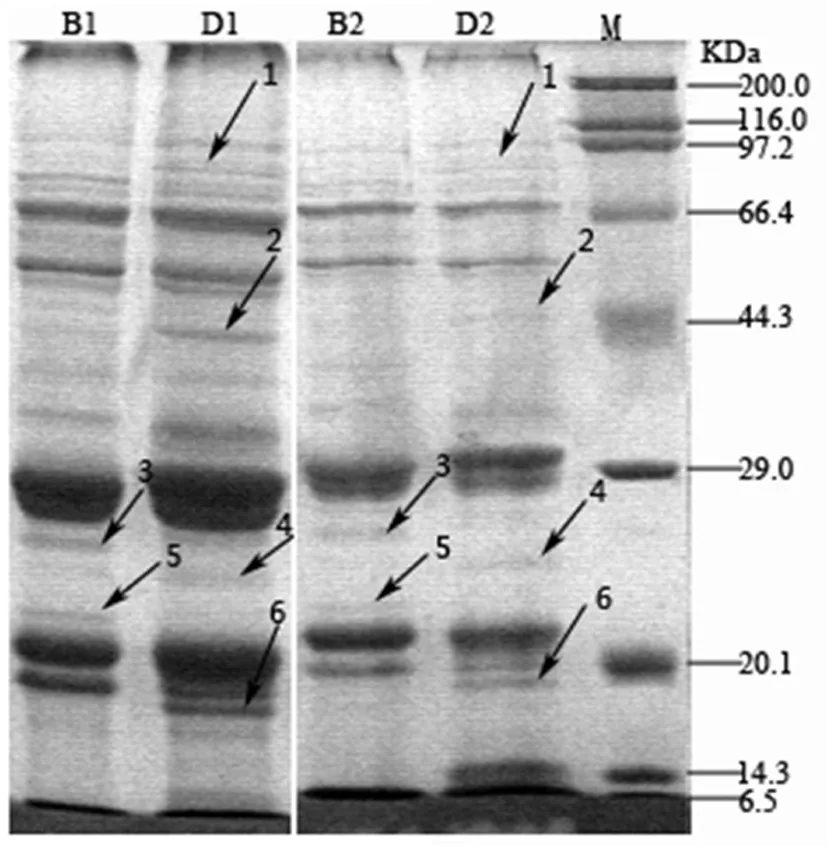
注:M. Maker;B1.苯酚提取抱茎独行菜种子蛋白;B2.TCA/丙酮提取抱茎独行菜种子蛋白;D1.苯酚提取独行菜种子蛋白;B2.TCA/丙酮提取独行菜种子蛋白。每条泳道蛋白上样量为20 μg,箭头标注两种独行菜差异蛋白条带
Note: M. Maker; B1.Phenol extractionLepidiumperfoliatumLinnaeus seed protein; B2. TCA/acetone extractionLepidiumperfoliatumLinnaeus seed protein; D1. Phenol extractionLepidiumapetalumWild seed protein; B2. TCA/acetone extractionLepidiumapetalumWild seed protein. Each Lane-20 μgprotein, Arrow marked difference between the two species ofLepidiumseed protein bands
图4 两种独行菜种子蛋白图谱比较
Fig.4 Comparison of two species ofLepidiumseed protein profiles
3 讨 论
种子蛋白组学的研究能够很好地揭示种子萌发相关的生理调控机制。蛋白组学的研究基于双向电泳和质谱分析两种技术的结合,其中蛋白样品的纯度、产量对双向电泳的蛋白分离及鉴定影响很大,所以蛋白样品的制备是双向电泳实验最基础也是最重要的步骤之一,但因为植物组织含有的代谢产物的多样性,至今没有一种方法适合提取所有植物的蛋白。所以根据实验材料的特点进行蛋白提取方法的探索和改进是非常必要的[16~18],在进行种子蛋白双向电泳前,对种子蛋白进行SDS-PAGE电泳分析,可以在节约试剂的情况下有效地判断蛋白提取方法的好坏[19~20]。
由于研究材料的两种独行菜种子为多糖粘液质种子,不仅含有醌类、酚类、脂质等次级代谢产物,而且种皮遇水后会膨化出较多的胶状多糖,但因其体积较小,无法对其进行去种皮处理,所以,只能通过改进已有的蛋白提取法来尽量减少这些物质对蛋白提取的影响。TCA/丙酮提取法为常用的蛋白提取法,低温提取缓冲液可以很好地抑制蛋白酶的活性,减少蛋白的降解,实验步骤少操作简单,能够很好地去除酚类、脂类和色素,但其也具有蛋白质重溶难无法去除蛋白提取物中的醌类和多糖的缺点;苯酚提取法在蛋白提取中也很有优势,能够很好地去除酚类、多糖、色素及盐离子,但其通过酚相来抽提蛋白质,操作步骤较多,易造成蛋白损失;裂解液提取法操作简单,提取液中的硫脲和尿素等能够很好地溶解蛋白质,但也易溶解非蛋白物质;改良的Tris-HCl提取法,能够利用SDS来加大对疏水蛋白的溶解,但该方法操作步骤较前三种方法多且耗时长。综合研究材料的特点,为了尽可能得到纯度高、杂质少、产量高的种子蛋白,做了如下调整,首先在种子研磨前就加入适量的PVPP,以期在研磨过程中与种子粉末充分接触,加大去醌类、酚类的能力;其次,通过提高4种提取方法中的离心转速和时间,以期去除种子多糖;因为实验步骤多,操作时间长,为防止提取过程中蛋白质的降解,除了所有实验步骤尽量在冰上操作外,还采用PMSF来抑制酶的活性,但因PMSF遇水后活性会降低,所以在实验操作中,所有超过1 h的实验步骤都间歇加入适量PMSF来抑制蛋白的降解;除裂解液提取法获得的是蛋白溶液外,其它三种方法都获得是蛋白质沉淀,考虑到有机物丙酮及蛋白粉末过干对蛋白重溶的影响,故将获得的蛋白沉淀放在冰上通风10 min,既减少了丙酮含量也不会使获得的蛋白粉末过干。实验发现,改进后的TCA/丙酮法能够很好地去除多糖,获得较多的种子蛋白质,而调整的苯酚提取法虽获得纯度较高的种子蛋白,但其产量较少,提取的高丰度蛋白较多,这会影响到双向电泳的蛋白分离,降低分子量相近的低丰度蛋白的辨别和鉴定;而改进的Tris-HCl提取法的提取效果没有实验预期的好,虽无杂质干扰电泳,但蛋白产量太少很难满足双向电泳的使用量;调整的裂解液提取法获得的种子蛋白虽然最多,但也提取到了很多干扰蛋白电泳的杂质。最终通过实验发现,加入PVPP能够很好促进蛋白裂解,提高离心速率和时长能够很好地去除多糖,而裂解液提取法由于强溶解能力不适合用来直接提取种子蛋白,改进的Tris-HCl提取法虽然去除杂质的能力最强,但蛋白的损失也最多,不适合样品量较少的蛋白提取;调整的苯酚提取法能够获得高纯度杂质少的种子蛋白,但也容易获得较多高丰度蛋白,不适合实验后期的双向电泳蛋白质的分离鉴定;改进后的TCA/丙酮法能够有效地去除多糖对蛋白提取的影响,获得纯度较好的种子蛋白。
徐莉等[21]通过对银杏雌雄果的SDS-PAGE电泳蛋白图谱分析发现银杏雌雄种子蛋白条带存在明显差异,证明可以根据这些蛋白条带分辨出雌性种子,研究在对两种独行菜种子蛋白进行SDS-PAGE电泳分析时发现,两种独行菜种子蛋白条带存在明显且稳定的差异,认为这些差异蛋白条带,不仅说明两种独行菜种子基因间的差异,也能在蛋白水平上辨别两种独行菜种子提供参考依据。
4 结 论
确定了实验中改进的TCA/丙酮提取法为最佳,该方法的蛋白提取率较高,SDS-PAGE电泳蛋白图谱清晰,蛋白条带较多,杂质干扰低,适合用于后期两种独行菜种子双向电泳的蛋白样品制备;也确定了两种独行菜种子蛋白的SDS-PAGE电泳图谱中的稳定差异条带可以为两种独行菜种子辨别提供参考依据。
References)
[1] 刘勇民, 马新玉, 罗秀英.新疆产三种独行菜的生药学研究[J]. 中国中药杂志, 1988, 13(10): 11-12.
LIU Yong-ming, MA Xin-yu, LUO Xiu-ying. (1988). Study on the Pharmacognosy of Three species oflepidiumL. [J].ChinaJournalofChineseMateriaMedica, 13(10):11-12.(in Chinese)
[2]于淑玲. 独行菜的栽培及其利用价值[J]. 特种经济动植物, 2003, 6(12): 30.
YU Shu-ling. (2003). Cultivation and utilization value ofLepidiumapetalum Wild [J].SpecialEconomicAnimalandPlant, 6(12): 30. (in Chinese)
[3]孟君, 李群, 李冠. 两种独行菜种子萌发生理特性研究[J]. 生物技术, 2008, 18(2): 32-35.
MENG Jun, LI Qun, LI Guang. (2008). Physiological Characterisitic of seed germination of two species oflepidiumL. [J].Biotechnology, 18(2): 32-35. (in Chinese)
[4]赵惠新, 李群, 周晶,等. 短命植物独行菜种子萌发过程对低温的耐受特性[J]. 云南植物研究, 2010, 32(5): 448-454.
ZHAO Hui-xin, LI Qun, ZHOU Jin, et al. (2010). The characterisitics of low temperature tlerance during seed germination of the ephemeral plantlepidiumapetalum(cruciferae) [J].ActaBotanicaYunnanica, 32(5): 448-54. (in Chinese)
[5]李萍萍,曾卫军,周茜,等. 解除独行菜种子低温萌发停滞的温度响应蛋白筛选及表达分析[J]. 分子植物育种, 2016,14(3):722-729.
LI Ping-ping, ZENG Wei-jun, ZHOU Xi, et al. (2016). Screening and expression ananlysis of temperature-responsing proteins that can remove low temperature stagnancy of germination inlepidiumseeds [J].MolecularPlantBreeding, 14(3):722-729. (in Chinese)
[6]谷丽丽, 刘立鸿, 油天钰, 等. 新疆短命植物抱茎独行菜种子粘液质特性的研究[J]. 西北植物学报, 2008, 28(12): 2 451-2 460.
GU Li-li, LIU Li-hong, YOU Tian-yu, et al. (2008). Characterization of the Seed Coat Mucilage Properties of Ephemeral PlantLepidiumperfoliatumL in Xinjiang [J].ActaBotanicaBoreali-OccidentaliaSinica, 28(12):2,451-2,460. (in Chinese)
[7]袁祯燕, 多力坤·买买提玉素甫, 黄培佑. 早春短命植物独行菜天然种衣与水分的关系[J]. 种子, 2006, 25(9):1-3.
YUAN Zhen-yan, Duolikun Maimaitiyusufu, HUANG Pei-you. (2006). The Relationship Between Water and the Seed Coat ofLepidiumApetalum-an Ephemeral [J].Seed, 25(9):1-3. (in Chinese)
[8]宋明方, 刘会良, 张道远,等. 准噶尔荒漠120种植物粘液繁殖体的甄别与比较[J]. 中国沙漠, 2009, 29(6):1 134-1 140.
SONG Ming-fang, LIU Hui-liang, ZHANG Dao-yuan, et al. (2009). Screening and Comparison on Myxospermy of 120 Species Occurring on the Junggar Desert [J].JournalofDesertResearch, 29(6):1,134-1,140. (in Chinese)
[9]Damerval, C., De Vienne, D., Zivy, M., & Thiellement, H. (1986). Technical improvements in two‐dimensional electrophoresis increase the level of genetic variation detected in wheat‐seedling proteins.Electrophoresis, 7(7): 52-54.
[10]Hurkman, W. J., & Tanaka, C. K. (1986). Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis.PlantPhysiology, 81(3): 802-806.
[11]李晓琳, 邵爱娟, 陈敏, 等. 酸浆种子蛋白提取方法的比较研究[J]. 中国实验方剂学杂志, 2010,16(1): 14-17.
LI Xiao-lin, SHAO Ai-juan, CHEN Min, et al. (2010). Comparison of Protein Extraction Methods for the Semen Seu Fructus Physalis [J].ChineseJournalofExperimentalTraditionalMedicalFormulae, 16(1): 14-17. (in Chinese)
[12]杨柳, 李海林, 张振乾. 油菜种子蛋白质提取方法研究[J]. 作物研究, 2015, (1): 11-15.
YANG Liu, LI Hai-lin, ZHANG Zhen-qian. (2015). Study on protein extraction methods for seed of rapeseed [J].CropResearch, (1):11-15. (in Chinese)
[13]梁丛敏, 李玉琴, 杨冬之,等. 甘蓝型油菜种子油体蛋白提取及双向电泳分析[J]. 南方农业学报, 2013, 44(11):1 776-1 780.
LIANG Cong-min, LI Yu-qin,YANG Dong-zhi, et al. (2013). 2D-polyacrylamide gel electrophoresis analysis and extraction ofoilbody protein in seed of Brassica napus [J].JournalofSouthernAgriculture, 44(11): 1,776-1,780. (in Chinese)
[14]Bradford, M. M. (1976). A rapid method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, anal. biochem.AnalyticalBiochemistry, 72(s1-2): 248-254.
[15]张富春,李江伟.分子生物学实验技术[M].乌鲁木齐:新疆大学出版社,2008:82-88.
ZHANG Fu-chun, LI Jiang-wei. (2008).Protocolsinmolecularbiology[M]. Urumqi: Xinjiang University Publishing House: 82-88. (in Chinese)
[16]郑蕊, 喻德跃.适于蛋白质组研究的大豆种子蛋白双向电泳技术的改进[J]. 大豆科学, 2005, 24(3):166-170.
ZHENG Rui, YU De-yue. (2005). Improvement of two-dimensional electrophoresis of bean seed proteome analysis [J].Soybeanscience, 24(3):166-170. (in Chinese)
[17]孙杰, 刘永志, 康俊梅,等. 野牛草种子蛋白质组双向电泳样品制备方法的分析比较[J]. 安徽农业科学, 2009, 37(13):176-178.
SUN Jie, LIU Yong-zhi, KANG Jun-mei, et al. (2009). Comparative Analysis on the Preparation Methods of Bidirectional Electrophoretic Samples of Proteome from Buffalo Grass Seeds [J].JournalofAnhuiAgriculturalSciences, 37(13):176-178. (in Chinese)
[18]张晓林, 陆秀君, 马蓓蓓,等. 天女木兰种子蛋白双向电泳体系的建立[J]. 西北农林科技大学学报(自然科学版), 2012,(8):207-214.
ZHANG Xiao-lin, LU Xiu-jun, MA Bei-bei, et al. (2012). Establishment of two-dimensional electropjoresis system of Magnolia sieboldii K.Koch seeds [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition) , (8):207-214. (in Chinese)
[19]夏江勇, 吕潇, 张晓倩,等. 向日葵种子蛋白双向电泳技术体系建立的初步研究[J]. 种子, 2014, 33(12):94-97.
XIA Jiangyong,lü Xiao,Zhang Xiaoqian, et al. (2014). A preliminary study on Two-dimentional Electrophoresitic Technology System for Sunflower seed Protein[J].seed, 33(12):94-97.(in Chinese)
[20]Bae M S, Cho E J, Choi E Y, et al. (2004). Analysis of the Arabidopsis nuclear proteome and its response to cold stress[J].PlantJournalforCell&MolecularBiology, 36(5):652-663.(in Chinese)
[21]徐莉, 胡增, 吴阳清,等. 银杏种子蛋白的SDS-PAGE电泳分析[J]. 南方农业, 2015,(13):47-48.
XU Li, Hu Zeng, Wu Yangqing, et al. (2015). SDS-PAGE electrophoresis analysis of protein from Ginkgo biloba L seed[J].SouthChinaAgriculture, (13):47-48.(in Chinese)
Comparative Study of Four Methods of Total Protein Extraction from Seeds of Two Species ofLepidiumPlants
DING Jin-peng, ZHANG Na, LI Qun
(College of Life Science and Technology, Xinjiang University, Urumuqi 830046, China)
【Objective】 To explore the extraction methods of protein samples for SDS-PAGE and two-dimensional electrophoresis (2-DE) of the stem, vegetable, and vegetable seeds, and lay the foundation for the study of seed protein proteomics of the two species ofLepidiumplants.【Method】The efficiency of four protein extraction methods were compared and analyzed through protein purity detection and SDS-PAGE.【Result】Of all the four methods, TCA/acetone extraction method generated higher yield as well as highest resolution and clear estelectrophoresis bands in SDS-PAGE, lysis extraction method got the highest protein yield whereas with highest impurities, Tris-HCl method and phenol method could obtain the highest purity but lowest protein yield, meanwhile protein extracted by lysis method and phenol method had the highest level of high-abundance proteins which could cause serious interference in further SDS-PAGE and 2-DE analysis. We got 6 differential expressed bands after compared between two species ofLepidiumplants by SDS-PAGE using seed total protein extracted by TCA/acetone extraction method and phenol method.【Conclusion】TCA/acetone seed total protein extraction method is an optimal sample preparation protocol for SDS-PAGE and 2-DE. Besides, the differential bands of SDS-PAGE electrophoresis of two kinds ofLepidiumseed protein could provide reference for screening two seeds.
short ultivars; growth stages; major gene plus polygene inheritance; genetic analysis; SDS-PAGE
Li Qun(1971-), female, Xinjiang, Ph.D., Master Instructor, Mainly engaged in research work in plant stress physiology and molecular biology, (E-mail) liqun_007@126.com
10.6048/j.issn.1001-4330.2017.07.017
2017-03-25
国家自然科学基因项目“新疆濒危植物高山离子芥抗冷相关功能基因组分析与关键基因克隆”(31160051);新疆维吾尔自治区重大科技专项“新疆早春短命植物与模式植物拟南芥的比较基因组学与功能基因组学研究”(200840102-40)
丁金鹏(1991-),女,甘肃武威人,硕士,研究方向为植物逆境生理与分子生物学,(E-mail)1592397633@qq.com
李群(1971-),女,北京人,副教授,博士,硕士生导师,研究方向为植物逆境生理与分子生物学,(E-mail)liqun_007@126.com
S188
A
1001-4330(2017)07-1305-08
Supported by: National Natural Science Foundation"Functional genome analysis of cold resistant and key gene clone in Xinjiang endangered plant Chorispora bungeana"(31160051); The Key Scientific Projects for Supporting Xinjiang Uygur Autonomous Region "Comparative genomics and functional genomics of early spring ephemeral plants and model plants of Arabidopsis thaliana in Xinjiang" (200840102-40).
