采用CDR3亲和力转移方法快速获得抗FSHR抗体
2017-09-06席欧彦邱玲玲马晓玲秦瑞坪赵婷李江伟
席欧彦,邱玲玲,马晓玲,秦瑞坪,赵婷,李江伟
(新疆大学生命科学与技术学院/新疆生物资源基因工程省部共建重点实验室,乌鲁木齐 830046)
采用CDR3亲和力转移方法快速获得抗FSHR抗体
席欧彦,邱玲玲,马晓玲,秦瑞坪,赵婷,李江伟
(新疆大学生命科学与技术学院/新疆生物资源基因工程省部共建重点实验室,乌鲁木齐 830046)
【目的】评价骆驼来源的纳米抗体cAbBCII10作为非抗体亲和力转移骨架的潜能,采用亲和力转移的方法,将FSHR结合肽段移植到cAbBCII10的抗原结合区以快速获得抗FSHR抗体。【方法】将FSHR结合肽FSH33-53编码序列,分别移植入纳米抗体cAbBCII10的CDR1和CDR3区域中,命名为VHH-hFSH1 和VHH-hFSH3。采用DNA合成方法获得VHH-hFSH1,VHH-hFSH3和cAbBCII10的DNA编码序列,把这些DNA序列克隆到pET22b载体上,将其转化到BL21(DE3)感受态细胞中。经过诱导和表达再用Ni离子亲和纯化获得纯的单域抗体。采取ELISA方法鉴定纯化的cAbBCII10,VHH-hFSH1、VHH-hFSH3与FSHR的结合能力及特异性。【结果】通过框架移植获得的VHH-hFSH1 ,VHH-hFSH3和cAbBCII10蛋白均在细菌胞间质可溶性表达。将FSHR结合肽FSH33-53移植到cAbBCII10的CDR3获得的VHH-hFSH3具有特异结合FSHR活性。【结论】cAbBCII10可以作为移植的框架,FSH和FSHR结合肽段移植到cAbBCII10的CDR1和CDR3区可以获得亲和性较高的抗FSHR抗体。
亲和力转移;FSHR;FSH33-53;cAbBCII10;纳米抗体
0 引 言
【研究意义】卵泡刺激素受体(follicle-stimulating hormone receptor,FSHR)是一种跨膜糖蛋白,属于G蛋白偶联受体超家族中糖蛋白亚家族成员。近期发现FSHR普遍表达于各种进程的肿瘤新生血管内皮的细胞表面。表明了FSHR是一种合适的肿瘤标志物和抗体作用的良好靶点。【前人研究进展】国内外制备抗FSHR抗体都是多克隆抗体或是来自小鼠杂交瘤细胞的单克隆抗体,这些抗体能够在细胞和组织中特异性识别FSHR蛋白[1-2]。但因为全分子抗体分子量过大,不利于在体内的快速清除和对肿瘤组织的有效穿透。因此,无论是针对FSHR的诊断还是靶向治疗,都需要得到更合适的抗体,或者能够对现有抗体分子进行结构改造以提高敏感性得到良好的体内代谢[3]。最早,有研究者在骆驼(Camelidae)体内发现除了常规抗体之外,还存在着一种自身缺失轻链和CH1区的重链抗体(heavy chain antibody,HCAb),其可变区仍具备很好的抗原识别和结合作用[4],重链抗体的可变区(variable domains of the HCAb,VHH)也被称为纳米抗体,具备分子小,生产成本较低,水溶能力强,结构稳定性好以及优先识别受体和配体结合部位的特点[5-6],使得该抗体能够作为一种小型化的基因工程抗体而且在最初实验研究阶段和制备药物等领域有很大的应用潜能。【本研究切入点】由于骆驼纳米抗体分子小、结构简单,只具有3个抗原结合区的特性,使得在设计抗体模拟物和小分子抗体方面成为了理想的结构框架。对VHH抗体的结构和稳定性进行的深入研究中还发现VHH的抗原结合环(loop)并不符合人和小鼠VH中的典型抗体结构[7]。然后对VHH与其抗原结合复合物的空间结构分析显示,VHH抗体与抗原的结合大部分由CDR3环介导[8]。与哺乳动物VH的结构显著不同,但依旧保持了完全的抗原结合活性。此外,VHH结构域的CDR3环相比于小鼠和人VH中的CDR3更长,其相对于增加了VH的抗原结合表面,并部分补偿了轻链的缺乏。另外框架区尤其是FR2在抗体的稳定性方面发挥重要作用。结合这些研究结论,Saerens 等[9]分析了大量VHH抗体的框架区,发现结合β内酰胺酶具有完整框架区可以接受骆驼VHH抗体亚家族II中的大部分抗体的三个CDR的移植,具有CDR 通用移植骨架的潜能,cAbBCII10也是迄今为止分离的最稳定的VHH结构域之一,其框架已经用于许多框架移植和人源化研究[10-14]。其他研究者采用该抗体进行亲和力移植也获得了一定的成功。【拟解决的关键问题】对目前而言,还没有采用非抗体来源的亲和力转移至cAbBCII10完整框架区的报道。为了评价骆驼来源的纳米抗体cAbBCII10作为非抗体亲和力转移骨架的潜能,研究主要是把FSH结构中与其受体结合的肽段FSH33-53[15]移植到cAbBCII10的抗原结合区,为今后快速获得抗FSHR纳米抗体提供新的途径与方法。
1 材料与方法
1.1 材 料
抗c-Myc标签单克隆抗体(HRP)购于Cell Signaling,蛋白Maker购自TaKaRa公司,镍柱Ni Sepharose购于GE公司,抗FSHR单克隆抗体购买于R&D公司,TES缓冲溶液(10 mM Tris,1 mM EDTA,20%葡萄糖pH 8.0)其他试剂均为化学分析纯。
1.2 方 法
1.2.1 亲和力转移方法构建cAbBCII10表达载体
采用全基因合成方法获得cAbBCII10编码序列,通过酶切位点NcoI和XhoI 将其克隆至pET22b载体上。采用同样方法(由上海杰瑞生物公司合成)将FSH33-53编码DNA序列分别插入到cAbBCII10的CDR1和CDR3区域,并命名为VHHhFSH1和VHHhFSH3,通过酶切位点NcoI和XhoI将其克隆至pET22b载体上。DNA测序验证合成和构建是否正确。
1.2.2 重组蛋白的胞间质表达和纯化
将重组质粒pET22b-cAbBCII10、pET22b-VHHhFSH1和pET22b-VHHhFSH3通过热击法分别转化到大肠杆菌BL21(DE3)中,挑取单克隆,37℃培养。再把1%的一活菌液接种到在500 mL含有氨苄的LB培养基里,220 r/min的摇床中,4 h;加入IPTG诱导表达重组蛋白。利用高渗法破碎细胞。TES缓冲溶液冰浴处理细胞4 h,5倍稀释TES冰浴细胞4 h,-20℃过夜。之后冰浴溶解,离心20 min取得上清就为胞间质蛋白。采用镍离子亲和柱对cAbBCII10、VHHhFSH1、VHHhFSH3抗体进行纯化。先用20 mM咪唑缓冲液缓慢的结合2 h,20 mM咪唑洗杂,500 mM咪唑缓冲液洗脱。取得的样品经15%SDS-PAGE凝胶电泳的方式检测抗体蛋白的表达以及纯化抗体的纯度。再用Bradford法定量获得纯化之后的蛋白具体浓度。
1.2.3 间接ELISA方法检测胞间质表达的VHHhFSH1和VHHhFSH3与FSHR的结合活性和特异性
将浓度为8 μg/mL的抗原FSHR包被在96孔ELISA板中,4℃过夜。纯化的抗体cAbBCII10、VHHhFSH1、VHHhFSH3 以及FSHR抗体(R&D公司)作为一抗,浓度固定在10 μg/mL;抗FSHR蛋白使用的二抗为C-myc-HRP鼠单克隆抗体(CUSABIO公司),稀释比例为1∶3 000;DAB进行显色。检测合成抗体VHHhFSH1和VHHhFSH3对抗原FSHR的特异性。阴性对照BSA,阳性对照为商业化的抗FSHR单克隆抗体(由公司购买)。
1.2.4 非竞争ELISA检测VHHhFSH1和VHHhFSH3对FSHR的结合亲和力
选择结合特异性显著的VHHhFSH1、VHHhFSH3抗体,使用ELISA的方法验证其对抗原FSHR的亲和力。抗原FSHR包被浓度为8 μg/mL,抗FSHR蛋白的一抗为VHHhFSH1、VHHhFSH3抗体的依次稀释浓度为5、10、20、30、40、50、60、70和80 μg/mL;二抗为抗c-Myc标签HRP鼠单克隆抗体(Cell Signaling),稀释比例(1∶3 000);DAB显色。
2 结果与分析
2.1 VHHhFSH1、VHHhFSH3和cAbBCII10载体的构建
实验通过将人的FSH与受体结合的肽段FSH33-53分别移植到cAbBCII10的CDR1和CDR3区,命名为VHHhFSH1和VHHhFSH3(由上海杰瑞生物公司合成)。以制备能与FSHR特异性结合的抗体。移植氨基酸序列。利用基因合成方法获得移植片段的DNA序列。将合成的DNA序列通过酶切位点NcoI和XhoI构建到pET22b载体上,得到重组质粒pET22b-cAbBCII10、pET22b-VHHhFSH1和pET22b-VHHhFSH3。表1

表1 框架移植的氨基酸序列
注:a.表中斜体加粗氨基酸序列为移植到cAbBCII10的CDR1的FSH33-53编码序列;b.表中斜体加粗氨基酸序列为移植到cAbBCII10的CDR3的FSH33-53编码序列
Note: a. The italicized amino acid sequence in the table is the FSH33-53 coding sequence of CDR1 grafted to cAbBCII10; b. The bolded amino acid sequence in the table is the FSH33-53 coding sequence of CDR3 grafted to cAbBII10
构建好的重组质粒经过DNA测序及抗体序列分析表明,VHHhFSH1和VHHhFSH3序列均分别正确移植到cAbBCII10的CDR1和CDR3区域。图1

注:图中斜体部分为移植的FSH33-53的氨基酸序列
Note:
图1 cAbBCII10、VHHhFSH1和VHHhFSH3的氨基酸序列比对结果
Fig.1 Comparison of amino acid sequences of cAbBCII10, VHHhFSH1 and VHHhFSH3
2.2 重组抗体在大肠杆菌中的表达与纯化
质粒pET22b-cAbBCII10、pET22b-VHHhFSH1和pET22b-VHHhFSH3转入表达菌BL21(DE3)中诱导表达,经过高渗低渗的方法,获得的蛋白均以胞间质的形式进行表达。纯化后的蛋白分子量大小在20kDa左右。 图2
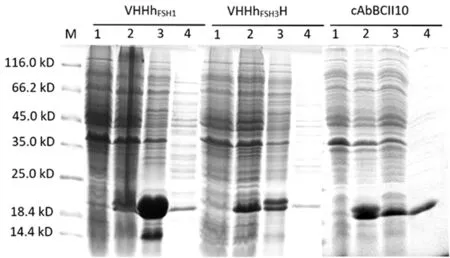
M:蛋白marker;1:未诱导菌液;2:IPTG诱导菌液;3:包涵体表达蛋白;4:胞间质表达蛋白
M:protein marker;1:uninduced bacterial lysate; 2:IPTG induced bacterial lysate; 3:precipitation of induced bacterial lysate; 4:supernatant protein of induced bacterial lysate
图2 cAbBCII10、VHHhFSH1、VHHhFSH3重组蛋白在大肠杆菌中的表达
Fig.2 Expression of the recombinant protein cAbBCII10, VHHhFSH1and VHHhFSH3
采取镍离子亲和层析,纯化带有His标签的cAbBCII10、VHHhFSH1、VHHhFSH3重组蛋白,经过SDS-PAGE电泳,可以看到单一且清晰的条带,因此可以知道得到的纳米抗体纯度在90%以上。再利用Bradford法检测纯化各组分蛋白的浓度分别为cAbBCII10(200 g/mL)、VHHhFSH1(140 μg/mL)、VHHhFSH3(100 μg/mL)。图3
2.3 VHHhFSH1和VHHhFSH3与FSHR的结合特性
将纯化的重组蛋白VHHhFSH1、VHHhFSH3与抗原FSHR通过ELISA测定其亲和力。抗原FSHR蛋白包被浓度均为8 μg/mL每孔;重组抗体蛋白VHHhFSH1、VHHhFSH3为10 μg/mL。结果表明,与阴性对照BSA对比,VHHhFSH1、VHHhFSH3的特异性均有显著性差异(**P<0.05)。图4
随后选择特异性显著的VHHhFSH1、VHHhFSH3 抗体,利用ELISA的方法检测其对抗原FSHR的亲和力。将抗原FSHR包被的浓度均设为8 μg/mL,随着抗体浓度的提高,结合能力提高,最终在20 μg/mL时其结合饱和并趋于平衡。 VHHhFSH1、VHHhFSH3 抗体在浓度为20 μg/mL的时候,结合能力最好,随着抗体浓度的提高,结合能力达到饱和,最终在40 μg/mL时结合饱和并趋于平衡。图5

M:蛋白Marker(116 kD ,66.2 kD ,45.0 kD ,35.0 kD,25.0 kD,18.4 kD,14.4 kD);1:未诱导菌液;2:IPTG诱导菌液;3:包涵体表达蛋白;4:胞间质表达蛋白
M:protein marker(116 kD ,66.2 kD,45.0 kD,35.0 kD,25.0 kD,18.4 kD,14.4 kD); 1:uninduced bacterial lysate; 2:IPTG induced bacterial lysate; 3:precipitation of induced bacterial lysate; 4:supernatant protein of induced bacterial lysate
图3 重组蛋白cAbBCII10、VHHhFSH1、VHHhFSH3的纯化SDS-PAGE凝胶电泳图
Fig.3 Purification of recombinant proteins cAbBCII10, VHHhFSH1, VHHhFSH3 SDS-PAGE gel electrophoresis
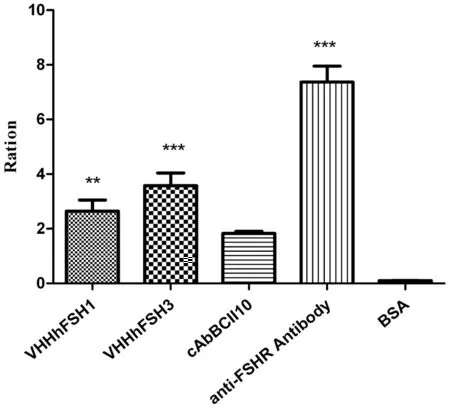
图4 ELISA检测cAbBCII10、VHHhFSH1、VHHhFSH3与FSHR的特异性
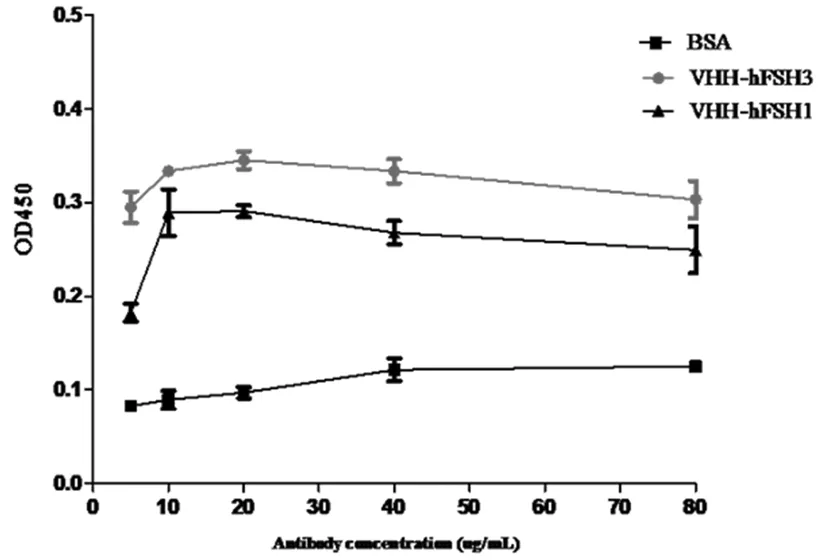
图5 ELISA检测重组抗体VHHhFSH1和VHHhFSH3对抗原FSHR的亲和力
3 讨 论
cAbCⅡ10的晶体结构作为可移植的框架结构已经被报道[14],将肽的序列移植到CDR1区或者CDR3区可能会导致cAbCⅡ10框架的细微的结构变化,而移植到CDR2则会导致骆驼体内典型的免疫球蛋白结构解体。因此在cAbBCII10的晶体结构中CDR1和CDR3的移植具有合适的稳定框架。实验中移植CDR3的抗体要比移植CDR1的抗体的结合能力强。这表明CDR3相比其他CDR区,CDR3长度更长,可识别的区域更大。也可能原因是移植的肽段在cAbBCII10的CDR3区更有利于与其它FR区形成结合FSHR的空间结构可能形成线性互补位。
对于选择FSH33-53肽段进行移植具有以下优点:肽的氨基酸序列短,10~30个氨基酸序列;氨基酸的序列≥50%为亲水残基序列(Leu,Val,Ile,Phe,Trp);可以直接识别跨膜的受体的表面,利用结构数据可以直接对胞外环或者胞外区进行定位,获得抗原的表位图谱[16-19]。据文献报道,骆驼抗体cAbBCII10 VHH的可变片段可以作为结合肽的移植的新框架材料,研究也成功利用这个框架制备得到了抗FSHR的抗体。这说明cAbBCII10VHH片段是单结构域可以对各种CDR区耐受,而且CDR1和CDR3结构可以充分暴露在空间结构表面[20]。
4 结 论
研究主要是把FSHR结合肽FSH33-53编码序列,分别移植入纳米抗体cAbBCII10的CDR1和CDR3区域中,并在大肠杆菌BL21(DE3)中经过诱导和表达得到了可溶性的纳米抗体VHHhFSH1、VHHhFSH3蛋白。通过验证纳米抗体与抗原FSHR的结合特异性,结果显示在抗体浓度为10 μg/mL时,两个纳米抗体均可以与抗原结合。又进一步验证两个纳米抗体与抗原FSHR结合的亲和力,在抗体浓度为20 μg/mL时结合能力最好,其中VHHhFSH3的亲和力更强,表明VHH-hFSH3具有特异结合FSHR活性。在今后的研究中,我们将进一步优化FSH33-53的密码子,以提高抗FSHR抗体与FSHR结合能力,对今后的设计有效的抗体片段具有一定的指导意义。
References)
[1] Wu, J., Wang, Y., Xiao, W., Meyer, K. B., Schmidt, K. M., & Morris, R. E., et al. (2004). Assessment of recombinant porcine follicle-stimulating hormone receptor using a novel polyclonal ectodomain antibody.EndocrineResearch, 30(2): 269-285.
[2] Vannier, B., Loosfelt, H., Meduri, G., Pichon, C., & Milgrom, E. (1996). Anti-human fsh receptor monoclonal antibodies: immunochemical and immunocytochemical characterization of the receptor.Biochemistry, 35(5): 1,358-1,366.
[3] 夏雪琴, 木亚沙尔·买买提拉洪, 翟田甜,等. 抗卵泡刺激素受体纳米抗体的制备及鉴定[J]. 细胞与分子免疫学杂志, 2013, 29(8):829-833.
XTA Xue-qin, Muyashaer Maimaitilahong, ZHAI Tian-tian,et al. (2013). Preparation and identification of anti-follicle-stimulating hormone receptor nano-bodies [J].ChineseJournalofCellularandMolecularImmunology, 29(8): 829.(in Chinese)
[4] Hamers-Casterman, C., Atarhouch, T., Muyldermans, S., Robinson, G., Hamers, C., & Songa, E. B., et al. (1993). Naturally occurring antibodies devoid of light chains.Nature, 363(6428): 446-448.
[5] Huang, L., Muyldermans, S., & Saerens, D. (2010). Nanobodies?: proficient tools in diagnostics.ExpertReviewofMolecularDiagnostics,10(6): 777-785.
[6] 杨珂, 王冬. 纳米抗体及其应用[J]. 细胞与分子免疫学杂志, 2008, 24(4): 425-427.
YANG Ke, WANG Dong. (2008). Nanobody and its application [J].ChineseJournalofCellularandMolecularImmunology, 24(4): 425-427.(in Chinese)
[7] Decanniere, K., Muyldermans, S., & Wyns, L. (2000). Canonical antigen-binding loop structures in immunoglobulins: more structures, more canonical classes? 1.JournalofMolecularBiology, 300(1): 83-91.
[8] Lvgren, J., Pursiheimo, J. P., Pyykk, M., Salmi, J., & Lamminm?ki, U. (2016). Next generation sequencing of all variable loops of synthetic single framework scfv-application in anti-hdl antibody selections.NewBiotechnology, 33(6): 790-796.
[9] Hattori, T., & Mnakanishi, U. (2010). High affinity anti-inorganic material antibody generation by integrating graft and evolution technologies: potential of antibodies as biointerface molecules.JournalofBiologicalChemistry, 285(10): 7,784-7,793.
[10] Conrath, K. E., Lauwereys, M., Galleni, M., Matagne, A., Frère, J. M., & Kinne, J., et al. (2001). Beta-lactamase inhibitors derived from single-domain antibody fragments elicited in the camelidae.AntimicrobialAgents&Chemotherapy, 45(10): 2,807-2,812.
[11] Dumoulin, M., Conrath, K., Van, M. A., Meersman, F., Heremans, K., & Frenken, L. G., et al. (2002). Single-domain antibody fragments with high conformational stability.ProteinScienceAPublicationoftheProteinSociety, 11(3): 500-515.
[12] Stefan Ewert, Christian Cambillau, §., Katja Conrath, ‖. A., & Andreas Plückthun. (2002). Biophysical properties of camelid vhh domains compared to those of human vh3 domains?.Biochemistry,41(11): 3,628-3,636.
[13] Conrath, K., Vincke, C., Stijlemans, B., Schymkowitz, J., Decanniere, K., & Wyns, L., et al. (2005). Antigen binding and solubility effects upon the veneering of a camel vhh in framework-2 to mimic a vh.JournalofMolecularBiology, 350(1): 112-125.
[14] Saerens D; Pellis M; Loris R; Pardon E; Dumoulin M; Matagne A; Wyns L; Muyldermans S; Conrath K. (2005). Identification of a universal vhh framework to graft non-canonical antigen-binding loops of camel single-domain antibodies.Journalofmolecularbiology, 352(3): 597-607.
[15] Coloma, T. A. S., Dattatreyamurty, B., & Jr, L. E. R. (1990). A synthetic peptide corresponding to human fsh beta-subunit 33-53 binds to fsh receptor, stimulates basal estradiol biosynthesis, and is a partial antagonist of fsh.Biochemistry, 29(5): 1,194-1,200.
[16] Muyldermans, S. (2001). Single domain camel antibodies: current status.JournalofBiotechnology, 74(4): 277-302.
[17] Harmsen, M. M., & De Haard, H. J. (2007). Properties, production, and applications of camelid single-domain antibody fragments.AppliedMicrobiologyandBiotechnology, 77(1): 13-22.
[18] De, M. A. (2011). Biotechnological applications of recombinant single-domain antibody fragments.MicrobialCellFactories, 10(1): 44.
[19] Hutchings, C. J., Koglin, M., & Marshall, F. H. (1900). Therapeutic antibodies directed at g protein-coupled receptors.Mabs, 2(6): 594-606.
[20] Vincke, C., Loris, R., Saerens, D., Martinez-Rodriguez, S., Muyldermans, S., & Conrath, K. (2009). General strategy to humanize a camelid single-domain antibody and identification of a universal humanized nanobody scaffold.JournalofBiologicalChemistry, 284(5): 3,273-3,284.
Rapid Generation of Anti-FSHR Nanobody by CDR3 Affinity Transfer Approach
XI Ou-yan, QIU Ling-ling, MA Xiao-ling, QIN Rui-ping, ZHAO Ting, LI Jiang-wei
(Xinjiang Key Laboratory of Biological Resources and Genetic Engineering / College of Life Science and Technology, Xinjiang University, Urumqi 830046,China)
【Objective】 To evaluate the potential of camel-derived antibody cAbBCII10 as a non-antibody affinity transfer skeleton, the FSHR binding peptide was grafted to the antigen-binding region of cAbBCII10 using affinity transfer to rapidly obtain anti-FSHR antibody.【Method】The FSH binding motif FSH 33-53 coding sequence was inserted into the CDR1 and CDR3 regions of the nanobody cAbBCII10, respectively, and named VHH-hFSH1 and VHH-hFSH3. These DNA sequences were cloned into pET22b vector and transformed into E. coli BL21 (DE3), and purified single-domain antibody was obtained by IPTG induction and Ni-affinity affinity chromatography.【Result】Finally binding capacity and specificity of purified cAbBCII10, VHH-hFSH1 and VHH-hFSH3 with FSHR were identified by ELISA. The VHH-hFSH1, VHH-hFSH3 and cAbBCII10 proteins obtained by the framework transplantation were expressed in the intercellular space of bacteria. ELISA experiments showed that the VHH-hFSH3 obtained by grafting the FSHR binding peptide FSH33-53 to the CDR3 of cAbBCII10 had a specific binding to FSHR activity.【Conclusion】CAbBCII10 can be used as a graft framework, FSH and FSHR binding peptide grafted into the CDR1 and CDR3 regions of cAbBCII10 can obtain higher affinity anti-FSHR antibody.
affinity transfer; FSHR; FSH33-53; cAbBCII10; nanobody
LI Jiang-wei (1967-), male, native place: Urumqi, Xinjiang. Professor, research field: Molecular immunology , (E-mail)jwli67@sina.com
10.6048/j.issn.1001-4330.2017.07.016
2017-04-24
国家自然科学基金项目“骆驼单域抗体框架区作为小分子抗体通用移植骨架的研究”(31370933);国家自然科学基金项目“基于高通量测序对骆驼抗体库的多样性分析和数据挖掘及新纳米抗体的发现”(31570935)
席欧彦(1990-),女,新疆伊犁人,硕士研究生,研究方向为生物学,(E-mail)1543687922@qq.com
李江伟(1967-),男,新疆乌鲁木齐人,教授,研究方向为分子免疫学,(E-mail)jwli67@sina.com
S188
A
1001-4330(2017)07-1298-07
Supported by: National Natural Science Foundation of China "Study on the Universal Transplantation Framework of Camel Single Domain Antibody Framework as Small Molecule Antibody"(31370933);National Natural Science Foundation of China "Diversity Analysis and Data Mining of Camel Antibody Library Based on High Throughput Sequencing and Discovery of New Nanobody Antibody"(31570935)
