玉米ZmCIPK23基因Mutator插入突变体的鉴定
2017-09-06陈果陈勋基李建平郝晓燕常晓春足木热木郑军黄全生
陈果,陈勋基,李建平,郝晓燕,常晓春,足木热木,郑军,黄全生
(1.新疆农业科学院核技术生物技术研究所,乌鲁木齐 830091;2.中国农业科学院作物科学研究所,北京 100081)
玉米ZmCIPK23基因Mutator插入突变体的鉴定
陈果1,陈勋基1,李建平1,郝晓燕1,常晓春1,足木热木1,郑军2,黄全生1
(1.新疆农业科学院核技术生物技术研究所,乌鲁木齐 830091;2.中国农业科学院作物科学研究所,北京 100081)
【目的】玉米ZmCIPK23基因的候选突变体连续与玉米自交系B73回交并自交,最终得到以B73为背景的纯合突变体,为研究该基因的功能奠定材料基础。【方法】从玉米Mutator(Mu)突变体库中定向筛选到玉米ZmCIPK23基因的候选突变体。在田间种植候选突变体,利用巢式PCR对这些后代植株进行鉴定,选择阳性植株与B73杂交。通过连续的回交及自交,最终获得该基因的纯合突变体。【结果】通过PCR鉴定,获得了以B73为背景的ZmCIPK23基因纯合的突变体zmcipk23。【结论】获得了玉米ZmCIPK23基因的Mu插入的纯合突变体zmcipk23,为研究该基因的功能奠定了基础。
玉米;Mutator转座子;ZmCIPK23;突变体
0 引 言
【研究意义】类钙调磷酸酶B互作蛋白激酶(CIPK)是植物所特有的一类蛋白激酶,在植物逆境如干旱﹑高盐应答等非生物胁迫反应中起着重要的作用,而在重要农作物玉米中CIPK基因的功能研究还非常少。研究从反向遗传学角度出发,利用玉米Mutator转座子,定向筛选ZmCIPK23基因Mu插入的突变体。通过PCR等鉴定方法,最终获得玉米ZmCIPK23基因的纯合突变体,为研究该基因在逆境胁迫下的功能奠定基础。【前人研究进展】Mutator转座子在玉米功能基因组学及突变体库构建中起着非常重要的作用,利用该转座子构建了许多玉米突变体库[1]。随着Mutator突变体库的建立,许多方法如热不对称交错PCR(TAIL-PCR)、酶切-连接-扩增(DLA)等先后用于检测Mu转座子插入位点[2, 3]。 已有研究报道,利用Mutator转座子,鉴定了5个对干旱胁迫响应的玉米蛋白磷酸酶基因[4]。类钙调磷酸酶B互作蛋白激酶(CIPK)是植物所特有的一类蛋白激酶,该基因家族在植物非生物逆境胁迫中发挥着重要的作用。在拟南芥中,CIPK23能够磷酸化K+转运蛋白AKT1,从而在低钾胁迫下,植株能够正常生长发育[5](Xu, 2006 #2440;Ragel, 2015 #2439)。在玉米中,对CIPK基因的功能报道有限。ZmCIPK16受ABA、干旱、NaCl等诱导表达;ZmCIPK16过表达后能部分消除拟南芥sos2突变体对盐敏感的表型[6]。过表达的玉米ZmCIPK21能降低转基因拟南芥中Na+的含量,增强转基因拟南芥耐盐性;并且该基因过表达后,能够互补拟南芥突变体cipk1-2[7]。在玉米基因组中,分布着至少43个CIPK基因[8], 然而其参与的调控通路,尤其在非生物胁迫逆境中的调控途径却知之甚少,并且在玉米功能基因组学研究中,利用Mutator转座子研究CIPK基因的功能还未见报道。【本研究切入点】玉米基因组中至少有43个CIPK基因,然而迄今为止,只有极少数的基因有功能研究报道,并且还是借助模式植物拟南芥,通过异源表达的方式进行的。而直接在玉米基因组中研究其功能还未见报道。研究利用玉米Mutator转座子以及PCR鉴定的方法,在玉米中鉴定并得到ZmCIPK23基因的纯合突变体,期望为该基因的功能研究奠定基础。【拟解决的关键问题】获得可稳定遗传并纯合的ZmCIPK23基因突变体,为研究该基因在逆境胁迫下的功能奠定基础。
1 材料与方法
1.1 材 料
玉米ZmCIPK23基因Mu插入的候选突变体材料,回交受体材料为自交系B73。
1.2 方 法
1.2.1 玉米ZmCIPK23基因候选突变体材料的种植及回交
将ZmCIPK23基因候选突变体材料和自交系B73分别种植于安宁渠试验场,每个材料种植3行,每行定苗15株。行长3 m,行距60 cm,株距20 cm。待玉米长至5~6叶,单株提取玉米叶片基因组DNA,用于PCR鉴定。鉴定完成后,保留含有Mu因子的玉米植株,并与B73回交。以此方法类推,直到与B73回交5代后,并自交2代,得到BC5F2代候选突变体材料。此时对候选突变体进行基因型鉴定,保留阳性植株,自交授粉得到BC5F3代材料,用于基因型鉴定,确定所得到BC5F3代材料为ZmCIPK23基因纯合突变体材料。
1.2.2 玉米叶片基因组DNA提取
玉米叶片DNA提取采用CTAB法。2%CTAB提取液的配制:4 g CTAB、16.4 g NaCl、8 mL 0.5 M EDTA(pH=8.0)、20 mLTris.HCL(pH=8.0)溶于150 mL蒸馏水中,定容至200 mL。所提取的DNA稀释至大约50 μg/uL,用于PCR鉴定。
1.2.3 引物设计
Mu-TIR引物根据Mutator末端反向重复序列设计Mu-TIR-AGA GAA GCC AAC GCC A(AT)C GCC TC(CT) ATT TCG TC[3]。ZmCIPK23基因的特异引物采用primer3.0在线软件设计(http://bioinfo.ut.ee/primer3-0.4.0/)。在ZmCIPK23基因5’端设计引物ZmCIPK23-GS5’-ACCCTGCGACAAGAAGAGGT,在ZmCIPK23基因3’端设计特异引物ZmCIPK23-GS3’-GACGAGCTCCATGACGATGTA和巢式引物ZmCIPK23-GS3N-GGTCGAGATCTCTCGCTTGAT。图1
1.2.4ZmCIPK23基因候选突变体材料的PCR鉴定及Mu插入位点的确定
以ZmCIPK23基因候选突变体材料的基因组DNA为模板,用Mu-TIR作为上游引物,基因特异性引物ZmCIPK23-GS3’和巢式引物ZmCIPK23-GS3N分别作为下游引物,PCR扩增含有Mu序列的目的基因片段。PCR反应程序为94℃ 3 min;94℃ 30 S,58℃ 30 S,72℃ 45 S,循环35次;72℃延伸7 min。电泳检测PCR产物,若能扩增出预期大小的目的条带,且巢式PCR的条带差异也为预期值,可判断为Mu插入的阳性植株。
用琼脂糖凝胶DNA回收试剂盒(北京全式金生物技术有限公司)回收ZmCIPK23基因片段,将回收片段连接到pGWC-T载体上,转化大肠杆菌DH5a。选取阳性单克隆菌落送北京华大基因公司测序,测序结果用DNAMAN软件分析,与该基因的基因组序列比对,确定Mu插入到该基因的具体位置。基因片段的回收参照回收试剂盒说明进行。
1.2.5 Mu转座子插入ZmCIPK23基因纯合突变体的鉴定
种植BC5F2代植株,每一份BC5F2材料种植15株,PCR鉴定每株Mu插入位点的基因型。以每一单株DNA为模板,用引物组合Mu-TIR与ZmCIPK23-GS3',Mu-TIR与ZmCIPK23-GS3N分别扩增含有Mu序列的ZmCIPK23基因;引物组合ZmCIPK23-GS5’与ZmCIPK23-GS3',ZmCIPK23-GS5’与ZmCIPK23-GS3N 分别扩增不含有Mu序列的ZmCIPK23基因。根据PCR扩增结果,鉴定每一株Mu插入位点的基因型。如果Mu-TIR与ZmCIPK23-GS3',Mu-TIR与ZmCIPK23-GS3N扩增出含有Mu序列的ZmCIPK23基因,而ZmCIPK23-GS5’与ZmCIPK23-GS3',ZmCIPK23-GS5’与ZmCIPK23-GS3N不能扩增出不含有Mu序列的ZmCIPK23基因,则该单株为Mu插入的纯合体。对鉴定为纯合体的植株自交,得到BC5F3代种子。进一步,对BC5F3代的同一插入株系,随机选取10粒种子种于温室内,单株提取DNA,采用以上引物组合进行PCR鉴定,若PCR鉴定其全部为Mu插入纯合体,则可以确定已获得可遗传的纯合Mu插入纯合突变体。PCR反应程序为94℃ 3 min;94℃ 30 S,58℃ 30 S,72℃ 45 S,循环35次;72℃延伸7 min。以自交系B73基因组DNA为模板作为正对照,H2O为模板作为负对照。
2 结果与分析
2.1ZmCIPK23基因可遗传的Mu转座子插入突变体的鉴定
研究选取玉米类钙调磷酸酶B互作蛋白激酶23即ZmCIPK23基因(Zm00001d018799)的Mu插入候选突变体BC3F1代材料。为了进一步验证并得到可遗传的突变体,首先利用巢式PCR,对候选突变体的子代进行检测。
由于Mu转座子具有约220 bp的末端反向重复序列(TIR),所以在TIR区设计简并引物Mu-TIR。在ZmCIPK23基因5’端设计引物ZmCIPK23-GS5’,在ZmCIPK23基因3’端设计特异引物ZmCIPK23-GS3’和巢式引物ZmCIPK23-GS3N(材料与方法)。通过引物组合Mu-TIR与ZmCIPK23-GS3',Mu-TIR与ZmCIPK23-GS3N检测该基因内Mu转座子的插入(图1,图2),并且这两对引物均能扩增出目标条带的植株,才判定为阳性突变体。利用该方法,检测了候选突变体。根据PCR检测结果,鉴定为阳性突变体的植株,如图所示的(3),(4),(5),(7),(8),(9),(12),用自交系B73回交得到BC4F1。种植BC4F1代植株,对其PCR检测,仍然能够检测到Mu转座子的插入。同样的方法,对BC5F1代植株,仍能够检测到Mu转座子的插入,说明该突变体为可遗传的Mu转座子插入突变体。对鉴定为阳性的BC5F1植株自交授粉,获得BC5F2代种子。图2
2.2ZmCIPK23基因Mu转座子插入位点的确定
对以上含有Mu插入的候选突变体,将其引物组合ZmCIPK23-GS5’与ZmCIPK23-GS3'扩增的PCR产物连接到PGWC-T载体上并测序。测序结果用DNAMAN软件分析,发现扩增片段的5’端含有Mu转座子末端反向重复序列。扩增的序列再与ZmCIPK23的基因组序列比对,确定出其中该基因的序列部分,进而扩增序列中Mu转座子序列与该基因序列结合的位点,即为Mu转座子插入ZmCIPK23基因的具体序列位点。结果发现,Mu转座子插入到ZmCIPK23基因的位点位于第1个内含子区。
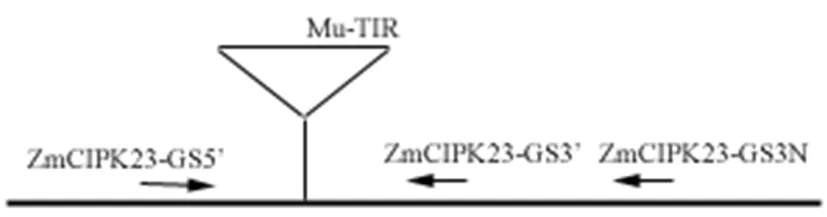
注:Mu-TIR:Mutator 转座子末端反向重复序列
Note: Mu-TIR: Mutator Transposon Terminal Inverted Repeat
图1 引物设计
Fig.1 The primer designed
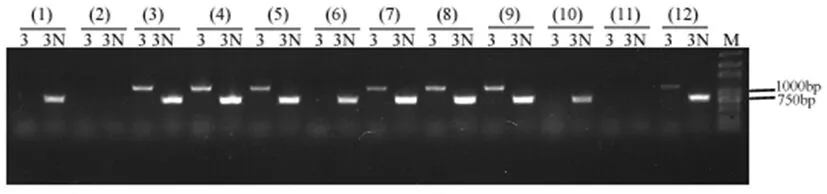
注:用引物组合Mu-TIR与ZmCIPK23-GS3',Mu-TIR与ZmCIPK23-GS3N鉴定Mu转座子的插入;M:D2000 plus DNA Maker;(1)~(12):待鉴定候选突变体;3:引物对Mu-TIR与ZmCIPK23-GS3'的扩增产物;3N:引物对Mu-TIR与ZmCIPK23-GS3N的扩增产物
Note: The primers Mu-TIR and ZmCIPK23-GS3', Mu-TIR and ZmCIPK23-GS3N were used to identify the Mu insertion plant of ZmCIPK23; M: D2000 plus DNA Maker; (1)-(12): Candidate mutants to be identified; 3: The PCR products of the primers Mu-TIR and ZmCIPK23-GS3'; 3N: The PCR products of the primers Mu-TIR and ZmCIPK23-GS3N
图2 Mu转座子插入突变体的鉴定
Fig.2 Identification of the Mu insertion plant ofZmCIPK23
2.3ZmCIPK23基因Mu转座子插入纯合突变体的鉴定
为了鉴定突变体在非生物逆境胁迫下的表型,通常需要得到纯合突变体;根据孟德尔遗传定律,一般在F2代就能分离出纯合的突变体。因此,研究在获得了候选突变体BC5F2代种子的基础上,对BC5F2代的每个单株进行了基因型的检测。检测方法为通过引物组合Mu-TIR与ZmCIPK23-GS3',Mu-TIR与ZmCIPK23-GS3N和引物组合ZmCIPK23-GS5’与ZmCIPK23-GS3',ZmCIPK23-GS5’与ZmCIPK23-GS3N 分别扩增每一个单株材料。如果引物Mu-TIR与ZmCIPK23-GS3',Mu-TIR与ZmCIPK23-GS3N扩增出含有Mu序列的ZmCIPK23基因,而引物ZmCIPK23-GS5’与ZmCIPK23-GS3',ZmCIPK23-GS5’与ZmCIPK23-GS3N不能扩增出不含有Mu序列的ZmCIPK23基因,则该单株为所需要的Mu插入纯合体(图3)。对鉴定为纯合体的植株自交授粉,获得BC5F3代种子。为了确认得到的纯合突变体,对获得的BC5F3代纯合突变体种子,随机选取了10粒种子,种在培养室,提取DNA,用上述方法,鉴定其基因型。这10粒种子全部为纯合的基因型。由此可以证明上述方法的准确性以及获得了ZmCIPK23基因Mu插入的纯合突变体。图3
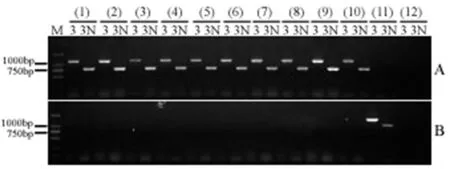
注:M:D2000 DNA maker;(1)~(10):BC5F3代10个不同的单株;(11):自交系B73为模板,正对照;(12):水为模板,负对照;A:3:引物对Mu-TIR与ZmCIPK23-GS3'的扩增产物;3N:引物对Mu-TIR与ZmCIPK23-GS3N的扩增产物;B:3:引物对ZmCIPK23-GS5’与ZmCIPK23-GS3'的扩增产物;3N:引物对ZmCIPK23-GS5’与ZmCIPK23-GS3N的扩增产物
Note: M: D2000 DNA maker; (1)-(10): Individual BC5F3generation plants; (11): Inbred line B73, positive control; (12): Water, negative control; A:3:The PCR products of the primers Mu-TIR and ZmCIPK23-GS3';3N: The PCR products of the primers Mu-TIR and ZmCIPK23-GS3N; B:3: The PCR products of the primers ZmCIPK23-GS5' and ZmCIPK23-GS3'; 3N: The PCR products of the primers ZmCIPK23-GS5' and ZmCIPK23-GS3N
图3 BC5F3代Mu转座子插入纯合突变体的鉴定
Fig.3 Identification of the BC5F3homozygous mutant of the Mu insertion
3 讨 论
类钙调磷酸酶B互作蛋白激酶(CIPK)是植物所特有的一类蛋白激酶,在诸如盐,低钾,ABA,干旱,低温等胁迫下发挥功能[9](Zhu, 2002 #13;Liu, 2000 #2436)。在玉米中,至少有43个CIPK基因,然而对其功能的研究报道却很少。已有研究发现,ZmCIPK16过表达后能部分消除拟南芥sos2突变体对盐敏感的表型;而过表达的玉米ZmCIPK21能降低增强转基因拟南芥耐盐性[6]。玉米中存在大量的CIPK基因,而对其参与的调控路径,行使的功能却知之甚少,尤其在非生物逆境胁迫响应中的作用研究的就更少了。在拟南芥中,与玉米ZmCIPK23同源的基因CIPK23响应低钾胁迫,使植物能够吸收更多的K+,从而使得植物能够正常发育[10]。研究鉴定了玉米ZmCIPK23基因的Mutator插入纯合突变体,期望能为分析该基因在非生物逆境胁迫下,尤其在玉米响应低钾胁迫信号途径中的作用奠定基础。
Mu转座子它能够插入到基因的任何区域,包括启动子、内含子、外显子等区域[11],引起基因的表达、蛋白结构发生改变,最终影响其功能。研究通过测序发现,Mu转座子插入到ZmCIPK23基因的第1个内含子区。Mu转座子插入到内含子,可能使得该基因的剪切发生改变,进而改变ZmCIPK23蛋白的正常生理生化结构,最终使得该基因不能正常行使功能。
Mu转座子作为一种标签,在其两端含有保守的末端反向重复序列(TIRs),因此可以设计引物Mu-TIR,与引物ZmCIPK23-GS5’、ZmCIPK23-GS3'、ZmCIPK23-GS3N组合,可以通过简单易行的PCR方法鉴定候选突变体是否含有Mu因子以及是否纯合。通过鉴定,阳性植株与B73回交,连续回交至5代。并且在BC3F1,BC4F1,BC5F1代植株中鉴定到候选材料均含有Mu因子,证实所得到的材料为可遗传的突变体。根据孟德尔遗传定律,在BC5F2代植株中,鉴定了突变体的基因型,筛选出纯合的突变体。对于纯合的突变体,自交得到BC5F3。为了确保所得到的材料为纯合突变体,再一次对自交得到的BC5F3代突变体材料进行基因型鉴定。随机挑选了其中一个穗子的10粒种子进行了基因型鉴定。结果显示其全部为纯合突变体,所得到的材料为纯合的候选突变体,同时也说明了这种PCR鉴定基因型的方法准确。因此,研究获得了ZmCIPK23基因Mu插入的纯合突变体,为研究该基因在玉米非生物逆境胁迫响应中的功能奠定了材料基础。
4 结 论
研究通过PCR鉴定,获得了玉米ZmCIPK23基因Mu插入的纯合候选突变体。通过测序发现,Mu转座子插入到ZmCIPK23基因的位点位于第1个内含子区,可能引物该基因的剪切发生改变,从而导致ZmCIPK23蛋白的正常生理生化结构发生变化。研究获得了ZmCIPK23基因Mu插入的纯合突变体,为深入研究该基因在玉米逆境胁迫响应中的功能奠定了基础。
致 谢
感谢美国爱荷华州立大学(Iowa State University)Patrick Schnable教授为本研究提供候选突变体材料。
References)
[1] 李见坤, 郑军. 玉米 Mutator 转座子突变体库研究进展[J]. 分子植物育种,2012,10(2):238-244.
LI Jian-kun, ZHENG Jun. (2012). Overview of maize mutant libraries mediated by mutator transposon [J].MolecularPlantBreeding, 10(2): 238-244. (in Chinese)
[2]Liu, Y. G., & Chen, Y. (2007). High-efficiency thermal asymmetric interlaced pcr for amplification of unknown flanking sequences.Biotechniques, 43(5): 649-656.
[3]Liu, S., Dietrich, C. R., & Schnable, P. S. (2009). Dla-based strategies for cloning insertion mutants: cloning the gl4 locus of maize using mu transposon tagged alleles.Genetics, 183(4): 1,215-1,225.
[4]陈果, 李见坤, 王国英, 等. Mu转座子介导的玉米插入突变体的鉴定[J]. 分子植物育种,2011,9(5):572-578.
CHEN Guo, LI Jian-kun, WANG Guo-ying, et al. (2011). Identification of the mutator insertional mutants in maize [J].MolecularPlantBreeding, 9(5): 572-578. (in chinese)
[5]Xu J, Li H, Chen L, Wang Y, Liu L, He L, Wu W. (2006). A Protein Kinase, Interacting with Two Calcineurin B-like Proteins, Regulates K+Transporter AKT1 in Arabidopsis[J].Cell. 125(7):1,347-1,360.
[6]Zhao, J., Sun, Z., Zheng, J., Guo, X., Dong, Z., & Huai, J., et al. (2009). Cloning and characterization of a novel cbl-interacting protein kinase from maize.PlantMolecularBiology, 69(6): 661-674.
[7]Chen, X., Huang, Q., Zhang, F., Wang, B., Wang, J., & Zheng, J. (2014). Zmcipk21, a maize cbl-interacting kinase, enhances salt stress tolerance in arabidopsis thaliana.InternationalJournalofMolecularSciences,15(15):14,819-14,834.
[8]Chen, X., Gu, Z., Xin, D., Liang, H., Liu, C., & Ji, H., et al. (2011). Identification and characterization of putative cipk genes in maize.JournalofGeneticsandGenomics, 38(2): 77-87.
[9]Zhu, J. K. (2002). Salt and drought stress signal transduction in plants.AnnualReviewofPlantBiology, 53(53): 247-273.
[10]Wang, X. P., Chen, L. M., Liu, W. X., Shen, L., Wang, F. L., & Zhou, Y., et al. (2016). Atkc1 and cipk23 synergistically modulate akt1-mediated low potassium stress responses in arabidopsis.PlantPhysiology, 170(4): 2,264-2,277.
[11]Dietrich, C. R., Cui, F., Packila, M. L., Li, J., Ashlock, D. A., & Nikolau, B. J., et al. (2002). Maize mu transposons are targeted to the 5' untranslated region of the gl8 gene and sequences flanking mu target-site duplications exhibit nonrandom nucleotide composition throughout the genome.Genetics, 160(2): 697-716.
Identification of the Mutator Insertional Mutants inZmCIPK23
CHEN Guo1, CHEN Xun-ji1, LI Jian-ping1, HAO Xiao-yan1, CHANG Xiao-chun1, Zumuremu1, ZHENG Jun2, HUANG Quan-sheng1
(1.Research Institute of Nuclear & Biotechnology, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, China; 2.Institute of Crop Sciences,Chinese Academy of Agricultural Sciences,Beijing 100081, China)
【Objective】 The candidate mutants of maizeZmCIPK23 gene were continuously backcrossed and self-pollinated with B73 in fields, and finally homozygous mutants with B73 background were obtained, which laid the material foundation for studying the function of this gene.【Method】The candidate mutants ofZmCIPK23 were screened from a maize Mutant library. They were planted and analyzed by nested PCR. The positive plants with Mu-insertion in theZmCIPK23 gene were self-pollinated and backcrossed with B73 in the field. Thus the homozygous mutants were obtained.【Result】The homozygous mutant ofZmCIPK23 gene was obtained by PCR.【Conclusion】The homozygous mutant (zmcipk23) of Mu insertion ofZmCIPK23 gene was obtained. This study has provided a foundation for the functional analysis of theZmCIPK23 gene.
maize (ZeaMaysL.); mutator transposon;ZmCIPK23; mutant
HUANG Quan-sheng(1964-),male, native place: Urumqi, Xinjiang. Professor, Doctor, research field: Plant molecular biology. (E-mail)hquansheng@126.com
10.6048/j.issn.1001-4330.2017.07.002
2017-02-22
新疆维吾尔自治区自然科学基金“玉米干旱胁迫相关基因Mu插入突变体的鉴定及抗旱性”(2013211B22)
陈果(1984-),男,四川南充人,助理研究员,研究方向为玉米分子生物学,(E-mail)252931257@qq.com
黄全生(1964-),男,新疆乌鲁木齐人,研究员,博士,研究方向为植物分子生物学,(E-mail)hquansheng@126.com
S513
A
1001-4330(2017)07-1185-06
Supported by: Xinjiang Natural Science Foundation " Identification and Drought Resistance Appraise of Mutants of Drought Stress-Related Genes in Maize" (2013211B22)
