2株耐热真菌的分离鉴定及其产酶活性研究
2017-09-06杨红梅殷亚兰史应武高雁林青张涛楚敏娄恺
杨红梅,殷亚兰,史应武,高雁,林青,张涛,楚敏,娄恺
(新疆农业科学院微生物应用研究所/新疆特殊环境微生物实验室,乌鲁木齐 830091)
2株耐热真菌的分离鉴定及其产酶活性研究
杨红梅,殷亚兰,史应武,高雁,林青,张涛,楚敏,娄恺
(新疆农业科学院微生物应用研究所/新疆特殊环境微生物实验室,乌鲁木齐 830091)
【目的】对新疆玛纳斯火烧洼热气泉土壤样品中,分离出的2株耐热真菌MHS7和MHS9进行鉴定,并研究其产酶活性。【方法】利用平板稀释涂布法分离筛选耐热真菌,基于菌株形态学特征和rDNA ITS序列分析,对分离得到的耐热真菌菌株进行初步分类鉴定;分别测定各菌株产淀粉酶、蛋白酶、纤维素酶、脂肪酶、木聚糖酶和糖苷酶的能力。【结果】得到2株耐热真菌MHS7和MHS9,初步鉴定菌株MHS7属于小裸囊菌属(Gymnascella),菌株MHS9属于曲霉属(Aspergillus)。产酶活性检测表明,菌株MHS7和MHS9均能产淀粉酶、蛋白酶、纤维素酶和脂肪酶,其中,菌株MHS9产淀粉酶和蛋白酶的活性相对较高。【结论】耐热真菌MHS7和MHS9均能同时产四种酶,具有潜在的应用价值。
耐热真菌;热气泉;酶活性
0 引 言
【研究意义】耐热真菌属于一类特殊的高温真菌类群,最低生长温度低于20℃,最高生长温度在50℃左右(一般为40℃或40℃以上)[1,2]。耐热真菌既能在一般高温条件下生长,也能在常温条件下自然生长,具有很强的竞争力,在堆肥、温泉、热泉、沙漠、草堆、自热垃圾堆等高温环境中都广泛存在。热气泉(60~300℃)是一类天然的热汽释放口,通常存在于地下煤层蕴藏量丰富的地区。它是由于长时间地下煤层自燃,加热地下水形成大量蒸汽,沿岩层节理、裂缝、断裂处或煤层燃烧塌陷处喷出所致,并在局部形成高氡、高温、高湿的微小气候[3,4]。此极端环境为耐热菌的生长、繁殖提供了理想的条件,因其生境的特殊性而具有较大的研究潜力。对热气泉这一独特地热生境耐热菌的发掘及其产酶研究,是降低高温酶生产成本的一个可能途径。【前人研究进展】耐热真菌的研究日益引起人们的重视。国外已描述和报道89种耐热真菌[5,6];《中国真菌总汇》和《中国菌种目录》中共收集、记载了35种此类真菌[7,8],但并没有进一步明确鉴定它们是否属于耐热真菌;Chen等[9]报道了1个中国耐热真菌新种;张勇等[10,11]系统调查研究了我国不同生态类型耐热真菌的种类及多样性,报道了8个中国耐热真菌新记录种;梁茵等[12]明确鉴定出28种中国耐热真菌,其中包括2个中国新记录种,分属于接合菌门、子囊菌门和担子菌门;殷亚兰等[13]从新疆吐鲁番分离得到129株耐热真菌,并对其功能酶进行了筛选,发现该地区耐热真菌资源丰富,产酶种类多样。【本研究切入点】前期通过免培养技术对新疆玛纳斯火烧洼热气泉土壤细菌和古菌多样性进行了分析,结果发现该生境下的细菌、古菌群落组成与其它地热土壤微生物相似,并且存在着大量潜在的细菌新物种、高温硫代谢菌及氮循环菌[14,15]。但是此生境下耐热真菌及产酶活性的相关研究,还未见报道。研究对新疆玛纳斯火烧洼一眼热气泉土壤样品中分离出的2株耐热真菌MHS7和MHS9进行鉴定,并研究其产酶活性。【拟解决的关键问题】以新疆玛纳斯火烧洼一眼热气泉土壤为研究对象,分离、筛选可培养耐热真菌,确定其分类地位,对获得的耐热真菌菌株进行产酶(蛋白酶、脂肪酶、淀粉酶、纤维素酶、木聚糖酶、糖苷酶)定性研究,为该生境下耐热真菌的进一步开发利用奠定基础。
1 材料与方法
1.1 材 料
1.1.1 样品采集
土壤样品采自新疆玛纳斯火烧洼一眼热气泉(洞口温度65℃)。沿热气泉洞口内表面均匀采集0~5 cm土壤,混匀后装入无菌聚乙烯袋,4℃避光保存运至实验室,立即进行耐热真菌的分离。
1.1.2 培养基
1.1.2.1 分离培养基
PDA培养基(g/L):去皮马铃薯 200,葡萄糖 20,琼脂 20,pH 6.5。
1.1.2.2 产酶筛选培养基
淀粉酶筛选培养基(g/L):可溶性淀粉 20,氯化钾 0.5,硝酸钠 2,磷酸钾1,硫酸镁0.5,琼脂 18,蒸馏水1 000 mL,pH 自然。
蛋白酶筛选培养基(g/L):蛋白胨 10,葡萄糖 1,氯化钠 5,氯化钙0.1,酪氨酸 0.1,酪素 5,琼脂 22,蒸馏水1 000 mL,pH 7.0。
纤维素酶筛选培养基(g/L):羧甲基纤维素 8,硝酸钠 3,氯化钾 0.5,磷酸氢二钾1,硫酸铁 0.01,硫酸镁0.5,琼脂 20,氯霉素 0.05,蒸馏水1 000 mL, pH 6.0。
脂肪酶筛选培养基(g/L):酵母膏 10,磷酸氢二钠 1 ,磷酸二氢钾 1.5,氯化钠 0.5,硫酸镁0.5,硫酸铵 5,三丁酸甘油酯乳化液,去氧胆酸钠1,琼脂 18,蒸馏水1 000 mL,pH自然。
木聚糖酶筛选培养基(g/L):木聚糖 10,硝酸钠 2,磷酸二氢钾 2, 磷酸氢二钾 1,氯化钠 0.5,硫酸镁 0.5,琼脂 20,蒸馏水1 000 mL,pH值自然。
糖苷酶筛选培养基(g/L):乳糖10,硝酸钠 3,磷酸氢二钾 1, 氯化钾 0.5,硫酸镁0.5,硫酸铁 0.01,琼脂 15,蒸馏水1 000 mL,pH自然。
1.2 方 法
1.2.1 菌株的分离和纯化
取10 g研磨的土壤样品置于盛有90 mL无菌水的三角瓶中,加入直径为0.2 mm的玻璃珠,200 r/min摇匀1 h。摇匀后的样品进行系列稀释(10-2、10-3、10-4),每个梯度各取200 μL涂布于分离培养基上,每个培养基每个稀释度均设置3个平行,每种培养基设一个空白,40℃培养3~8 d。根据平板上菌落生长的不同形态特征,挑取单菌落进行分离与纯化。得到的纯化真菌菌株转移到新的培养基中,于19℃培养3 d 以上,将生长菌株确定为耐热真菌[1,2]。
1.2.2 菌株的分类鉴定
挑取不同菌落形态的菌株,使用真菌基因组提取试剂盒提取菌株DNA,采用真菌ITS基因通用引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′进行rDNA ITS基因PCR扩增。反应条件为: 94℃ 5 min;94℃ 30 s、54℃ 30 s、72℃ 50 s,35个循环;72℃ 10 min。扩增的PCR产物送至上海生物工程有限公司进行rDNA ITS基因序列测定;使用Blast搜索程序从GenBank核酸数据库(http://www.ncbi.nlm.nih.gov)中调出与测定序列相似性较高的基因序列,用CLUSTAL X软件进行多重序列比对,运用MEGA 5.1软件采用邻接法进行系统进化树构建。研究中得到的序列已提交至GenBank,收录号分别为:KY629638,KY629639。
1.2.3 菌株产酶活性筛选
采用透明圈法,将纯化后的单菌落分别点接于上述6种产酶筛选培养基中,每个菌落设置3个重复,40℃恒温培养3~7 d。测量不同菌株产生的透明圈直径和菌落直径,酶活大小用透明圈直径与菌落直径的差值(D)表示,D值越大,表明酶活越强。采用DPS 9.5进行数据统计分析。
2 结果与分析
2.1 菌株MHS7和MHS9的菌落形态特征
新疆玛纳斯火烧洼热气泉土壤样品中分离获得2株耐热真菌,分别命名为MHS7和MHS9。菌株MHS7在PDA平板培养基上生长较慢,菌落呈卵形至球形,中部白色凸起,有放射状沟纹,边缘光滑;菌落反面呈浅黄色。菌株MHS9在PDA平板培养基上生长较快,菌落正面锈红色,外观似绒毛状;菌落反面呈暗红褐色。图1
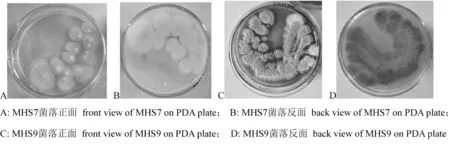
图1 耐热真菌菌株MHS7和MHS9在PDA培养基上的菌落形态
2.2 菌株MHS7和MHS9的rDNA ITS序列分析
对菌株MHS7和MHS9的rDNA ITS基因进行序列测定,GenBank数据库中ITS基因序列相似性比对结果表明,菌株MHS7与3株已知的小裸囊菌属菌株的同源性为86%~99%,菌株MHS9与10株已报道的曲霉属菌株ITS基因序列的同源性为85%~99%。其中,菌株MHS7与分离自突尼斯土壤中的嗜角蛋白真菌菌株SOIL-TUITS29 (Gymnascellaaurantiac,KP147985)[16]有99%的相似性,构建的系统进化树分析表明这两个菌株形成一进化簇。菌株MHS9与曲霉属菌株NRRL 71 (Aspergillusglaucus,EF652047,有性态为Eurotiumherbariorum)、菌株NRRL 78 (Aspergilluschevalieri,AY373886,有性态为Aspergilluschevalieri)、菌株NRRL 90 (Aspergillusamstelodami,AY373885,有性态为Eurotiumamstelodami)、菌株UPM A14 (Aspergillusruber,HM152565,有性态为Eurotiumrubrum)有99%的相似性,构建的系统进化树分析表明菌株MHS9与以上4个菌株形成一进化簇。图2
2.3 耐热真菌MHS7和MHS9的产酶活性研究
研究表明,菌株MHS7和MHS9均能同时产淀粉酶、蛋白酶、纤维素酶和脂肪酶4种酶,不产木聚糖酶和糖苷酶。方差检验分析结果表明,菌株MHS7和MHS9产淀粉酶和蛋白酶的活性显著高于产纤维素酶和脂肪酶的活性(P<0.01)。与菌株MHS7相比,菌株MHS9产淀粉酶和蛋白酶的活性明显较高,差异显著(P<0.01)。表1

图2 菌株MHS7和MHS9基于rDNA ITS序列同源性构建的系统发育树

菌株编号No.淀粉酶Amylase蛋白酶Protease纤维素酶Cellulase脂肪酶Lipase木聚糖酶Xylanase糖苷酶GlycosidaseMHS7+++cC++++bB++dD+eE--MHS9+++++aA+++++aA++dD+eE--
注:各组间不同大、小写字母分别表示在0.01、0.05水平上差异显著,“+++++”表示透明圈D值为20~25 mm;“++++”表示D值为15~20 mm;“+++”表示D值为10~15 mm;“++”表示D值为5~10 mm;“ +”表示D 值为0~5 mm;“-”表示不产生透明圈,其中糖苷酶筛选中“-”表示为阴性
Note: Different uppercase and lowercase letters indicate significant difference at 0.01 or 0.05 level, respectively, "+++++": 20-25 mm; "++++": 15-20 mm; "+++": 10-15 mm; "++ ": 5-10 mm; "+ ": 0-5 mm; "-": No transparent circle
3 讨 论
新疆是中国地下煤火重要分布区之一,形成了大量热气泉地热景观,是研究微生物的独特模型。前期以新疆玛纳斯火烧洼热气泉为研究对象,通过构建16S rDNA基因克隆文库和T-RFLP技术,对火烧洼热气泉土壤细菌和古菌多样性进行了分析。结果发现该生境下的微生物群落组成与其它地热土壤微生物相似,并且存在着大量潜在的细菌、古菌新物种以及高温硫代谢菌和氮循环菌[14,15]。对新疆玛纳斯火烧洼1眼热气泉土壤中的耐热真菌进行研究,对其中的两株真菌进行了初步鉴定。其中,菌株MHS7初步鉴定为小裸囊菌属(Gymnascella)菌株,与分离自突尼斯土壤中的嗜角蛋白真菌菌株SOIL-TUITS29[22]有99%的相似性。有研究表明小裸囊菌属菌株可以产生角蛋白酶,具有降解角蛋白的能力[17]。微生物(真菌、放线菌、细菌等)分泌的角蛋白酶是酶研究的热点之一,在饲料、有机肥料、制革、食品加工、医药、化妆品及环境保护等方面具有很大的应用潜力。分析表明,新疆玛纳斯火烧洼热气泉土壤中含有重要、新颖、具潜在应用价值的微生物资源,值得进一步研究。
耐热真菌所产生的热稳定多聚物降解酶(蛋白酶、脂肪酶、淀粉酶等)在饲料制造加工、食品酿造业、医药工业、洗涤剂行业、废水废料的处理、生物能源等开发利用上均有很大的应用价值,并有可能会带来巨大的经济效益[18-21]。目前,在热气泉生境下,尚未有其它研究发现产多种酶活性的耐热真菌;研究发现,耐热真菌菌株MHS7和MHS9均能同时产淀粉酶、蛋白酶、纤维素酶和脂肪酶。关于产酶条件的进一步优化及酶学特性正在研究中,为进一步开发和利用功能酶提供良好的研究材料。
4 结 论
研究对新疆玛纳斯火烧洼热气泉土壤中的耐热真菌及产酶活性进行研究,得到2株耐热真菌MHS7和MHS9,初步鉴定MHS7属于小裸囊菌属(Gymnascella),与菌株SOIL-TUITS29 (Gymnascellaaurantiac)有99%的相似性;MHS9属于曲霉属(Aspergillus),与菌株NRRL 71 (Aspergillusglaucus)、菌株NRRL 78 (Aspergilluschevalieri)、菌株NRRL 90 (Aspergillusamstelodami)、菌株UPM A14 (Aspergillusruber)有99%的相似性。产酶活性研究表明,菌株MHS7和MHS9均能同时产淀粉酶、蛋白酶、纤维素酶和脂肪酶4种酶。其中,这两株真菌产淀粉酶和蛋白酶的活性显著高于产纤维素酶和脂肪酶的活性(P<0.01);与菌株MHS7相比,菌株MHS9产淀粉酶和蛋白酶的活性明显较高(P<0.01)。研究为该特殊生境下耐热真菌的进一步开发利用提供菌种资源和技术支撑。
References)
[1] Cooney, D. G., & Emerson, R. (1965). Thermophilic fungi. an account of their biology, activities, and classification.TheQuarterlyReviewofBiology, 40(3): 292.
[2] Mouchacca, J. (1997). Thermophilic fungi - biodiversity and taxonomic status [review] [french].CryptogamieMycologie, 18(1): 19-69.
[3] 张建民, 管海燕, 曹代勇, 等. 中国地下煤火研究与治理[M]. 北京: 煤炭工业出版社, 2008.
ZHANG Jian-min, GUAN Hai-yan, CAO Dai-yong, et al. (2008).UndergroundcoalfiresinChina:origin,detection,fire-fighting,andprevention[M]. Beijing: China Coal Industry Publish House. (in Chinese)
[4] 吴继尧, 姚华, 郑玉建, 等. 新疆热气泉调查分析[J]. 新疆医科大学学报, 1994, 17(2): 93-96.
WU Ji-yao, YAO Hua, ZHENG Yu-jian, et al. (1994). A survey of heat-gas springs in Xinjiang [J].JournalofXinjiangMedicalUniversity, 17(2): 93-96. (in Chinese)
[5] Mouchacca, J. (2000). Thermotolerant fungi erroneously reported in applied research work as possessing thermophilic attributes.WorldJournalofMicrobiologyandBiotechnology, 16(8):869-880.
[6] Jean, M. (2007). Heat tolerant fungi and applied research: addition to the previously treated group of strictly thermotolerant species.WorldJournalofMicrobiologyandBiotechnology, 23(12): 1,755-1,770.
[7] 戴芳澜. 中国真菌总汇[M]. 北京: 科学出版社, 1979.
DAI Fang-lan. (1979).SyllogeFungorumSinicorum[M]. Beijing: Science Press. (in Chinese)
[8] 周宇光. 中国菌种目录[M]. 北京: 化学工业出版社, 2007.
ZHOU Yu-guang. (2007).Chinacatalogueofcultures[M]. Beijing: Chemical Industry Press.(in Chinese)
[9] Chen, G. Q., & Zheng, R. Y. (1999). A new thermophilic variety of absidia idahoensis from china.Mycotaxon, (69): 173-179.
[10] ZHANG Yong, LI Duochuan, (2013). Three new records of thermotolerant fungi from China.Mycosystema, 30(1): 116-122.
[11] 张勇, 李多川. 耐热真菌五个中国新记录种[J]. 菌物学报, 2013, 32(1): 142-149.
ZHANG Yong, LI Duo-chuan. (2013). Five new records of thermotolerant fungi from China [J].Mycosystema, 32(1):142-149. (in Chinese)
[12] 梁茵, 王芳, 李安娜, 等. 耐热真菌的分类鉴定及rDNA-ITS系统发育分析[J]. 菌物学报, 2011, 30(4): 542-550.
LIANG Yin, WANG Fang, LI An-na, et al. (2011). Thermotolerant fungi and their phylogenetic analyses based on rDNA-ITS sequences [J].Mycosystema, 30(4): 542-550. (in Chinese)
[13] 殷亚兰, 常玮, 张涛, 等. 新疆吐鲁番地区耐热真菌多样性及其功能酶的筛选[J]. 新疆农业科学, 2016,53(7): 1 288-1 296.
YIN Ya-lan, CHANG Wei, ZHANG Tao, et al. (2016). Thermotolerant fungi diversity and enzyme activities in Turpan prefecture, Xinjiang [J].XinjiangAgriculturalSciences, 53(7): 1,288-1,296. (in Chinese)
[14] 徐建华, 杨红梅, 曾军, 等. 新疆玛纳斯热气泉免培养土壤细菌多样分析[J].微生物学报, 2010, 50(5):568-573.
XU Jian-hua, YANG Hong-mei, ZENG Jun, et al. (2010). Bacterial diversity in a hot gas spring soil of MaNasi County, Xinjiang by culture-independent approach [J].ActaMicrobiologyicaSinica, 50(5):568-573. (in Chinese)
[15] Zhang, T., Xu, J., Zeng, J., & Lou, K. (2013). Diversity of prokaryotes associated with soils around coal-fire gas vents in manasi county of xinjiang, china.AntonievanLeeuwenhoek, 103(1): 23-36.
[16] Anane, S., Al-Yasiri, M. H., Normand, A. C., & Ranque, S. (2015). Distribution of keratinophilic fungi in soil across tunisia: a descriptive study and review of the literature.Mycopathologia, 180(1): 1-8.
[17] Currah, R. S. (1986). Taxonomy of the onygenales: arthrodermataceae, gymnoascaceae, myxotrichaceae and onygenaceae.Mycotaxon, (24): 1-216.
[18] Purwani, Suhartono, M. T., Rukayadi, Y., Hwang, J. K., & Yu, R. P. (2004). Characteristics of thermostable chitinase enzymes from the indonesian bacillus sp.13.26.Enzyme&MicrobialTechnology, 35(2-3): 147-153.
[19] Haki, G. D., & Rakshit, S. K. (2003). Developments in industrially important thermostable enzymes: a review.BioresourceTechnology,89(1): 1-34.
[20] Sharma, R., Chisti, Y., & Banerjee, U. C. (2001). Production, purification, characterization, and applications of lipases.BiotechnologyAdvances,19(8): 627-662.
[21] Atomi, H. (2005). Recent progress towards the application of hyperthermophiles and their enzymes.CurrentOpinioninChemicalBiology, 9(2): 166-173.
Isolation, Identification and Enzyme Activities of Two Thermotolerant Fungi
YANG Hong-mei, YIN Ya-lan, SHI Ying-wu, GAO Yan, LIN Qing, ZHANG Tao, CHU Min, LOU Kai
(Xinjiang Laboratory of Special Environmental Microbiology / Research Institute of Microbiology, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, China)
【Objective】 This project aims to have a preliminary identification of the two thermotolerant fungi MHS7 and MHS9 isolated from a hot gas spring in Manasi County of Xining and study their enzyme activities.【Method】Thermotolerant fungi were isolated and screened by using a agar dilution method, and the primary identification was studied according to cultural characteristics and rDNA ITS (Internal Transcribed Spacer) sequences analysis. The amylase, protease, cellulose, lipase, xylanase and glycosidase were detected on six special selective media for thermotolerant fungus strains with the enzyme activity.【Result】Two strains of thermotolerant fungi named MHS7 and MHS9 were isolated. ITS sequence analysis identified that the strain MHS7 belonged toGymnascellasp., and the strain MHS9 wasEurotiumsp.. Studies on enzyme-producing activities of strains MHS7 and MHS9 indicated that both of them produced amylase, protease, cellulose, and lipase. Of the two, the strain MHS9 had higher levels of amylase and protease activities than the strain MHS7.【Conclusion】The thermotolerant fungi MHS7 and MHS9 had complex enzyme activities and might have potential application value.
thermotolerant fungi; hot gas spring; enzyme activities
LOU Kai (1968- ), male, native place: Henan. Professor, Ph.D, research field: Microbiology,(E-mail)loukai02@mail.tsinghua.edu.cn
10.6048/j.issn.1001-4330.2017.07.013
2017-03-30
新疆维吾尔自治区自然科学基金项目“新疆玛纳斯热气泉高温菌分离鉴定及产酶研究”(2013211A044)
杨红梅(1979- ),女,湖北人,副研究员,研究方向为微生物学,(E-mail)yhmzhyq@126.com
娄恺(1968-),男,河南人,研究员,博士,研究方向为微生物学,(E-mail)loukai02@mail.tsinghua.edu.cn
S188
A
1001-4330(2017)07-1278-06
Supported by: Natural Science Foundation of Xinjiang Uygur Autonomous Region "Isolation, Identification and Enzyme Production of Thermophilic Strains from Hot Gas Springs in Manasi County, Xinjiang"(2013211A044)
