樱桃汁饮料中花青素的快速测定方法
2017-09-04安春志王有志
安春志,王有志
(广东南华工商职业学院,广东广州510507)
樱桃汁饮料中花青素的快速测定方法
安春志,王有志
(广东南华工商职业学院,广东广州510507)
建立一种快速、有效的高效液相色谱法,测定樱桃汁饮料中芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷的方法。样品经0.5%盐酸乙醇提取后,采用C18柱(4.6 mm×150 mm,5 μm)分离,以乙腈-5%磷酸梯度洗脱的条件下,用PDA检测器检测,外标法峰面积定量。结果表明,芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷标液在20.0 μg/mL~200.0 μg/mL浓度范围内线性良好,相关系数r2为0.999,芍药素-3-葡萄糖苷检出限为40 mg/kg,定量限为120 mg/kg,锦葵定-3-葡萄糖苷检出限为50 mg/kg,定量限为150 mg/kg,两个目标物的加标回收率为88.4%~92.6%。该方法具有前处理简单、检测速度快的优点,适用于樱桃汁饮料中芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷的定量检测。
樱桃汁;花青素;高效液相色谱
花青素(anthocyanins)又称花色素,是一类广泛存在于植物中的水溶性天然色素,属黄酮类化合物[1],多以糖苷的形式存在,植物中常见花青素的化学结构见图1。

图1 植物中常见花青素的化学结构Fig.1 Chemical structure of common anthocyanidins in plants
如图1所示,花青素作为一种天然食用色素,安全、无毒、资源丰富,而且具有一定的营养作用,在食品、化妆、医药等方面有着巨大的应用潜力[2-6]。花青素是迄今为止所发现的最强效的自由基清除剂,具有抗氧化、抗癌、促进视红素再合成等多种生理活性。樱桃中所含有的花青素十分丰富,由樱桃制成的樱桃汁饮料中也含有花青素。樱桃中一般含有的花青素是芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷这两种[7-9],但是针对樱桃汁饮料中这两种花青素的研究较少,所以本试验针对这两种花青素来研究相应的检测方法。
目前,关于花青素的分析方法目前用得较多的是紫外分光光度法和HPLC法等[10-12]。紫外分光光度法一般测定是样品中花青素总的含量,缺点是不能确定单一组分的含量,易受到有色物质的干扰等。高效液相色谱法为现在常用的检出方法,但是在前处理的步骤上繁琐,费时,试验的成本较大。本试验在原有的高效液相色谱法的基础上,对前处理步骤进行改进,并对检测条件进行优化,能对樱桃汁饮料中芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷的各个组分的含量能够做到快速、准确的检测。
1 材料与方法
1.1 仪器与试剂
2695型高效液相色谱系统、2998型PDA检测器:美国Waters;芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷标准品:国家标准物质中心。
1.2 色谱条件
色谱柱:C18柱(4.6 mm×150 mm,5 μm);流速:1.0 mL/min;进样量:10 μL;柱温:25 ℃。
1.3 试验方法
1.3.1 色谱条件的优化
固定流动相流速1.0 mL/min,配制不同体系的流动相体系,流动相Ⅰ:甲醇-5%磷酸溶液(体积比为25∶75);流动相Ⅱ:甲醇-5%乙酸溶液(体积比为 25∶75);流动相Ⅲ:乙腈-5%磷酸溶液(体积比为 25∶75);流动相Ⅳ:乙腈-5%乙酸溶液(体积比为25∶75),考察4种流动相对芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷色谱行为的影响;并优化合适的洗脱模式,使得目标峰的出峰时间合适,分离度较好,峰形尖锐、对称。
1.3.2 检测波长的选择
本试验采用PDA检测器进行全波长扫描(扫描范围200 nm~600 nm),根据芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷标准品的响应值,选择比较合适的检测波长。
1.3.3 标准曲线的制作
称取相应质量的芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷标准品,配制成浓度为 20.0、40.0、80.0、100.0、200.0 μg/mL 的标准溶液,进行仪器分析,以峰面积为纵坐标,浓度为横坐标绘制标准曲线。
1.3.4 样品提取溶剂的选择
根据芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷的理化特点,试验比较蒸馏水、0.5%柠檬酸、0.5%盐酸、0.5%盐酸乙醇、0.5%盐酸丙三醇等5种提取溶剂的提取效果。
1.3.5 加标回收试验
以已知花青素含量的樱桃汁饮料为基质,加入芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷标准溶液,选择优化后的前处理条件操作,上机检测,计算回收率。
2 结果与讨论
2.1 色谱条件的优化
参考相关文献 [13-15],发现不同文献检测芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷的流动相体系不同,主要分为四大类流动相体系:甲醇/磷酸溶液体系、甲醇/乙酸溶液体系、乙腈/磷酸溶液体系和乙腈/乙酸溶液体系。所以为了了解这些流动相对这芍药素-3-葡萄糖苷和锦葵定-3-葡萄糖苷色谱行为的影响,本研究固定流动相洗脱速度,配制不同体系的流动相Ⅰ:甲醇-5%磷酸溶液(体积比为25∶75);流动相Ⅱ:甲醇-5%乙酸溶液(体积比为25∶75);流动相Ⅲ:乙腈-5%磷酸溶液(体积比为25∶75),流动相Ⅳ:乙腈-5%乙酸溶液(体积比为25∶75);并考虑洗脱模式对两个目标物的分离度的影响,来确定流动相及洗脱模式对芍药素-3-葡萄糖苷和锦葵定-3-葡萄糖苷色谱行为的影响。色谱条件对目标物的影响见图2。
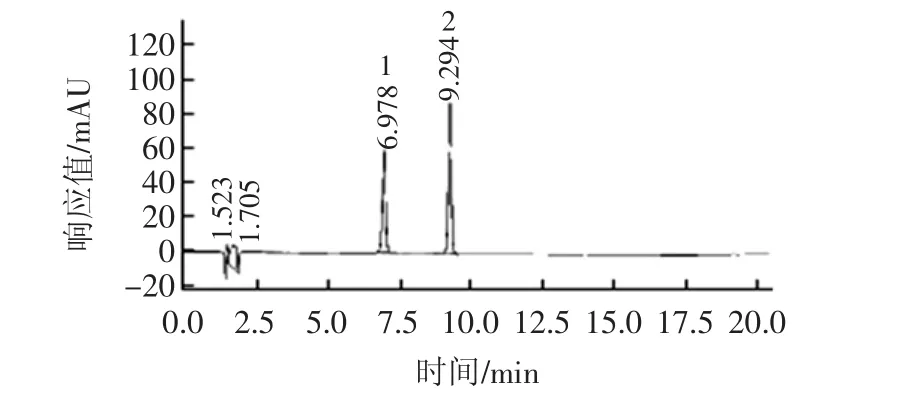
图2 芍药素-3-葡萄糖苷(峰1)、锦葵定-3-葡萄糖苷(峰2)色谱图Fig.2 Chromatogram of peonidin-3-glucoside and malvidin-3-glucoside
结果表明:甲醇、乙腈在分离和保留芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷上并没有明显差别,但是考虑到乙腈洗脱能力更强,选用乙腈作为流动相体系之一。乙腈-5%磷酸溶液与乙腈-5%乙酸溶液相比,乙腈-5%磷酸溶液能更好的将样品中的杂质峰分开。
但是在乙腈-5%磷酸溶液体系下,等度洗脱的条件芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷两者的分离度不好,所以本试验进一步摸索了乙腈-5%磷酸溶液流动相梯度洗脱的条件。最终流动相洗脱条件A(乙腈)-B(5% 磷酸溶液)为 0~5.0 min、B25%;5.0 min~12.0 min、B25%~40%;12.0 min~20.0 min、B40%~25%,芍药素-3-葡萄糖苷在6.978 min出峰,锦葵定-3-葡萄糖苷在9.294 min出峰,两者能得到良好的基线分离,分离度较好,其峰型良好,出峰时间合适。
2.2 检测波长的选择
本试验采用PDA检测器对芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷进行全波长扫描(范围200 nm~600 nm)。全波长扫描图见图3。

图3 全波长扫描图Fig.3 Full wavelength scanning chart
如图3所示,两个目标物在215、515 nm附近各存在一个吸收峰。但是215 nm波长条件下干扰物质较多,所以选择515 nm作为芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷的检测波长。
2.3 标准曲线的制作
为了验证芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷在流动相体系中的线性关系,配制了浓度为20.0、40.0、80.0、100.0、200.0 μg/mL 的系列标准溶液。试验结果表明,芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷在 20.0 μg/mL~200.0 μg/mL 内均具有良好的线性关系(r2>0.999);采用在空白基质中添加目标组分的方法,依据色谱峰的信噪比(S/N)大于3倍确定检出限(LOD),S/N大于10倍确定定量限(LOQ),得到芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷组分的LOD为40 mg/kg和 50 mg/kg,LOQ 为 120 mg/kg和 150 mg/kg,结果见表1。

表1 保留时间、标准曲线、相关系数、检出限与定量限Table 1 Retention time,standard curve,correlation coefficient,detection limit and quantitative limit
2.4 样品提取溶剂的选择
根据花青素的理化特性,易溶于水、乙醇、丙三醇、柠檬酸及盐酸等极性较强的溶剂,而难溶于苯、氯仿、乙醚、四氯化碳、乙酸乙酯等非极性的溶剂。同时花青素分子中含有多个酚羟基及吡喃环上有四价氧离子,具有酸及碱的性质,能溶于稀酸及稀碱,且对酸和碱很敏感,且在酸性溶剂中较稳定,所以通常采用酸化提取液作为提取剂来提取花青素。
所以本试验分别比较了蒸馏水、0.5%柠檬酸、0.5%盐酸、0.5%盐酸乙醇、0.5%盐酸丙三醇等5种提取溶剂的提取效果,溶剂:样品按4∶1的比例(体积比)混合,结果以两种目标物的平均回收率为比较依据。溶剂对提取率的影响见图4。
结果发现,与样品以一定比例混合的蒸馏水、0.5%柠檬酸、0.5%盐酸以及0.5%盐酸丙三醇提取的提取液,杂质较多,无法与芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷分离,色谱图中目标峰峰形拖尾,影响目标物的分析;而0.5%盐酸乙醇与样品以4∶1(体积比)提取的样液,目标峰可与杂质完全分离,且峰形对称,可以作为樱桃子饮料中0.5%盐酸乙醇的提取溶液。

图4 溶剂对提取率的影响Fig.4 Effect of solvent on extraction rate
2.5 加标回收与相对偏差
在以上试验的优化条件下,利用以已知花青素含量的樱桃汁饮料为基质进行加标回收率试验,在分别添加0.2、0.4、0.6 g/kg等3个梯度浓度的标准溶液,每个浓度平行测定5次,测定结果见表2。

表2 方法的回收率及相对标准偏差(n=5)Table 2 Recoveries and relative standard deviations(RSD)of the method(n=5)
由表2可见,芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷的加标回收率为88.4%~92.6%,相对标准偏差(RSD)为1.5%~2.2%,表明本试验所建立的方法具有可靠的准确度和精密度。
2.6 实际样品的测定
应用本文所建立的方法,对樱桃汁饮料中的芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷进行测定,能从饮料中快速地检测出芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷。此方法选择性强、重现性高,能达到基线分离,樱桃汁饮料的色谱图见图5。

图5 樱桃汁饮料的色谱图Fig.5 The chromatograms of cherry juice drink
如图5所示,是一款樱桃汁饮料中测定花青素的色谱图,芍药素-3-葡萄糖苷(6.991 min)、锦葵定-3-葡萄糖苷(9.248 min)。
3 结论
建立一种高效液相色谱-PDA检测器检测樱桃汁饮料中芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷的分析方法。结果表明,在流动相:乙腈-5%磷酸梯度洗脱的条件下,目标物能得到良好的基线分离,其峰型良好,出峰时间合适。在515 nm的检测波长下,样品经过0.5%盐酸乙醇与样品以4∶1(体积比)提取后,可实现对目标物的有效提取。样品中的芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷的加标回收率能达到88.4%~92.6%,能满足检测目标物质的要求,可以准确快速有效地检测樱桃汁饮料中芍药素-3-葡萄糖苷、锦葵定-3-葡萄糖苷两种花青素的含量。
[1]赵宇瑛,张汉.花青素的研究现状及发展趋势[J].安徽农业科学,2005,33(5):904-905
[2]张长贵,董加宝,王祯旭.原花色素及其开发应用[J].四川食品与发酵,2006(4):8-12
[3]韩泽梅,李晓波,张玉平,等.树莓种子原花青素的提取分离工艺研究[J].天然产物研究与开发,2006,18(9):108-111
[4]伟光.张黎明.山楂叶原花青素提取分离工艺研究[J].食品工业研究,2008,29(3):216-218
[5]马玉美.葡萄籽中原花青素提取分离纯化研究进展[J].湖南工程学院学报,2006,16(3):88-90
[6]张磊,侯红萍.葡萄籽中原花青素的保健功能[J].山西食品工业,2005,32(4):31-34
[7]耿敬章,秦公伟,张志健.超声波辅助提取樱桃中原花青素[J].中国食品添加剂,2010,12(7):183-187
[8]刘艳秋,孟庆繁,高文韬.酸樱桃果实中原花青素提取工艺的研究[J].湖北农业科学,2014,53(6):1384-1387
[9]杨博,鄢又玉,钟方旭,等.火棘果中原花青素提取工艺优化[J].中国食物与营养,2011,17(5):60-66
[10]宋阳成,陈玉娟,李皓,等.蓝莓类饮料中花青素的快速检测方法[J].食品科学,2010,31(24):334-336
[11]姚开,何强,吕远平,等.葡萄籽提取物中原花青素含量的测定[J].食品与发酵工业,2002,28(3):17-19
[12]姚开,何强,吕远平,等.葡萄籽提取物中原花青素含量不同测定方法比较[J].化学研究与应用,2002,14(2):230-232
[13]杨磊,苏文强,汪振洋,等.落叶松树皮提取物中低聚原花青素含量测定方法的研究[J].林产化学与工业,2004(24):111-114
[14]鲍俊竹,陈月坤,徐桂花.测定葡萄籽提取物中原花青素含量的方法[J].农业科学研究,2005,26(1):43-45
[15]肖付才,李华,王华.葡萄籽原花青素的提取和检测方法[J].食品研究与开发,2007,28(6):165-168
Rapid Determination of Anthocyanins in Cherry Juice Drink by HPLC
AN Chun-zhi,WANG You-zhi
(NanHua College of Industry and Commerce,Guangzhou 510507,Guangdong,China)
A rapid and effective method was established for the determination of peonidin-3-glucoside and malvidin-3-glucoside in cherry juice drink by HPLC.After the sample was extracted by 0.5%ethanol hydrochloride,the targeted compound was separated on C18column(4.6 mm×150 mm,5 μm)using acetonitrile-5%phosphoric acid as mobile phase by gradient elution,with PDA detector and external standard method peak area quantification.The linear range of peonidin-3-glucoside and malvidin-3-glucoside was in the range of 20.0 μg/mL-200.0 μg/mL with a correlation coefficient of 0.999.The peonidin-3-glucoside detection limit was 40 mg/kg and the quantitative limit was 120 mg/kg.The malvidin-3-glucoside detection limit was 50 mg/kg and the quantitative limit was 150 mg/kg.The two targets recovery rate was 88.4%-92.6%.The method had the advantages of simple pretreatment,good extract effect and fast detection rate,and was suitable for the separation and quantitative detection of peonidin-3-glucoside and malvidin-3-glucoside in cherry juice drink.
cherry juice;anthocyanins;high performance liquid chromatography(HPLC)
10.3969/j.issn.1005-6521.2017.17.035
2017-01-10
安春志(1978—),男(汉),讲师,硕士,研究方向:中药、营养健康、药品经营管理。
