快速检测沙门氏菌的荧光免疫试纸的研制
2017-09-04张捷高静赵琢杨向莹刘志鹏畅晓晖柳明槐硕吴海燕陈广全张锡全
张捷,高静,赵琢,杨向莹,刘志鹏,畅晓晖,柳明,槐硕,吴海燕,陈广全,张锡全
(1.北京出入境检验检疫局检验检疫技术中心,北京100026;2.出入境食品安全检测北京市重点实验室,北京100026;3.厦门市产品质量监督检验院,福建厦门361006;4.天津出入境检验检疫局工业产品安全技术中心,天津300308;5.潍坊高新技术产业开发区人民医院,山东潍坊261205)
快速检测沙门氏菌的荧光免疫试纸的研制
张捷1,2,高静3,赵琢4,*,杨向莹1,2,刘志鹏4,畅晓晖1,2,柳明4,槐硕1,2,吴海燕5,陈广全1,2,张锡全1,2
(1.北京出入境检验检疫局检验检疫技术中心,北京100026;2.出入境食品安全检测北京市重点实验室,北京100026;3.厦门市产品质量监督检验院,福建厦门361006;4.天津出入境检验检疫局工业产品安全技术中心,天津300308;5.潍坊高新技术产业开发区人民医院,山东潍坊261205)
研制一种基于低噪声激发式荧光沙门氏菌免疫层析检测试纸条,用于沙门氏菌快速、高敏、兼顾定性及精准定量的检测。采用低噪声激发式荧光染料作为标记,采用免疫层析技术,制备靶向于沙门氏菌的免疫层析试纸条。检测时,采用专用便携式低噪声激发式荧光扫描仪分别扫描质控线和检测线,以检测线荧光强度检测值实现样本的定性及定量检测,并对免疫层析试纸条各项性能进行评价。低噪声激发式荧光沙门氏菌免疫层析检测试纸条制备成功,免疫层析试纸条性能检测结果显示,该试纸条特异性强、灵敏度高、检测限可达到0.5×103CFU/mL,是一种新型快速高效稳定的检测方法。该免疫层析试纸条可适用于食品及病理样本中沙门氏菌初筛和即时检测。
沙门氏菌;免疫层析检测试纸条;特异性;灵敏度;检测限
沙门氏菌作为致病菌检测的一项重要指标,在公共卫生、食品卫生、畜牧兽医和出入境检验检疫中均有重要的意义,同时也对沙门氏菌的快速及高精度的定量检测提出了更高的要求[1]。为探求快速、准确、高灵敏度、易操作且能够定量的检测方法,世界各国学者进行了大量研究,从以传统方法为基础发展到以免疫学、分子生物学为基础的快速检测方法,并在实践中不断取得新进展[2-3]。
免疫层析技术是一项有效结合了层析法卓越分离能力和免疫反应高度特异性的新型免疫检测技术,当前在疾病快速诊断、环境污染物分析及致病生物因子检定等领域得到广泛应用[4]。其原理是将特异抗原或抗体固定于硝酸纤维素膜的某一区带,当该干燥的硝酸纤维素膜一端浸入样品后,由于毛细管作用,样品将沿着该膜向前移动,当迁移至交联标记抗体的特定区域时,样品中相应的抗原即与该抗体发生特异性结合形成抗原-标记抗体复合物,经标记物的显色、发光或电化学反应而使该区域显示一定的信号,从而实现特异性免疫诊断。常用的标记物包括生色型探针(包括胶体金、胶体碳、着色微球等)和荧光分子(如有机荧光染料、量子点、稀土元素配合物、上转磷光颗粒等)[5]。
然而上述的标记物却存在灵敏度有限且无法实现精确定量检测等缺陷,进而限制了免疫层析技术的广泛应用。如现有技术中常见的利用酶标记催化生色底物的酶促反应而显色,可用于抗原或抗体的直接检测,将该方法应用于食品中沙门氏菌的检测,通过单克隆抗体大大降低假阳性率,但是该方法的灵敏度较分子生物学方法低,且必须经过增菌筛选纯培养步骤,因此难以在短时间内得到检测结果[6]。
对于现有的胶体金免疫层析技术,通过胶体金等纳米颗粒的聚集反应而显色,从而实现结果判定。虽然该种方法具有便捷、快速、准确和无污染等特点被广泛应用于医学检测和临床诊断,在病原体检测方面,其敏感性、特异性具有其他免疫学方法无可比拟的优势,且无需特殊仪器设备,对检测人员的专业要求低,有良好的基层应用开发前景。但这种方法中存在标记物的稳定性较差,颜色单一,灵敏度较低,受基质的背景干扰大等缺陷,且只能定性检测,不能做到精确定量检测,上述标记灵敏度有限且无法实现精确定量,限制了免疫层析技术的应用。另外,现有免疫层析技术一直主要用于对蛋白类的检测,对于微生物的检测则所见甚少,同时更难以实现微生物的定量检测,对于快速检测致病菌而言,其应用受到极大的限制[7-8]。
本文所要解决的技术问题在于现有技术中难于快速定量检测沙门氏菌的问题,进而提供一种基于低噪声激发式荧光标记的沙门氏菌免疫层析试纸条。本文采用荧光染料作为标记,采用免疫层析技术,制备靶向于沙门氏菌的免疫层析试纸条,检测时,采用专用便携式低噪声激发式荧光扫描仪分别扫描质控线和检测线,以检测线荧光强度检测值实现样本的定性及定量检测,该试纸条适用于食品及病理样本中沙门氏菌即时检测,此免疫层析试纸条具有快速、高敏、兼顾定性及精准定量及便携的特点。
1 材料与方法
1.1 材料
1.1.1 主要仪器
XC-CD型超声细胞粉碎机:宁波先倡电子科技有限公司;smartreader101型便携式近红外荧光扫描仪:北京博润福得科技发展有限公司。
1.1.2 材料与试剂
沙门氏菌标准菌株ATCC14028、副溶血弧菌标准菌株ATCC17802、单增李斯特菌标准菌株ATCC15313、金黄色葡萄球菌、志贺氏菌、大肠埃希氏菌:北京出入境检验检疫局检验检疫技术中心食品实验室分离菌株。牛血清白蛋白(Bovine serum albumin,BSA):北京索莱宝生物科技有限公司;Tween20:北京克劳宁生物科技有限公司;叠氮化钠:北京新鼎鹏飞科技发展有限公司;鼠抗沙门氏菌单克隆抗体:上海慧耘生物;鼠抗沙门氏菌多克隆抗体:上海慧耘生物;低噪声激发式荧光染料DyLight800:Thermofisher公司;羊抗鼠IgG多克隆抗体:北京华大蛋白质公司。
1.2 方法
1.2.1 低噪声激发式荧光标记的沙门氏菌免疫层析试纸条结构
低噪声激发式荧光标记的沙门氏菌免疫层析试纸条制备的示意图,如图1所示。
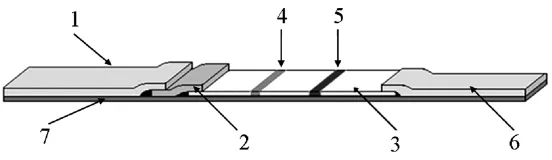
图1 低噪声激发式荧光标记的沙门氏菌免疫层析试纸条示意图Fig.1 The structure of low-noise excitation fluorescence detection of Salmonella immunochromatographic test dipstick
沿底板7的长度方向上依次粘附上的样品垫1、结合垫2、抗体承载膜3和吸水垫6。样品垫1、结合垫2、抗体承载膜3和吸水垫6之间,依次与且仅与相邻部位相接触且部分重叠;抗体承载膜3上粘附于所述底板7的中间部位,其上设置有相间隔的检测线4的质控线5,检测线4靠近结合垫2,质控线5靠近吸水垫6。质控线4与所述检测线5平行设置,检测线和质控线间距0.5 cm。结合垫2上喷涂有荧光染料标记的鼠抗沙门氏菌单克隆抗体;检测线4由可与沙门氏菌特异性结合的多克隆抗体鼠抗沙门氏菌多克隆抗体涂层组成;质控线5由与沙门氏菌以及可与沙门氏菌特异性结合的多克隆抗体均无关的羊抗鼠IgG多克隆抗体涂层形成。
1.2.2 低噪声激发式荧光标记的沙门氏菌免疫层析试纸条制备及使用
1.2.2.1 制备
①取以pH值为7.4的(磷酸缓冲盐溶液,phosphate buffer saline,PBS)缓冲液稀释10倍的荧光染料,染料与沙门氏菌单克隆抗体以1∶2质量比混合均匀,室温条件下避光反应2 h,随后将所得的标记产物放入含有PBS缓冲液的透析袋中,4℃透析4 h,向所述标记好的标记产物中添加终浓度为1.5%BSA、0.15%Tween20和0.015%叠氮化钠,4℃保存,备用;②在玻璃纤维素膜结合垫上喷涂以层析缓冲液稀释1 000倍后的上述步骤中的所述标记产物,然后室温风干,备用;③使用含 5%BSA,0.1%Tween 20 的 PBS(pH 7.4)缓冲液喷涂在所述纤维素膜样品垫(结构1),室温风干后,备用;④分别取所述沙门氏菌多克隆抗体和所述与沙门氏菌以及可与沙门氏菌特异性结合的多克隆抗体均无关的抗体用划线机在硝酸纤维素抗体承载膜上划所述检测线和所述质控线,室温风干,备用;⑤将上述步骤获得的所述样品垫、所述结合垫、所述抗体承载膜和所述吸水垫沿所述底板的长度方向上依次粘附,然后切割成试纸条。
1.2.2.2 使用
以pH值为7.4的PBS缓冲液稀释处理待测样品,取上清液超声破菌后作为待检样,用所述的试纸条进行免疫层析;荧光扫描所述检测线和所述质控线,分别测定所述检测线和所述质控线区域的荧光强度,若所述质控线区域出现荧光发射峰,则表明该试纸条有效,反之则无效;若所述检测线区域同时出现荧光发射峰则为阳性结果,反之则为阴性。
1.2.3 低噪声激发式荧光标记的沙门氏菌免疫层析试纸条性能评价方法
1.2.3.1 有效性检测
取鸡肉样品25 g,剪碎,用225 mL的pH值为7.4的含5%BSA,0.1%Tween 20的PBS缓冲液稀释样品,取上清液作为检样,吸取1 mL上清液至EP管中,超声破菌,直径3 mm探头,工作5 s,暂停15 s,40%能量,共计30次循环,吸取100 μL经超声处理的检样滴加到样品垫1上,待吸收干后再滴加50 μL上述的PBS缓冲液,用所述的试纸条进行免疫层析;室温放置15 min后,用便携式低噪声激发式荧光扫描仪分别测定检测线4和质控线5区域的荧光强度,分析结果。
1.2.3.2 特异性的检测
分别取实验室分离的沙门氏菌、金黄色葡萄球菌、志贺氏菌、大肠埃希氏菌、单增李斯特菌和副溶血弧菌调制成0.6×104CFU/mL的菌液,检测方法同1.2.3.1。
1.2.3.3 灵敏度和检测限的检测
采用添加回收试验方法,取未检出沙门氏菌鸡肉样品75 g,分作3份,分别加入已知浓度的沙门氏菌,剪碎,用225 mL的PBS缓冲液稀释所述鸡肉样品,吸取1 mL样本至EP管中,直径3 mm的探头,工作5 s,暂停15 s,40%能量,共计30次循环。吸取100 μL经超声处理的样品液滴加到样品垫1上,室温静置10 min,将所述试纸条放入便携式低噪声激发式荧光扫描仪中读数,利用标准曲线推算出沙门氏菌浓度。
在后续定量检测1.2.4.2试验中进行,试验方法相同。
1.2.4 低噪声激发式荧光标记的沙门氏菌免疫层析试纸条检测沙门氏菌实例方法
1.2.4.1 标准曲线的制作
取105CFU/mL的沙门氏菌纯菌(实验室分离株),用含PBS(pH 7.4)稀释液将所述纯菌进行1倍~100倍梯度浓度系列稀释,制成样品;然后吸取1 mL上清液至EP管中,超声破菌,直径3 mm探头,工作5 s,暂停15 s,40%能量,共计30次循环破菌处理;吸取50 μL样本滴加到样品垫1上,待样品吸收后再滴加50 μL上述的PBS缓冲液,室温静置10 min,将上述试纸条放入便携式低噪声激发式荧光扫描仪中读数。
稀释的沙门氏菌标准品分别进行有效性检测,扫描获得检测线4和质控线5的荧光值,如若反应正常后可继续进行。每个稀释度样本平行测量两次,取平均值作为测量值,记录检测结果,以该值对相应的样品浓度制作标准工作曲线,并拟合方程。
1.2.4.2 定量检测的步骤
定量检测方法与1.2.3.3试验方法相同。
2 结果与分析
2.1 低噪声激发式荧光标记的沙门氏菌免疫层析试纸条检测性能评价
2.1.1 有效性
利用低噪声激发式荧光标记的沙门氏菌免疫层析试纸条对鸡肉样品中的沙门氏菌进行检测,用便携式低噪声激发式荧光扫描仪分别测定所述检测线4和所述质控线5区域的荧光强度,若所述质控线5区域出现荧光发射峰,则表明该试纸条有效,反之则无效;若所述检测线4区域同时出现荧光发射峰则为阳性结果,反之则为阴性,结果如图2所示。
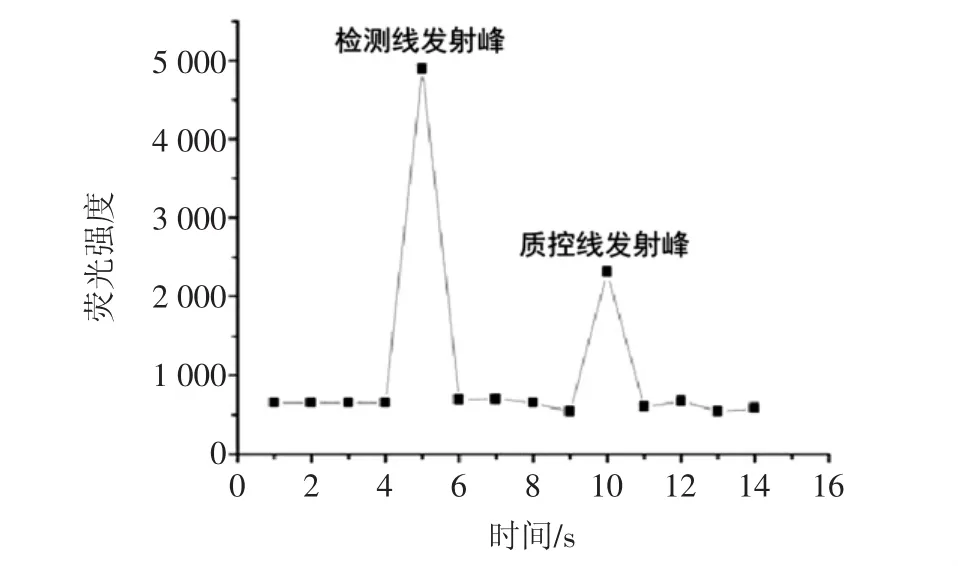
图2 免疫层析试纸有效性测试Fig.2 The effectiveness test of immunochromatographic dipstick
如图2所示,给出上述样品的定性检测结果,在检测线4区域和控制线5区域同时出现荧光发射峰,反应为阳性结果,该样品中含有沙门氏菌,证明该低噪声激发式荧光标记的沙门氏菌免疫层析试纸条是可用的,具有有效性。
2.1.2 特异性
利用低噪声激发式荧光标记的沙门氏菌免疫层析试纸条对沙门氏菌、金黄色葡萄球菌、志贺氏菌、大肠埃希氏菌、单增李斯特菌和副溶血弧菌进行检测,结果如图3所示。
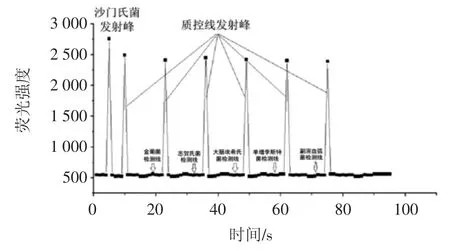
图3 免疫层析试纸特异性测试Fig.3 The specificity test of immunochromatographic dipstick
由图3可以看出,除沙门氏菌样品外,其余检测的细菌在检测线位置均未出现发射峰,各菌的试纸条均在质控线处出现发射峰,表明本方法对沙门氏菌的检测特异性好,与其他4个菌属无交叉反应。
2.1.3 灵敏性
低噪声激发式荧光标记的沙门氏菌免疫层析试纸条,其发射光谱位于低噪声激发式区域(波长为650 nm~1100 nm)的低噪声激发式荧光探针具有较高的信噪比,并由此保障了其高检测灵敏度,同时由于生物基体极少在低噪声激发式光谱区自发荧光,使得基于此类探针标记的分析检测免受背景荧光干扰;因散射光强度与波长的四次方成反比,发射光位于长波区的低噪声激发式荧光探针受其干扰小[9-10]。与常用的胶体金免疫层析试纸条相比,基于低噪声激发式荧光染料标记的免疫层析体系对靶标菌的灵敏度提高约200倍。利用低噪声激发式荧光标记的沙门氏菌免疫层析试纸条对鸡肉样品中的沙门氏菌进行检测,并与已知浓度进行比对,在2.3.2试验中得到论证,结果如表2所示,证明采用的基于荧光标记法测定的沙门氏菌的浓度较为准确、灵敏性好,可用于日常沙门氏菌的检测之用。
2.1.4 检测限
沙门氏菌胶体金免疫层析试纸条的最低检出限为1×105CFU/mL[11],而本研究中基于低噪声激发式荧光染料的沙门氏菌免疫层析试纸条的最低检出限为0.5×103CFU/mL,检测线明显低于沙门氏菌胶体金免疫层析试纸条。
2.2 低噪声激发式荧光标记的沙门氏菌免疫层析试纸条定量检测沙门氏菌的实例
2.2.1 标准曲线的制备
稀释的沙门氏菌标准品:1×105、0.5×105、1×104、0.5×104、1×103、0.5×103、1×102、10 CFU/mL 的样品分别进行检测,扫描获得检测线4和质控线5的荧光值,同时出现检测区域荧光峰和质控区域荧光峰方表明反应正常。每个稀释度样本平行测量两次,取平均值作为测量值,检测结果见表1。
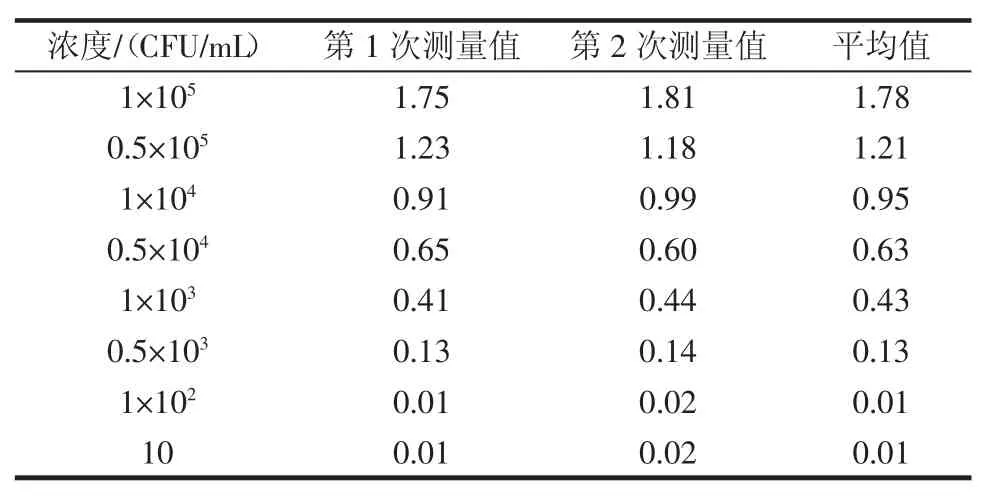
表1 不同浓度沙门氏菌标准品对应检测结果Table 1 Detection results of suspension of Salmonella with different concentrations
以该测量值对相应的样品浓度制作标准工作曲线,如图4所示,并拟合得适用的标准曲线为y=1.492 7x+2.573 8,R2=0.941 6。
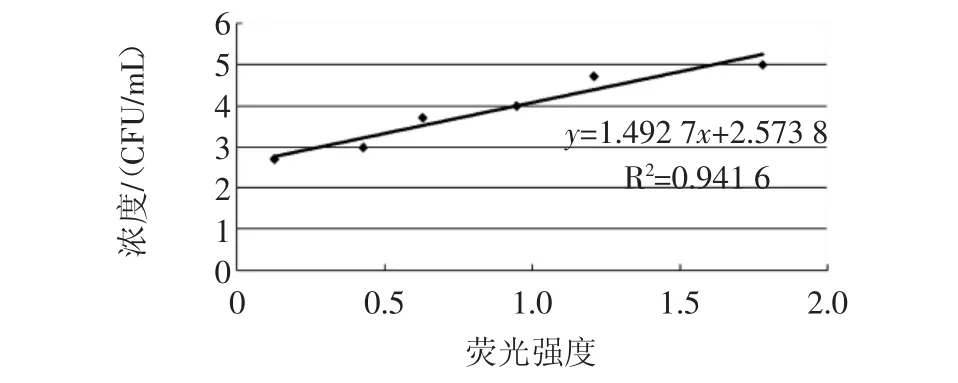
图4 沙门氏菌的标准曲线制作Fig.4 The standard curve of Salmonella
2.2.2 沙门氏菌的定量检测
采用添加回收试验方法,取未检出沙门氏菌鸡肉样品进行添加已知浓度的沙门氏菌操作,最后将所述试纸条放入便携式低噪声激发式荧光扫描仪中读数,结果见表2。
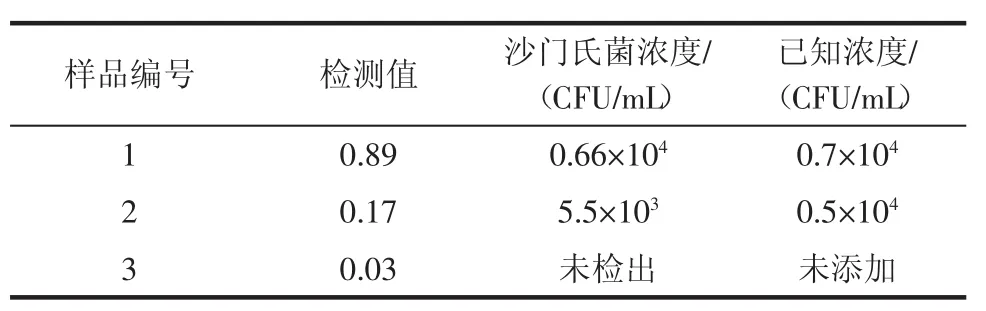
表2 根据标准曲线计算样品中的沙门氏菌的浓度Table 2 Calculate the concentration of Salmonella in the sample according to the standard curve
由上述表格数据可知,与已知的沙门氏菌的浓度相比,样品1在已知浓度为0.7×104CFU/mL时,免疫层析试纸检测浓度为0.66×104CFU/mL;样品2在已知浓度为0.5×104CFU/mL时,免疫层析试纸检测浓度为5.5×103CFU/mL;样品3在已知未添加沙门氏菌时,免疫层析试纸未检测出。由此本研究研制的基于荧光标记法测定的沙门氏菌的浓度试纸条较为准确,可用于日常沙门氏菌的检测使用。
3 讨论
沙门氏菌作为致病菌检测的一项重要指标,在世界各国细菌性食物中毒病例中,沙门氏菌引起的食物中毒案例常居榜首或第二位[12-13]。在公共卫生、食品卫生、畜牧兽医和出入境检验检疫中均有重要的意义,同时也对沙门氏菌的快速及高精度的定量检测提出了更高的要求。传统的检测方法耗时、操作繁琐,而基于免疫学原理的产品存在检测限高、特异性不强等问题[14-16]。近红外检测方法与其他检测方法相比,信噪比高,灵敏度理想。与常用的胶体金免疫层析试纸条相比,基于近红外荧光染料标记的免疫层析体系对靶标菌的灵敏度提高约100倍。如沙门氏菌胶体金免疫层析试纸条的最低检出限为1×105CFU/mL[11],而本研究中基于近红外荧光染料的沙门氏菌免疫层析试纸条的最低检出限为0.5×103CFU/mL。
传统的免疫层析法依赖胶体金颗粒的聚集效应而生色以判读结果,其颜色深浅虽与样品中靶标菌的浓度存在一定的数量关系,但无法进行准确定量[17-18]。近红外检测方法的优点在于便携,适用于现场、即时、快速检测。本方法所涉的免疫层析试纸条及近红外荧光扫描仪均属于便携可移动装置,且整个检测过程可在45 min内完成,适用于现场、即时、快速检测。相对于传统培养法需要5 d~6 d的检测周期及繁琐的培养基配制等过程具有显著的时效性优势;相对于PCR及实时荧光定量PCR法等分子生物学法在仪器的检测速度、便携性及现场适用性上呈明显优势。
综上,本研究所建立的近红外荧光染料检测方法,既降低了检测限,又缩短了检测时间,提高了食源性致病菌的检测效率,为进出口食品的快速检测提供了一种新的检测方法。
[1]Manzano M,Cocolin L,Astori G,et al.Development of a PCR microplate-capture hybridization method for simple,fast and sensitive detection of Salmonella serovars in food[J].Molecular and Cellular Probes,1998,12:227-234
[2]Jarquin R,Hanning I,Ahn S,et al.Development of rapid detection and genetic characterization of Salmonella in poultry breeder feeds[J].Sensors(Basel),2009(7):5308-5323
[3]刘喆,张书萧,王少辉,等.沙门氏菌的检测技术进展[J].中国动物传染病学报,2012(2):81-86
[4]Cheng Y L,Wang L C,Wang C H,et al.Immunochromatographic strip assay development for avian influenza antibody detection[J].Jpn J Vet Res,2015,63(4):183-190
[5]严华.胶体免疫金层析技术的应用与展望[J].微生物学免疫进展,2005,33(3):86-89
[6]樊淑华,王永立.胶体免疫层析技术应用研究进展[J].动物医学进展,2014,35(10):99-103
[7]Jin Q,Yang J,Lu Q,et al.Development of an immunochromatographic strip for the detection of antibodies against Porcine circovirus-2[J].J Vet Diagn Invest,2012,24:1151-1157
[8]Yang S,J Yang G,Zhang S,et al.Development of a peptidebased immunochromatographic strip for differentiation of serotype O footand-mouth disease virus-infected pigs from vaccinated pigs[J].J Vet Diagn Invest,2010,22:412-415
[9]Yang B C,H Z Tian,J Xu,et al.Guan.An integrated light emitting diode-induced fluorescence detector for capillary electrophoresis[J].Talanta,2006,69(4):996-1000
[10]Yang B C,F Tan,Y F Guan,et al.A collinear light-emitting diode-induced fluorescence detector for capillary electrophoresis[J].Talanta,2005,65(5):1303-1306
[11]夏诗琪,徐超莲,刘道峰.胶体金免疫层析法联检食品中5种典型沙门氏菌模型的建立和优化[J].食品科学,2014,35(22):154-158
[12]Matyas B,Cronquist A,Cartter M,et al.Preliminary FoodNet data on the incidence of infection with pathogens transmitted commonly through food[J].Jama-Journal of the American Medical Association.2010,303(21):2130-2132
[13]焦新安,刘秀梵.沙门氏菌分类学进展[J].国外医学(微生物学分册),1999,22(1):28-30
[14]Vaishnavi C,Kaur S,Singh K.Evaluation of an in-house rapid diagnostic method for detection of Salmonella entericaserovar Typhi in fecal specimens[J].Trop Gastroenterol,2006,27(1):19-21
[15]杨爱萍,黄金林.单抗酶联试剂盒与PCR方法快速检测沙门氏菌的比较[J].畜牧与兽医,2003(12):21-22
[16]Murphy N M,Mclauchlin J,Ohai C,et al.Construction and evaluation of a microbiological positive process internal control for PCR-based examination of food samples for Listeria monocytogenes and Salmonella enterica[J].International Journal of Food Microbiology,2007,120(1/2):110-119
[17]陈广全,张惠媛.电阻抗法检测食品中沙门氏菌[J].食品科学,2001,22(9):66-70
[18]吴刚,姜瞻梅,霍贵成,等.胶体金免疫层析技术在食品检测中的应用[J].食品工业科技,2007(12):216-218
Development of An Immunochromatographic Test Dipstick for Detection of Salmonella
ZHANG Jie1,2,GAO Jing3,ZHAO Zhuo4,*,YANG Xiang-ying1,2,LIU Zhi-peng4,CHANG Xiao-hui1,2,
LIU Ming4,HUAI Shuo1,2,WU Hai-yan5,CHEN Guang-quan1,2,ZHANG Xi-quan1,2
(1.Beijing Entry-Exit Inspection Quarantine Bureau Inspection Quarantine Technical Center,Beijing 100026,China;2.Beijing Key Laboartory of Entry-Exit Food Safty Testing,Beijing 100026,China;3.Xiamen Products Quality Supervision&Inspection Institute,Xiamen 361006,Fujian,China;4.Technical Center for Safety of Industrial Products,Tianjin Entry-Exit Inspection Quarantine Bureau,Tianjin 300308,China;5.Weifang People's Hospital of High-tech Industrial Development Zone,Weifang 261205,Shandong,China)
A rapid and accurate detection product was developed for Salmonella with a low-noise excitation fluorescence detection of Salmonella immunochromatographic test dipstick.The immune-chromatography paper strips were prepared by using immunochromatography,a low-noise,high-emission fluorescent dye.In inspection,special portable low noise excitation fluorescent scanner was uesd to detected control line and test line respectively,the fluorescence intensity detected value of the line can achieve qualitative and quantitative detection of samples.The low-noise excitation fluorescence detection of Salmonella immunochromatographic test dipstick prepared successfully.Immunochromatographic dipstick performance test results show that the test dipstick specificity,high sensitivity,limit of detection was 0.5×103CFU/mL.It was a new fast and efficient and stable detection tools.The immunochromatographic dipstick can be applied immediately detect Salmonella in food samples and pathology.
Salmonella;immunochromatographic test dipstick;specificity;sensitivity;detection limit
10.3969/j.issn.1005-6521.2017.17.027
2016-12-11
质检公益性行业科研专项项目(201410049);国家质检总局科技计划项目(2015IK011)
张捷(1965—),男(汉),高级工程师,博士,研究方向:食品安全评价。
*通信作者:赵琢,高级工程师,博士。
