核桃清蛋白抗氧化肽的制备及其活性研究
2017-09-04刘威闵伟红刘春雷曹柏营赵凡睿
刘威,闵伟红,*,刘春雷,曹柏营,赵凡睿
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.小麦和玉米深加工国家工程实验室,吉林长春130118)
核桃清蛋白抗氧化肽的制备及其活性研究
刘威1,2,闵伟红1,2,*,刘春雷1,2,曹柏营1,2,赵凡睿1,2
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.小麦和玉米深加工国家工程实验室,吉林长春130118)
以核桃清蛋白为原料,用碱性蛋白酶进行酶解制备抗氧化肽,通过单因素与响应面试验,分析确定制备核桃清蛋白抗氧化肽的最佳工艺条件为:pH9.5,温度45℃,底物浓度4%,加酶量8 000 U/g,酶解时间2.5 h。对最优条件下制备的抗氧化肽进行活性研究,测定其Fe2+螯合能力及对羟基自由基、DPPH·、ABTS+·3种自由基的清除能力,结果表明核桃清蛋白抗氧化肽对几种自由基均有显著的清除作用和金属离子螯合能力,是一种活性的的天然抗氧化剂。
核桃清蛋白;酶解优化;抗氧化活性
研究表明,许多疾病可称为“自由基”疾病,能否有效地清除自由基成为解决各类疾病的关键问题。近年来药食同源植物受到广泛的重视,开发植物资源的功能活性提取成分及保健食品具有巨大潜力及应用价值,且开发具有抗氧化活性的植物提取物用以预防和治疗氧化及自由基引发的疾病,减少心脑血管疾病、肿瘤及机体老化引发的各类疾病的发病率具有重要的意义[1-2]。
长白山核桃仁蛋白含量一般为14%~17%,最高可达29.7%,消化率可达85%以上[3-4],核桃蛋白效价与动物蛋白相近,是一种良好的植物蛋白质。其中清蛋白占核桃蛋白的40%左右,是一种水溶性蛋白。本研究采用响应面分析法对酶解制备核桃清蛋白抗氧化肽进行工艺优化,并在此基础上研究其抗氧化活性,为核桃蛋白的充分利用和核桃多肽功能性产品的开发提供参考。与人工合成的抗氧化剂相比,通过酶解植物蛋白得到的抗氧化肽更受到人们的青睐[5-7],它们具有易于被人体吸收、安全无副作用的特点,所以植物抗氧化肽的开发和应用前景十分广阔[8]。
1 材料与方法
1.1 材料与试剂
核桃清蛋白:吉林农业大学发酵工程实验室自制(参照Tan的方法[9])。
DPPH、ABTS、菲洛嗪:sigma公司;碱性蛋白酶2.4 L(酶活力45 642 U/mL):诺维信生物技术有限公司;氢氧化钠、盐酸等试剂均为国产分析纯。
1.1.2 仪器设备
1.2 方法
1.2.1 核桃清蛋白抗氧化肽的制备
核桃清蛋白溶液进行均质,90℃水浴锅内水浴15 min,冷却至酶解温度,用NaOH(0.5 mol/mL)调节蛋白溶液到一定pH值,加入定量碱性蛋白酶,酶解一定时间(此过程用NaOH调节pH值),酶解结束后,在90℃水浴锅内水浴15 min进行灭酶处理,用NaOH调节蛋白溶液到pH值至7,5 000 r/min离心10 min,取上清,冷冻干燥后得到核桃清蛋白抗氧化肽。
1.2.2 水解度(DH)测定
水解度的测定采用pH-stat法[10]
1.2.3 单因素试验设计
以酶解物的羟基自由基清除能力为指标。底物浓度 0.01、0.02、0.03、0.04、0.05、0.06、0.07 g/mL,温度 40、45、50、55、60 ℃,加酶量 2 000、4 000、6 000、8 000、10 000、12 000 U/g(以干基计),pH 值 7.5、8.0、8.5、9.0、9.5、10.0、10.5, 酶 解 时 间 0.5、1、1.5、2、2.5、3、3.5、4、4.5、5 h,进行单因素试验。
1.2.4 响应面法优化核桃清蛋白抗氧化肽酶解制备工艺
根据单因素试验结果,选出影响较大的3个因素,根据Box-Behnken中心组合试验设计原理,开展三因素三水平的响应面试验,试验设计及数据处理均利用Design Expert 8.0.5软件完成,试验因素及水平表见表1。
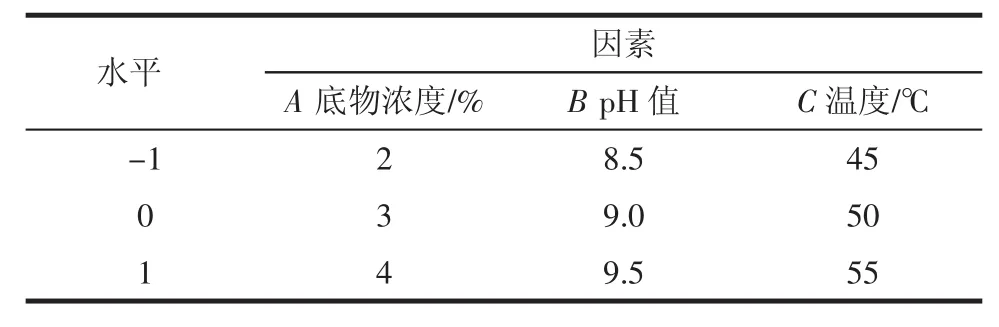
表1 响应面分析因素水平表Table 1 Factors and their coded levels teasted in response surface analysis
1.2.5 核桃清蛋白抗氧化肽抗氧化性的测定
1.2.5.1 羟基自由基(·OH)清除作用的测定
参照Amarowicz的试验方法[11]。
没有什么值得敬服之处的苏州园林,毫无“月落乌啼”诗意的寒山寺,这些现实击碎了芥川脑海里由古诗词所构建的浪漫唯美的中国形象,作为“中国趣味的爱好者”,当他来到中国,发现现实中的中国与古诗词中的中国之间的反差时,失望之情溢于言表。
1.2.5.2 ABTS+自由基清除作用的测定
参照Kong的试验方法[12]。
1.2.5.3 DPPH自由基清除能力测定
参照Xie的试验方法[13]。
1.2.5.4 Fe2+螯合能力的测定
参照Yu-Ling Lee的试验方法[14]。
2 结果与分析
2.1 单因素试验结果
对酶解时间、pH值、加酶量、底物浓度、水解温度进行了单因素试验,见图1~图5。

图1 酶解时间对羟基自由基清除能力和水解度的影响Fig.1 Effect of hydrolysis time on scavenging capacities against hydroxyl radical and DH
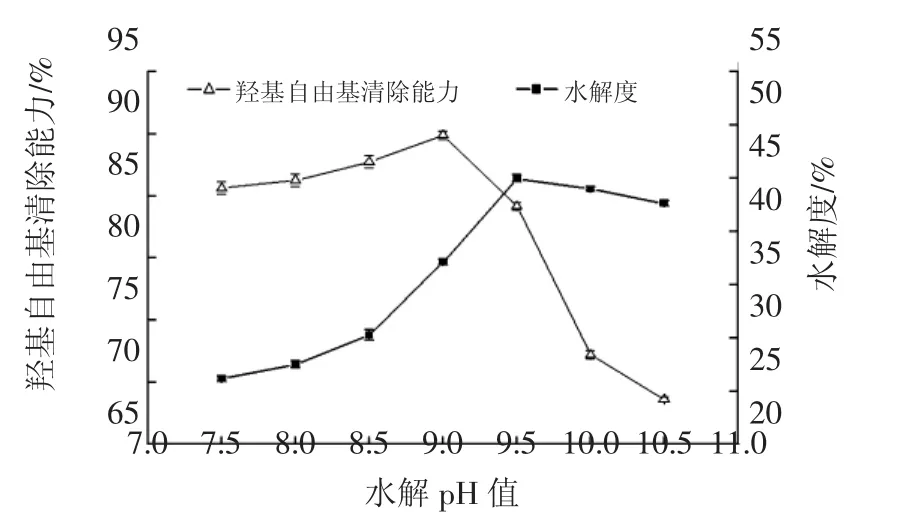
图2 pH值对羟基自由基清除能力和水解度的影响Fig.2 Effect of pH on scavengin capacities against hydroxyl radical and DH
根据图1~图5所示,当羟基自由基清除能力和水解度两种指标上升及下降趋势一致时,单因素,结果比较容易确定,当两种指标趋势不一致时,综合考虑两种指标,由于试验重点是测定蛋白及其水解多肽的抗氧化性质,所以测定考虑其对羟基自由清除能力这一指标的考察,可以得到时间2.5 h、pH9.0、加酶量为8 000 U/g、底物浓度3%、水解温度50℃为最佳水解条件,选取其中影响较大的水解温度、pH值、底物浓度三因素进行响应面设计。

图4 底物浓度对羟基自由基清除能力和水解度的影响Fig.4 Effect of substrate concentration on scavenging ca-pacities against hydroxyl radical and DH
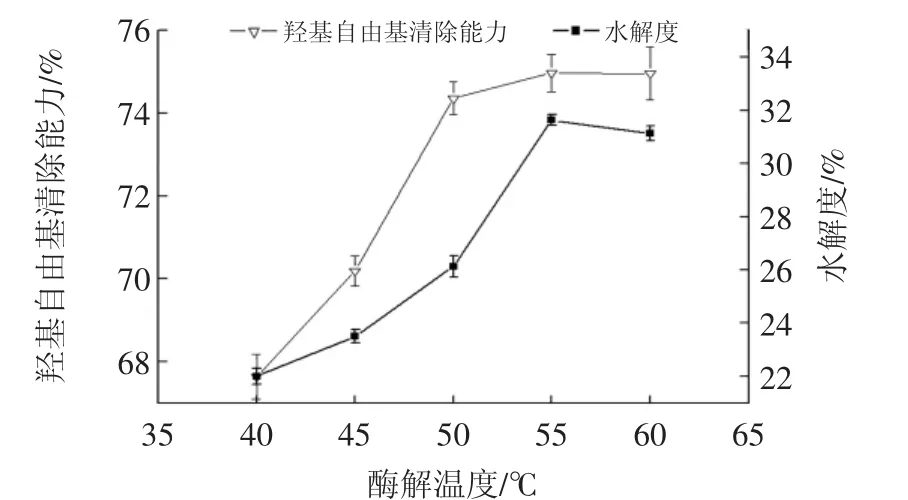
图5 酶解温度对羟基自由基清除能力和水解度的影响Fig.5 Effect of hydrolysis temperature on reducing power and DH
2.2 响应面法优化核桃清蛋白酶解工艺
2.2.1 模型的建立与分析
响应面设计及结果见表2。
以羟基自由基清除能力为响应值进行了回归模拟方差分析,结果见表3。以下为以羟基自由基清除能力为响应值回归拟合所得各因素函数表达:
羟基自由基清除能力(%)=-717.83+87.445A+10.301 5B+75.452 5C-1.474AB-1.8AC-0.305BC-0.39A2+0.038 3B2-5.477 5C2
由方差分析得出P值,模型极显著,模型的失拟性不显著,回归决定系数R2=0.942 9,修正决定系数,说明方程拟合性较好,可以应用于对酶解条件的分析预测。根据结果进行分析:一次项C极显著,二次项C2极显著。说明该模型拟合程度较好,用该模型对酶解制备核桃抗氧化肽的工艺进行优化是合适的,得到最优的酶解工艺条件为:pH9.5,温度45℃,底物浓度4%,加酶量8 000 U/g,酶解时间2.5 h。

表2 响应面设计及结果Table 2 Box-Behnken design and results for response surface analysis
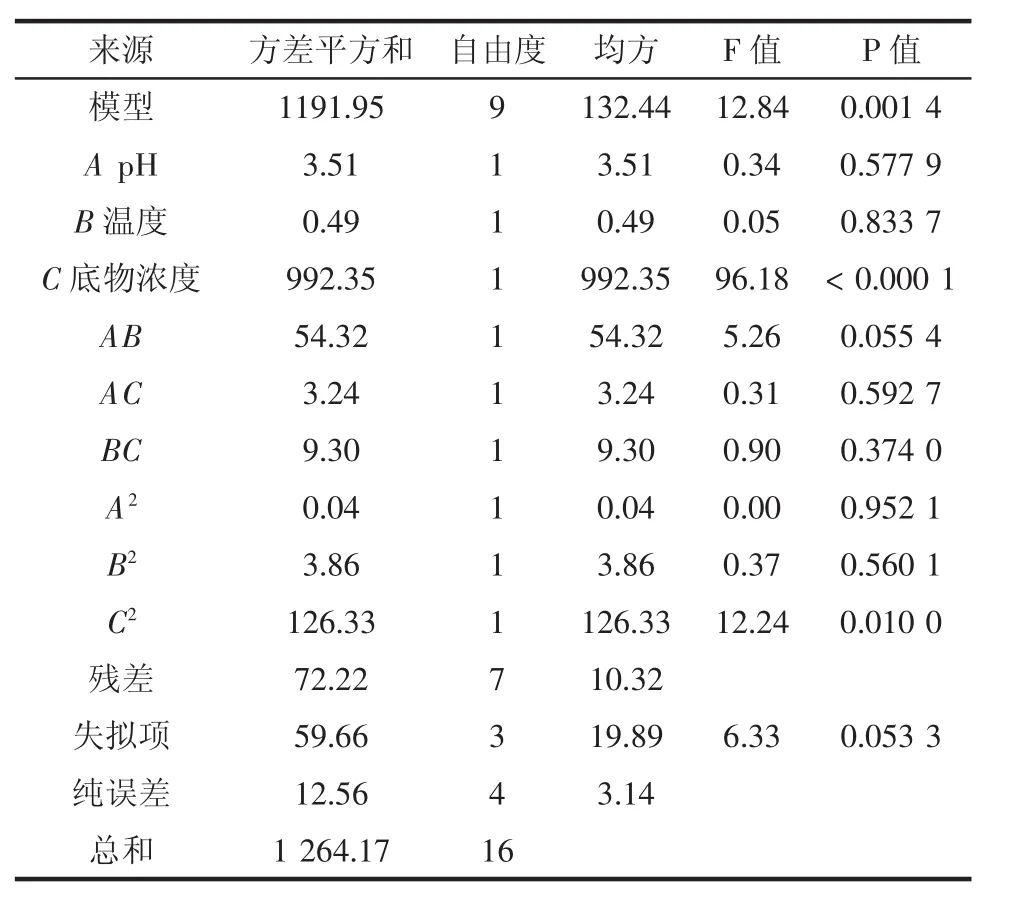
表3 回归模拟方差分析Table 3 Regression and the analysis of variance
2.2.2 验证试验
在最优条件下对响应面优化条件进行验证,羟基自由基清除能力77.03%,接近预测值(79.56%)。与理论值无显著性差异(P>0.05),表明试验所得模型具有实际价值。
2.3 核桃清蛋白抗氧化肽抗氧化性的测定
2.3.1 ABTS+自由基清除能力的测定
ABTS在适当的氧化剂作用下氧化成绿色的ABTS+自由基,有自由基清除剂存在时,ABTS+·的产生会被抑制,测定吸光度即可得出样品清除ABTS+自由基的能力见图6。
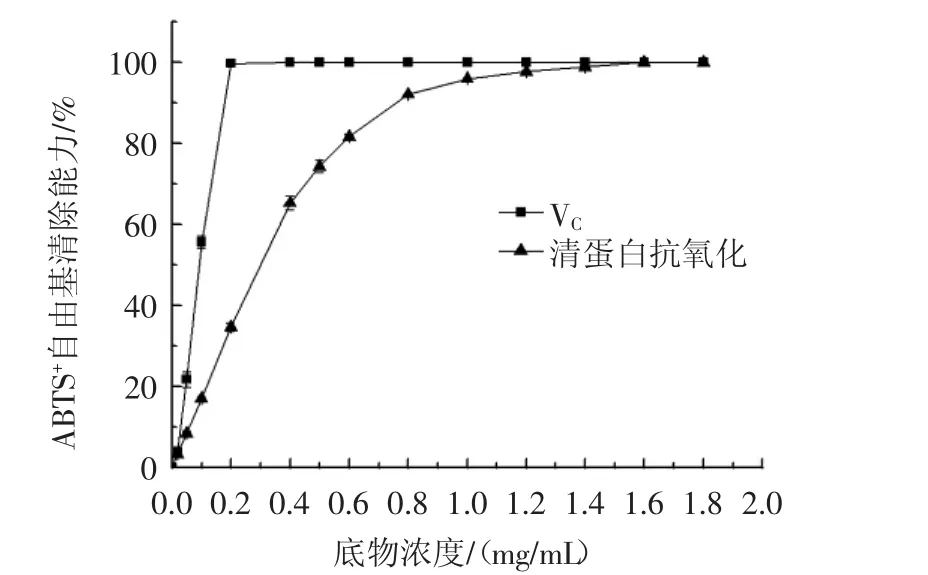
图6 清蛋白抗氧化肽、VC对ABTS+自由基的清除作用Fig.6 Scavenging effect of albumin antioxidant peptide and VCwith ABTS+radical
如图6所示,清蛋白抗氧化肽对ABTS+自由基的清除率随浓度的增大不断升高,当浓度为0.5 mg/mL时,清除效果达到(74.37±1.5)%,对ABTS+自由基的清除能力高于松子抗氧化肽(60%,1 mg/mL)、经胰液素酶水解脱脂核桃粉蛋白质得到的水解物[(69.21±7.66)%,0.5 mg/mL][15-16]。
2.3.2 DPPH自由基清除能的测定
试验中以VC为阳性对照,测定不同浓度时VC及多肽对DPPH自由基的清除作用见图7。
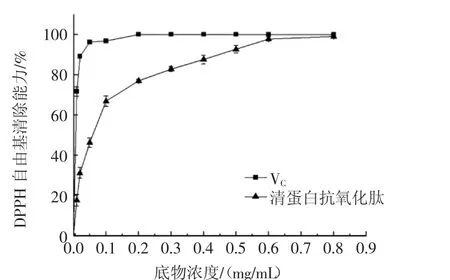
图7 清蛋白抗氧化肽、VC对DPPH自由基的清除作用Fig.7 Scavenging effect of albumin antioxidant peptide and VCwith DPPH radical
如图7所示,清蛋白抗氧化肽对DPPH自由基的清除率随浓度的增大而升高,表现出良好的剂量关系,并在0.5 mg/mL时达到(92.63±1.83)%,高于经胰液素酶水解脱脂核桃粉蛋白质得到的水解物[(87.79±1.49)%,2.0 mg/mL]、谷胱甘肽[(94.83±0.35)%,2.0 mg/mL]、核桃分离蛋白酶解产物(90.08%,1.2 mg/mL)[16-17]。
2.3.3 羟基自由基(·OH)清除作用的测定
羟基自由基是人体内危害性最大的自由基。在反应过程中,亚铁离子与双氧水释放出的羟基自由基会与水杨酸结合,形成紫色物质。有自由基清除剂存在时,紫色会褪去,从褪色程度可以判断其清除自由基能力的强弱见图8。

图8 清蛋白抗氧化肽、VC对羟基自由基的清除作用Fig.8 Scavenging effect of albumin antioxidant peptide and VCwith hydroxyl radical
如图8所示,清蛋白抗氧化肽对羟基自由基的清除作用随浓度的增加而显著提高,当浓度为5 mg/mL时,清除率到达84.07%,高于核桃分离蛋白酶解产物(94.56%,15 mg/mL)、松子抗氧化肽(32.15%,8 mg/mL)[17,15]。
2.3.4 Fe2+螯合能力的测定
亚铁离子的存在,会加速脂质氧化的过程,所以测定对金属离子的螯合能力可以衡量出样品的抗氧化能力见图9。

图9 清蛋白氧化肽、EDTA对Fe2+的螯合能力作用Fig.9 Ferrous ions chelating capacity of albumin antioxidant peptide and EDTA
如图9所示,清蛋白抗氧化肽对Fe2+的螯合能力呈现良好的剂量关系,浓度仅为0.5 mg/mL时螯合率为89.65%,高于经胰液素酶水解脱脂核桃粉蛋白质得到的水解物[74.00±2.03%,2.0(mg/mL)][16]。
3 结论
本试验以核桃清蛋白为原料,用碱性蛋白酶进行酶解,在单因素试验基础上,采用响应面法优化酶解制备抗氧化肽的最佳工艺条件为:pH9.5,温度45℃,底物浓度4%,加酶量8 000 U/g,酶解时间2.5 h,此条件下水解度为28.68%,羟基自由基清除能力73.34%。
试验考察了酶解制备的清蛋白抗氧化肽的活性,浓度为5 mg/mL时,羟基自由基清除率达到84.07%,浓度为0.5 mg/mL时,DPPH自由基清除率达到(92.63±1.83)%、ABTS+自由基清除率达到(74.37±1.5)%、Fe2+螯合率达到89.65%。结果表明,核桃清蛋白抗氧化肽的抗氧化能力在一定范围内呈现出良好的剂量关系。根据其剂量关系趋势,我们可以断定,在浓度足够大时,核桃清蛋白抗氧化肽对羟基自由基、DPPH自由基、ABTS+自由基的清除率及Fe2+螯合率均能够达到100%。而且通过与其他原料的蛋白、多肽在不同抗氧化指标的比较可以知道,清蛋白抗氧化肽的抗氧化指标效果是非常好的。所以核桃清蛋白抗氧化肽具有较强的抗氧化活性,对几种自由基均有显著的清除作用,是一种良好的天然抗氧化剂,拥有广阔的研究价值和市场前景。
[1]陈庆亮,单成钢,朱京斌,等.药食同源食品起源与行业现状分析[J].黑龙江农业科学,2011(7):114-116
[2]赵黎明,刘兵,夏泉鸣,等.中国保健食品现状和发展趋势[J].中国食物与营养,2010(10):4-7
[3]魏丽丽.核桃楸的药理作用研究[J].黑龙江医药,2009,22(4):532-534
[4]杜蕾蕾.冷榨核桃制备核桃油和核桃蛋白的研究[D].武汉:武汉工业学院,2009
[5]Kudo K,Onodera S,Takeda Y,et al.Antioxidative activities of some peptides isolated from hydrolyzed potato protein extract[J].Journal of functional foods,2009,1(2):170-176
[6]Jamdar S,Rajalakshmi V,Pednekar M,et al.Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J].Food Chemistry,2010,121(1):178-184
[7]Zhang T,Li Y,Miao M,et al.Purification and characterisation of a new antioxidant peptide from chickpea (Cicer arietium L.)protein hydrolysates[J].Food Chemistry,2011,128(1):28-33
[8]张昊,任发政.天然抗氧化肽的研究进展[J].食品科学,2008,29(4):443-447
[9]Tan S H,Mailer R J,Blanchard C L,et al.Extraction and characterization of protein fractions from Australian canola meals[J].Food Research International,2011,44:1075-1082
[10]Adlernissen J.Enzymic hydrolysis of food proteins[J].Canadian Medical Association Journal,1986,172(8):1783-1785
[11]AMAROWICZ R,NACZK M,SHAHIDI F.Antioxidant activity of various fractions of non-tannin phenolics of canola hulls[J].Journal of Agricultural and Food Chemistry,2000,48(7):2755-2759
[12]KONG B,XIONG Y L.Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J].Journal of Agricultural and Food Chemistry,2006,54(16):6059-6068
[13]XIE Z,HUANG J,XU X,et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chemistry,2008,111(2):370-376
[14]LEE Y-L,YEN M-T,MAU J-L.Antioxidant properties of various extracts from Hypsizigus marmoreus[J].Food Chemistry,2007,104(1):1-9
[15]冷帅辰.长白山松仁抗氧化肽的制备、分离纯化及鉴定[D].长春:吉林农业大学,2015
[16]Gu M,Chen H P,Zhao M M,et al.Identification of antioxidant peptides released from defatted walnut(Juglans Sigillata Dode)meal proteins with pancreatin[J].LWT-Food Science and Technology,2015,60(1):213-220
[17]孙琳琳.长白山核桃楸种仁蛋白功能性质及其酶解产物的抗氧化活性研究[D].长春:吉林农业大学,2014
Preparation and Activity of Antioxidant Peptide from Walnut Albumin
LIU Wei1,2,MIN Wei-hong1,2,*,LIU Chun-lei1,2,CAO Bai-ying1,2,ZHAO Fan-rui1,2
(1.College of Food Science and Engineering,Jilin Agricultural University,Changchun 130118,Jilin,China;
2.National Engineering Laboratory on Wheat and Corn Further Processing,Changchun 130118,Jilin,China)
Walnut albumin were used as raw material,walnut albumin isolated was hydrolyzed by Alcalase to prepare antioxidant peptide.Through single-factor experiment and response surface method,the optimal hydrolysis conditions were determined as pH of 9.5,temperature of 45℃,substrate concentration of 4%,Alcalase concentration of 8 000 U/g and hydrolysis time of 2.5 h.To assess the antioxidant potential,walnut albumin antioxidant peptide was tested for its ferrous ions chelating capacity and scavenging capacities against hydroxyl radical,DPPH·,ABTS+·.The experimental results showed that walnut albumin antioxidant peptide had significant scavenging effect against several kinds of free radicals,and ferrous ions chelating capacity,and it was a kind of natural antioxidants which had stronger antioxidant activities.
walnut albumin;hydrolysis optimization;antioxidant activity
10.3969/j.issn.1005-6521.2017.17.010
2016-12-15
国家“863”计划项目(2013AA102206)
刘威(1991—),男(汉),硕士研究生,研究方向:食品生物化学与功能性食品。
*通信作者:闵伟红(1971—),女,教授,博士生导师,主要从事发酵工程、粮油科学与深加工技术研究。
