大孔树脂纯化生姜多酚的研究
2017-09-04刘军伟李啸晨侯婴惠王芸宋荣珍唐晓珍
刘军伟,李啸晨,侯婴惠,王芸,宋荣珍,唐晓珍
(山东农业大学食品科学与工程学院,山东泰安271018)
大孔树脂纯化生姜多酚的研究
刘军伟,李啸晨,侯婴惠,王芸,宋荣珍,唐晓珍*
(山东农业大学食品科学与工程学院,山东泰安271018)
采用大孔树脂吸附法对生姜多酚纯化工艺进行研究。选择5种大孔吸附树脂,筛选出AB-8树脂为生姜多酚的纯化树脂并通过静态试验及动态吸附对生姜多酚的大孔树脂纯化工艺优化。确定生姜多酚纯化树脂的静态吸附条件为:最佳吸附时间为2 h,最佳的吸附温度为30℃,树脂质量为10 g;动态吸附条件为:将100 mL上样浓度为1 mg/mL的生姜多酚,在上样流速1 mL/min条件下进行吸附,用体积为150 mL的70%乙醇溶液洗脱,此条件下解吸率为85.9%。
生姜;多酚;大孔树脂;纯化
生姜为姜科植物姜的鲜根茎,是日常生活中的调味料,也是传统药食两用的植物。生姜多酚是生姜的主要功能成分,近年来国内外研究表明,生姜多酚具有抗氧化[1-2]、抗炎[3]、抗糖尿病[4]、抗肥胖以及抗癌[5-6]等生物学功能,在食品、化妆品,医药等领域获得广泛应用[7-8]。
生姜多酚提取的方法很多,如溶剂法[9],水蒸汽蒸馏法,超声波法[10],超临界和微波萃取法,酶法辅助提取[11]等。由于提取的生姜多酚含有较多的杂质[12],还需要进一步分离纯化。而关于其纯化工艺方法也有所不同,主要有大孔树脂吸附法[13]、离子交换层析[14]法等。而大孔树脂理化性质稳定,具有良好的选择性、易解吸吸附、高机械强度、再生效果好、周期使用长等优点且对提取物兼有分离和筛选作用,被广泛应用于天然产物的分离纯化[15-16]。李波等[17]研究了大孔树脂纯化红松松球鳞片多酚。付瑞敏等[18]研究了大孔树脂对苹果多酚的吸附。马艺丹等[19]研究了神秘果种子多酚的大孔树脂工艺研究。
基于以上研究现状,本试验通过对5种树脂进行静态吸附试验,筛选出合适的大孔树脂,并通过静态试验及动态吸附对生姜多酚的大孔树脂纯化工艺进行研究,得出最佳工艺条件,为生姜多酚的综合利用提供技术参考。
1 材料与方法
1.1 材料
新鲜生姜:山东潍坊江海食品有限公司。
1.2 试剂
无水乙醇:天津凯通化学试剂有限公司;香草醛:天津市百世化工有限公司;AB-8、HPD-400、S-8、AL-1、D4020大孔树脂:沧州宝恩化工有限公司。
1.3 主要仪器
RE52CS旋转蒸发器、SHZ-ⅢD型循环水真空泵:上海亚荣生化仪器厂;HH-6数显恒温水浴锅:江苏常州国华电器有限公司;TDL-5-A离心机:上海安亭科学仪器厂;万分之一天平:上海台钰电子有限公司;UV-725型紫外可见分光光度计:上海元析仪器有限公司;恒流泵、层析柱、HD-3紫外检测仪、HD-A层析图谱采集分析仪、SBS-100数控计滴自动部分收集器:上海沪西分析仪器厂有限公司。
1.4 方法
1.4.1 标准曲线的绘制
参照黄雪松等[20]的方法,配制浓度为20 μg/mL的香草醛标准溶液。准确吸取标准溶液1.0、2.0、3.0、4.0、5.0、6.0 mL,95%乙醇定容,在280 nm测定吸光度。以香草醛浓度为横坐标(μg/mL)、吸光度为纵坐标,绘制标准曲线,计算其标准曲线回归方程为:y=0.137 3x-0.129,R2=0.996 2
1.4.2 大孔树脂的预处理
用95%乙醇浸泡大孔树脂24 h,水洗至无醇味,无白色浑浊;加入5%HCl浸泡3 h,水洗至中性;加入5%NaOH浸泡3 h,水洗至中性,加水浸泡。每次洗脱完毕,需重复以上操作,达到树脂的再生[21]。
1.4.3 多酚提取液的制备
取100 g生姜去皮切丝,200 mL 80%乙醇打浆,浸提2 h,4 500 r/min离心5 min,抽滤,收集上清液,抽滤液减压浓缩,过超滤。
1.4.4 吸附率、解吸率、泄露率的计算
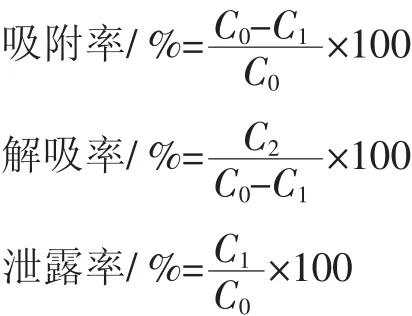
式中:C0为吸附前多酚的浓度,mg/mL;C1为吸附后多酚的浓度,mg/mL;C2为解吸后多酚的浓度,mg/mL。
1.4.5 大孔树脂的筛选
准确称取处理好的5份大孔树脂各10 g于250 mL烧杯中,分别加入100 mL的生姜多酚提取液,于30℃水浴锅中静置2 h,使其充分吸附饱和。按照1.4.1的方法测吸光度,按照1.4.4的方法计算吸附率。
1.4.6 大孔树脂的静态吸附
按照1.4.5的方法,加入不同的树脂质量,在不同的吸附时间和温度下,以吸附率为指标,分别确定最佳的树脂质量、吸附时间、温度。
1.4.7 大孔树脂的动态吸附
通过静态吸附试验,将筛选出的树脂湿法装柱,考察上样速率、上样浓度对泄漏率的影响以及洗脱剂浓度、洗脱剂体积对解吸效果的影响。
2 结果与分析
2.1 大孔树脂的筛选
大孔树脂的吸附性主要依靠分子间的范德华力或氢键的作用,吸附的性能与吸附的比表面积有关[22]。同一成分但不同类型的树脂吸附性能不同,同一型号的树脂对不同的吸附量也存在不同程度的差异[22]。为了选择合适的树脂,分别进行吸附率的测定如表1所示。

表1 5种树脂吸附吸附结果Table 1 Results of adsorption of five types of resin
由表1可以看出5种不同极性的大孔树脂都存在吸附率,说明大孔树脂均有不同程度的吸附,其中AB-8大孔树脂相对于其他的树脂的吸附率最高,这与生姜多酚极性较弱,更易被弱极性的大孔树脂吸附有关。故选择AB-8大孔树脂进行下一步试验。
2.2 大孔树脂的静态吸附
2.2.1 吸附时间的确定
大孔树脂吸附的速率,是分析吸附效果的重要指标[23]。静态吸附时间的确定见图1。
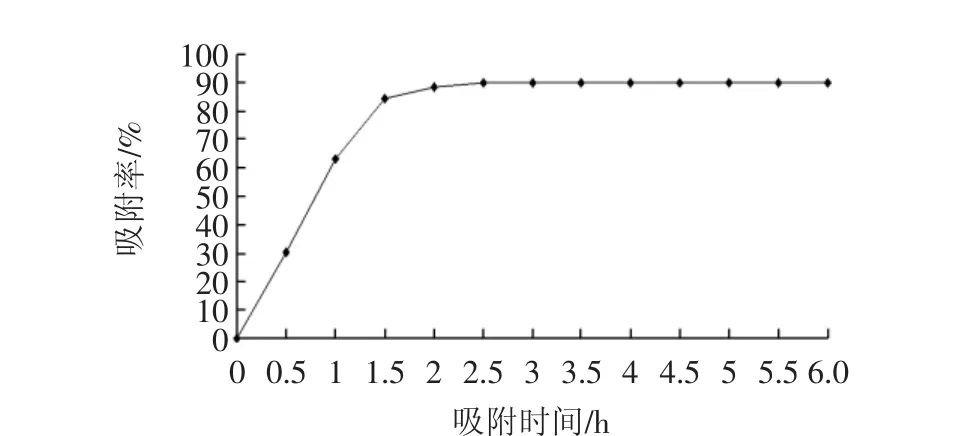
图1 静态吸附时间的确定Fig.1 Determination of static adsorption time
由图1可知,大孔树脂的吸附率随着时间的延长而升高(P<0.05),在2 h之前吸附率上升较快,2 h后基本上保持不变,差异不显著(P>0.05)。这是因为在多酚足够多的情况下,树脂与多酚充分接触,吸附速率较快,随着时间的延长,料液中的多酚含量下降较快。2 h之后多酚基本完全吸附,故吸附率基本保持不变。因此,最佳的吸附时间为2 h。
2.2.2 吸附温度的确定
温度是影响吸附效果的重要因素[24]。静态吸附温度的确定见图2。

图2 静态吸附温度的确定Fig.2 Determination of static adsorption temperature
由图2可以看出大孔树脂的吸附率随温度升高而显著增加,30℃时达到最大,随后显著降低,这是因为大孔树脂的吸附是物理吸附,低温使吸附过程达不到平衡,随着温度升高,会使吸附的速率加快,出现吸附率增加的情况[24]。而物理吸附是一个放热的过程,升高温度,吸附量会有所降低。因此,最佳的吸附温度为30℃。
2.2.3 树脂质量的确定
树脂质量是影响吸附效果的重要因素。树脂质量不同,吸附率也不同,树脂质量的确定见图3。

图3 树脂质量的确定Fig.3 Determination of resin quality
由图3可以看出随着树脂质量的增加,吸附率逐渐增加(P<0.05),当质量为10 g时达到最大值。10 g后基本上保持不变,差异不显著(P>0.05)。这是因为树脂对多酚的吸附量是有限的,所以树脂质量较少时,不足以完全吸附多酚,当树脂质量增加到一定量时,多酚已完全吸附,再增加质量,多酚的吸附率也不会增加。故树脂质量为10 g。
2.3 大孔树脂的动态吸附
2.3.1 上样速率的确定
上样流速是影响大孔树脂吸附效率的重要因素。上样流速对吸附效果的影响,主要体现在料液在树脂表面的扩散,流速不同则树脂的饱和吸附量不同,若流速过高,料液来不及扩散到树脂表面就被冲出柱子而发生泄露,而上样流速过小,虽有利于树脂对料液的吸附,但树脂达到饱和的时间会延长,降低树脂吸附率[25-26]。上样流速对泄露率的影响见图4。

图4 上样流速对泄露率的影响Fig.4 Effect of feeding speed on leakage rate
由图4可知,在上样量低于80 mL时,不同流速样液泄漏率基本不变,当超过100 mL时,泄漏率随着流速的增大而增大,这是因为上样液流速不同,树脂与多酚的接触时间也会有差别,流速过快多酚没有与树脂充分接触就流出,导致泄露点提前到80 mL,流速减慢能使多酚与树脂充分接触,从而吸附更多的量,而1mL/min的泄漏率在同样的上样体积下低于2mL/min,同时,若上样速率低于1 mL/min,等量多酚的情况下,耗时会增加,效率变低。综合以上因素最佳的上样速率为1 mL/min。同时确定了最佳的上样体积为100 mL。
2.3.2 上样浓度的确定
上样浓度也是影响吸附效果的重要因素。一般来说,大孔树脂的吸附量一般与上样浓度成反比,低浓度有利于吸附[27]。上样浓度过低,纯化时间长、效率低,而上样浓度过高易引起吸附不充分,堵塞树脂,泄露点出现较早,吸附量较低,造成样品浪费[27]。上样浓度对泄露率的影响见图5。
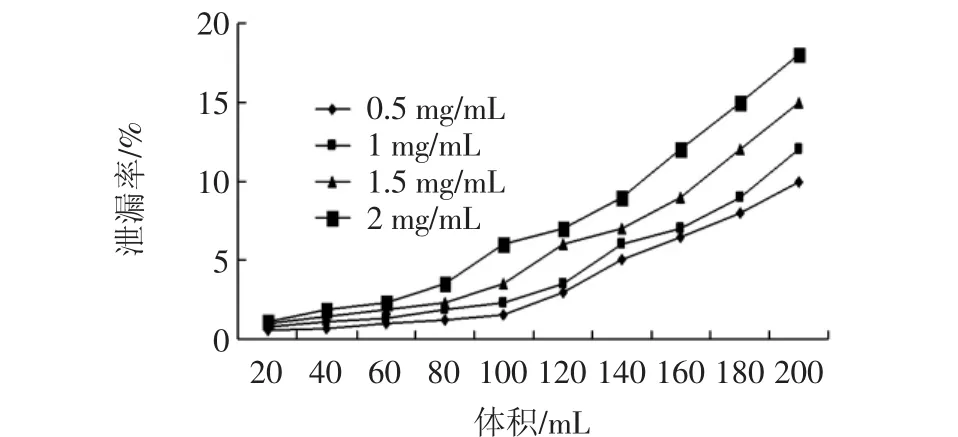
图5 上样浓度对泄露率的影响Fig.5 Effect of sample concentration on leakage rate
由图5可知,在上样量低于60 mL时,不同浓度样液泄漏率基本不变,当80 mL时,2 mg/mL的样液泄漏率显著增加,其原因可能是树脂吸附达到饱和,而不能再吸附更多的多酚,导致泄漏率增加。当超过100 mL时泄漏率随着浓度的增大而增大。可能是因为在多酚溶液浓度较低时,增加浓度,可以增加多酚分子与树脂的接触,而当试液浓度增加至一定量后,继续升高浓度,树脂接触表面多酚分子过多,影响多酚分子在树脂内部的扩散,导致泄漏率有所升高[26]。考虑到在泄露发生情况相同的条件下,1 mg/mL与0.5 mg/mL的泄漏率相差不大,考虑到吸附的效率,1 mg/mL浓度更适用于生产要求。因此选择最佳上样浓度为1mg/mL。
2.3.3 洗脱剂浓度的确定
影响洗脱效果的因素有很多,其中洗脱剂的浓度是影响的重要因素。选择合适解吸剂时应考虑溶解吸附物质效果好,而且具备沸点低,易回收,环境污染少等优点[28]。试验中常用的洗脱剂有甲醇、乙醇、丙酮等,由于甲醇和丙酮的毒性较大,而乙醇无毒且溶解性较好,且生姜多酚主要应用在食品及医药领域,出于安全性的考虑[28],选用无毒的乙醇作为解吸剂。洗脱剂浓度对解吸率的影响见表2。

表2 洗脱剂浓度对解吸率的影响Table 2 Effect of eluent concentration on desorption rate
由表2可以看出以不同浓度的乙醇作为洗脱剂,解吸率随浓度的升高而显著增加,浓度为70%时达到最大,随后降低,这可能是由于不同浓度乙醇的极性不同,在一定程度上影响多酚的解吸效果,浓度较高时极性偏小,会溶解一些醇溶性的杂质,导致解吸率下降[29]。由于乙醇浓度过高,挥发性会增大,出于经济因素等,选择70%乙醇作为洗脱溶剂。
2.3.4 洗脱剂体积的确定
洗脱剂体积对解吸率的影响见图6。
由图6可以看出,在低于150 mL时随着洗脱剂体积的增加,解吸率逐渐增加(P<0.05)。超过150 mL时解吸率基本保持平衡,差异不显著(P>0.05)。这是因为随着洗脱剂的增加,多酚被逐渐洗脱下来,当达到一定量时,多酚基本洗脱完全,解吸率保持平衡。综合考虑,在多酚被充分洗脱下的前提下,出于经济的考虑,应尽量节省洗脱剂的用量。故最佳的洗脱剂体积为150 mL。
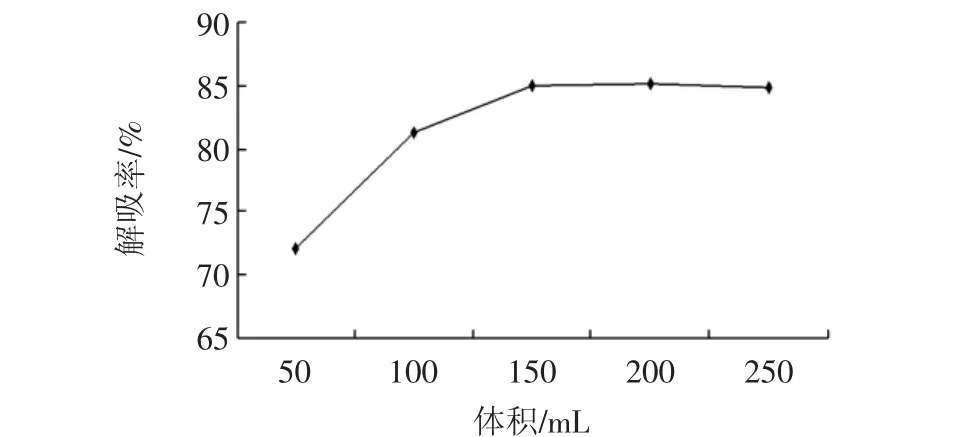
图6 洗脱剂体积对解吸率的影响Fig.6 Effect of eluent volume on desorption rate
3 结论
AB-8树脂为生姜多酚的纯化树脂,生姜多酚的纯化树脂的静态吸附条件为:最佳的吸附时间为2 h,最佳的吸附温度为30℃,树脂质量为10 g;动态吸附条件为:将100 mL上样浓度为1 mg/mL的生姜多酚,在上样流速1 mL/min条件下进行吸附,用体积为150 mL的70%乙醇溶液洗脱,此条件下解吸率为85.9%。
[1]SLi S Q,NAGENDRA P S.Characterization,antioxidative and bifidogenic effects of polysaccharides from Pleurotus eryngii after heat treatments[J].Food Chemistry,2016,197:240-249
[2]DONG H M,ZHANG Q,LI Y,et al.Extraction,characterization and antioxidant activities of polysaccharides of Chuanminshen violaceum[J].International Journal of Biological Macromolecules,2016,86:224-232
[3]WEN Z S,XIANG X G,JIN H X,et al.Composition and anti-inflammatory effect of polysaccharides from Sargassum horneri in RAW264.7 macrophages[J].International Journal of Biological Macromolecules,2016,88:403-413
[4]Fuhrman B,Volkovan,Aviram M,et al.Pomegranate juice polyphenols increase recombinant paraoxonase-1 binding to high-density lipoprotein:studies in vitro and in diabetic patients[J].Nutrition,2010,26(4):359-366
[5]Almuammar M,Khan F.Obesity:the preventive role of the pomegranate(Punica-granatum)[J].Nutrition,2012,28(6):595-604
[6]Yanagi S,Matsumura K,Marui A,et al.Oral pretreatment with a green tea polyphenol for cardioprotection against ischemia-reperfusion injury in an isolated rat heart model[J].Journal of Thoracic and Cardiovascular Surgery,2011,141(2):511-517
[7]NicollR,Henein MY.Ginger(Zingiberofficinale Roscoe):ahot remedy for cardiovascular disease[J].Int J Cardiol,2007,31(3):408-409
[8]李大峰,贾冬英,姚开,等.生姜及其提取物在食品加工中的应用[J].中国调味品,2011,36(2):20-23
[9]Judith Kammerer,Dietmar R Kammerer,Reinhold Carle.Impact of saccharides and amino acids on the interaction of apple polyphenols with ion exchange and adsorbent resins[J].Journal of Food Engineering,2010,98(2):230-239
[10]Daniella Pingret,Anne-Sylvie Fabiano-Tixier,Carine LeBourvellec,et al.Lab and pilot-scale ultrasound-assisted water extraction of polyphenols from apple pomace[J].JournalofFoodEngineering,2012,111(1):73-81
[11]王华斌,王珊,傅力.酶法提取石榴皮多酚工艺研究[J].中国食品学报,2012,12(6):56-65
[12]Judith Kammerer,Dietmar R Kammerer,Uwe Jensen,et al.Interaction of apple polyphenols in a multi-compound systemupon adsorption onto a food-grade resin[J].Journal of Food Engineering,2010,96(4):544-554
[13]Jing Li,Howard A.Use of expanded bed adsorption to purify flavonoids from Ginkgo biloba L.[J].Journal of Chromatography A,2009,1216:8759-8770
[14]Zhang Jing,Yue Lin,Khizar Hayat,et al.Purification of flavonoid from Gingko biloba extract by zinc complexation method and its effect on antioxidant activity[J].Separation and Purification Technology,2010,71:273-278
[15]Zhang Yu,Jiao Jing-jing,Liu Cheng-mei,et al.Isolation and purification of four flavone C-glycosides from antioxidant of bamboo leaves by acroporous resin column chromatography and preparative high-performance liquid chromatography[J].Food Chemistry,2008,107:1326-1336
[16]刘安军,刘慧慧,郭丹霄,等.大孔吸附树脂分离纯化枸杞叶总黄酮的研究[J].现代食品科技,2012,28(3):292-296
[17]李波,包怡红,王振宇.大孔树脂纯化红松松球鳞片多酚及其抗氧化活性研究[J].食品工业科技,2012,33(22):251-255
[18]Ruimin Fu,Yaya Wang,Feng Yu,et al.Optimization of the macroporous resin-based adsorption of apple polyphenol through response surface methodology[J].Toxicological&Environmental Chemistry,2016,98(3/4):479-491
[19]马艺丹,刘红,马思聪,等.神秘果种子多酚大孔树脂纯化工艺研究[J].食品与机械,2016,32(2):139-143
[20]黄雪松,王建华,路福绥.姜酚的提取、分离和鉴定[J].山东农业大学学报(自然科学版),1998,29(4):511-514
[21]张素华,王正云.大孔树脂纯化芦笋黄酮工艺的研究[J].食品科学,2006,27(2):182-186
[22]董琦,高珊.大孔树脂纯化桦褐孔菌多酚及其成分分析[J].食品科学,2015,36(22):131-135
[23]谭永霞,王洪庆,陈若芸.长穗桑中的α-葡萄糖苷酶抑制剂成分研究[J].中国药学杂志,2010,45(18):1376-1379
[24]王金亭,鞠秀萍,吴广庆.大孔吸附树脂纯化紫荆花红色素的研究[J].食品研究与开发,2009,30(4):49-53
[25]艾志录,王育红,王海,等.大孔树脂对苹果渣中多酚物质的吸附研究[J].农业工程学报,2007,23(8):245-248
[26]郭娟.苹果渣中苹果多酚的提取、纯化及功效研究[D].郑州:河南农业大学,2006
[27]刘丽香.甘薯叶中多酚提纯工艺及抗氧化活性研究[D].南京:南京农业大学,2008
[28]田晶.AB-8树脂法提取大豆皂苷的研究[J].食品与发酵工业,1999,26(1):16-18
[29]王振宇,刘春平.大孔树脂AB-8对苹果多酚的分离纯化[J].食品研究与开发,2009,30(4):21-24
Purification of Phenols from Ginger by Macroporous Resin
LIU Jun-wei,LI Xiao-chen,HOU Ying-hui,WANG Yun,SONG Rong-zhen,TANG Xiao-zhen*
(College of Food Science and Engineering,Shandong Agricultural University,Tai'an 271018,Shandong,China)
The purification process of ginger polyphenol was studied by macroporous resin adsorption.Five kinds of macroporous adsorption resins were selected.AB-8 resin was selected as a suitable material to purify the polyphenols from ginger.The macroporous resin purification process of ginger polyphenol was optimized by static test and dynamic adsorption.The results were as follows:the optimum adsorption time 2 h,the optimum adsorption temperature 30℃and the resin mass 10 g.The the concentration of the sample 1 mg/mL,the volume 100 mL,low rate of sample solution 1mL/min,with 70%ethanol as eluting solvent,while elution volume was 150 mL.Under these conditions,desorption rate was 85.9%.
ginger;polyphenol;macroporous resin;purification
10.3969/j.issn.1005-6521.2017.17.009
2016-12-02
国家科技支撑计划课题(2012BAD33B07);山东省自然科学基金(ZR2014CM035)
刘军伟(1990—),男(汉),研究生,主要从事功能食品方面研究。
*通信作者
