房颤患者Cx40基因单核苷酸多态性研究*
2017-09-04梁志红刘科成全智华唐惠芳
梁志红,刘科成,全智华,唐惠芳
(南华大学附属第一医院,湖南 衡阳 421000)
房颤患者Cx40基因单核苷酸多态性研究*
梁志红,刘科成,全智华,唐惠芳
(南华大学附属第一医院,湖南 衡阳 421000)
目的 探讨缝隙连接蛋白40基因(GJA5)单核苷酸多态性在房颤发生中的作用。方法 选择2012年6~12月南华大学附属第一医院心血管内科住院患者200例,分为房颤组98例(持续性发颤)及对照组102例(窦性心律)。收集患者一般临床资料并通过经胸心脏彩超采集患者左房内径值,静脉采血提取DNA,经聚合酶链反应(PCR)及电泳法检测SNP的位点,PCR扩增产物纯化后直接测序查看SNP位点;哈德温伯格平衡检验后,比较各组间基因分型和基因频率,就房颤危险因素非条件Logistic回归分析。结果 GJA5基因rs10465885存在A/G多态性,房颤组等位基因A、G频率分别为0.54和0.46。对照组等位基因A、G频率分别为0.45和0.55。哈德温伯格平衡检验显示组间均符合其平衡,房颤组AA基因型高于对照组,AG、GG基因型以及等位基因频率差异无统计学意义。GJA5基因(rs10465885)AA基因型(O∧R=2.49)和左房直径(O∧R=1.29)是房颤的危险因素,GJA5基因(rs10465885)基因型和左房直径无关。结论 GJA5基因rs10465885位点存在基因多态性,AA基因型与左房直径是房颤的危险因素。
GJA5基因;rs10465885;基因型;等位基因;心房颤动
心房的电重构和结构重构在房颤的发生和维持中起着重要的作用[1],房颤时结构重构分子水平的改变之一为缝隙连接蛋白排列混乱[2]。心脏缝隙连接由40个左右的缝隙连接通道构成,心肌细胞主要表达缝隙连接蛋白40(Connexin40,Cx40)和Cx43(Connexin43,Cx43)等。房颤时Cx40表达量减少,分布出现侧边化改变,影响细胞间的连接和传导,从而增加房颤的易感性[3-9]。GJA5基因是Cx40蛋白的编码基因。GROENEWEGEN等[10]在患有心房静止家族的研究中发现:Cx40基因启动子A的-44区域由G转变为A(-44G→A),转录起始位点71区域由A转变为G(+71A→G)。FIROUZI等[11]对Cx40基因启动子研究证明其存在单核苷酸多态性(-44AA/+71GG)。这类患者通过延长心房不应期,更加容易诱导房颤发生。该2项研究人群均为欧洲白种人群,由于单核苷酸多态性(single nucleotide polymorphism,SNP)存在地域和人种的差异,本研究对衡阳地区房颤患者GJA5基因位点分布情况进行研究。
1 资料与方法
1.1 研究对象
病例来自2012年6~12月南华大学附属第一医院心血管内科住院患者200例,分为房颤组和对照组。房颤组为持续性房颤患者(98例),对照组为窦性心律患者(102例)。
排除标准:①肝肾功能衰竭;②心功能IV级;③合并严重瓣膜狭窄、心包炎、心肌病、肺心病、先天性心脏病、甲状腺功能亢进、肥厚性梗阻性心肌病、限制性心肌病、缩窄性心肌病、起搏器术后或30 d内心脏手术后;④不在衡阳地点居住,不符合调查对象的条件;⑤不能完成全部的调查步骤,调查内容有缺失或者调查数据有明显的错误,且数据无法进行更正或者核对者。
入组对象为随机选择的衡阳地区汉族人群,年龄≥18岁。资料收集及血样采集经研究对象的知情同意。患者入组后,收集患者一般资料:性别、年龄、有无长期吸烟史、嗜酒史、高血压病史及相关实验室检查等,并通过经胸心脏彩超采集患者左房内径值。
1.2 主要仪器与试剂
ABI3730XL测序分析仪(Applied biosystems公司,美国),PCR仪(Bio-Rad公司,美国),凝胶成像分析仪(Applied Biosystems公司),DNA琼脂糖凝胶电泳仪(Bio-Rad公司),低温低速桌面离心机(Beckman公司,美国),低温高速桌面离心机(Beckman公司),0.1~2.5μl移液器(Eppendorf公司),0.5~10μl移液器(Eppendor公司),2~20μl移液器(Eppendorf公司,德国),50~200μl移液器(Eppendorf公司,德国),100~1 000μl移液器(Eppendorf公司),CPA 225D电子天平(Sartorius公司,德国),超净工作台(Heal Force公司,中国),恒温水浴箱(上海金宏公司,中国),超纯水仪(ELGA公司,英国),圆周震荡器(IKA公司,德国),DW-FL253冰箱(中科美菱公司,中国),-20℃冰柜(海尔公司),WP700P21型微波炉(格兰仕电器有限公司,中国),OMEGA血样DNA提取试剂盒(D3471-02)BDv3.0检测试剂盒。
1.3 标本采集
采集患者住院次日清晨空腹时静脉血3~5 ml置于K3EDTA采血管和普通生化管内,立即置于离心机将血清、血浆和血细胞分离,放入-80℃冰箱中保存以备检测和DNA提取。
1.4 DNA提取
使用华大基因(武汉分公司)提供的OMEGA血样DNA提取试剂盒(D3471-02),按照说明书提取血液基因组DNA。
1.5 引物设计
通过NCBI基因数据库和Ensembl数据库获得GJA5基因的全基因组序列,找出目标SNP片段位置,用Primer5.0软件(加拿大Primer公司)进行设计扩增引物对。rs10465885引物:GJA5正向引物:CCAT ACCTCACCTACCAG,GJA5反向引物:CAGTGCTTG CTGCCTTGT。
1.6 PCR扩增
由华大公司负责合成引物。收到引物以先用高速离心机以12 000 r/min转速离心约2 min,然后再开盖,加入适量的双蒸水溶解为100 pmol/μl储存液,再从储存液中取出用双蒸水稀释的20 pmol/μl工作液,最后将工作液分装进入多个小管后,同储存液一起放入-20℃冰箱中保存以备用。先用5个样品进行实验,获得满意扩增效果的条件才确定为最终使用条件。PCR反应总体系为25μl,其中10× CoralLoad PCR Buffer(QIAGEN)2.5μl,25 mmol MgCl20.5μl,dNTP 2μl,正向引物、反向引物各1μl,DNA模板2μl,Taq DNA Polymerase 0.5μl,去离子水15.5μl。按顺序依次加入dNTP、P1、P2、Taq酶和双蒸水,加盖后先放置在振荡器上,振荡30 s,然后再离心30 s。在Mixture中分别加入DNA、10× CoralLoad PCR Buffer(QIAGEN),加样后进行封盖,再离心30 s,开启PCR仪,输入确定的反应条件参数,将样本放入后,自动进行PCR扩增。
1.7 基因分型
PCR反应及电泳法被用来检测SNP的位点。PCR扩增产物纯化后进行直接测序。SNP(rs 10465885)位点由美国生产的ABI3730XL测序仪检测,应用BDv3.0检测试剂盒检测,最后使用Lasergene软件来寻找SNP位点。经琼脂糖凝胶电泳检测,发现目的条带后,Axygen凝胶回收试剂盒纯化,应用第一代测序仪,双脱氧链末端终止法(sanger法)进行测序。测序结果使用Lasergene软件分析
1.8 统计学方法
采用SPSS 19.0统计软件进行数据分析。哈德温伯格平衡(Hardy-Weinberg Equilibrium)检验样本的群体代表性。计数资料、基因型、等位基因频率分布的比较用χ2检验;计量资料之间的比较用t检验和方差分析。房颤危险因素分析使用多因素非条件Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 房颤组和对照组临床资料的比较
房颤组与对照组的年龄和左房直径符合正态分布;房颤组与对照组之间性别、年龄、吸烟、饮酒史差异均无统计学意义,但左房内径(left atrial diameter,LAD)在房颤组高于对照组。见表1。
2.2 PCR结果分析
随机抽取16个PCR样本进行电泳检测。PCR扩增的产物经凝胶电泳后显示一条特异性荧光带,即为目的DNA片段。根据所设计正反向引物之间的碱基对数,该片段长度为250~300 bp,电泳后所示的特异性荧光带符合该长度,故该产物是目的基因(GJA5基因)片段扩增产物。见图1。
2.3 SNP位点的核苷酸序列分析
ABI3730XL测序仪直接测序后使用lasergene软件发现GJA5 rs10465885存在A/G多态性。见图2~4。
2.4 哈德温伯格平衡检验
GJA5基因rs10465885位点AA、AG和GG在房颤组实际分布与预期分布差异无统计学意义;在对照组实际分布与预期分布差异无统计学意义,表明两组研究样本具有群体代表性。见表2。
2.5 GJA5基因rs10465885多态性基因分型分析结果
GJA5基因rs10465885位点位于启动子B区的TATA盒区域。AA基因型分布频率在房颤组高于对照组(P=0.02),GG基因型和AG基因型在两组间差异无统计学意义。见表3。
2.6 GJA5基因rs10465885多态性基因频率比较
GJA5基因rs10465885位点A、G基因频率在房颤组以等位基因A为主,对照组以等位基因G为主,虽然房颤组A基因频率高于对照组,但是差异无统计学意义(χ2=3.227,P=0.072)。见表4。
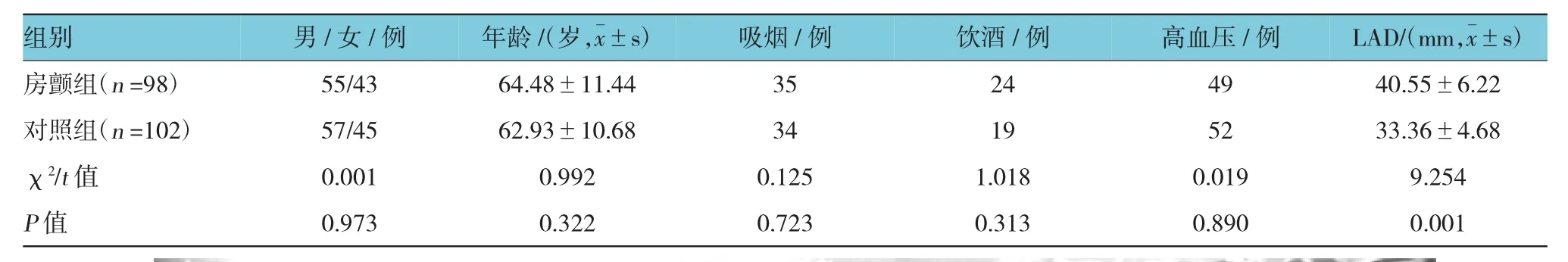
表1 房颤组和对照组临床资料比较
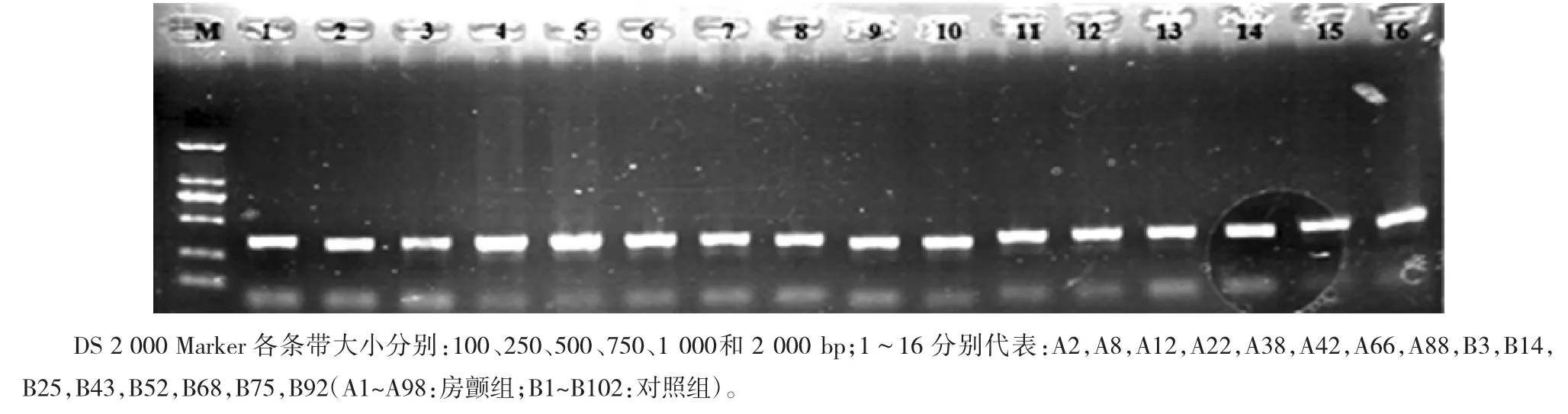
图1GJA5 PCR产物电泳图

图2 基因型AA(标本A1)
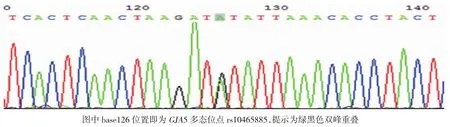
图3 基因型AG(标本A2)

图4 基因型GG(标本A11)
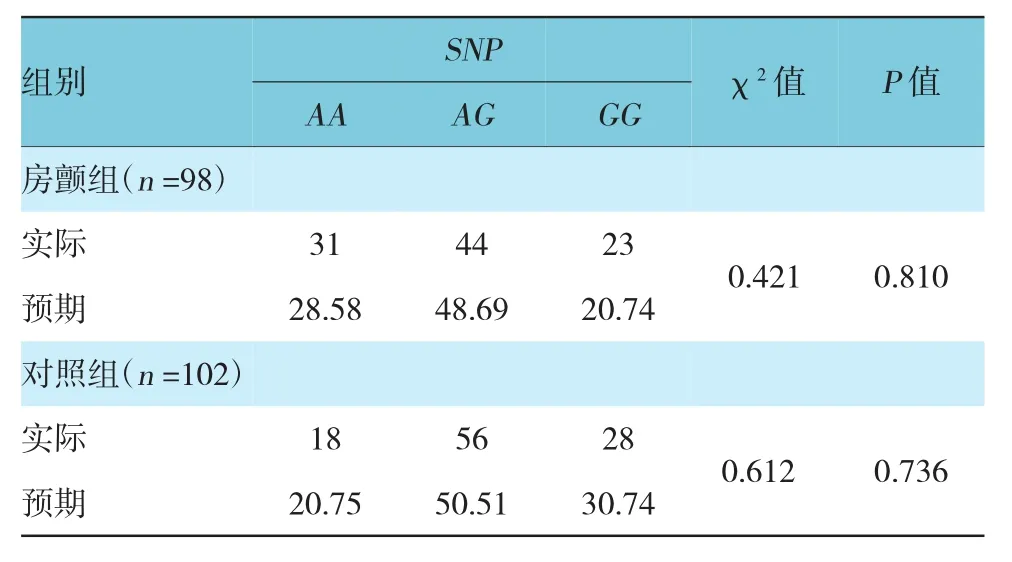
表2 各组间哈德温伯格平衡检验

表3 房颤组与对照组基因分型比较 例(%)
2.7 房颤危险因素的非条件多因素Logistic回归分析
该研究纳入分析的房颤患者危险因素有性别、年龄、吸烟史、饮酒史、LAD及3种基因型。以房颤作为因变量,性别、年龄、吸烟史、饮酒史、LAD及3种基因型作为自变量,分别进行赋值。使用非条件多因素Logistic回归分析,模型的自变量选择Forward:LR法纳入预测变量,自变量的纳入模型的概率水平取0.05,剔除的概率水平为0.1,检验水准取0.05,最终进入回归方程的变量有LAD与基因型AA。见表5。
2.8 GJA5基因rs10465885基因分型与左房直径的关系
对不同基因型患者的左房直径比较使用方差分析,其中AA型49例,AG型99例,GG型52例。3种基因型患者的LAD差异没有统计学意义。见表6。
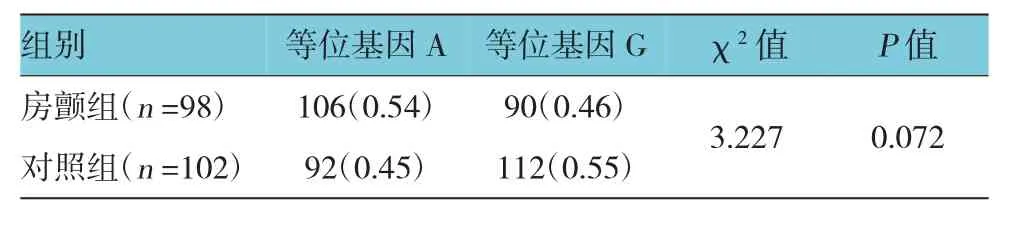
表4 GJA5基因rs10465885多态性基因频率 例(%)
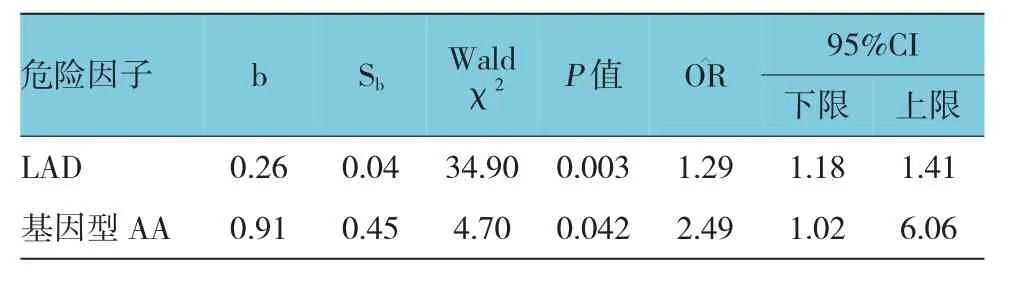
表5 房颤非条件Logistic回归分析
表6 基因型与左房直径关系 (±s)
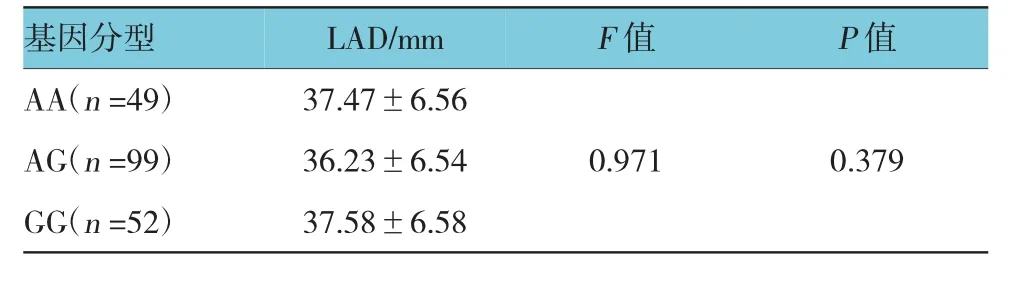
表6 基因型与左房直径关系 (±s)
基因分型LAD/mm F值P值AA(n=49) 37.47±6.56 AG(n=99) 36.23±6.54 0.971 0.379 GG(n=52) 37.58±6.58
3 讨论
Cx40是心房的主要缝隙连接蛋白,和Cx43相比较,它在心房特异性表达,而心室表达量极少[12]。SNP是指在基因组水平上,由单个核苷酸变异引起的DNA序列多态性,这种突变包括错意突变和同义突变[13]。GJA5基因编码 Cx40蛋白是连接蛋白基因家族中重要的一员,因编码蛋白的分子质量为40 kD而得名,定位1q21.1[12]。GJA5基因有2个外显子,外显子1A(100 bp)或1B(132 bp)和外显子2。外显子1A与1B的差异在于5’端非编码区,分别受启动子A和启动子B控制,影响蛋白表达的组织特异性。在心脏中2种连接蛋白40都有表达,并特异地表达于人类心房肌、房室结、His束、左右束支和近端蒲肯野纤维,心室中表达量极少,所有表达的Cx40蛋白均由358个氨基酸组成[12]。
SUN等[14]发现Cx40蛋白基因突变V85I、L221I与房颤相关。与野生型GJA5相比,这2种突变均可以通过调控Cx40蛋白表达来显著增加缝隙连接半通道电流从而增加房颤发生,表明GJA5基因变化与房颤的发病机制具有相关性。WIRKA等[15]发现GJA5基因启动子B区域TATA盒上存在多态位点rs10465885,该位点突变引起Cx40表达下降,并与房颤相关。WIRKA对rs10465885位点的基因分型资料进行荟萃分析,同样得出rs10465885位点与房颤的发生相关。CHRISTOPHERSEN等[16]发现rs10465885与房颤相关,该位点与房颤相关的机制可能是由于该位点通过改变启动子B的TATA盒序列,影响该启动子的活动性,从而使Cx40表达下降,从而诱发房颤的发生。上述研究均表示rs10465885位点的改变通过调整Cx40的表达从而影响房颤的发生。
本研究纳入衡阳地区汉族人群作为研究对象,连续在南华大学附属第一医院随机选取98名持续性房颤患者和102例条件匹配的窦性心律患者,选定 GJA5基因启动子 B区的 TAT A盒子区域rs10465885位点,与房颤进行关联分析。采用准确性最高的直接测序法,发现房颤组AA基因型高于对照组;该结果与加拿大学者CHRISTOPHERSEN等[16]一致,房颤组等位基因A位点频率高于对照组,但差异无统计学意义,可能与本实验样本偏少及人种不同有关。采用多因素非条件Logistic回归分析结果提示:基因型AA携带者患房颤风险是非此基因型的2.49倍;在校正年龄、性别、吸烟饮酒史、高血压病史等因素的影响后,基因型AA仍是衡阳地区汉族人群房颤的危险因素。该结果提示GJA5基因rs10465885AA型可能为衡阳地区汉族人群房颤的易患基因型。
本研究通过3730XL测序仪直接测序后还发现:入选的房颤患者在rs10465885位点存在A/G多态性,分别为AA型、AG型和GG型。LAD增大是房颤发生的危险因素,为了明确该位点不同基因型和左房直径之间是否存在关联,对房颤患者不同基因型及其对应的LAD之间做方差分析,其中GG型的LAD略大,但差异没有统计学意义,提示该位点的多态性与房颤患者LAD无关。但也可能是因为LAD的扩大是多因素造成,其改变是多种影响综合引起,亦可能与本实验样本量较小相关。二者之间是否存在关联以及其中的机制,仍需要进一步的研究和扩大样本量。
[1]European Heart Rhythm Association.Guidelines for the management of atrial fibrillation:the task force for the management of atrial fibrillation of the european society of cardiology(ESC)[R]. Europace,2010(10):1360-1420.
[2]EDWARD P A.Sequencing deeper to find the genetic mechanism of atrial fibrillation[J].Heart Rhythm,2014,11(3):458.
[3]HSIEH M H,LIN Y J,WANG H H,et al.Functional charac-terization of atrial electrograms in a pacing-induced heart failure model of atrial fibrillation:importance of regional atrial connexin40 remodeling[J].J Cardiovasc Electrophysiol,2013,24(5): 573-582.
[4]CHALDOUPI S M,LOH P,HAUER R N.The role of connexin 40 in atrial fibrillation[J].Cardiovasc Res,2009,84(1):15-23.
[5]DUPAYS L,MAZURAIS D,RüCKER-MARTIN C.Genomic organization and alternative transcripts of the human Connexin40 gene[J].Gene,2003,305(1):79-90.
[6]BAGWE S,BERENFELD O,VAIDYA D et al.Altered right atrial excitation and propagation in connexin40 knockout mice[J]. Circulation,2005(112):2245-2253.
[7]ROSENBERG M A,DAS S,PINZON P Q et al.A novel transgenic mouse model of cardiac hypertrophy and atrial fibrillation [J].J Atr Fibrillation,2012,2(9):1-15.
[8]ZHOU S H,HE X Z,LIU Q M.et al.Study on the spatial distribution pattern of Cx40 gap junctions in the atria of patients with coronary heart disease[J].Cardiol J,2008,15(1):50-56.
[9]LI J Y,LAI Y J,YEH H I.et al.Atrial gap junctions,NF-kappaB and fibrosis in patients undergoing coronary artery bypass surgery:the relationship with postoperative atrial fibrillation[J] Cardiology,2009,112(2):81-88.
[10]GROENEWEGEN W A,FIROUZI M,BEZZINA C R,et al.A cardiac sodium channel mutation cosegregates with a rare connexin 40 genotype in familial atrial standstill[J].Circ Res,2003 (92):14-22.
[11]FIROUZI M,RAMANNA H,KOK B,et al.Association of human connexin 40 gene polymorphisms with atrial vulnerability as a risk factor for idiopathic atrial fibrillation[J].Circ Res, 2004,95:e29-33.
[12]臧小彪,张树龙.缝隙连接蛋白40和心房颤动[J].心血管病学进展,2011,32(4):554-557.
[13]杨昭庆,洪坤学,褚嘉佑.单核苷酸多态性的研究进展[J].国外医学:遗传学分册,2000,23(1):4-8.
[14]SUN Y,HILLS M D,YE W G,et al.Atrial fibrillation-linked germline GJA5/connexin40 mutants showed an increased hemichannel function[J].PLoS One,2014,19(4):e95125.
[15]WIRKA R C,GORE S,VAN WAGONER D R,et al.A common connexin-40 gene promoter variant affects connexin-40 expression in human atria and is associated with atrial fibrillation [J].Circ Arrhythm Electrophysiol,2011,4(1):87-93.
[16]CHRISTOPHERSEN I E,HOLMEGARD H N,JABBARI J,et al.Rare variants in GJA5 are associated with early-onset lone atrial fibrillation[J].Can J Cardiol,2013,29(1):111-116.
(张西倩 编辑)
Study onCx40gene single nucleotide polymorphism in patients with atrial fibrillation*
Zhi-hong Liang,Ke-cheng Liu,Zhi-hua Quan,Hui-fang Tang (The First Affiliated Hospital of University of South China,Hengyang,Hunan 421000,China)
Objective To discuss the correlations ofCx40gene(GJA5)single nucleotide polymorphism(SNP)with atrial fibrillation.Methods Two hundreds of patients were selected in the Department of Cardiovascular Medicine, the First Affiliated Hospital of University of South China from June 2012 to December 2012 and divided into atrial fibrillation group(98 cases with continuous fibrillation)and control group(102 cases with sinus rhythm).Clinic information of the patients was collected.Left atrial diameters of the patients were collected through chest and cardiac color ultrasonography.DNA was extracted from venous blood.The locus of SNP was detected through PCR and electrophoresis,and directly examined after PCR products were purified.Based on Hardy-Weinberg Equilibrium examination,the genotype and gene frequency of each group were compared.And non-conditional logistic regression analysis was carried out on the risk factors of atrial fibrillation.ResultsGJA5gene rs10465885 had A/G polymorphism.The frequency of allele A and G of the atrial fibrillation group was 0.54 and 0.46 respectively,and that of the control group was 0.45 and 0.55 respectively.In accordance with Hardy-Weinberg Equilibrium examination,the groups complied with the equilibrium.The AA genotype of the arial fibrillation group was significantly higher than that of the control group.There was not significant difference in AG,GG genotype or allele frequency between the two groups.The AA genotype of rs10465885 locus ofGJA5gene(O∧R=2.49)and left atrial diameter(O∧R=1.29)were the risk factors of atrial fibrillation.The genotype ofGJA5gene(rs10465885)had no correlation with the left atrial diameter.Conclusions Gene polymorphism exists at rs10465885 locus ofGJA5gene.AA genotype and left atrial diameter are the risk factors of atrial fibrillation.
GJA5gene;rs10465885;genotype;allele;atrial fibrillation
R394.5
A
2016-12-18
国家自然科学基金(No:30900625)
唐惠芳,E-mail:1132226235@qq.com;Tel:18573405159
10.3969/j.issn.1005-8982.2017.19.006
1005-8982(2017)19-0028-06
