腹膜透析患者心血管钙化的演变及临床意义
2017-09-03程慧栋周婷婷娄丽璇刘志红俞雨生
余 乐 程慧栋 周婷婷 周 岩 娄丽璇 刘志红 俞雨生
腹膜透析患者心血管钙化的演变及临床意义
余 乐 程慧栋 周婷婷 周 岩 娄丽璇 刘志红 俞雨生
目的:动态观察腹膜透析(PD)患者心血管钙化的患病率和演变情况,分析影响钙化的因素及临床意义。 方法:前瞻性观察150例PD患者,评估基线临床特征及心血管钙化的患病率,随访30个月,分别于第0、12和24个月评估钙化的影像学演变。Logistic回归分析影响心血管钙化及进展的相关因素;计算患者的全因或心血管疾病(CVD)死亡率和非致死性心血管事件(CVE)的发生率,分析相关危险因素。 结果:基线时57.3%的患者存在钙化,至随访结束,心血管钙化率升至63.2%,53.5%(61/114)的患者观察到钙化进展。随访中5.3%(8/150)患者死亡,最常见的死因是CVD(75%),CVE的发生率为19.3%。有临床意义钙化患者的全因死亡(P=0.004)和CVD死亡显著高于其他患者(P=0.002)。低蛋白血症及二尖瓣钙化是全因死亡和CVD死亡的独立危险因素;年龄>46岁、低密度脂蛋白胆固醇及冠状动脉钙化+心瓣膜钙化是CVE的独立危险因素。 结论:PD患者合并心血管钙化的患病率较高,病变进展较快,与CVD的发生有着密切的联系,心血管钙化对整体预后产生不良影响。
腹膜透析 心血管钙化 演变 预后
随着慢性肾脏病(CKD)的进展,矿物质代谢紊乱导致的钙磷代谢异常、继发性甲状旁腺亢进、骨成分和结构的改变及心血管和软组织钙化日显突出,KDIGO将此类病理生理变化称为慢性肾脏病-矿物质和骨异常(CKD-MBD)[1]。CKD患者较正常人群血管和瓣膜钙化的发病风险增高,钙化程度加重,且钙化进展加快[2-4],而心血管钙化或钙化进展是CKD患者心血管和全因死亡的独立危险因素[2,5-8]。目前国内关于腹膜透析(PD)人群心血管钙化的研究大多入组患者较少、随访时间常短,对这类患者的临床特点及预后缺乏客观认识。为此,我们以PD患者作为观察对象,进行单中心前瞻性观察性研究,旨在调查PD患者心血管钙化的患病率和进展情况,并探讨其影响因素及对预后的影响。
对象和方法
研究对象 选取2013年12月至 2014年8月在南京总医院国家肾脏疾病临床医学研究中心行PD治疗的患者。入选标准:(1)年龄≥18周岁,性别不限;(2)已规律PD治疗≥6个月的终末期肾病(ESRD)患者;(3)自愿加入本研究并签署知情同意书。排除标准:(1)预期寿命<6个月或存在已经证实的恶性肿瘤;(2)合并急性肾损伤;(3)活动性炎症性疾病;(4)甲状旁腺切除术后;(5)影响钙、软组织钙化的伴随疾病;(6)妊娠、哺乳期妇女,或计划在6个月内怀孕的妇女;(7)不能进行动脉、瓣膜钙化检测或结果不可靠的患者(如心律失常、截肢或严重的周围血管病变)。当患者行肾移植或改行血液透析(HD)时即退出本研究。
方法 研究共入组150例PD患者,每6个月随访1次,共随访30个月。记录患者基线和随访中的一般情况、物理体检、药物治疗、透析状况和实验室检查结果。分别于第0、12和24个月进行心血管钙化的影像学评估。应用多层螺旋CT计算冠状动脉钙化积分(CACS,Agatston方法)[9],腹部侧位平片计算腹主动脉钙化积分(AACS,Kauppila方法)[10],超声心动图检测到在二尖瓣、主动脉瓣有超过1 mm厚的强回声,即认为存在心脏瓣膜钙化(CVC)[11]。由于轻度冠状动脉钙化(CAC)、轻度腹主动脉钙化(AAC)发生心血管疾病(CVD)的风险非常低,目前认为CACS>100分、AACS≥5分有临床意义[12-13]。因此在本研究中,当出现CACS>100、AACS≥5、CVC中任意1种或多种情况时,定义为临床有意义钙化;反之,当出现CACS≤100+无AAC+无CVC、无CAC+AACS<5+无CVC或CACS≤100+AACS<5+无CVC中任意1种情况时,定义为有钙化但无临床意义。钙化进展定义为两次影像学检查发现新钙化的出现或原有钙化积分的增加;随访终点事件为死亡和CVE。
统计学分析 采用SPSS 22软件进行统计学分析,所有假设检验使用显著性水平为0.05的双侧检验。正态计量资料以均数±标准差表示;偏态资料以中位数(四分位间距)表示;分类变量以频数和频率表示。连续变量选择t检验或秩和检验进行组间比较;分类变量组间比较采用卡方检验或Fisher精确检验。影响心血管钙化及进展的相关因素通过Logistic回归进行分析;进行钙化进展的相关分析时,对应连续变量,使用每个参数随访周期的平均值进行分析。采用Kaplan-Meier方法分析终点事件,并用Log-rank进行显著性检验,COX回归分析心血管钙化等因素对预后的影响。P<0.05为差异有统计学意义。
结 果
基线临床特征 150例患者中男性69例(46%),女性81例(54%)。平均年龄46.7±13.4岁,平均透析龄39.6±21.7月。采用持续不卧床腹膜透析(CAPD)及日间不卧床腹膜透析(DAPD)模式的患者分别为16例(10.7%)和133例(88.6%),1例(0.7%)采用自动化腹膜透析(APD);所有患者均使用PD4(钙离子浓度1.25 mmol/L)透析液。ESRD病因:未经肾活检的患者中慢性肾小球肾炎72例(48%),非肾小球肾炎12例(8.0%);经活检的患者中IgA肾病36例(24%),高血压肾损害10例(6.7%),糖尿病肾病6例(4%),其他14例(9.3%)。150例患者基线临床特征详见表1。
心血管钙化的演变及影响因素 基线86例(57.3%)患者存在心血管钙化,其中58例(38.7%)患者的钙化有临床意义。至随访结束,总钙化率升至63.2%(72/114),在61例(53.5%)患者中观察到钙化进展,150例患者中有36例(24%)患者缺乏第二次心血管钙化影像学数据。
影响心血管钙化的因素 Logistic回归显示年龄是所有钙化发生的独立危险因素。此外,透析龄和糖尿病是CACS>100的独立危险因素,标准蛋白分解率(nPCR)是保护因素;高磷是AACS≥5的独立危险因素;CVC的独立危险因素还包括透析龄和踝部收缩压(表2)。
影响心血管钙化进展的因素 Logistic回归分析影响心血管钙化进展的相关因素(表3)。年龄及透析方式(CAPD)是CAC进展的独立危险因素;AAC进展的独立危险因素为高敏C反应蛋白(hs-CRP)水平,而残余肾功能(RRF)和25(OH)D3水平则是AAC进展的保护因素;血清钙、全段甲状旁腺激素(iPTH)水平及收缩压是CVC进展的独立危险因素。
心血管钙化与远期预后 至随访结束,150例患者中有16例改行HD,9例接受肾移植,5例在随访期间行甲状旁腺切除术,8例失随访,8例(5.3%)患者在随访期间死亡,其中6例死于CVD(3例猝死,2例脑出血,1例心脏衰竭),非CVD死亡2例(1例肝功能衰竭及肺部感染,1例放弃治疗),29例(19.3%)发生非致死性心血管事件。
按基线时是否有有临床意义钙化将患者分组,以全因或CVD死亡为终点事件,采用时序检验进行比较,两组的生存曲线分布差别都有统计学意义(全因死亡,P=0.004;CVD死亡:P=0.002)。以非致死性心血管事件为终点分析,两组差别无统计学意义(图1)。

表1 腹膜透析患者基线时的临床资料
LVMI:左室质量指数;iPTH:全段甲状旁腺激素;HDL:高密度脂蛋白胆固醇;LDL:低密度脂蛋白胆固醇;rGFR:残余肾小球滤过率;Kt/V:尿素清除指数;Ccr;肌酐清除率;nPCR:标准蛋白分解率;*:与全无钙化组比较,P<0.05;**:与临床有意义钙化组比较,P<0.05

表2 影响PD患者心血管钙化相关因素的Logistic分析(n=150)
PD:腹膜透析;CACS:冠状动脉钙化积分;AACS:腹主动脉钙化积分;CVC:心脏瓣膜钙化;nPCR:标准蛋白分解率;高磷:血清磷 >1.78 mmol/L

表3 影响PD患者心血管钙化进展相关因素的Logistic分析(n=114)
PD:腹膜透析;CAC:冠状动脉钙化;AAC:腹主动脉钙化;CVC:心脏瓣膜钙化;rGFR:残余肾小球滤过率;iPTH:全段甲状旁腺激素
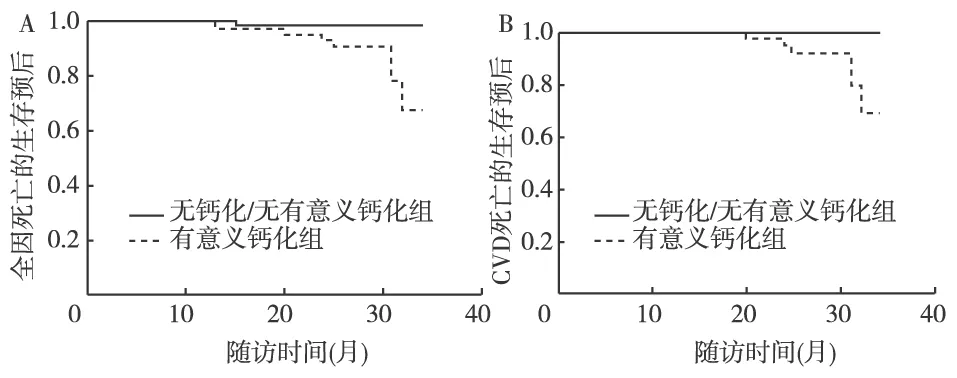
图1 不同程度钙化组患者生存曲线的比较A:有意义钙化组和无钙化/无有意义钙化组相比,基于全因死亡的生存曲线分布有统计学差异;B:有意义钙化组和无钙化/无有意义钙化组相比,基于CVD、死亡的生存曲线分布有统计学差异
随访期间患者的全因死亡、CVD死亡、CVE与血清钙、磷或iPTH的基线水平无显著相关。
以是否存在CAC进展、AAC进展、CVC进展及总的钙化进展将114例患者分别进行分组,结果显示上述四种钙化的进展与全因死亡、CVD死亡及非致死性心血管事件均无明显相关。
终点事件的相关危险因素分析 多因素COX回归分析显示,低蛋白血症及二尖瓣钙化是全因死亡和CVD死亡的独立危险因素。对非致死性心血管事件,年龄>46岁,高低密度脂蛋白胆固醇及CAC+CVC是其独立危险因素(表4)。

表4 终点事件的相关危险因素COX回归分析(n=150)
低蛋白血症:血清白蛋白<35g/L;LDL:低密度脂蛋白胆固醇;CAC:冠状动脉钙化;CVC:心脏瓣膜钙化
讨 论
随着CKD的进展,患者CKD-MBD的症状和体征呈进行性上升趋势,研究表明这些病变可增加全因死亡和CVD死亡风险[14]。因此,钙磷代谢在心血管事件中的作用越来越引起重视。但是,国内涉及PD患者的数据很少。本研究系刘志红院士等领导的中国多中心CKD患者血管钙化负荷研究[15]的一部分及延伸,研究方法先进,所获结果可靠性强。结果显示PD患者中心血管钙化较为常见,并且呈持续进展态势。基线时57.3%的患者存在钙化, 30个月随访结束时心血管钙化率升至63.2%,在半数以上的患者中观察到钙化进展,有5.3%的患者死亡。Gallieni等[16]研究490例PD患者的发现,77%的患者基线时存在心血管钙化,随访36个月心血管钙化率升至90%,73%的患者钙化进展,11%的患者死亡[16],所得心血管钙化的发生率、钙化进展率及死亡率均高于本研究。我们分析认为,PD治疗因长期暴露于标准钙透析液(SCD:钙离子浓度1.75 mmol/L)中,可导致高钙血症的发生,心血管钙化的发生率可能因此较高。体外细胞培养模型或离体模型的相关研究表明[17-18],主动脉钙化需要钙和磷升高,其中钙对主动脉钙化的影响较磷酸盐可能更深远。一项小型非随机研究表明PD液中的钙离子浓度影响动脉硬化的进展[19]。张炯等[20]已证实采用低钙透析液(LCD:钙离子浓度1.25 mmol/L)行PD治疗可能减少心血管钙化的发生率及钙化进展。在Gallieni等[16]的研究中,29.8%的PD患者使用SCD,68.6%使用LCD,另有1.4%使用浓度为1.5 mmol/L的透析液,而本研究所有患者均使用LCD,这可能是本研究患者心血管钙化的发生率、进展率及死亡率均较低的原因。PD透析液的高钙暴露在血管钙化中的作用值得进一步研究。
本项研究入组患者较少、随访时间短可能是导致低死亡率和低CVE发病率的重要因素。另外本研究中未详尽调查患者CVD住院率、住院时间及心血管重复住院率。钙磷代谢研究需要进一步的临床和观察性试验,只有揭示了更多的CVD和死亡的风险因素,才能更好地确定最佳治疗方案。
1 Kidney Disease:Improving Global Outcomes (KDIGO) CKD-MBD Work Group.KDIGO clinical practice guideline for the diagnosis,evaluation,prevention,and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD).Kidney Int Suppl,2009,(113):s1-130.
2 Sigrist MK,Taal MW,Bungay P,et al.Progressive Vascular Calcification over 2 Years Is Associated with Arterial Stiffening and Increased Mortality in Patients with Stages 4 and 5 Chronic Kidney Disease.Clin J Am Soc Nephrol,2007,2(6):1241-1248.
3 Russo D,Corrao S,Miranda I,et al.Progression of Coronary Artery Calcification in Predialysis Patients.Am J Nephrol,2007,27(2):152-158.
4 Kronenberg F,Mündle M,Längle M.Prevalence and progression of peripheral arterial calcifications in patients with ESRD.Am J Kidney Dis,2003;41(1):140-148.
5 Okuno S,Ishimura E,Kitatani K,et al.Presence of abdominal aortic calcification is significantly associated with all-cause and cardiovascular mortality in maintenance hemodialysis patients.Am J Kidney Dis,2007,49(3):417-425.
6 Sharma R,Pellerin D,Gaze DC,et al.Mitral annular calcification predicts mortality and coronary artery disease in end stage renal disease.Atherosclerosis,2007,191(2):348-354.
7 Russo D,Corrao S,Battaglia Y,et al.Progression of coronary artery calcification and cardiac events in patients with chronic renal disease not receiving dialysis.Kidney Int,2011,80(1):112-118.
8 Verbeke F,Van Biesen W,Honkanen E,et al.Prognostic value of aortic stiffness and calcification for cardiovascular events and mortality in dialysis patients:outcome of the calcification outcome in renal disease (CORD) study.Clin J Am Soc Nephrol,2011,6(1):153-159.
9 Agatston AS,Janowitz WR,Hildner FJ,et al.Quantification of coronary artery calcium using ultrafast computed tomography.J Am Coll Cardiol,1990,15(4):827-832.
10 Kauppila LI,Polak JF,Cupples LA,et al.New indices to classify location,severity and progression of calcific lesions in the abdominal aorta:a 25-year follow-up study.Atherosclerosis,1997,132(2):245-250.
11 Wong M,Tei C,Shah PM.Sensitivity and specificity of two-dimensional echocardiography in the detection of valvular calcification.Chest,1983,84(4):423-427.
12 Xiao DM,Wu Q,Fan WF,et al.Effect of serum FGF-23,MGP and fetuin-A on calcium-phosphate metabolism in maintenance hemodialysis patients.Hemodial Int,2013,17(4):483-492.
13 An WS,Lee SM,Park TH,et al.Association between diastolic dysfunction by color tissue Doppler imaging and vascular calcification on plain radiographs in dialysis patients.Kidney Blood Press Res,2012,35(6):619-626.
14 Blacher J,Guerin AP,Pannier B,et al.Arterial calcifications,arterial stiffness,and cardiovascular risk in end-stage renal disease.Hypertension,2001,38(4):938-942.
15 Liu ZH; China Dialysis Calcification Study (CDCS) Group.Vascular calcification burden of Chinese patients with chronic kidney disease:methodology of a cohort study.BMC Nephrol,2015,16:129.
16 Gallieni M,Caputo F,Filippini A,et al.Prevalence and progression of cardiovascular calcifications in peritoneal dialysis patients:A prospective study.Bone,2012,51(3):332-337.
17 Shroff RC,McNair R,Figg N,et al.Dialysis Accelerates Medial Vascular Calcification in Part by Triggering Smooth Muscle Cell Apoptosis.Circulation,2008,118(17):1748-1757.
18 Lomashvili K,Garg P,O’Neill WC.Chemical and hormonal determinants of vascular calcification in vitro.Kidney Int,2006,69(8):1464-1470.
19 Demirci MS,Ozkahya M,Asci G,et al.The influence of dialysate calcium on progression of arterial stiffness in peritoneal dialysis patients.Perit Dial Int,2009,29 (Suppl 2):S15-17.
20 张炯,俞雨生,胡伟新,等.不同腹膜透析液对钙磷代谢的影响.肾脏病与透析肾移植杂志,2007,16(4):329-335.
(本文编辑 律 舟)
Evolution of cardiovascular calcification and clinical significance in peritoneal dialysis patients
YULe,CHENGHuidong,ZHOUTingting,ZHOUYan,LOULixuan,LIUZhihong,YUYusheng
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
YUYusheng(E-mail:yuyusheng@medmail.com.cn)
Objective:To dynamically observe the morbidity and evolution of cardiovascular calcification in peritoneal dialysis (PD) patients, and to analyze the factors influencing calcification and its clinical significance. Methodology:One hundred fifty PD patients were enrolled in a prospectively study. Their baseline clinical features and the morbidity of cardiovascular calcification were assessed. The durations of follow-up were 30 months. The calcification was assessed at 0, 12 and 24 months, respectively. The Logistic regression was used to analysis factors affecting cardiovascular calcification and progression. The Kaplan-Meier method was used to calculate the all-cause mortality, cardiovascular disease (CVD) mortality and nonfatal cardiovascular events (CVE), and COX regression analysis was associated with the risk factors. Results:57.3% of patients had calcification at baseline, and at the end of follow-up, the cardiovascular calcification rate increased to 63.2%, and calcification progression was observed in 53.5% of patients. 5.3% of patients died during follow-up, the most common cause of death was CVD (75%), and the incidence of CVE was 19.3%. The all-cause mortality (P=0.004) and CVD mortality (P=0.002) were significantly higher in patients with clinically significant calcification than in other patients. Hypoalbuminemia and mitral calcification are independent risk factors for all-cause mortality and CVD mortality. Age more than 46 years, low-density lipoprotein cholesterol and coronary artery calcification + heart valve calcification were independent risk factors for CVE. Conclusion:PD patients with high morbidity of cardiovascular calcification and the progression of calcification was rapid. Cardiovascular calcification may be closely related to the occurrence of CVD events, and it could be negative effects on prognosis.
peritoneal dialysis cardiovascular calcification evolution prognosis
10.3969/j.issn.1006-298X.2017.04.006
国家重点研发计划课题(2016YFC0904103);国家科技支撑计划课题(2015BAI12B09,2015BAI12B02)
南京大学医学院附属金陵医院(南京总医院)肾脏科 硕士研究生(余 乐)国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
俞雨生(E-mail:yuyusheng@medmail.com.cn)
2017-03-06
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有
