高热、无尿、神志不清
2017-09-03许书添郭锦洲李世军
孙 丹 许书添 郭锦洲 李世军
·临床集锦·
高热、无尿、神志不清
孙 丹 许书添 郭锦洲 李世军
44岁男性,赴非洲务工人员,寒战、高热5d后出现无尿、意识不清,迅速进展为多器官功能不全综合征。血涂片找到疟原虫环状体。肾活检病理示间质性炎性细胞浸润及小管炎伴小管急性损伤。最终诊断重症疟疾,多器官功能不全综合征,急性肾损伤。
重症疟疾 急性肾损伤 多器官功能不全综合征
病例摘要
现病史 44岁男性患者,因“寒战、高热1周后,少尿、血清肌酐(SCr)升高17d”入院。
患者2016-04-13出现寒战、发热伴乏力、纳差,体温最高40℃。当地医院以输注利巴韦林、左氧氟沙星、维生素C及补液等治疗3d,体温降至38℃以下,仍感乏力、纳差,恶心、呕吐胃内容物数次。18日尿量减少(约200 ml/d),尿色初为黄色,不断加深,后呈黑色,当晚19时出现神志不清,呼之不应,无抽搐,无口吐白沫,无大、小便失禁。19日当地医院查血涂片疟原虫阳性;C反应蛋白(CRP)213.53 mg/L,血红蛋白(Hb)84 g/L,血小板27×109/L,降钙素原>100 ng/ml,SCr 249.7 μmol/L,总胆红素463.5 μmol/L,直接胆红素220.46 μmol/L,谷丙转氨酶16 U/L,谷草转氨酶26 U/L,乳酸脱氢酶347 U/L;尿常规:隐血++,蛋白±。予血浆2 500 ml置换后续以间断床边连续性静脉-静脉血液滤过(CVVH)治疗(共6次,末次5月3日),青蒿琥酯120 mg/d×6d抗疟原虫,先后予头孢曲松、哌拉西林、左氧氟沙星、头孢噻肟抗感染,输注血小板、红细胞悬液及洗涤红细胞,并予护肝及、退热(复方氨林巴比妥158 mg×1支)、羟乙基淀粉(500 ml×1支)及大剂量维生素C(0.5g×45支)等治疗。21日早晨5时神志转清,无肢体偏瘫,体温降至正常范围。25日复查血疟原虫阴性。5月3日复查Hb 67 g/L,血小板231×109/L,总胆红素40.85 μmol/L,直接胆红素24.44 μmol/L,SCr 488.3 μmol/L,仍贫血、持续无尿(20~30 ml/d),于2016-05-04收入院。
既往史及个人史 1992年行阑尾切除术。2011年至非洲安哥拉工作,常受蚊虫叮咬,同年曾出现寒战、高热,疑似疟疾,未抽血检查,口服抗疟药后症状消失。2016-04-01回国探亲。吸烟20年,25支/d。偶有饮酒。否认高血压、糖尿病病史。否认肝炎、结核病史。家族史无特殊。
体格检查 体温37.4℃,血压 146/66 mmHg。神清,精神萎。双肺未闻及干湿啰音。心音有力,律齐,未及杂音。右下腹可见长约10 cm陈旧手术疤痕,腹软、肝脾肋下未及。右侧股静脉置管在位通畅,双下肢中度水肿。
实验室检查
尿液 尿蛋白0.13 g/24h(尿量100 ml),红细胞32.1/μl,5.8/HPF,非均一型小红细胞,白细胞+++;C3和α2m正常,NAG酶311.7 U/g·Cr,RB蛋白30 mg/L,尿溶菌酶4.01 mg/L,尿渗量325 mOsm/(kg·H2O)。滤过钠排泄分数16.7%。尿游离血红蛋白 160 mg/L。
血液 Hb 56 g/L,红细胞计数1.86×106/mm3,白细胞计数12.5×109/L,中性粒/淋巴79.3%/11.3%,血小板计数179×109/L,网织红细胞3.16%,CRP 108.9 mg/L。血清白蛋白25.9 g/L,球蛋白31.2 g/L,尿素氮25.7 mmol/L,SCr 607 μmol/L,尿酸 265 μmol/L,总胆红素21.6 μmol/L,谷丙转氨酶39 U/L,谷草转氨酶22 U/L,乳酸脱氢酶710 U/L,总胆固醇2.15 mmol/L,三酰甘油0.9 mmol/L,钠140.1 mmol/L,钾5.4 mmol/L,氯101 mmol/L,总二氧化碳22.4 mmol/L,钙2 mmol/L,磷2.1 mmol/L。
免疫学 ANA 1:128,其余自身抗体阴性。补体正常,H因子正常范围。免疫球蛋白:IgG 18 g/L,IgA 1.06 g/L,IgM 1.29 g/L,IgE 55.7 IU/ml。ASO及RF正常。外周血淋巴细胞亚群CD3+378个/μl,CD4+145个/μl,CD8+106个/μl,CD19+111个/μl,CD20+112个/μl,Treg 7个/μl。乙肝两对半:HBsAb+,传染病四项均阴性。
溶血检查 游离血红蛋白301.2 mg/L(正常0~300 mg/L)。直接、间接coombs试验,血清酸化溶血及红细胞碎片阴性。血清结合珠蛋白正常。
内皮功能 血管细胞黏附分子(VCAM)2 760.41 ng/ml(300~1 000 ng/ml),血栓调节蛋白14.26 ng/ml(3.5~5.8 ng/ml),E-选择素129.42 ng/ml(35~65 ng/ml),循环内皮细胞 15个/ml。ADAMTS13活性检测445.1 ng/ml(424~1 098 ng/ml)。
病原学检查 血培养阴性。血厌氧菌培养:阴性。血疟原虫检查(5月4日)阴性,(5月13日、23日)找到疟原虫环状体。
影像学检查
肾脏B超 双肾B超见肾脏肿胀明显。左肾:107 mm×54 mm×53 mm;右肾:110 mm×52 mm×55 mm。双肾见数个点状强回声,未见后声影。双肾轮廓规则,包膜连续完整,双肾内未见肾盂肾盏扩张。
其他辅助检查 腹部B超:肝囊肿,胆囊胆汁淤积,胰脾未见异常。胸部CT:两肺炎症。头颅MRI:未见明显异常。
治疗经过 患者入院后予抗感染,输注红细胞悬液改善贫血,甲泼尼龙40 mg/d,床边CRRT等处理。5月12日患者体温升至38.9℃,5月13日血涂片找到疟原虫环状体(图1),上报市疾控中心,在其指导下予青蒿琥酯注射剂(120 mg/次,第0、12、24、48h静推)抗疟原虫,用药24h后,体温降至正常范围,复查血疟原虫连续3日阴性。20日尿量逐渐增多至2 720 ml,SCr降至552 μmol/L,尿素氮降至23.9 mmol/L,摆脱透析。5月23日体温再次升至38.6℃,复查血再次找到疟原虫环状体,再次上报市疾控中心,予青蒿琥酯注射剂(剂量方案同前)联合磷酸伯氨喹片(39.6 mg/d×8d)抗疟原虫,用药24h后,体温降至正常范围,复查血疟原虫转阴。25日拔除右颈内静脉置管。27日转普通病房。30日SCr降至202.4 μmol/L(图2)。
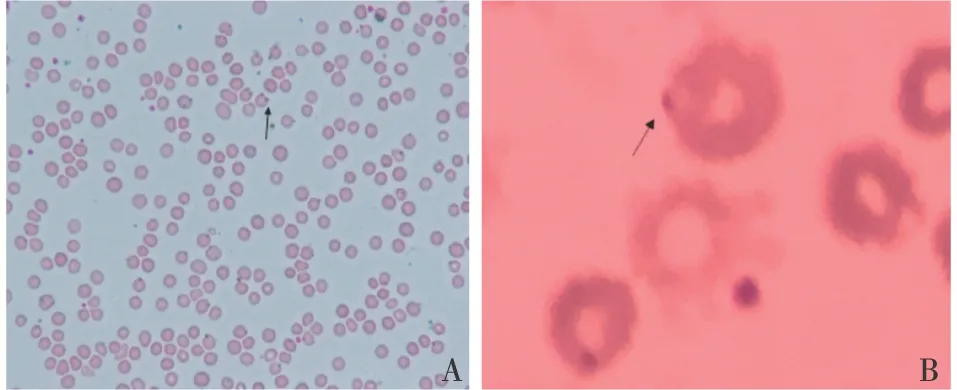
图1 疟原虫环状体(↑)被寄生红细胞大小正常;环状体纤细,位于红细胞边缘,大小约红细胞直径1/5,核1~2个;考虑恶性疟原虫(A:薄血膜,×100;B:薄血膜,×400)

图2 患者血红蛋白、血小板、尿量、血清肌酐变化情况
诊疗分析
病史特点 (1)有疟疾病疫源地(非洲)生活史;(2)起病表现高热、寒战、乏力、纳差;(3)血涂片找到疟原虫环状体,形态学提示恶性疟疾;(4)肾脏损害表现少尿、黑尿,SCr迅速升高;(5)病程中出现神志不清、胆红素升高、贫血、血小板降低等多脏器损害表现。综上,患者重症疟疾诊断明确。患者急性肾损伤(AKI)表现突出,需考虑以下原因。
(1)溶血尿毒综合征(HUS):HUS可由感染、多种毒素、抗内皮细胞抗体、药物等多种因素诱发,这些因素致内皮损伤是发病的关键。本患者疟疾诊断明确,疟原虫可造成内皮细胞损伤,且实验室检查提示AKI、溶血性贫血、血小板降低,内皮损伤指标高,临床诊断HUS成立。
(2)肾含铁血黄素沉着导致的AKI:含铁血黄素沉着症是肾功能损伤的常见原因,多见于血管内溶血、心脏瓣膜病患者。本例患者有血管内溶血、黑尿表现,需考虑含铁血黄素沉积可能。
(3)药物相关肾损害:患者病程中有使用羟乙基淀粉、大剂量维生素C等药物病史,药物相关肾损害不能除外。但患者用药之前即存在肾功能损害,考虑药物系加重肾功能损害的原因之一。
(4)重症疟疾致AKI(MAKI):疟疾可通过多种机制造成肾功能损害:本例患者病初有呕吐纳差,可致循环血容量不足;高热、全身性炎症反应释放大量炎性介质和血管活性物质,可导致血流动力学紊乱、AKI和多器官功能障碍综合征;受感染的红细胞破裂,堵塞肾小管;病程中曾有高胆红素血症,亦可直接损伤肾小管。
因患者肾功能恢复较慢,为进一步明确肾脏损害特点行肾活检。
肾活检病理
光镜 12个肾小球中2个球性废弃,1个节段硬化。余正切肾小球体积增大,节段系膜区轻度增宽,囊壁节段增厚(图3A)。PASM-Masson:阴性。肾小管间质慢性病变合并急性病变中度(图3B),灶性小管萎缩,较多小管炎上皮细胞胞质内及管腔内见偏振光下具有折光性的结晶(图3C),管腔内见蛋白管型及颗粒管型,皮质区间质纤维化+,髓质区间质增宽纤维化++~+++(图3D)。含铁血黄素染色阴性。
免疫荧光 阴性。
电镜 观察1个肾小球。间质散在炎性浸润。超微结构观察肾小管间质急性损伤明显。肾小球基膜厚380~870 nm,偶见基膜与基膜紧贴,未见电子致密物沉积。肾小球足细胞足突融合10%~20%。肾小球毛细血管袢开放好,袢腔内偶见淋巴细胞浸润。
最后诊断 (1)重症疟疾(输入型恶性疟疾)(累及脑、肾、肝脏、血液系统);(2)急性间质性肾炎伴急性肾小管损伤,AKI 3期;(3)多器官功能障碍综合征。
随访 2016-06-10再次出现疟疾发作,给予青蒿素片治疗。2016-08-25复查尿蛋白定量0.62 g/24h(尿量1 800 ml),SCr 166.2 μmol/L,尿酸444 μmol/L,Hb 124 g/L,血小板226×109/L。2016-11-24复查尿蛋白0.44 g/d(尿量1 200 ml),SCr 127.3 μmol/L,尿酸511 μmol/L。
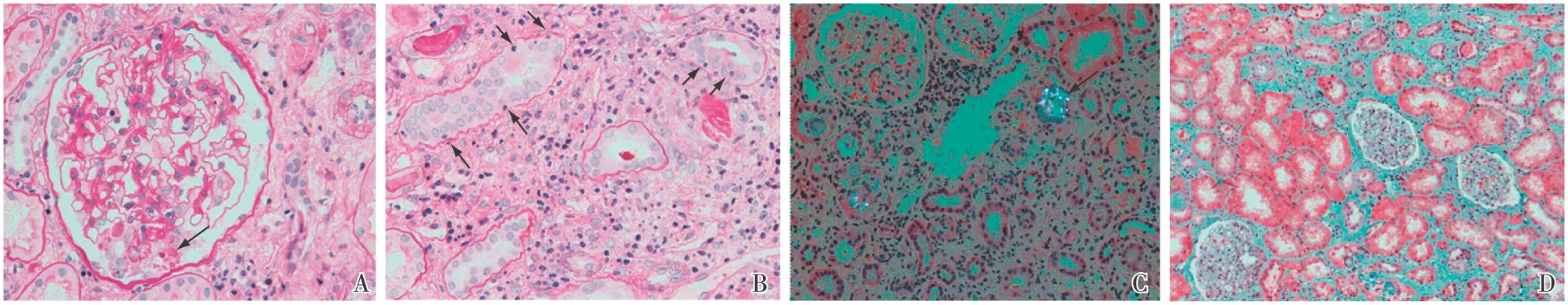
图3 A:肾小球节段硬化,硬化周围足细胞肿胀,胞质内见PAS阳性透明滴(↑)(PAS,×400);B:肾间质区域增宽,单个核细胞浸润,较多小管炎(↑)(PAS,×400);C:肾小管上皮细胞胞质及管腔内见偏振光下具有折光性的结晶(↑)(HE,×200);D:皮质区肾间质增宽,轻度纤维化(Masson三色,×200)
讨 论
疟疾主要流行于热带及亚热带,是全球致死率最高的寄生虫病。据世界卫生组织(WHO)《2016全球疟疾报告》,2015年全球报道疟疾病例2.12亿例,其中90%来自非洲,其次为东南亚(7%)和地中海地区(2%)。死亡42.9万人,99%为儿童[1]。近年来,随着外出务工和国际交流的增加,我国输入型疟疾病例急剧增加,2014年报道本土病例仅67例,而输入型病例达2 854例[2]。输入型病例以男性青壮年为主,主要来自东南亚(以间日疟为主,发病高峰5~6月)及非洲(以恶性疟疾为主,全年发病)[3]。
疟疾治疗不及时或不彻底,可迅速进展为重症或复杂性疟疾(表1)。引起重症或复杂性疟疾的多为恶性疟,其次为间日疟,三日疟和卵形疟则很少出现。重症疟疾进展迅速,数小时内即造成患者死亡。未予及时治疗,死亡率达100%;予及时、有效地治疗,死亡率可降至10%~20%[4]。该患者早期诊治不及时,发病后1周内出现少尿,SCr及胆红素升高,意识障碍等多器官功能不全表现,重症疟疾明确。
AKI是疟疾较严重的并发症,可单独发生或为多器官功能损害的一部分。MAKI发生率13%~17.8%,死亡率11.9%~29%[5]。最典型的三联征为贫血、黄疸和肾衰竭。其他临床症状包括少尿或无尿(60%~70%),脑型疟疾、电解质紊乱等[5]。MAKI机制目前尚未完全的明确,可能原因包括被疟原虫寄生的红细胞机械堵塞、高胆红素血症直接毒副作用、有效循环血容量不足、细胞因子释放、免疫复合物沉积、肾脏微循环毛细血管网损害等(图4)[6]。有个案报道疟疾可致HUS或血栓性微血管病。疟原虫可损伤内皮细胞,是导致血栓性微血管病的可能原因[7-8]。肾活检病理可见肾皮质坏死、寡免疫复合物沉积的系膜增生性肾小球肾炎、膜性肾病和急性肾小管坏死[9]。大部分MAKI患者肾功能可完全恢复,15%的患者肾功能部分恢复或需行维持性血液透析。影响肾脏预后的因素包括诊治的延误及合并多脏器功能衰竭等[5]。

表1 重症或复杂性疟疾诊断标准[4]
2016年WHO指南认为出现以上任意一项即可诊断重症或复杂性疟疾
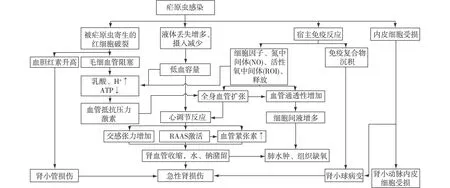
图4 重症疟疾致急性肾损伤的发生机制[6]
本例患者以高热大汗、纳差起病,造成液体摄入不足及丢失过多,有效循环血容量不足,可导致肾前性肾功能损害。后患者迅速出现多脏器功能不全,致血管紧张素、血管升压素等多种缩血管因子释放,收缩肾血管,造成肾组织的缺血、缺氧。疟疾发作时,寄生于红细胞内的疟原虫造成大量细胞被破坏,一方面机械堵塞肾毛细血管网及肾小管,另一方面造成高胆红素血症,直接损伤肾小管。另外,患者病程中使用羟乙基淀粉、大量维生素C等药物,造成草酸结晶沉积,但结晶分布并不广泛,考虑结晶性肾病系肾功能损害的加重因素。综上,该患者AKI考虑疟疾感染导致的全身性炎症和内皮细胞损伤、血管活性物质释放、有效循环血容量不足、肾毒性药物使用等多因素所致。患者随访时肾功能仍未完全恢复正常,可能与初始肾损伤程度较重、存在多重致病因素及病程中疟疾多次再燃等因素有关。
疟疾经治疗临床症状消失后可出现再燃或复发。再燃指疟疾患者在经过一定的治疗或机体免疫力等因素作用下,发作停止,但体内尚存少量红细胞内的疟原虫。无新感染,经数周到数月(<2个月),红细胞内残存的疟原虫再次大量增殖,再次出现临床症状。再燃与宿主抵抗力和特异性免疫力的下降及疟原虫的抗原变异有关。感染人体的四种疟原虫均可发生再燃,特点为发作比先前症状轻,发作次数少,配子体出现率高。疟疾复发指疟疾患者在适当治疗后,停止发作,症状消失,外周血中已检测不出疟原虫,在无新感染的情况下,肝细胞内休眠子,经过数月至年余休眠后复苏,进行裂体增殖,引起肝细胞破裂,产生的肝细胞内期裂殖子侵入红细胞内进行大量繁殖,再次出现疟疾症状。仅见于间日疟、卵形疟[4,10]。本例患者数月内疟疾多次发作,每次发作症状均比前次轻,考虑为疟疾再燃。
目前WHO抗疟疾治疗首推青蒿琥酯为基础的联合治疗[11]。疟疾一旦确诊,需立即使用足量高效抗疟药物。对于重症或复杂性疟疾,治疗首要目的为降低死亡率,其次为减少致残率及防止再发。2016年,英国疟疾治疗指南建议肠外给予高剂量抗疟药物。首选青蒿琥酯,推荐剂量为2.4 mg/kg,分别于第0、12、24h使用一次,24h后每日一次,静脉给药,至少使用24h,最多使用5d。同时予以呼吸、循环支持,防止肺水肿、电解质紊乱,输血、控制癫痫发作等对症支持治疗[10]。AKI的治疗原则为加强管理,及时予肾脏替代治疗和避免使用肾毒性药物[12]。对于出现溶血尿毒综合征的患者,早期血浆置换可达血液学完全缓解[8]。疟疾再燃患者,可再次予青蒿琥酯或联合其他药物治疗[10]。伯氨喹为杀灭肝细胞内休眠子最有效的药物,为预防疟疾复发的首选药物,标准疗程为15 mg/d,连用14d[10]。
小结:本文报道了输入型重症疟疾合并AKI,多器官功能不全患者。近年来,我国输入型疟疾病例呈增多趋势,延误诊治可迅速进展为重症疟疾,出现多器官功能障碍,死亡率极高,远期预后差。治疗不及时或者不彻底易导致疟疾再燃或复发。目前,临床医师对输入型疟疾的警惕性及重症疟疾危害性认识不足,治疗方案仍有欠缺,需加强改进。
1 World Malaria Report 2016.http://www.who.int/malaria/publications/world-malaria-report-2016/en/
2 Sun JL,Lai SJ,Zhang ZK,et al.Comparison of demographical characteristics of malaria cases from malaria control to elimination in China Zhonghua Yu Fang Yi Xue Za Zhi,2016,50(4):296-301.
3 夏志贵,杨曼尼和张少森.2011年全国输入性疟疾病例流行病学分析.中华疾病控制杂志,2014,18(3):226-230.
4 Guidelines for the Treatment of Malaria-3rd Edition.http://apps.who.int/medicinedocs/en/m/abstract/Js21839en/
5 Shukla VS,Singh RG,Rathore SS,et al.Outcome of malaria-associated acute kidney injury: a prospective study from a single center.Ren Fail,2013,35(6):801-805.
6 Mishra SK,Das BS.Malaria and acute kidney injury.Semin Nephrol,2008,28(4):395-408.
7 Sinha A,Singh G,Bhat AS et al.Thrombotic microangiopathy and acute kidney injury following vivax malaria.Clin Exp Nephrol,2013,17(1):66-72.
8 Keskar VS,Jamale TE,Hase NK.Hemolytic uremic syndrome associated with Plasmodium vivax malaria successfully treated with plasma exchange.Indian J Nephrol,2014,24(1):35-37.
9 Kanodia KV,Shah PR,Vanikar AV,et al.Malaria Induced Acute Renal Failure: a Single Center Experience.Saudi J Kidney Dis Transpl,2010,21(6):1088-1091.
10 Lalloo DG,Shingadia D,Bell DJ,et al.UK malaria treatment guidelines 2016.J Infect,2016,72(6):635-649.
11 Updateon artemisinin and ACT resistance.http://www.who.int/malaria/publications/atoz/update-artemisinin-resistance-october2016/en/
12 Das BS.Renal failure in malaria.J Vector Borne Dis,2008,45(2):83-97.
(本文编辑 律 舟 凡 心)
Hyperpyrexia,oliguria and obnubilation
SUNDan,XUShutian,GUOJinzhou,LIShijun
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
A 44 year-old man who had worked in Africa,presented with chills and persisted fever,progressing to multiple organ dysfunction rapidly. His blood test found ring-stage Plasmodium. The kidney biopsy revealed interstitial inflammatory cellular infiltration and tubulitis with acute tubular injury. The final diagnosis for the case was severe malaria,acute kidney injury(AKI),multiple organ dysfunction syndrome(MODS).
severe malaria acute kidney injury multiple organ dysfunction syndrome
10.3969/j.issn.1006-298X.2017.04.021
南京大学医学院附属金陵医院(南京总医院)肾脏科硕士研究生(孙 丹)国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2017-03-15
