乳腺癌组织中miR-210表达与分子分型的相关性分析
2017-09-03陈庆峰胡海燕
李 云,吴 琍,陈庆峰,胡海燕
(1.山东青岛大学医学院附属医院乳腺外科,山东 青岛 266003;2.山东青岛大学医学院生物化学与分子生物学教研室,山东 青岛 266003)
乳腺癌组织中miR-210表达与分子分型的相关性分析
李 云1,吴 琍1,陈庆峰2,胡海燕2
(1.山东青岛大学医学院附属医院乳腺外科,山东 青岛 266003;2.山东青岛大学医学院生物化学与分子生物学教研室,山东 青岛 266003)
目的观察乳腺癌组织中miRNA-210的表达水平,分析其与乳腺癌临床病理中肿瘤分子亚型的关系。方法收集本院确诊的50例浸润性乳腺癌患者经手术切除的乳腺癌组织标本及正常乳腺组织(距癌肿边缘>5cm),采用实时定量RT-RCR(qRT-PCR)法检测miRNA-210表达水平,收集对应乳腺癌患者的临床病理资料,分析乳腺癌组织中miRNA-210与肿瘤分子分型的关系。结果浸润性乳腺癌组织中miRNA-210在HER-2高表达型乳腺癌组织中表达最高,其次是三阴型乳腺癌,在LuminalB型的两个分型中表达相似,在LuminalA型中表达最低,差异有统计学意义(P<0.05)。浸润性乳腺癌组中miRNA-210表达与患者年龄、肿瘤大小、组织分级及病理分期等方面的差异无统计学意义(P>0.05),因此与其他临床病理参数无关。结论miRNA-210在乳腺癌组织不同分子分型中表达水平不同,且与乳腺癌分子分型相关,可以作为乳腺癌分子分型诊断的参考及三阴型乳腺癌治疗的新突破。
浸润性乳腺癌;miR-210;分子亚型
同阶段的乳腺癌患者对疾病的治疗反应和总体结果明显不同,根据乳腺恶性肿瘤的临床表现不能最准确的进行对乳腺癌的分类及转移的预测[1]。近年来,乳腺癌个体化治疗已逐渐取代了常规的乳腺癌手术治疗方式,针对不同分子分型的乳腺癌个体化治疗研究也随之开展。参照1996年美国乳腺癌协会制定的《乳腺癌诊疗指南》,将其分子分型分为:①LuminalB(B1型):ki67≥20%,ER+和/或PR<20%,HER2-,满足ki67≥14%或PR-低表达中任意一项时,复发风险高;②HER2+(B2型):ER+和/或PR+、HER2高表达;③LuminalA型:HER2-,ER+或PR+,ki67<14%,复发风险较低;④HER2+型:ER-和PR-,HER2+;⑤基底样型/三阴性型:ER-、PR-和HER2-;⑥其他特殊类型乳腺癌[2]。miRNA是21–25个核苷酸长的非编码RNA,在转录后水平调控基因表达结合非编码区(3utrs)或开放阅读靶基因的框架,导致靶mRNA降解或抑制mRNA的翻译[3]。miR-210是Fockens JA等发现的与乳腺癌相关的miRNA,乳腺癌的转移复发也与之密切相关,也是非转移性乳腺癌预后较差的标志之一[4]。
本实验结合国内外相关文献报道的miRNA表达情况,应用RT-RCR(qRT-PCR)法对50例浸润性乳腺癌及其癌胖正常乳腺组织的miRNA-210进行定量分析,进一步探究其与临床病理中癌组织病理分子分型的关系。以期在临床工作中进行更加精准的进行乳腺癌个体化治疗并对治疗效果与复发转移的概率进行预测。
1 资料与方法
1.1 临床资料
留取50例自2015年10月~2016年7月于我院行乳腺切除手术的病人乳癌组织标本,经病理证实均为浸润性乳腺癌。术中同时留取相应癌旁正常乳腺组织(距癌肿边缘>5 cm)作为对照。患者均为女性,年龄24~69岁。所有患者术前均未行放化疗及内分泌治疗。符合以上条件者方可入组。标本均于-80℃低温冰箱储存备用。收集入组乳腺癌患者临床病理报告中相关数据。
1.2 试剂
mircute mRNA第一链cDNA合成盒、miRcute miRNA 提取试剂盒、mircute miRNA的检测盒(SYBR Green)均购自天根生物科技有限公司。
1.3 方法
1.3.1 引物设计
Real Time PCR检测目的基因引物。
1.3.2 提取样本总RNA
a.样品处理:在液氮环境下磨碎组织,每30~50 mg组织加1 ml 裂解液MZ,用匀浆仪进行匀浆处理,样品体积<裂解液MZ体积的十分之一。
b.将上述样品在室温下放置5 min,待蛋白核酸复合物分离完全。C.缓缓注入200 μl四氯化碳,密封,摇晃15 sec后常温静置5 min。d.4℃ 12,000 rpm (~13,400×g) 离心15 min,把水相转移到新管中。e.量取转移液的体积,加入0.43倍转移液体积的无水酒精,混匀(此时溶液可能出现浑浊)。将制得的混合物转入吸附柱中,室温12,000 rpm(~13,400×g)进行30 sec的离心后弃掉吸附柱miRspin,取剩余液体。f.量取剩余液体的体积,注入其0.75倍体积的无水酒精,混匀(此时溶液可能出现浑浊)。将得到混合物加进吸附柱miRelute中,离心条件如上,离心后弃掉流出液,保留吸附柱miRelute。
1.3.3 RNA电泳
在电泳凝胶中,取5 μlRNA进行电泳,检测RNA完整程度。
1.3.4 反转录
①miRNA 3' 末端进行加Poly (A)处理
②预先冷处理的RNase Free water反应管内加入总体积为20 μl 的以下物品( E.coli Poly(A) Polymerase最后加)。见表1。

表1 反转录底物的配制
③移液器轻轻混匀上述配制的反应液,短暂离心后在37℃反应1 h。
④Poly (A)修饰的miRNA 进行逆转录反应。
⑤按照表2组分进行反应液的配制。

表2 反应液的配制
⑥以上反应液配置好之后使用移液器吹打,6000 rpm离心20 s,离心后在37℃下反应1 h,cDNA反应液保存于-20℃条件下。
1.3.5 RealTime-PCR
(1)分析方法及相关仪器
使用2-△△CT法对数据进行相对定量分析,仪器采用荧光定量PCR仪,
(2)操作流程
①反应体系的设置:实验操作流程均严格按照产品说明书进行。见表3。

表3 反应体系
②样品RealTimePCR检测
在上述条件下扩增目的基因引物及内参基因引物。同时在60-95℃进行溶解曲线分析。见表4。
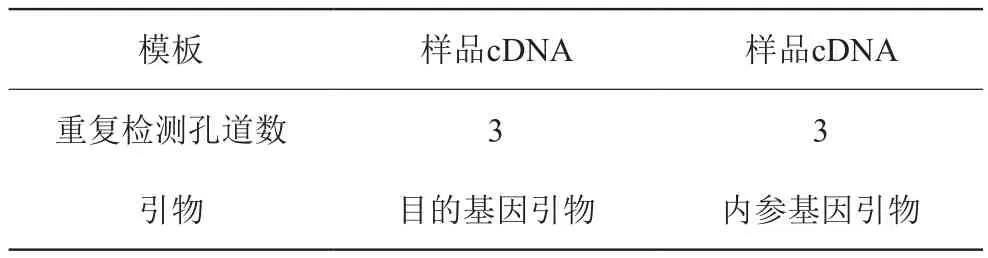
表4 样品RealTimePCR检测设计
1.4 统计学处理
本次实验中所有数据,采用SPSS 22.0统计软件进行分析,多组数据均以“均数±标准差”表示,行t检验,多组变量间比较采用单因素方差分析,结果为P<0.05,差异有统计学意义。
2 结 果
2.1 miRNA-210在乳腺癌组织中的表达水平
本实验采用实时定量PCR技术,检测50例浸润性乳腺癌患者癌组织与正常乳腺组织(距癌肿边缘>5cm)中miRNA-210的表达情况,结果显示患者两组标本组织中目的基因均能检测到,且扩增曲线良好,扩增率较高,见图1、图2。其中两组miRNA-210的表达量分别为(4.39±2.86)、(1.94±1.52)μg/ml,差异有统计学意义(t=5.017,P<0.01)
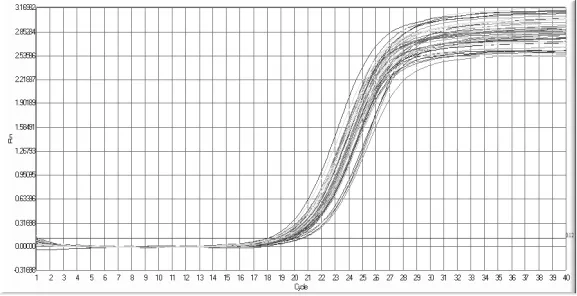
图1 乳腺癌组织扩增曲线
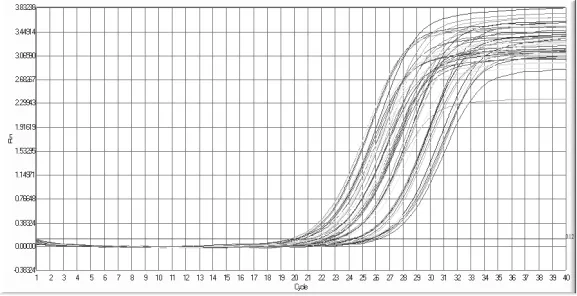
图2 正常组织扩增曲线
2.2 乳腺癌组织中miRNA-210的表达与临床病理因素的关系
根据收集所得入组乳腺癌患者临床病理因素与实验数据比较,得出其与年龄、肿瘤大小、组织分级及病理分期等方面的差异无统计学意义(P>0.05),见表5。
表5 miRNA-210乳腺癌组织表达水平与各临床病理参数的关系(±s)
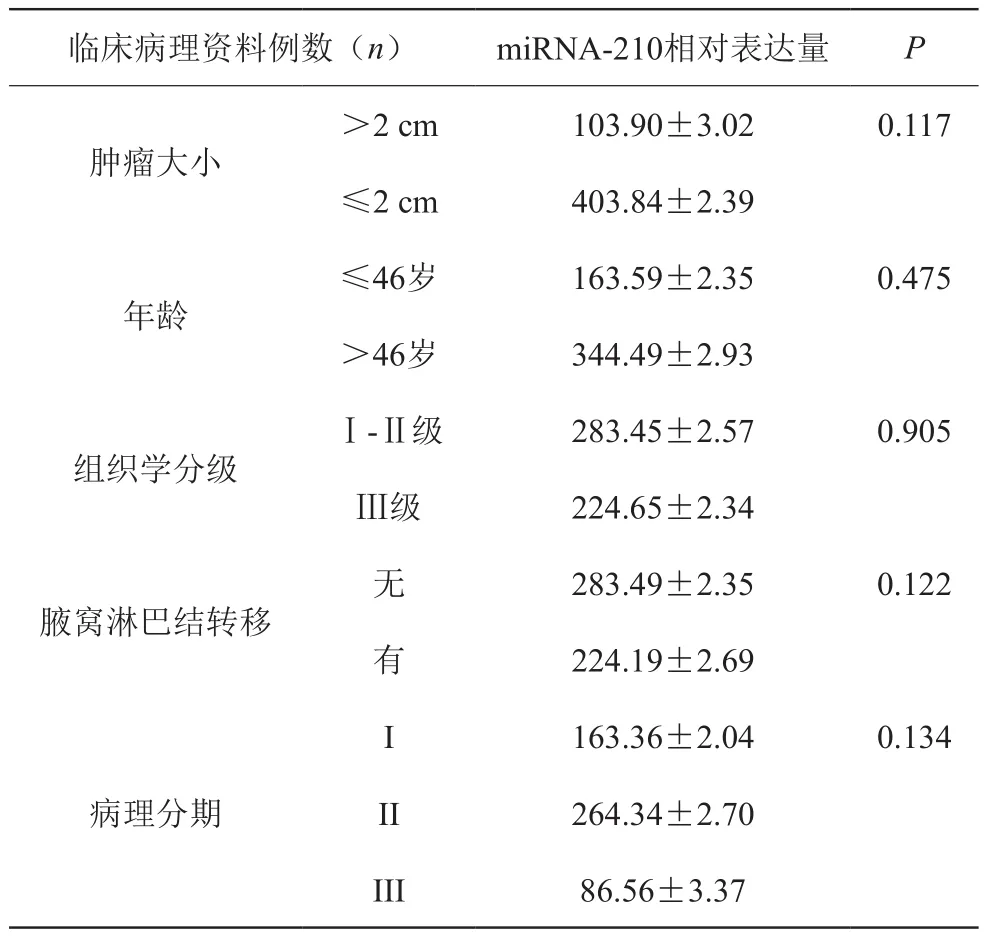
表5 miRNA-210乳腺癌组织表达水平与各临床病理参数的关系(±s)
临床病理资料例数(n) miRNA-210相对表达量 P肿瘤大小>2 cm 103.90±3.02 0.117≤2 cm 403.84±2.39年龄≤46岁 163.59±2.35 0.475>46岁 344.49±2.93组织学分级Ⅰ-Ⅱ级 283.45±2.57 0.905Ⅲ级 224.65±2.34腋窝淋巴结转移无283.49±2.35 0.122有224.19±2.69病理分期I 163.36±2.04 0.134 II 264.34±2.70 III 86.56±3.37
2.3 乳腺癌组织中miRNA-210的表达与分子亚型的关系
miRNA-210在HER-2高表达型乳腺癌组织中表达最高,其次是三阴型乳腺癌,在LuminalB型的两个分型中表达相似,在LuminalA型中表达最低,差异有统计学意义(P<0.05),见表6。
表6 乳腺癌组织中miRNA-210的表达与分子亚型的关系(±s)
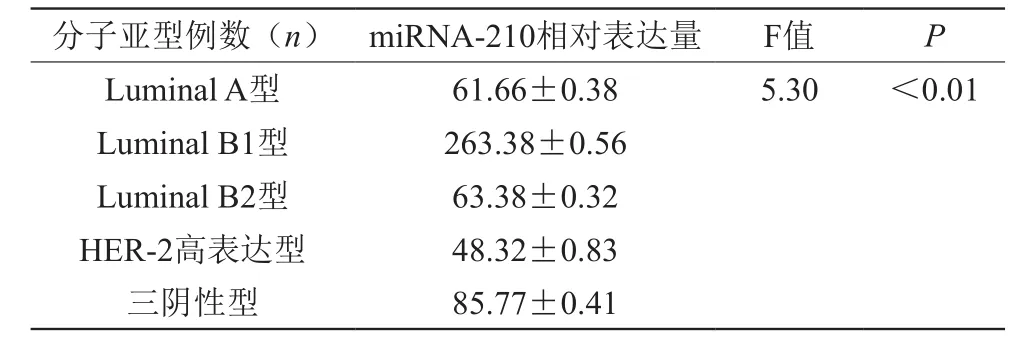
表6 乳腺癌组织中miRNA-210的表达与分子亚型的关系(±s)
分子亚型例数(n) miRNA-210相对表达量 F值 P Luminal A型 61.66±0.38 5.30 <0.01 Luminal B1型 263.38±0.56 Luminal B2型 63.38±0.32 HER-2高表达型 48.32±0.83三阴性型 85.77±0.41 ?
3 讨 论
在大多数亚洲国家,乳腺癌发病率正在迅速增长,与西方女性相比亚洲女性在发病年龄和发病形式上有明显不同。并且在未来20年乳腺癌发病率仍将继续增长。[5]按照乳腺癌基因表达谱和其分子生物学行为,可将乳腺癌分为官腔型、正常乳腺样型、HER-2高表达型和基底细胞样型。[6]这种分型在中国人中同样适合。[7]不同分子亚型的乳腺癌患者治疗方案及预后和复发概率存在明显差异。据文献报道,乳腺癌手术后经临床病理证实ER和PR阳性的患者采用内分泌治疗的有效率高达70%~80%,而ER和PR阴性的患者内分泌治疗有效率低于10%,已不接受激素调控[8]。所以临床病理分期较好的LuminalA型乳腺癌患者甚至可以不需接受术后化疗,仅行内分泌治疗就可达到治疗目的。而激素受体阴性的分型中HER-2过表达型乳腺癌可接受靶向治疗来对局部复发和远处转移进行防控。三阴型乳腺癌的恶性程度在所有分子分型中最高,在手术切除和化疗后仍不能明显降低复发和转移风险,预后最差。
微小RNA在乳腺癌发生发展及肿瘤细胞增殖、侵袭、转移等生物学行为中均起一定作用。部分miRNA作为原癌基因,也有部分作为抑癌基因。据相关研究发现,miRNA-210的启动子可携带乏氧应答原件(HRE),其为缺氧诱导型RNA,HRE由乏氧诱导因子进行识别[9]。癌细胞增殖产生的缺氧条件下,内皮细胞的miRNA-210相关蛋白可被激活,可促进血管内皮生长因子诱导的毛细血管结构形成及迁移[10]。由此可见,miRNA-210高表达与乳腺癌侵袭、增殖和临床不良预后有关[11]。
本研究结果得出miRNA-210在乳腺癌组织中的表达具有一定的规律性,在HER-2高表达型乳腺癌中表达最高,三阴型其次,LumialA型最低。而且与患者的年龄、肿瘤大小、癌组织分级、有无腋窝淋巴结转移及临床病理分期无关。从本实验结果可以看出,乳腺癌组织的miRNA-210的表达与其分子分型相关,有作为乳腺癌分型的参考指标的潜力。而miRNA-210在三阴性乳腺癌中相对高表达,三阴型乳腺癌又是临床治疗上预后最差的分子分型。现有文献表明,人类检测到大量miRNA-210靶点,靶点受体参与乳腺组织的DNA修复、血管结构生成、细胞生存等[12]。因此,miRNA-210在不久的将来可作为乳腺癌治疗的新靶点,改善三阴型乳腺癌患者的预后,在临床治疗工作中获得较大突破。
[1] LJ van,H Dai,MJ van,YD He,AA Hart.Gene expression profiling predicts clinical outcome of breast cancer[J].Nature,2002,415(6871):530.
[2] 黄三钱,钟晶敏,李 晶,刘志红,曾 亮.乳腺癌分子分型的研究进展[J].现代生物医学进展,2016,16(22):4384-4387.
[3] Takahashi RU,Miyazaki H,Ochiya T.The role of mieroRNAs in the regulation of cancer stem cells[J].Front Genet,2014,4(3):295.
[4] 申 曦,孙 强,王常珺,等.乳腺癌相关的miRNA研究进展[J].中华外科杂志,2011,49(6):561-563.
[5] Toi M,Ohashi Y,Seow A,et a1.The Breast Cancer Working Group presentation was divided into three sections:the epidemiology,pathology and treatment of breast cancer.Jpn J Clin Oncol,2010,40 Suppl l:i13-18.
[6] Kurebayashi J.Current clinical trials of endocrine therapy for breast cancer[J].Breast Cancer,2007,14(2):200-214.
[7] sorlie T,Perou CM,Tibshirani R,et al.Gene expression paterns of breast carcinomas distinguish tumor subclasses with clinical implications[J].Proc Natl Acad Sci USA,2001,98(19):10869-10874.
[8] Sorlie T,Tibshirani R,Parker J,etal.Repeated observation of breast tumor subtypes in Independent gene expression data sets [J].Proc Natl Acad Sci USA,2003,100(14):8418-8423.
[9] Huang X,Ding L,Bennewith KL,et al.Hypoxia-inducible miRNA-210 regulates normoxic gene expression involved in tumor initiation[J].Mol Cell,2009,35(6):856-867.
[10] Fasanaro P,D’Alessandra Y,Di Stefano V,et al.MicroRNA-210 modulates endothelial cell response to hypoxia and inhibits the receptor tyrosine kinase ligand ephrin –A3[J].J Biol Chem,2008,283(23):15878-15873.
[11] Rothe F,Ignatidis M,Chaboteaux C,et al.Global microRNA epression profiling identifies miR-210 associated with tumor proliferation ,invasion and poor clinical outcome in breast cancer[j].PloS One,2011,6(6):e20980.
[12] 方 茜,郝岗平.miRNA-210在恶性肿瘤中的研究进展[J].泰山医学院学报,2013,34(5):396-400.
本文编辑:吴 卫
R737.9
B
ISSN.2095-8242.2017.026.4968.03
