丁香酚对金黄色葡菌球菌抗菌作用的探究
2017-09-03马艳玲李海贤曾荣
马艳玲,李海贤,曾荣*
(佛山科学技术学院食品科学与工程学院,广东佛山528231)
丁香酚对金黄色葡菌球菌抗菌作用的探究
马艳玲,李海贤,曾荣*
(佛山科学技术学院食品科学与工程学院,广东佛山528231)
为了寻找代替化学防腐剂的绿色安全天然添加剂,研究了丁香酚对金黄色葡萄球菌的抑菌作用。以丁香酚为原材料,采用96孔板微量稀释法和琼脂平板稀释法确定最低抑菌浓度(M IC)和最低杀菌浓度(MBC),通过菌落数直观地确定丁香酚对金黄色葡萄球菌的M IC值和MBC值;并以分光光度计法探究不同质量浓度丁香酚对金黄色葡萄球菌中苹果酸脱氢酶(MDH)和琥珀酸脱氢酶(SDH)酶活性的影响。结果表明,丁香酚对金黄色葡萄球菌的最低抑制浓度(M IC)为600μg/m L,最低杀菌浓度(MBC)为700μg/m L,其可将金黄色葡萄球菌菌体蛋白质质量浓度、苹果酸脱氢酶(MDH)酶活、琥珀酸脱氢酶(SDH)酶活分别降至0.033mg/m L、8.28 U/mg、2.40U/m L,原因可能是抑制了菌体三羧酸循环和电子链传递中相关关键酶的活性。
丁香酚;金黄色葡萄球菌;抗菌作用;苹果酸脱氢酶;琥珀酸脱氢酶
随着食品安全话题不断受到关注,人们对食品的质量有了更高的要求,不但要求营养,还要求绿色健康。因长期使用化学防腐剂而导致致癌性、致突变性和致畸性等潜在安全问题时有发生[1],同时会对自然界的生态环境造成不利的影响[2]。因此,寻找广谱、高效、低毒、安全的食品防腐剂成为食品领域研究的热点之一。
丁香是桃金娘科蒲桃属植物,原产印尼,是我国进口“南药”之一。其内富含多种活性成分(丁香酚,β-石竹烯等),具有抗氧化、抑菌驱虫和治疗神经痛等功效[3]。其中丁香酚(2-甲氧基-4-(2-丙烯基)苯酚)是丁香精油最主要的抗菌活性成分。国内外有很多关于丁香以及丁香精油的研究:安同伟等[4]采用超临界二氧化碳萃取法提取丁香酚,并通过抑菌试验和动物试验分别检验了丁香酚的抗菌功能和麻醉作用。曾荣等[5]以丁香精油及丁香酚为研究对象,发现丁香精油和丁香酚具有广谱抗菌性,对供试的革兰氏阴性和阳性菌均表现出了较强的抑菌活性,其中对革兰氏阳性菌的抑制效果优于革兰氏阴性菌。FEMANDO L等[6]发现丁香酚对婴儿利什曼原虫有影响。丁香酚作为植物精油的重要活性成分,在生物防腐抑菌方面具有一定的潜力。体外实验研究发现,丁香酚对于多种致病菌有抑制作用[7]。其中革兰氏阳性菌金黄色葡萄球适应性强,是引起食品污染以及细菌性食物中毒的主要来源[8]。
细菌中的苹果酸脱氢酶(malatedehydrogenase,MDH)和琥珀酸脱氢酶(succinate dehydrogenase,SDH)在三羧酸循环和呼吸链中起着重要作用,是三羧酸循环和电子传递链的关键酶,其活性大小直接影响到细菌的生长[9]。因此,本研究以金黄色葡萄球(Staphylococcusaureus)为供试菌,采用96孔板微量法和琼脂平板稀释法探究丁香酚对金葡菌的最低抑制浓度(m inimum inhibition concentration,M IC)和最低杀菌浓度(minimum bactericidal concentration,MBC),并研究丁香酚对细菌体内的苹果酸脱氢酶和琥珀酸脱氢酶酶活性的影响,为探究丁香酚抑菌作用机理提供理论依据。
1 材料与方法
1.1 材料与试剂
丁香酚(纯度≥99%):广州和博生物科技有限公司;金黄色葡萄球菌(Staphylococcus aureus)ATCC25923:广东省微生物研究所菌种保藏中心;吐温80:海麦克林生化科技有限公司;营养琼脂和MH肉汤:青岛高科园海博生物技术有限公司;LB肉汤培养基:生物工程上海有限公司;考马斯亮蓝:上海源聚生物科技有限公司;牛血清蛋白:宝泰克生物科技有限公司;苹果酸脱氢酶试剂盒和琥珀酸脱氢酶试剂盒:南京建成生物工程研究所;氯化钠、磷酸、磷酸氢二钠、磷酸二氢钾等均为国产分析纯。
1.2 仪器与设备
MulitisknalFC型酶标仪、GENESYS10S紫外可见分光光度计:赛默飞世尔(上海)仪器有限公司;HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司。
1.3 实验方法
1.3.1 丁香酚对金黄色葡萄球菌的M IC测定
采用96孔板微量稀释法和琼脂平板稀释法[10-11]。取96孔板,第一列为空白对照(CK),加入MH肉汤200μL,每列的第一个孔加入MH肉汤100μL,第2~10列第1~5个孔加入用肉汤稀释丁香酚,含量分别为1.0mg/m L、0.9mg/m L、0.8mg/m L、0.7mg/m L、0.6mg/m L、0.5mg/m L、0.4mg/m L、0.3mg/m L、0.2mg/m L,每孔100μL,且加入100μL菌悬液,每个孔的菌浓度为5×105CFU/m L(即第2~10列第1个孔为丁香酚空白,第2~10列第2~5个孔为丁香酚样品)。同时设置阳性对照(第11列第1~5个孔加入100μLMH肉汤以及100μL悬菌液)以及试剂实验组(第12列第1~5个孔加入100μLMH肉汤以及100μL吐温)。37℃培养24 h,观察结果。以阳性对照中细菌生长呈浑浊和空白对照透明为前提,观察其他孔内浑浊情况。抑菌率的测定[11]:本试验以轻微模糊或浊度明显减少为判定终点。同时,在酶标仪上读取波长620nm处的吸光度值。抑菌率计算公式如下:

以抑菌率为90%的浓度为最低抑菌浓度(M IC),以抑菌率为99%的浓度为最低杀菌浓度(MBC)[11]。另外采用第二个方法琼脂平板稀释法来测试,用肉汤稀释丁香酚,加入45m L的琼脂中,使其含量分别为0.9mg/m L、0.8mg/m L、0.7mg/m L、0.6mg/m L、0.5mg/m L,再在每一个培养皿中加入10μL菌悬液,37℃培养24h,观察结果,以平板未见菌落的最低丁香酚含量为M IC,实验重复3次。
1.3.2 丁香酚对金黄色葡萄球菌的MBC测定
从96孔板微量稀释法实验中取浊度明显减少的丁香酚样品试液,接种至无菌琼脂中,摇匀,37℃培养24 h,未见菌落生长的为MBC,实验重复3次。
1.3.3 丁香酚对金黄色葡萄球菌体内MDH和SDH酶活性的影响
将金黄色葡萄球菌接分别接入LB培养基和含M IC丁香酚的LB培养基,150 r/min振荡培养24 h,10 000 r/min离心培养液10m in收集菌体,并用磷酸盐缓冲液(phosphate buffered saline,PBS)(pH7.3)洗涤菌体3次,每组设置3个平行样。加入与菌体等体积的2mg/m L的溶菌酶溶液,搅拌后置于37℃水浴锅中,当菌体开始发粘时取出,按照菌体:PBS缓冲液=1∶6(V/V)进行配比,10 000 r/min低温离心10m in,取出上清液备用。按照考马斯亮蓝法测定蛋白含量,以小牛血清蛋白对照[12-13]。按照试剂盒说明书方法进行检测。
MDH酶活测定:于波长340 nm处进行比色,双蒸水调零后,加入50μL上清液,取已预温好的1m L工作液迅速冲入0.5 cm的石英比色皿中,于20s时读吸光度值OD1,反应1min后读取吸光度值OD2;空白对照取50μL双蒸水,加入1m L工作液,其他操作与测定相同,于20 s时读吸光度值A1,反应1m in后读取吸光度值A2。MDH酶活计算公式如下:

SDH酶活测定:于波长600 nm处进行比色,蒸馏水调零后,加入100μL上清液,取已预温好的2.6m L工作液迅速冲入1 cm的比色皿中,于5 s时读吸光度值OD1',反应1 m in后读取吸光度值OD2'。SDH酶活计算公式如下:
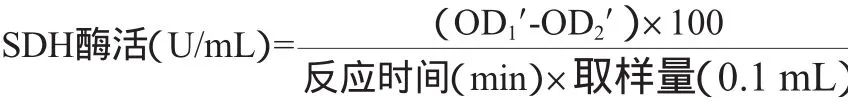
2 结果与分析
2.1 丁香酚对金黄色葡萄球菌M IC和MBC结果
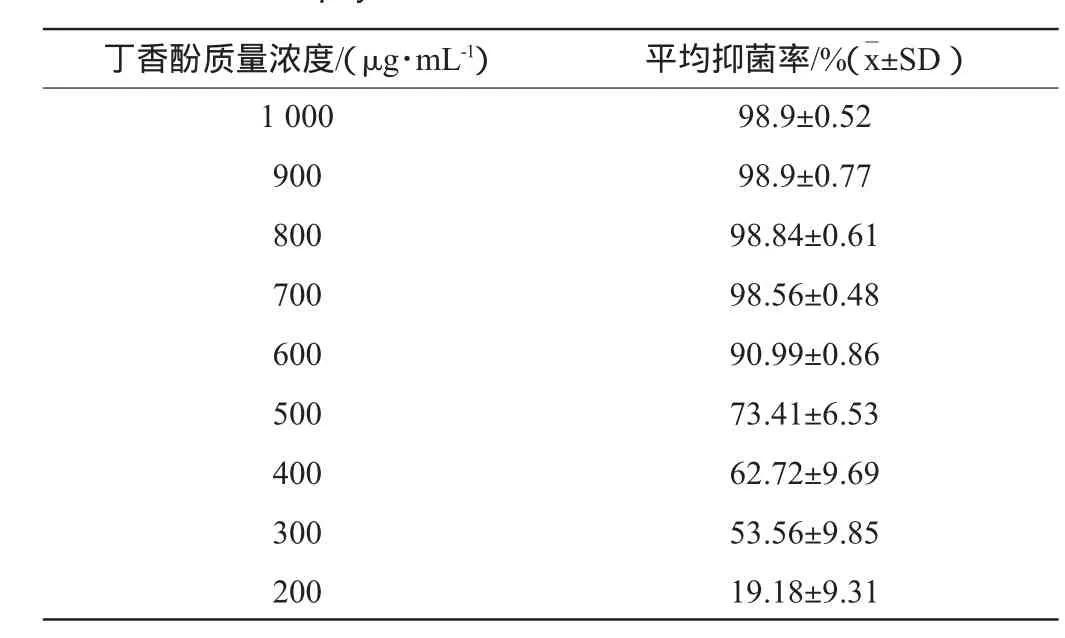
表1 不同质量浓度丁香酚对金黄色葡萄球菌抑菌率的影响Table 1 Effects of different concentrations o f eugeno lon antibacterial rate of Staphylococcus aureus
由分光光度计法检测OD值无显著差异可知,试剂对照组和阳性对照组浑浊程度几乎一致,即说明吐温对照组的菌体生长状态和阳性对照几乎无差别,因此,可忽略丁香酚的溶剂(0.1%吐温)对金黄色葡萄球菌的生长影响。由于菌液的OD值可以衡量菌液中细菌的数目[8],因此OD值的变化可以反应不同浓度的丁香酚对金黄色葡萄球菌的抑菌效果的差异。以OD值为基础,用抑菌率来分析丁香酚对金黄色葡萄球菌的M IC和MBC。根据96孔微量稀释法结果显示(见表1),最低抑菌浓度为600μg/m L,最低杀菌浓度为700μg/m L。
采用琼脂平板法测定M IC和MBC,结果见图1、图2。

图1 不同质量浓度丁香酚对金黄色葡萄球菌的抑菌情况Fig.1 Antibacterialeffectof different concentration of eugenolon Staphylococcus aureus

图2 不同质量浓度丁香酚对金黄色葡萄球菌的杀菌情况Fig.2 Sterilization effect of different concentration of eugenolon S.aureus
由图1、图2可知,与阳性对照相比,丁香酚对金黄色葡萄球菌的最低抑制浓度为600μg/m L,最低杀菌浓度为700μg/m L。在探测不同浓度丁香酚对金葡菌的抑菌实验和杀菌实验中,可以直观看出阳性对照的菌落数比用500μg/m L浓度处理的金葡菌的菌落数多,在600μg/m L质量浓度处理的金葡菌,几乎没有菌落,丁香酚质量浓度700~900μg/m L时,未见有菌落。且可以知道以未加丁香酚的阳性对照为参考,随着作用于金葡菌的丁香酚浓度增大,细菌在平板的密集程度下降。因此,丁香酚对金葡菌抑制作用存在浓度依赖性。
2.2 丁香酚对金葡菌体内蛋白质浓度的影响

表2 丁香酚对金黄色葡萄球菌菌体蛋白质浓度的影响Table 2 Effect of eugenolon protein contents of S.aureus
由表2可知,对照组培养基中金黄色葡萄球菌的蛋白质质量浓度为0.27mg/m L,丁香酚组培养基中金黄色葡萄球菌的蛋白质质量浓度为0.033mg/m L,较对照组降低了87.78%,丁香酚组和对照组的蛋白质质量浓度差异极显著(P<0.01)。丁香酚组与对照组相比,细菌蛋白质浓度降低。
2.3 丁香酚对金葡菌体内MDH酶活力的影响

表3 丁香酚对金黄色葡萄球菌MDH酶活的影响Tab le 3 Effect of eugenolon MDH activity of S.aureus
由表3可知,对照组培养基中金黄色葡萄球菌的MDH酶活力16.93U/mg,丁香酚组培养基中金黄色葡萄球菌的MDH酶活力为8.28 U/mg,较对照组降低了51.10%,丁香酚组和对照组的MDH酶活性差异极显著(P<0.01)。因此丁香酚组与对照组相比,细菌体内MDH酶活性降低。
2.4 丁香酚对金葡菌体内SDH酶活力影响

表4 丁香酚对金黄色葡萄球菌SDH酶活的影响Table 4 Effect of eugenolon SDH activity of S.aureus
由表4可知,对照组培养基中金黄色葡萄球菌的SDH酶活力为4.00U/m L,丁香酚组培养基中金黄色葡萄球菌的SDH酶活力为2.40U/m L,较对照组降低了40.00%,丁香酚组和对照组的SDH酶活性差异显著。丁香酚组与对照组相比,细菌体内SDH酶活性降低。
3 讨论
在20世纪50年代,医药工作者已经开始研究中药抑菌的效果,发现很多中药具有抑菌抗菌的作用。丁香酚具有广谱抑菌效果,能抑制金黄色葡萄球菌、大肠杆菌、灰霉病菌等的生长[5,14-15]。由于丁香酚是天然提取物,具有很高的安全性,与化学防腐剂相比,有着安全无毒、绿色环保的优点。因此,丁香酚在食品工业中得到广泛的研究应用[16-18]。但是对于研发食品防腐剂,不但是探究其抗菌效果,更重要的是了解其抑菌机制。抑菌剂主要的作用机理是:一是作用于细胞壁和生物膜系统,使细胞透性改变,从而使细胞代谢紊乱;二是作用于核酸等遗传物质,导致DNA复制、转录以及表达受到了抑制;三是作用于细菌细胞内的酶系统或功能蛋白,抑制代谢途径。目前的食品防腐剂大多是通过抑制微生物的酶活性而起作用的。
结果表明,丁香酚有效抑制细菌的生长,且具有浓度依赖性。通过对酶活力和蛋白质含量的试验,预测其抑菌机理。首先从丁香酚的化学结构角度来分析,丁香酚是苯酚类,从分子结构上看,丁香酚中含有酚羟基、醚键、碳碳双键,具有酚醚和烯烃性质。苯酚类的结构,酚的羟基氧原子的未共用电子对与苯环的共轭作用,不但使苯酚成稳定化合物,而且也有利于苯酚的离解,然后解离成苯氧负离子,该离子可能与酶中的活性部位形成化学键,进而导致代谢系统紊乱[2]。然后,从酶的角度分析可能存在的抑菌机理。酶是生物大分子,足迹布满相当大的生物膜系统。从丁香酚作用于金黄色葡萄球菌后,苹果酸脱氢酶和琥珀酸脱氢酶酶活力降低,与对照组相比,有显著的差异,特别是苹果酸脱氢酶。苹果酸脱氢酶和琥珀酸脱氢酶都是三羧酸循环的氧化还原酶,是细胞生长代谢和繁殖必需之物。苹果酸脱氢酶和琥珀酸脱氢酶正常能否进行化学反应,会直接影响到三羧酸循环的运行,影响到细胞代谢。因此,从酶活力的角度分析,可能的作用机理是丁香酚影响了这两个酶的分子结构,使其发生了变化,从而改变了构像,使酶活性降低。最后,从丁香酚对金葡菌蛋白浓度的影响结果表现,丁香酚能够抑制部分蛋白质的合成。从蛋白质合成的角度来分析作用机理,可能的作用机理是丁香酚对蛋白质作用于金黄色葡萄球菌后,因为起细胞透性的改变,使得与蛋白合成相关的核酸类物质外泄,进而导致蛋白质的合成受到抑制,并最终导致细胞死亡。
4 结论
丁香酚能抑制金黄色葡萄球菌生长,其最低抑制浓度为600μg/m L,最低杀菌浓度为700μg/m L,其可将金黄色葡萄球菌菌体蛋白质质量浓度、苹果酸脱氢酶(MDH)酶活、琥珀酸脱氢酶(SDH)酶活分别降至0.033mg/m L、8.28U/mg、2.40U/m L。其机理可能是抑制了菌体三羧酸循环和电子链传递中相关关键酶的活性,影响了菌体的正常生长。
[1]许元明,农娟.化学合成食品防腐剂的研究进展[J].山东化工,2016,42(3):37-39.
[2]庄军辉.丁香酚体内外抗氧化作用及其机制研究[D].洛阳:河南科技大学,2014.
[3]楼兴隆,李晓明,张鞍灵,等.丁香油抑菌成分研究[J].西北农业学报,2006,15(3):91-93.
[4]安同伟,陈庆忠,孙建.丁香酚的最优提取方法及药理作用[J].山东畜牧兽医,2013,32(2):5-6.
[5]曾荣,陈金印,林丽超.丁香精油及丁香酚对食品腐败菌的抑菌活性研究[J].江西农业大学学报,2013,35(4):852-857.
[6]DUTRA F L,OLIVEIRA M M,SANTOSR S,el al.Effects of linalool and eugenolon the survivalof Leishmania infantum(L.)chagasiwithin macrophages[J].Acta Tropica,2016,164(8):69-76.
[7]XIEY J,YANG Z L,CAOD Y,el al.Antiterm itic and antifungalactivities of eugenol and its congeners from the flower buds of Syzgium aromaticun(clove)[J].Ind Crop Prod,2015,77(9):780-786.
[8]李彦媚,赵喜红,徐泽智,等.金黄色葡萄球菌引起食物中毒的作用机智与其耐药性的研究进展[J].现代生物医学进展,2011,11(14):2786-2792.
[9]李俊霖,杨晓慧,王腾飞,等.10-HDA对金黄色葡萄球菌的抑菌机理研究[J].中国食品学报,2014,14(12):73-79.
[10]National comm ittee for clinical laboratory standards.Referencemethod forbroth dilution antigungalsusceptibility testing of yeast[M].Tentative Standard M 27T,NationalComm ittee for Clinical Laboratory Standards, 2008:51-56.
[11]COCKERILL F R.Clinical and laboratory standards institute[M]// M 100-S23:performance standards for antimicrobial susceptibility testing:Twenty-third informationalsupplement,2013:32-34.
[12]赵卓,嵇雅茹,籍浩天,等.温度对考马斯亮蓝法测定蛋白质浓度的影响[J].安徽农业科学,2015,43(4):5-7.
[13]贺常亮,张小艺,杨航.金银花提取物对金黄色葡萄球菌的抗菌作用研究[J].贵州畜牧兽医,2013,37(4):11-14.
[14]李姝毅,马秋华,杨蓉娅,等.丁香酚体外抗阿萨希毛孢子菌作用研究[J].中药药理与临床,2013,29(4):61-63.
[15]吕世明,陈杖榴,陈建新,等.丁香酚体外抑菌作用研究[J].食品科学,2008,29(9):122-124.
[16]石晓骏,申霄婵,王芳,等.丁香精油的提取及其对老北京肉肚抑菌作用[J].北京农学院学报,2016,31(1):89-93.
[17]陈梅.丁香精油对番茄采后腐烂抑制作用及成分分析[J].山西农业大学学报:自然科学版,2016,36(9):678-684.
[18]CHEN X N,REN L P,LIM L,et al.Effects of clove essential oil and eugenol on quality and browning control of fresh-cut lettuce[J].Food Chem,2017,214(6):432-439.
Investigation ofantibacterialeffectofeugenolon Staphylococcusaureus
MA Yanling,LIHaixian,ZENG Rong*
(SchoolofFood Science and Engineering,Foshan University,Foshan 528231,China)
In order to seek a green and natural chemical preservatives,the antibacterial effectof eugenol on Staphylococcus aureus was investigated. Using eugenolas raw material,them inimum inhibition concentration(M IC)and them inimum bactericidal concentration(MBC)were confirmed by plate dilution and brothm icrodilutionmethod.The effects of different concentrationsof eugenolonmalic dehydrogenase(MDH)and succinodehydrogenase(SDH)activity were investigated by spectrophotometer.The results showed that the M ICwas 600μg/m land the MBC was700μg/m l.In addition,the protein content,MDH activity and SDH activity of S.aureus could be declined to 0.033mg/m l,8.28 U/mg and 2.40 U/m lafter treated by eugenol.Themain reason forvarietieswas that thekey enzyme for the cell tricarboxylic acid cycleand electron chainwere inhibited by eugenol.
eugenol;Staphylococcusaureus;antibacterialeffect;malatedehydrogenase;succinic dehydrogenase
TS202.3
0254-5071(2017)08-0130-04
10.11882/j.issn.0254-5071.2017.08.028
2017-05-31
广东省自然科学基金项目(2015A030310301)
马艳玲(1986-),女,讲师,博士,研究方向为食品生物技术。
*通讯作者:曾荣(1978-),女,副教授,博士,研究方向为食品生物技术。
