响应面优化龙胆多糖的提取工艺及抗氧化性研究
2017-09-03宫江宁韦元净杨子艺
宫江宁,韦元净,杨子艺
(贵州师范大学化学与材料科学学院,贵州贵阳550001)
响应面优化龙胆多糖的提取工艺及抗氧化性研究
宫江宁,韦元净,杨子艺
(贵州师范大学化学与材料科学学院,贵州贵阳550001)
该研究优化了龙胆草多糖的提取工艺,并对其体外抗氧化活性进行了评价。在单因素试验的基础上,选择醇沉浓度,提取温度,提取时间,液料比为考察因素,以龙胆草多糖提取率为响应值,应用Box-Behnken试验进行四因素三水平设计,采用响应面法来优化龙胆草多糖的提取工艺。并评价龙胆草多糖清除DPPH·﹑ABTS+·﹑OH·﹑O2-·作用以及总还原能力。结果表明,龙胆草多糖的最佳提取工艺为醇沉体积分数为90%,提取时间为2 h,液料比为26∶1(m L∶g),提取温度为75℃;龙胆草多糖的实际提取率为(5.89±0.25)%,与预测值相比,偏差较小。龙胆草多糖有一定的抗氧化活性,但活性均小于同浓度的维生素C。
龙胆草;多糖;响应面试验;抗氧化活性
龙胆草(Gentianascabra Bunge)属于多年生草本植物,又名龙胆﹑地胆草或草龙胆,是龙胆科植物(如条叶龙胆、三花龙胆﹑龙胆或坚龙胆)的干燥的根和茎[1-2]。龙胆草有清热利胆、杀菌、消炎、健胃、保肝等功效[2-4],常作苦味健胃药[5]。在临床上有很多应用,如治疗黄疸型肝炎及慢性胆囊炎、高血压、急性肾盂肾炎、皮肤病、咽炎、慢性支气管炎、上呼吸道感染急性角膜炎等[6-8]。
龙胆草中含有多种化学成分(如环烯醚萜、裂环烯醚萜、苷类、生物碱、黄酮、汕酮、多糖等[2])。其中多糖为龙胆草的有效成分之一,研究发现植物多糖一般对人体无害,并有抗病毒、抗氧化、降血脂、降血糖、抗衰老、抗凝血、提高免疫力和抗肿瘤的效果[4],此外龙胆多糖还具有增效减毒的双重作用[9]。
本研究采用单因素试验和中心复合试验,考察醇沉体积分数、提取温度、提取时间、料液比对多糖提取率的影响,优化龙胆草多糖的水提工艺,并采用维生素C作为阳性对照,考察龙胆草多糖总还原能力以及清除1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)等自由基的能力,以期为龙胆草这一传统中药进一步开发利用和龙胆草多糖的生物活性提供理论依据。
1 材料与方法
1.1 材料与试剂
龙胆草购于贵州济仁堂,产地为贵州。氮-双(3-乙基苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonateacid),ABTS):上海源叶生物科技有限公司;DPPH:上海梯希爱化成工业发展有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
101-1A型电热鼓风干燥箱、FZ102型微型植物粉碎机:天津泰斯特仪器有限公司;A200S型电子天平:德国赛多利斯集团;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂。
1.3 方法
1.3.1 龙胆多糖提取工艺流程

原料的预处理:将龙胆草用去离子水洗净,50℃干燥,粉碎后用体积分数95%的乙醇80℃回流2 h,以脱除油脂、色素、单糖、小分子物质和低聚糖,过滤,将滤渣挥干乙醇后再置于50℃的烘箱中彻底干燥后,密封保存。
多糖的提取:称取10 g龙胆草粉末,加入一定比例的去离子水,置于一定温度的水浴锅中提取一定时间后,先用药筛过滤,再减压过滤,所得滤液减压浓缩至原体积的1/5,加入一定体积的乙醇,放于冰箱中沉淀24 h。过滤,然后依次用无水乙醇、丙酮清洗沉淀,将沉淀放入干燥器中自然干燥,得到龙胆草水提粗多糖[3]。
1.3.2 多糖提取率的计算
按照1.3.1中的方法,改变提取条件,进行单因素和响应面试验,得到干燥的龙胆草粗多糖,放于分析天平上称量,均按照下式计算多糖提取率。

1.3.3 龙胆多糖提取条件的单因素试验
按照1.3.1的提取流程,分别考察不同的提取时间(1.0h、1.5h、2.0h、2.5h、3.0h)、提取温度(50℃、60℃、70℃、80℃、90℃),液料比(10∶1、15∶1、20∶1、25∶1、30∶1)(m L∶g)、乙醇体积分数(50%、60%、70%、80%、90%)对多糖提取率的影响。
1.3.4 响应面试验优化
在单因素试验的基础上,根据Box-Behnken设计原理,选取提取醇沉体积分数(X1)、提取时间(X2)、液料比(X3)、提取温度(X4)4个因素,以龙胆多糖的提取率为响应值,采用4因素3水平的响应面分析法进行试验设计,对龙胆草多糖的提取工艺进行优化。响应面试验因素与水平设计见表1。
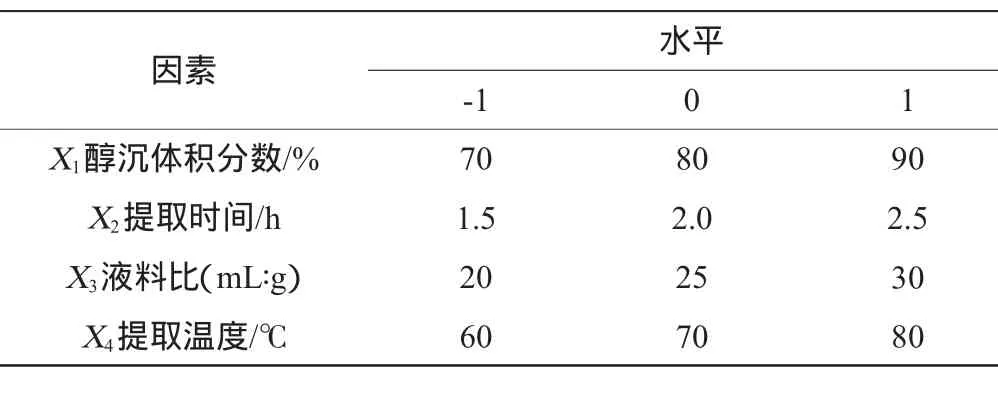
表1 响应面试验优化因素与水平Table 1 Factors and levels of response surface experim ents
1.3.5 龙胆草多糖的抗氧化活性
配制一定浓度的龙胆草多糖溶液,分别用比色法[10-13]检测多糖对DPPH·和ABTS+·的清除能力,采用水杨酸法[14]和邻苯三酚法[15-17]检测多糖对OH·和O2-·的清除能力,普鲁士蓝法[18]检测多糖的总还原能力。同时采用VC溶液做阳性对照,比较两种物质的抗氧化活性。
2 结果与分析
2.1 单因素试验结果
龙胆草多糖的提取时间、温度、液料比、醇沉体积分数对多糖提取率的影响的单因素试验结果见图1。

图1 提取时间(A)、提取温度(B)、液料比(C)、醇沉体积分数(D)对龙胆多糖提取率的影响Fig.1 Effects of extraction time(A),extraction tem perature(B), liquid-solid(C)ratio and alcoholprecipitation concentration (D)on extraction rate of Gentian polysaccharide
由图1A可知,龙胆草多糖提取率随着提取时间的增大,呈现增大的趋势,但当提取时间大于2 h后,提取率的增长幅度趋于平缓。考虑到提取时间过长,浪费能源,且如果提取时间过长,其它成分的溶出量也可能增加,影响到下一步提取分离的难度。所以选择最佳提取时间为2 h。
从图1B可知,在50~70℃范围内,当提取温度升高,多糖提取率提高,但当提取温度高于70℃时,提取率反而略有下降。这有可能是提取温度过高,会导致多糖氧化或使多糖发生部分水解。所以提取温度不能过高,在此选择70℃为最佳提取温度。
由图1C可知,液料比对龙胆草多糖提取率的影响较大。当液料比增大,龙胆草多糖的提取率也随之增大。液料比为10∶1(m L∶g)时,提取率只有1%,而当液料比>30∶1(m L∶g)时,提取率就有3.89%。且当液料比>25∶1(m L∶g)时,提取率增大的幅度趋于平缓。考虑到液料比太大,会增加后续的浓缩工作量,浪费时间和能源,所以选择25∶1(m L∶g)为适宜的液料比。
由图1D可知,醇沉体积分数对提取率的影响也很大,随着醇沉体积分数的增大,提取率显著增加。当醇沉体积分数为50%时,提取率只有1%,而当醇沉体积分数为90%时,提取率有5.6%。当醇沉体积分数>80%以后,提取率增大的幅度不大。考虑到醇沉体积分数过大,加入的乙醇过多,增大成本,所以选80%为最佳乙醇体积分数。
2.2 响应面试验结果
2.2.1 响应面试验设计与结果及方差分析
以多糖提取率为评价指标,响应面试验结果见表2,方差分析见表3。
对表2试验数据进行回归分析,建立二次响应面回归方程为:Y=3.6+1.93X1+0.24X2+0.21X3+0.60X4+0.15X1X2-
由表3可知,回归模型的P<0.000 1,表明该回归模型极显著;失拟项P>0.05,不显著,说明该模型成立。模型的相关系数R2=0.992 5,校正相关系数0,R2和R均较高且接近,说明模型准确性和通用性较高;变异系数(coefficientof variation,CV)值为6.01%<10%,说明试验的可信度与精确度高,拟合程度较好,实验操作可行,可以用此模型来预测龙胆草多糖最佳提取工艺。
该回归模型中的一次项X1、X2、X3、X4,交互项X3X4,二次项对提取率的影响极显著(P<0.01),二次项X2X4对提取率的影响显著(P<0.05)。各因素对龙胆草多糖提取率的影响大小顺序为醇沉体积分数(X1)>提取温度(X4)>提取时间(X2)>液料比(X3)。
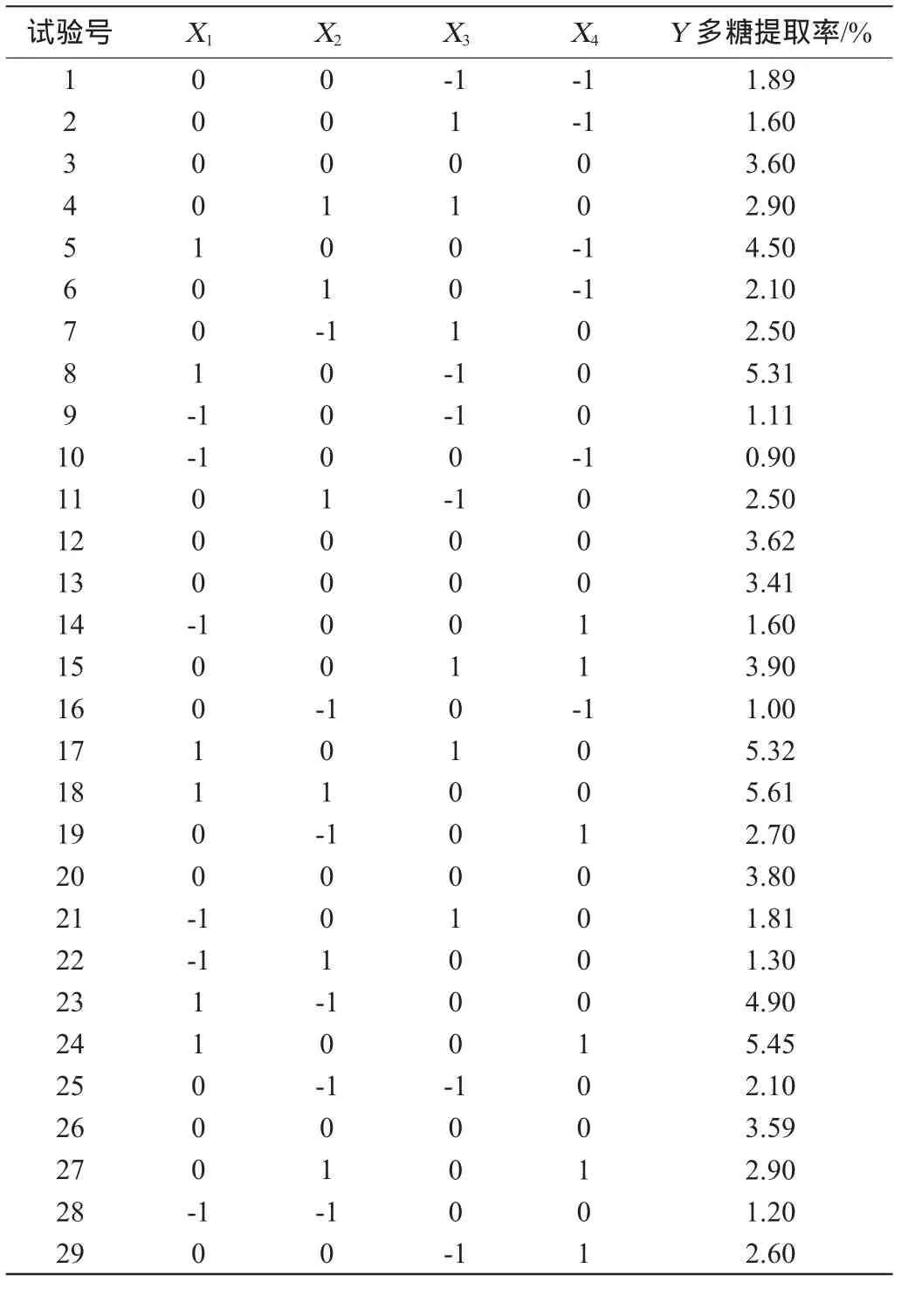
表2 Bex-Behnken试验设计与结果Table 2 Design and resu lts of Bex-Behnken experiments

表3 回归模型方差分析Table 3 Variance analysis of regression mode l
2.2.2 最优提取工艺验证
由该回归模型预测的龙胆草多糖最佳提取工艺条件为醇沉体积分数为90%,提取时间为2.11 h,液料比为26.36(m L∶g),提取温度为74.89℃,最大提取率预测值为5.99%。考虑到实际操作的可行性,将工艺条件改为醇沉体积分数90%,提取时间2 h,液料比26∶1(m L∶g),提取温度75℃。在此优化条件下进行3次平行试验,龙胆草多糖的提取率为(5.89±0.25)%,与预测值较接近,所以此模型可较好地模拟和预测龙胆草多糖提取率及最佳提取工艺。
2.3 龙胆草多糖的抗氧化活性
2.3.1 龙胆草多糖对DPPH·清除作用
龙胆草多糖及维生素C对DPPH·清除率的作用见图2。由图2可知,随着龙胆草多糖和维生素C溶液加入量的增多,对DPPH·清除率也随之增大,超过一定量之后基本不再变化。分别以龙胆草多糖质量浓度(0.05~0.80mg/m L)和维生素C质量浓度(0.0005~0.006mg/m L)对DPPH·的清除率进行线性拟合,求得龙胆草和维生素C的多糖清除DPPH·的IC50值分别为0.582 2mg/m L和0.003 7mg/m L,由IC50可以看出龙胆草多糖对DPPH·的清除能力远远小于维生素C。

图2 龙胆草多糖对DPPH·的清除能力Fig.2 Scavenging effect of polysaccharide from Gentiana scabra on DPPH·
2.3.2 龙胆草多糖对OH·的清除作用

图3 龙胆草多糖对OH·的清除能力Fig.3 Scavenging effectof polysaccharide from Gentiana scabra on OH·
龙胆草多糖及维生素C对DPPH·清除率的作用见图3。由图3可以看出,总的来说随着龙胆草多糖和维生素C溶液加入量的增多,对OH·清除率也随之增大,超过一定量之后基本不再变化。以龙胆草多糖质量浓度(0.05~1mg/m L)对OH·的清除率进行线性拟合,求得龙胆草多糖清除OH·的IC50为0.721 4mg/m L,以维生素C质量浓度(0.000 5~0.015mg/m L)对OH·的清除率进行线性拟合,得出维生素C的IC50为0.006 7mg/m L。由IC50可以看出龙胆草多糖对OH·的清除能力远远小于维生素C。
2.3.3 龙胆草对O2-·清除能力
龙胆草多糖对维生素C和多糖清除O2-·的能力结果见图4。由图4可以看出随着样品质量浓度的增加,龙胆草多糖和维生素C对O2-·的清除能力呈上升趋势,但龙胆草多糖的清除能力不高,远小于同浓度的维生素C,当维生素C的质量浓度为0.5mg/m L的时候,对O2-·的清除率已经达到99.62%。以样品质量浓度(0.05~1.00mg/m L)对O2-·的清除率进行线性拟合,求得龙胆草多糖清除O2-·的IC50为2.5mg/m L,维生素C清除O2-·的IC50为0.11mg/m L。
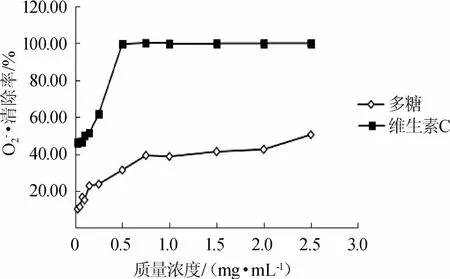
图4 龙胆草多糖清除的能力Fig.4 Scavenging effectof polysaccharide from Gentiana scabra on
2.3.4 龙胆草多糖的总还原能力

图5 龙胆草多糖总还原能力Fig.5 Reducing power o f polysaccharides from Gentiana scabra
龙胆草多糖以及维生素C的总还原能力见图5。从图5可以看出,随着龙胆草多糖和维生素C质量浓度的增加,其还原能力均呈上升趋势,但龙胆草的还原能力远远小于同浓度的维生素C的还原能力。而维生素C的质量浓度>0.75mg/m L以后,吸光度值就达到最大,且基本稳定,不再随着浓度的增大而升高。
2.3.5 龙胆草多糖对ABTS+·的清除能力
龙胆草多糖以及维生素C对ABTS+·的清除能力见图6。从图6可以看出,随着质量浓度的增大,龙胆草多糖以及维生素C对ABTS+·的清除能力均有所提高。在0.01~4mg/m L范围内,龙胆草多糖对ABTS+·的清除能力均低于同浓度的维生素C,在多糖和维生素C质量浓度为4mg/m L时和0.6mg/m L时,对ABTS+·的清除能力就达到了100%。以龙胆草多糖质量浓度(0.01~1.00mg/m L)对ABTS+·的清除率进行线性拟合,求得龙胆草多糖清除ABTS+·的IC50为0.6mg/m L,以维生素C质量浓度(0.01~0.05mg/m L)对ABTS+·的清除率进行线性拟合,得出维生素C的IC50为0.008mg/m L,由IC50也可以看出龙胆草多糖对ABTS+·的清除能力远远小于维生素C。
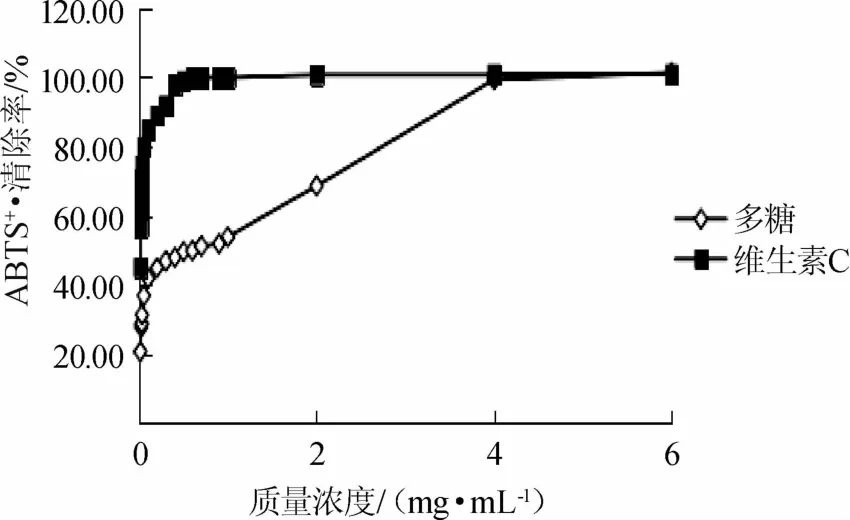
图6 龙胆草多糖清除ABTS+·的能力Fig.6 Scavenging effect of polysaccharides from Gentiana scabra on ABTS+·
3 结论
龙胆草为一种具有清热解毒功效的常见中药,含有多种活性物质,研究龙胆多糖的提取和抗氧化活性的条件具有重要价值。通过单因素试验和响应面法对龙胆草多糖提取工艺进行优化,建立较可靠的预测模型,影响龙胆草多糖提取率的主次顺序为醇沉体积分数>提取温度>提取时间>液料比。考虑到实际情况,得到最终的优化条件为醇沉体积分数90%,提取时间为2 h,液料比为26∶1(m L∶g),提取温度为75℃。经验证,得到的多糖提取率为(5.89±0.25)%,和预测值5.99%比较接近,说明此模型可以较好地预测实际提取率。
龙胆草多糖对自由基具有一定的清除能力,但均小于同浓度的维生素C,且龙胆草多糖的浓度与对自由基的清除能力呈一定的量效关系。龙胆草多糖的总还原能力也小于同浓度的维生素C,当浓度为4mg/m L时,多糖样品的吸光度值只有0.672,而维生素C质量浓度在0.75mg/m L时,吸光度就达到了2.905。龙胆草多糖清除自由基的IC50分别为:IC50(DPPH·)=0.582 2mg/m L,IC50(OH·)=0.721 4mg/m L,IC50(O2-·)=2.5mg/m L,IC50(ABTS+·)为0.6mg/m L,由IC50的大小判断出龙胆草多糖对这四种自由基清除能力的强弱顺序如下:DPPH·>ABTS+·>OH·>O2-·。
[1]程振玉,于丽颖,吉惠杰,等.龙胆多糖的不同提取工艺及抗氧化活性研究[J].河南工业大学学报:自然科学版,2016,37(5):81-86.
[2]王金宏.龙胆中植物多糖保肝降血脂及免役调节作用的研究[D].哈尔滨:哈尔滨商业大学,2012.
[3]王晨瑜,刘鑫,张晶,等.水溶性龙胆多糖的提取工艺研究[J].北方园艺,2013(10):155-157.
[4]宋海燕,梁丽青.龙胆药材中龙胆多糖的提取工艺研究[J].化工技术与开发,2016,45(9):28-31.
[5]LIR.Optimization ofextraction technology ofastragaluspolysaccharides by response surfacemethodology and its effecton CD40[J].Carbohyd Polym,2009,78(4):784-788.
[6]李佰纲.龙胆泻肝汤临床应用举隅[J].国医论坛,2006,21(3):31-32.
[7]刘涛,才谦,付玉芹,等.中药龙胆的研究进展[J].辽宁中医杂志,2004,31(1):85-86.
[8]孙海波,冷辉.十味龙胆花颗粒剂治疗慢性咽炎临床观察[J].中国中医药信息杂志,2001,8(12):85.
[9]SUN J,YIN G Y,CHEN L Y.Extraction of pumpkin polysaccharide by complex enzymemethod and its antioxidant research[J].Agr Sci Technol,2010,11(5):34-37.
[10]张迪,刘洋,李书艺.响应面试验优化复合酶法提取青蛇果多酚工艺及其抗氧化活性[J].食品科学,2016,37(4):51-57.
[11]赵焕新,景援朝,白虹,等.分心木中的化学成分及抗氧化活性研究[J].中国实验方剂学杂志,2016,22(7):54-57.
[12]LIC,HUAN Q,FU X,et al.Characterization,antioxidant and immunomodulatory activities of polysaccharides from Prunella vulgaris Linn[J].Int J Biol M acromol,2015,75:298-305.
[13]JIN L,GUAN X,LIUW,etal.Characterization and antioxidantactivity ofapolysaccharideextracted from Sarcandraglabra[J].Carbohyd Polym, 2012,90(10):524-532.
[14]程旺开,许月明,张冬冬.响应面优化黄秋葵叶多糖的提取工艺及其抗氧化活性考察[J].中国实验方剂学杂志,2017,23(4):38-42.
[15]王金华,杜超,梁晨,等.贵长猕猴桃多糖提取工艺及体外抗氧化功能[J].食品科学,2016,37(20):19-23.
[16]杨申明,范树国,文美琼,等.微波辅助提取澳洲坚果壳多糖的工艺优化及抗氧化性评价[J].食品科学,2016,37(10):17-22.
[17]徐盼菊,孟凡欣,唐萌,等.黑虎掌菌粗多糖制备及体外抗氧化活性研究[J].中国酿造,2017,36(3):150-155.
[18]王晨瑜.龙胆多糖的制备及生物活性分析[D].抚顺:辽宁石油化工大学,2014.
Extraction optim ization and antioxidantactivity ofGentian polysaccharides by response surfacemethodology
GONG Jiangning,WEIYuanjing,YANG Ziyi
(SchoolofChem istry and Material Science,Guizhou NormalUniversity,Guiyang 550001,China)
Theextraction technology of polysaccharide from Gentiana scabra Bungewasoptim ized and the in vitro antioxidantactivity wasevaluated. On the basis of single factor experiments,using alcohol precipitation concentration,extraction temperature,time and liquid-solid ratio as affecting factors,Gentian polysaccharideextraction ratio as response value,four factorsand three levelsBox-Behnken experimentswere designed,and then the extraction technology wasoptim ized by response surfacemethodology.The scavenging effectof Gentian polysaccharide on DPPH·,ABTS·,OH·,·was evaluated.Results showed that the optimum extraction conditions for Gentian polysaccharide was ethanol concentration 90%,extraction time2 h,liquid-solid ratio 26∶1(m l∶g),temperature75℃.Theactualextraction rate of polysaccharide from G.scabra was(5.89±0.25)%,and the deviation wasquite small compared with the predicted values.Gentian polysaccharide had certain antioxidant activity,but itwas less than vitam in C w ith the same concentration.
Gentiana scabra;polysaccharide;response surfaceexperiments;antioxidantactivity
TS201.2
0254-5071(2017)08-0134-05
10.11882/j.issn.0254-5071.2017.08.029
2017-03-23
贵州省科技厅计划项目(黔科合J字LKS[2012]17号)
宫江宁(1979-),女,副教授,硕士,研究方向为天然产物。
