灰树花菌丝体β-葡聚糖提取工艺优化
2017-09-03钟敏吴天祥聂文强芦红云
钟敏,吴天祥,2*,聂文强,芦红云
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州大学明德学院,贵州贵阳550025)
灰树花菌丝体β-葡聚糖提取工艺优化
钟敏1,吴天祥1,2*,聂文强1,芦红云1
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州大学明德学院,贵州贵阳550025)
以β-葡聚糖得率为考察指标,考察了热水浸提法、热水-复合酶法、超声波法、超声波-复合酶法对灰树花菌丝体β-葡聚糖得率的影响。影响提取的关键因素为超声功率、超声时间、复合酶添加量、酶解温度,采用正交试验对提取工艺进行优化。结果表明,采用超声波-复合酶法所得β-葡聚糖得率最大,灰树花菌丝体β-葡聚糖最佳提取条件为超声功率300W,超声时间15min,复合酶添加量1.5%,酶解温度40℃。在此条件下,灰树花菌丝体β-葡聚糖得率可达2.80mg/g。
灰树花;β-葡聚糖;提取;复合酶;正交试验
灰树花(Grifola frondosa)是一种药食两用真菌,又名贝叶多孔菌、栗子蘑、千佛菌等,日本称为舞茸,隶属于层菌纲、非褶菌目、多孔菌科[1-2]。灰树花营养丰富,还含有丰富的生物活性物质,其主要活性成分是灰树花多糖。灰树花多糖结构复杂,按链键结构可分为α型与β型,其中具有生物活性作用的多糖大多为β构型葡聚糖。β-葡聚糖具有抗肿瘤[3-4]、抗病毒[5]、提高免疫力[6-7]、抗氧化和抗衰老[8-9]以及降血糖降血脂[10]等作用,因此,近年来β-葡聚糖的研究受到国内外学者的广泛关注。
目前,对于真菌多糖的提取研究较为广泛,提取工艺也日趋成熟,主要集中在对总多糖的提取研究上,但以真菌β-葡聚糖为对象的研究却鲜有报道。目前,β-葡聚糖的提取主要有水提、酸碱提、超声波、微波辅助提取法[11-13],而采用超声波协同复合酶法提取灰树花菌丝体β-葡聚糖的研究未见报道。因灰树花中含有的大量纤维素、果胶、蛋白质等非糖类物质形成了较为致密的结构而阻碍了多糖的释放,以相应的酶进行处理可以降解非多糖物质,从而有利于多糖的释放[14],同时再辅以超声波,β-葡聚糖提取率可大大提高。本课题组前期已对灰树花菌丝体多糖及胞外多糖提取工艺做了研究[15-16]。本实验以灰树花发酵培养的菌丝体为材料,首先比较了4种不同提取方法对灰树花菌丝体β-葡聚糖得率的影响,以此获得较优的提取方法,在此基础上通过单因素试验确定了影响提取的关键因素,并采用正交试验对提取条件进行了优化,从而获得了最佳提取工艺,以期为β-葡聚糖的规模化制备提供了一定的技术支撑。
1 材料与方法
1.1 材料与试剂
灰树花(Grifola frondosa)菌株(菌种编号51616):中国微生物菌种保藏管理中心;β-葡聚糖:美国Sigma公司;纤维素酶(3U/mg)、果胶酶(40U/mg):北京索莱宝科技有限公司;木瓜蛋白酶(10万U/g):南宁庞博生物工程有限公司;刚果红(分析纯):天津市科密欧化学试剂有限公司;Na2HPO4·12H2O(分析纯):成都金山化学试剂有限公司;NaH2PO4·2H2O(分析纯):天津市光复科技发展有限公司;其余试剂均为国产分析纯试剂。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)斜面培养基:马铃薯(去皮)200 g/L,葡萄糖20 g/L,蛋白胨2 g/L,KH2PO42 g/L,MgSO4·7H2O 1 g/L,琼脂20 g/L,pH自然。
液体种子培养基:葡萄糖30 g/L,蛋白胨2 g/L,酵母膏6 g/L,MgSO4·7H2O 0.5 g/L,KH2PO40.5 g/L,pH自然。
发酵培养基:葡萄糖50g/L,蛋白胨5g/L,酵母膏10g/L,KH2PO42 g/L,MgSO4·7H2O 2 g/L,pH自然。
1.2 仪器与设备
BXM-30R型立式灭菌锅、GZX-9070MBE型数显鼓风干燥箱:上海博讯实业有限公司医疗设备厂;SW-CJ-1D净化工作台:苏州净化设备有限公司;SG8200HPT型超声波清洗机:上海冠特超声仪器有限公司;TDL-40B高速离心机:上海安亭科学仪器厂;CP114型电子天平:上海奥豪斯仪器有限公司;TS-2102C恒温振荡器:上海天呈仪器有限公司;pH计:成都世纪方舟科技有限公司;UV-1800双光速紫外可见光光度计:上海欣茂仪器有限公司。
1.3 方法
1.3.1 灰树花菌丝体制备
斜面种子培养:用接种铲从母种试管中挑取黄豆粒大小的菌丝块于PDA斜面培养基中部,置于25℃的恒温培养箱中培养至菌丝体长满整个斜面。
液体种子培养:用接种勺从斜面种子培养基中刮取蚕豆粒大小的菌丝体于100m L/250m L液体种子培养基中,25℃、150 r/m in摇床培养4~7 d。
发酵培养:用移液枪按接种量为10%吸取液体种子培养液于100m L/250m L发酵培养基中,25℃、150 r/m in摇床培养7~9 d[17]。
发酵结束后,将发酵液用8层纱布过滤后获得菌丝体,用蒸馏水反复冲洗菌丝体,最后将菌丝体置于60℃干燥箱中烘至恒质量后,研磨成粉放于干燥器中备用。
1.3.2 β-葡聚糖及总多糖的测定
总多糖的测定采用苯酚-硫酸法[18],其计算公式如下:

β-葡聚糖得率的测定采用刚果红显色法[19],计算公式如下:

1.3.3 不同提取方法基本工艺
称取一定质量的灰树花菌丝体粉末,加适当比例蒸馏水,分别采用热水浸提法(50℃恒温水浴锅中浸提1 h)、超声波提取法(240W室温条件下超声处理0.5 h)、热水-复合酶提取法(按菌丝体质量的2%添加复合酶(纤维素酶∶木瓜蛋白酶∶果胶酶=2∶1∶2)于50℃恒温水浴锅浸提1 h后迅速升温至90℃灭酶10m in)和超声波-复合酶提取法(240W室温条件下超声处理0.5 h,然后按菌丝体质量的2%添加复合酶于50℃恒温水浴锅中浸提1 h后迅速升温至90℃灭酶10m in)后,6 000 r/m in离心20m in,取上清液加4倍体积乙醇溶液(体积分数为95%)4℃醇沉24 h,4 000 r/min离心15m in后得沉淀,用乙醇溶液(体积分数为95%)清洗沉淀两次,最后将沉淀冷冻干燥后加水复溶,分别进行β-葡聚糖及多糖含量的测定,每组处理3个平行,取各得率的平均值。
1.3.4 单因素试验
采用超声波-复合酶提取法,分别考察超声功率(180W、240W、300W、360W、420W)、超声时间(15m in、30min、45m in、60m in、75m in)、复合酶添加量(0.5%、1.0%、1.5%、2.0%、2.5%)、酶解温度(30℃、35℃、40℃、45℃、50℃)、酶解时间(20m in、40m in、60m in、80m in、100m in)、酶解pH(4、5、6、7、8)对灰树花菌丝体β-葡聚糖得率的影响,每组处理3个平行,取各得率的平均值。
1.3.5 正交试验设计
根据单因素试验结果,以超声功率、超声时间、复合酶添加量、酶解温度为主要因素,以灰树花菌丝体β-葡聚糖得率为评价指标,采用L9(34)正交设计对灰树花菌丝体β-葡聚糖提取条件进行优化。正交试验因素与水平如表1所示。

表1 菌丝体β-葡聚糖提取工艺优化正交试验因素与水平Table 1 Factors and levels o f orthogonalexperim ents for myce liumβ-glucan extraction process op tim ization
1.3.6 数据处理
运用Origin 9.0和SPSS软件对数据进行处理。
2 结果与分析
2.1 不同提取方法的比较
本试验采用4种方法对灰树花菌丝体β-葡聚糖进行提取,所得总多糖及β-葡聚糖得率结果如表2所示。

表2 不同提取方法的灰树花菌丝体总多糖得率和β-葡聚糖得率Table 2 The yields of totalpolysaccharides andβ-glucan from G.frondosa m ycelium by different extraction m ethods
由表2可知,采用超声波提取法所得的β-葡聚糖和多糖得率高于热水浸提法,尤其是超声波结合复合酶法得率提升幅度较大。超声波可以有效地破碎菌丝体细胞壁,复合酶可以降解非多糖物质,两种方法有效结合从而利于多糖的释放,使β-葡聚糖得率提高,而常规的热水浸提法不仅提取时间较长而且提取效率低。综上所述,超声波-复合酶法为最佳的提取方法。
2.2 单因素试验结果
2.2.1 超声功率对提取效果的影响
考察超声功率对灰树花菌丝体β-葡聚糖及总多糖得率的影响,结果如图1所示。

图1 超声功率对β-葡聚糖得率的影响Fig.1 Effectof ultrasonic power onβ-glucan yield
由图1可知,当超声功率在180~240W范围内时,随着超声功率的增加,β-葡聚糖及总多糖得率均逐渐提高;当超声功率为240W时,β-葡聚糖得率达到最大值,为1.43mg/g;继续增大超声功率,β-葡聚糖得率有所下降,这可能由于超声功率过大,物理剪切力变大使糖苷键断裂,从而导致β-葡聚糖的结构被破坏,得率下降。因此,选择超声功率240W为宜。2.2.2超声时间对提取效果的影响
考察超声时间对灰树花菌丝体β-葡聚糖及总多糖得率的影响,结果如图2所示。

图2 超声时间对β-葡聚糖得率的影响Fig.2 Effect of u ltrasonic time onβ-glucan yield
由图2可知,随着超声时间的增加,β-葡聚糖及总多糖得率均呈先增加后下降的趋势。当超声时间为30min时,β-葡聚糖得率达到最大值,为1.07mg/g,得率先增加可能是因为灰树花菌丝体细胞壁的破裂及β-葡聚糖的释放需一定时间;而之后得率下降可能是因为超声时间过长会导致局部温度过高使β-葡聚糖降解,以及持续强度的空化效应使得部分β-葡聚糖结构破坏,使得率下降。因此,选择超声时间30m in为宜。
2.2.3 复合酶添加量对提取效果的影响
考察复合酶添加量对灰树花菌丝体β-葡聚糖及总多糖得率的影响,结果如图3所示。

图3 复合酶添加量对β-葡聚糖得率的影响Fig.3 Effect of compound enzym e addition onβ-glucan yield
由图3可知,当复合酶添加量在0.5%~1.5%范围内时,β-葡聚糖及总多糖得率均随复合酶添加量的增加而提高;当复合酶添加量为1.5%时,β-葡聚糖得率达到最大值,为1.55mg/g;继续增大复合酶添加量,β-葡聚糖得率有所下降。可能是因为刚开始随着复合酶添加量的增加,酶与底物接触的机会增加,致使β-葡聚糖更快的分离出来,β-葡聚糖得率升高,但是当复合酶添加量继续增大到一定程度,一部分酶分子没有机会与底物结合,底物被水解的速度降低,致使β-葡聚糖得率下降。因此,选择复合酶添加量1.5%为宜。
2.2.4 酶解温度对提取效果的影响
考察酶解温度对灰树花菌丝体β-葡聚糖及总多糖得率的影响,结果如图4所示。

图4 酶解温度对β-葡聚糖得率的影响Fig.4 Effect of enzymolysis temperature onβ-glucan yield
由图4可知,β-葡聚糖及总多糖得率总体呈先上升后下降的趋势。β-葡聚糖得率在酶解温度为40℃时达到最大值,为1.96mg/g。温度是影响酶活的重要因素之一,在一定温度范围内,酶解速度会随着温度的升高而加快;随着温度的继续升高,超过了最适的催化温度,催化效率就会大大降低,因此,选择酶解温度40℃为宜。
2.2.5 酶解时间对提取效果的影响
考察酶解时间对灰树花菌丝体β-葡聚糖及总多糖得率的影响,结果如图5所示。

图5 酶解时间对β-葡聚糖得率的影响Fig.5 Effect of enzymolysis tim e onβ-glucan yield
由图5可知,当酶解时间在20~100m in范围内时,β-葡聚糖及总多糖得率均随酶解时间的延长而增加;继续延长酶解时间,两者得率趋于平稳;酶解时间对β-葡聚糖及总多糖得率影响不大,当酶解时间为80min时β-葡聚糖得率达到最大值,为2.42mg/g。因此,选择酶解时间80min为宜。2.2.6酶解pH对提取效果的影响
考察酶解pH对灰树花菌丝体β-葡聚糖及总多糖得率的影响,结果如图6所示。

图6 酶解pH对β-葡聚糖得率的影响Fig.6 Effect of enzymolysis pH onβ-glucan yie ld
由图6可知,当酶解pH值在4~6范围内时,β-葡聚糖及总多糖得率随酶解pH的增大而提高,当酶解pH值为6时,β-葡聚糖得率达到最大值,为1.71mg/g;继续增大酶解pH,二者得率均开始下降,这可能是因为pH的增大影响了酶和底物的亲和力,酶的活性被破坏了,从而造成了β-葡聚糖得率的下降。因此,选择酶解pH6为宜。
2.3 正交试验结果与分析
根据单因素试验结果,选择对灰树花菌丝体β-葡聚糖得率影响较大的关键因素,即超声功率、超声时间、复合酶添加量、酶解温度进行正交试验分析,确定灰树花菌丝体β-葡聚糖的最佳提取工艺条件。按照L9(34)设计正交试验,正交试验结果及分析如表3所示,方差分析如表4所示。
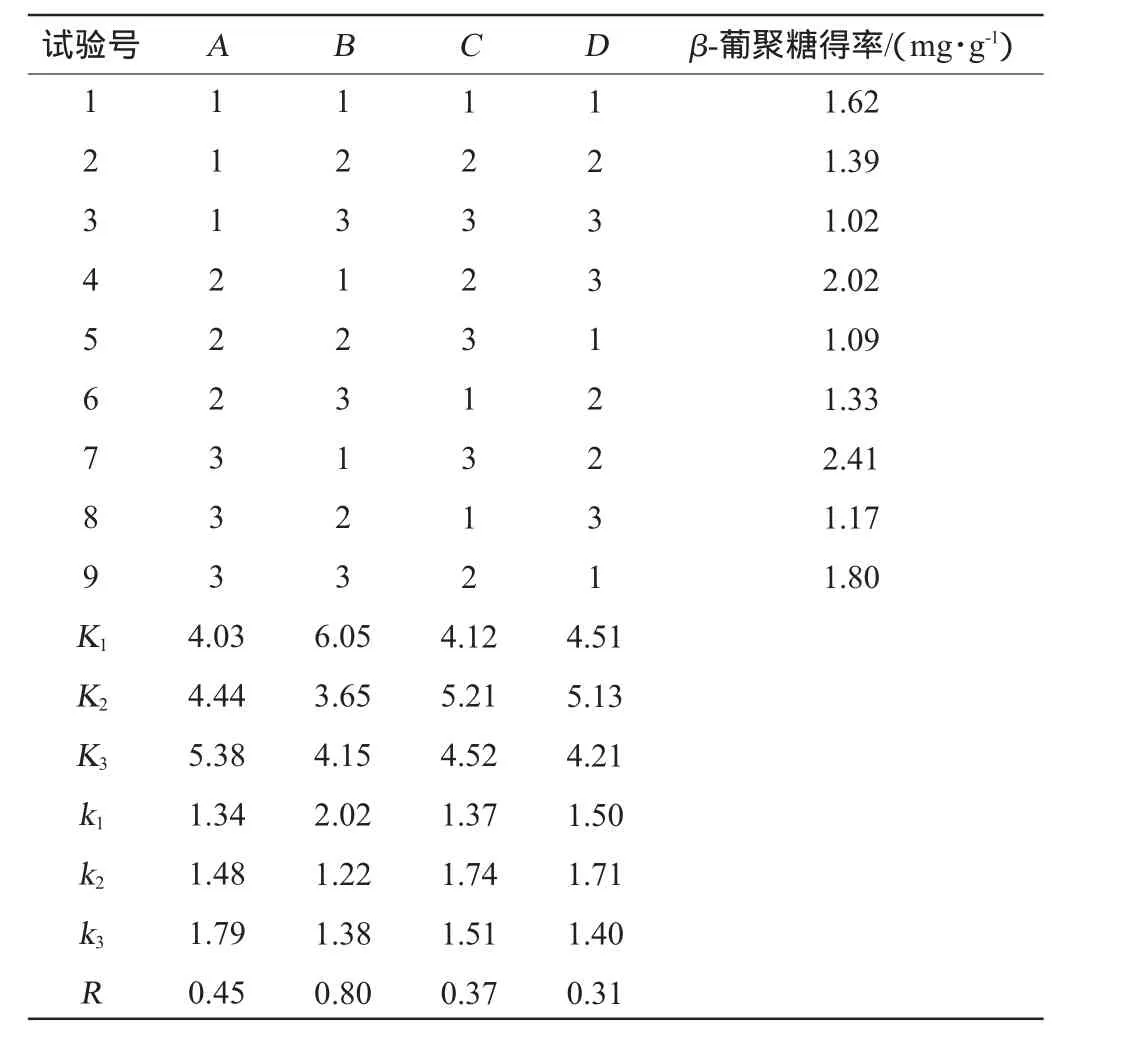
表3 灰树花菌丝体β-葡聚糖提取工艺优化正交试验结果与分析Table 3 Results and analysis oforthogonalexperim ents for G.frondosa m yceliumβ-glucan extraction process optim ization

表4 正交试验结果方差分析Table 4 Variance analysis of orthogonalexperiments results
由表3正交试验结果及极差分析可知,各因素对β-葡聚糖得率影响的次序为超声时间(B)>超声功率(A)>加酶量(C)>酶解温度(D)。由表4可知,超声时间对β-葡聚糖得率有显著影响(P<0.05),其余因素对结果影响不显著(P>0.05),确定最优水平组合为A3B1C2D2,即超声功率为300W,超声时间为15min,复合酶添加量为1.5%,酶解温度为40℃,在此最佳提取条件下进行3次平行验证试验,测得β-葡聚糖得率为2.80mg/g。
3 结论
本试验首先比较了灰树花菌丝体β-葡聚糖的4种提取方法,确定了超声波-复合酶法为最佳提取方法,之后通过单因素与正交试验确定了超声波-复合酶法提取的最佳工艺条件,即超声功率300W,超声时间15min,复合酶添加量1.5%,酶解温度40℃,经验证试验,β-葡聚糖得率可达2.80mg/g。该方法操作简便,不仅缩短了提取时间,而且提取效率也较高,为今后β-葡聚糖的规模化提取提供了理论依据。
[1]MAYELL M.Maitake extracts and their therapeutic potential-A review [J].A ltern M ed Rev,2001,6(1):48-60.
[2]徐晓宝,吴天祥.灰树花发酵过程天麻成分变化的HPLC检测方法研究[J].中国酿造,2012,31(5):182-185.
[3]TIAN J,MA J,MA K,et al.β-glucan enhances antitumor immune responsesby regulating differentiation and function ofmonocyticmyeloidderived suppressor cells[J].Eur J Immunol,2013,43(5):1220-1230.
[4]FANG J,WANG Y,LV X,et al.Structure of aβ-glucan from Grifola frondosa and its antitumor effect by activating Dectin-1/Syk/NF-κB signaling[J].G lycoconjugate J,2012,29(5-6):365-377.
[5]王文秀,孙红武,徐泽平.灰树花β-聚糖体外抗I型单纯疱疹病毒的试验[J].中国兽医杂志,2012,48(9):10-13.
[6]王宝琴,徐泽平,扬传伦.高纯度碱提灰树花发酵菌丝体β-葡聚糖的免疫活性研究[J].西北农林科技大学学报,2011,39(7):141-147.
[7]ADACHIY,OKAZAKIM,OHNO N,et al.Enhancement of cytokine production bymacrophagesstimulated with(1,3)-beta-D-glucan,grilolan (GRN),isolated from Grifolafrondosa[J].Biol Pharm Bull,1994,17(12): 1554-1560.
[8]JALALP,FATEMEHS,FARAHNAZT,etal.Protectiveeffectsof fungal β-(1-3)-D-glucan againstoxidative stress cytotoxicity induced by depleted uranium in isolated rathepatocytes[J].Humd Exp Toxicol,2010,30 (3):173-181.
[9]KAO PF,WANG SH,HUNGW T,etal.Structural characterization and antioxidative activity of low-molecular-weights beta-1,3-glucan from the residue of extracted Ganoderma lucidum fruiting bodies[J].J Biomed Biotechnol,2012,2012(1):1-8.
[10]刘影,孙阔.药食用真菌β-葡聚糖对治疗高血脂症的临床研究[J].中国保健营养,2013,23(1):290-291.
[11]张娟.燕麦β-葡聚糖提取、纯化及中试工艺的研究[D].合肥:安徽农业大学,2007.
[12]胡君荣.灰树花β-葡聚糖的高效提取及量化技术[D].杭州:浙江工业大学,2008.
[13]张冬雪,熊婷,王晓玲,等.灵芝菌丝体中β-葡聚糖的提取[J].菌物学报,2016,35(9):1139-1150.
[14]韦朝阳,徐财泉,茹广华,等.灰树花多糖的分步酶解法提取工艺研究[J].中国林副特产,2011(6):1-4.
[15]敖锐,吴天祥,付红伟.超声波协同复合酶法提取灰树花菌丝体多糖的工艺优化[J].贵州农业科学,2014,42(8):206-209.
[16]汤庆莉,张洪,张勇,等.灰树花胞外多糖提取工艺优化[J].核农学报,2013,27(11):1704-1708.
[17]张勇,吴天祥.天麻提取物的制备及其对灰树花发酵的影响[J].食品与机械,2012,28(1):150-153.
[18]侯晓梅,陈敏青,张慧蕾,等.中药提取物对灰树花深层发酵的影响[J].食品科技,2013,38(9):185-188.
[19]熊婷.灵芝发酵物中功能性β-葡聚糖的提取技术研究[D].株洲:中南林业科技大学,2015.
Optim ization ofextraction technology ofβ-glucan from Grifola frondosa mycelium
ZHONGM in1,WU Tianxiang1,2*,NIEWenqiang1,LU Hongyun1
(1.SchoolofLiquorand Food Engineering,Guizhou University,Guiyang 550025,China; 2.M ingde College ofGuizhou University,Guiyang 550025,China)
Usingβ-glucan yield as the evaluation index,hotwater extraction,hotwater-compound enzyme extraction,ultrasonic extraction and ultrasonic-compound enzymeextractionmethod on the yield ofβ-glucan from myceliaof Grifola frondosa were investigated.Theultrasonic power,ultrasonic time,compound enzyme addition and enzymolysis temperature were determ ined as the key factors for influencing extraction.The extraction processwasoptim ized by orthogonalexperiments.The resultsshowed that theyield ofβ-glucan extracted by ultrasonic-compound enzyme extraction method was themaximum.The optimum extraction conditions ofβ-glucan from mycelia of G.frondosa were ultrasonic power 300W,ultrasonic time 15 min,compound enzyme addition 1.5%and enzymolysis temperature 40℃.Under the conditions,the yield ofβ-glucan from mycelia of G.frondosa was2.80mg/g.
Grifola frondosa;β-glucan;extraction;compound enzyme;orthogonalexperiment
Q538
0254-5071(2017)08-0090-05
10.11882/j.issn.0254-5071.2017.08.020
2017-04-17
国家自然科学基金资助项目(31460537)
钟敏(1992-),女,硕士研究生,研究方向为发酵工程。
*通讯作者:吴天祥(1965-),男,教授,博士,研究方向为发酵工程和生物转化。
