组蛋白去乙酰化酶抑制剂RGFP109逆转胶质母细胞瘤U251细胞对替莫唑胺耐药性的机制研究
2017-09-03管晨峰李玉珍张开礼李宗阳黄国栋中山大学附属第八医院药学部广东深圳58000深圳大学附属第一医院神经外科广东深圳58035
管晨峰,李玉珍,张开礼,李宗阳,黄国栋#(.中山大学附属第八医院药学部,广东深圳 58000;.深圳大学附属第一医院神经外科,广东深圳 58035)
组蛋白去乙酰化酶抑制剂RGFP109逆转胶质母细胞瘤U251细胞对替莫唑胺耐药性的机制研究
管晨峰1*,李玉珍1,张开礼1,李宗阳2,黄国栋2#(1.中山大学附属第八医院药学部,广东深圳 518000;2.深圳大学附属第一医院神经外科,广东深圳 518035)
目的:研究组蛋白去乙酰化酶抑制剂RGFP109逆转胶质母细胞瘤U251细胞的耐药性机制。方法:建立对替莫唑胺(TMZ)耐药的TR/U251细胞,试验分为正常对照组、TMZ组(40 μmol/L)和TMZ(40 μmol/L)+RGFP109(0~120 μmol/L)不同浓度组,加入相应药物作用24 h后,CCK-8法检测细胞存活率,计算半数抑制浓度(IC50)。TUNEL法和Annexin V/PI法检测正常对照组、TMZ组和TMZ+RGFP109(42 μmol/L)组细胞的凋亡情况,免疫印迹法检测3组细胞中O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)、存活蛋白(Survivin)、B淋巴细胞瘤2(Bcl-2)、B淋巴细胞瘤xL(Bcl-xL)蛋白表达,凝胶迁移实验检测3组细胞中p65乙酰化水平及其与κB-DNA的结合能力。结果:与正常对照组和TMZ组比较,TMZ+RGFP109不同浓度组细胞存活率明显降低(P<0.05),且呈浓度依赖性。当RGFP109浓度为42 μmol/L时,TMZ对TR/U251细胞的敏感性与U251细胞相同。与正常对照组比较,TMZ组细胞中MGMT、Survivin、Bcl-2、Bcl-xL蛋白表达均增强(P<0.01),p65乙酰化水平无明显变化,但p65与κB-DNA的结合能力增强(P<0.01)。与TMZ组比较,TMZ+RGFP109组细胞中MGMT、Survivin、Bcl-2、Bcl-xL蛋白表达均减弱(P<0.01),p65乙酰化水平增强(P<0.01),p65与κB-DNA的结合能力减弱(P<0.01)。结论:RGFP109可通过下调转录因子κB调节的抗凋亡蛋白表达,减弱p65与κB-DNA的结合来逆转U251细胞对TMZ耐药。
组蛋白去乙酰化酶抑制剂RGFP109;转录因子κB;替莫唑胺;胶质母细胞瘤U251细胞;乙酰化
胶质母细胞瘤是最常见的中枢神经系统(CNS)恶性肿瘤。烷化剂替莫唑胺(TMZ)是胶质母细胞瘤化疗的主要药物,但其耐药性很大程度上减弱了其化疗效果。研究表明,转录因子κB(NF-κB)的丝氨酸磷酸化水平在胶质母细胞瘤中较高,其可导致各种细胞因子和原癌蛋白的表达失调[1]。因此,抑制NF-κB的活化可能成为解决胶质母细胞瘤耐药性问题的重要途径。
研究发现,组蛋白乙酰化酶(HAT)和去乙酰化酶(HDAC)在NF-κB翻译后修饰过程中发挥着重要的作用[2]。以组蛋白乙酰化和去乙酰化酶(HDAC1和HDAC3)去乙酰化为代表的可逆性进程,影响着p65与κB-DNA的相互作用,从而调节NF-κB的转录进程,进而可能对克服胶质母细胞瘤耐药性产生重要影响。RGFP109是二苯胺庚二酸类HDAC1和HDAC3的选择性抑制剂,具有良好的血脑屏障透过率,其针对帕金森病治疗的应用研究已进入临床研究阶段,具有良好的应用前景。本文以胶质母细胞瘤U251细胞为研究对象,研究RGFP109逆转U251细胞的耐药性的机制。
1 材料
1.1 仪器
CKX41倒置相差显微镜(日本Olympus公司);后置荧光显微镜(德国Leica公司);Multiskan go 1510酶标仪(美国赛默飞公司);TDL-5013台式离心机(上海安亭科学化学仪器厂)。
1.2 药品与试剂
TMZ胶囊(美国Merck Sharp&Dohme公司,批号:H20080313,规格:每粒20 mg);RGFP109原料药(美国Selleck公司,批号:S729201,纯度:99.17%);高糖DMEM培养基和胎牛血清(FBS)均购自美国Gibco公司;TUNEL细胞凋亡检测试剂盒(瑞士Roche公司);膜联蛋白Ⅴ(AnnexinⅤ)/碘化丙啶(PI)检测试剂盒(美国Invitrogen公司);兔源甘油醛-3-磷酸脱氢酶(GAPDH)、O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)、存活蛋白(Survivin);B淋巴细胞瘤2(Bcl-2)、B淋巴细胞瘤xL(Bcl-xL)单克隆抗体(美国Santa Cruz公司);NF-κB p65和乙酰化赖氨酸残基鼠单克隆抗体(美国Abcam公司);LightShift化学发光凝胶迁移实验(EMSA)试剂盒(美国Pierce Biotechnology公司)。
1.3 细胞
人恶性胶质母细胞瘤U251细胞株购自中国科学院生物化学和细胞生物学研究所。
2 方法
2.1 细胞培养
将U251细胞培养于含10%FBS的DMEM培养基中(添加链霉素、青霉素各100 u/mL),在含5%CO2、饱和湿度的37℃恒温培养箱中孵育,每隔3 d以0.25%胰酶消化、传代,并取部分对数生长期细胞悬浮于含10%二甲基亚砜(DMSO)、20%FBS、70%DMEM的细胞冻存液中,置于液氮保存。
2.2 耐药菌株的建立
采用前期研究[1]中已建立的稳定耐TMZ的U251细胞(TR/U251细胞)进行试验,已测得TMZ对TR/U251细胞的半数抑制浓度(IC50)为(283.45±22.38)μmol/L,对亲本U251细胞的IC50为(39.88±6.25)μmol/L。
2.3 分组与给药
以TMZ对亲本U251细胞的IC50为TMZ联合用药浓度。将TR/U251细胞分为正常对照组、TMZ组(40 μmol/L)和TMZ(40 μmol/L)+RGFP109(20、40、60、80、100、120 μmol/L)不同浓度组,通过细胞活性检测细胞存活率,筛选实现TMZ耐药性逆转的RGFP109联合用药浓度。再将试验进一步分为正常对照组、TMZ组、TMZ(40 μmol/L)+RGFP109(筛选所得浓度)组。
2.4 细胞活性测定
取对数生长期细胞接种于96孔板,每孔含2 500个细胞,37℃下培养24 h,按“2.3”项下分组加入含相应药物的培养基100 μL,每组设6个复孔,作用24 h。弃原培养液,每孔添加含10%CCK-8的培养液100 μL,继续37℃下培养2 h后酶标仪检测450 nm波长处的光密度(OD),计算细胞存活率。细胞存活率(%)=给药组OD值/正常对照组OD值×100%。试验重复2次。
2.5 TUNEL法检测细胞凋亡
取对数生长期细胞种植于细胞爬片(7.5×105mL-1)上培养24 h,按“2.3”项下分组给药,作用24 h,按照TUNEL试剂盒说明书进行染色,用后置荧光显微镜观察细胞凋亡情况(共计200个细胞)。
2.6 AnnexinⅤ/PI法检测细胞凋亡
取对数生长期细胞种植于6孔板(7.5×105mL-1)中培养24 h,按“2.3”项下分组给药,作用24 h,按照AnnexinⅤ/PI检测试剂盒说明书进行染色,用流式细胞仪检测细胞凋亡情况。
2.7 免疫印迹法检测细胞中NF-κB通路相关因子的蛋白表达
取对数生长期细胞种植于6孔板(7.5×105mL-1)中培养24 h,按“2.3”项下分组给药,作用24 h,分别加入细胞裂解液充分裂解细胞,提取蛋白。二喹啉甲酸(BCA)法测定蛋白浓度,确定蛋白电泳上样体积。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转移至聚偏氟乙烯膜(PVDF),5%脱脂奶粉室温封闭,洗膜,加入一抗(1∶500)溶液中4℃孵育过夜,加入二抗(1∶1 000)室温孵育1 h,漂洗。滴加增强化学发光(ECL)液后,在凝胶成像系统中曝光,用Quantity One软件统计各抗体条带灰度值。以MGMT、Survivin、Bcl-2、Bcl-xL与内参GAPDH灰度值的比值表示对应蛋白的相对表达量。
2.8 EMSA检测细胞中p65与κB-DNA的结合能力
取对数生长期的细胞种植于6孔板(7.5×105mL-1)中培养24 h,按“2.3”项下分组给药,作用12 h,提取细胞核蛋白,然后按照EMSA试剂盒说明书操作,采用生物发光法进行显色,检测p65与κB-DNA的结合能力。
2.9 统计学方法
3 结果
3.1 RGFP109浓度的筛选结果
与正常对照组(细胞存活率为100%)和TMZ组比较,TMZ+RGFP109(20~120 μmol/L)不同浓度组细胞存活率明显降低(P<0.01),并呈浓度依赖性。当RGFP109浓度为42 μmol/L时,TMZ对TR/U251细胞的敏感性与亲本U251细胞相同,因此选择42 μmol/L作为TMZ+RGFP109组中RGFP109的浓度。TMZ+RGFP109组和TMZ组细胞存活率的测定结果见图1。
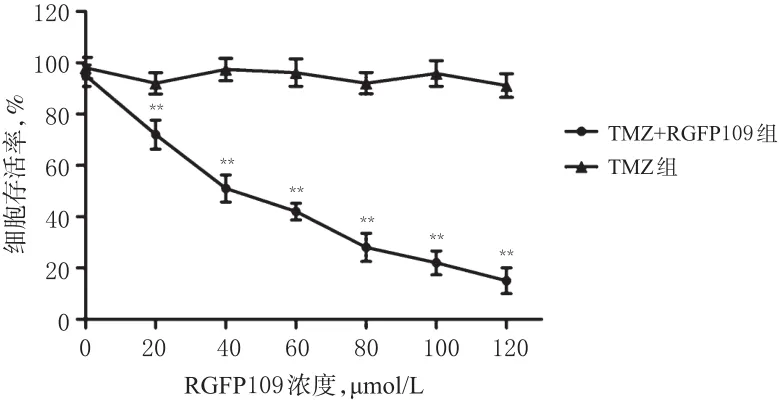
图1 TMZ+RGFP109组和TMZ组细胞存活率的测定结果Fig 1 Determination results of cell survival rate in TMZ+RGFP109 group and TMZ group
3.2 细胞凋亡情况
与正常对照组和TMZ组比较,TMZ+RGFP109组细胞的凋亡数明显增加,证实RGFP109逆转了TR/U251细胞的耐药性,增强了TMZ的细胞毒性作用。各组细胞凋亡情况的荧光图见图2,流式图见图3。

图2 各组细胞凋亡情况的荧光图Fig 2 Fluorescence diagram of cell apoptosis in each group

图3 各组细胞凋亡情况的流式图Fig 3 Flow cytometry of cell apoptosis in each group
3.3 细胞中NF-κB通路相关因子的蛋白表达
与正常对照组比较,TMZ组TR/U251细胞中MGMT、Survivin、Bcl-2和Bcl-xL的蛋白表达明显增强(P<0.01)。与TMZ组比较,TMZ+RGFP109组TR/U251细胞中MGMT、Survivin、Bcl-2和Bcl-xL的蛋白表达明显降低(P<0.01)。各组细胞中MGMT、Survivin、Bcl-2、Bcl-xL蛋白表达的电泳图见图4,测定结果见图5。
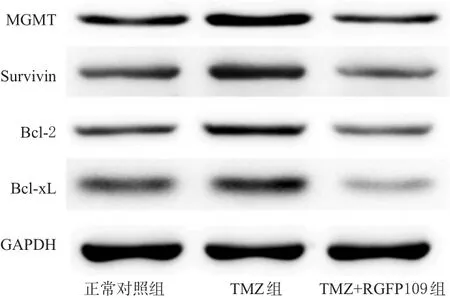
图4 各组细胞中MGMT、Survivin、Bcl-2、Bcl-xL蛋白表达的电泳图Fig 4 Electrophoresis chart of MGMT,Survivin,Bcl-2,Bcl-xL protein expressions in cells in each group
3.4 细胞中p65与κB-DNA的结合情况
与正常对照组和TMZ组比较,TMZ+RGFP109组细胞中乙酰化的赖氨酸残基增加,p65乙酰化水平显著增强(P<0.01),而p65-κ B-DNA表达明显减弱(P<0.01)。由此证明RGFP109导致了p65乙酰化增强,减弱了p65与其κB-DNA结合的能力,阻断了NF-κB通路的活化。各组细胞中p65乙酰化水平及其与κB-DNA结合的电泳图见图6,测定结果见图7。
4 讨论
有研究显示,NF-κB和相关肿瘤抑制基因的异常活化能促进胶质母细胞瘤细胞抵抗TMZ[2-4]。本研究结果也证明了RGFP109通过抑制NF-κB介导的转录后修饰克服了细胞对TMZ的抵抗性[5]。作为经典核转录因子,NF-κB的活化进程历经众多的翻译后修饰[6-7],其中乙酰化更是NF-κB反式激活的关键步骤[8-9]。因此,笔者集中探讨了RGFP109介导NF-κB通路的调节机制。
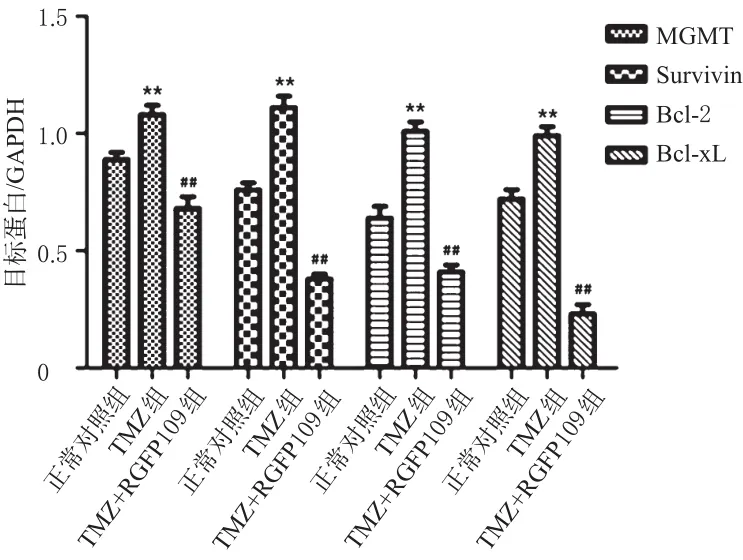
图5 各组细胞中MGMT、Survivin、Bcl-2、Bcl-xL蛋白表达的测定结果Fig 5 Determination results of MGMT,Survivin,Bcl-2,Bcl-xL protein expressions in cells in each group
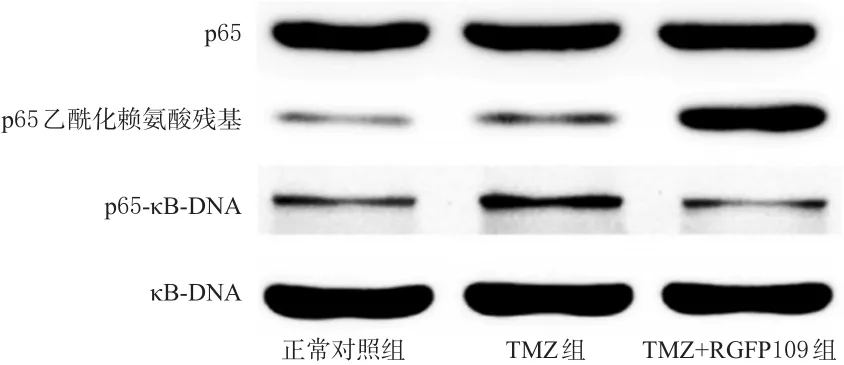
图6 各组细胞中p65乙酰化水平及其与κB-DNA结合的电泳图Fig 6 Electrophoresis chart of the p65 acetylation level and its binding with κB-DNA in cells in each group
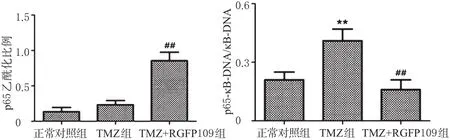
图7 各组细胞中p65乙酰化水平及其与κB-DNA结合的测定结果Fig 7 Determination results of the p65 acetylation level and its binding with κB-DNA in cells in each group
笔者曾在预试验中建立了多种胶质母细胞瘤细胞株,并初步观察到RGFP109能减弱细胞株对TMZ的耐药性以及增强TMZ诱导的细胞毒性。在本研究中,笔者使用TMZ和RGFP109共处理TR/U251细胞的方法来评估作用效果,并最终阐明了RGFP109减弱TR/U251细胞对TMZ的耐药性以及增强TMZ诱导的细胞毒性的机制。在本研究中,笔者还发现NF-κB诱导上调的抗凋亡蛋白可能与TMZ抵抗性的增强有关,并发现RGFP109能显著降低TR/U251细胞中NF-κB调节的抗凋亡蛋白MGMT、Survivin、Bcl-2和Bcl-xL的表达。进一步的免疫共沉淀结果分析表明,与正常对照组和TMZ组比较,TMZ+RGFP109组细胞乙酰化的赖氨酸残基的增加,显著增强了p65乙酰化水平。
此外,通过进一步的EMSA,证明了p65的乙酰化降低了其结合κB-DNA的能力,是导致NF-κB通路的活化受阻的重要原因。这也证明了RGFP109导致的p65乙酰化增强,减弱了p65与其κB-DNA结合的能力,阻断了NF-κB通路的活化,进而抑制κB-靶基因的表达,导致TR/U251细胞中NF-κB调节的抗凋亡蛋白MGMT、Survivin、Bcl-2和Bcl-xL的表达水平降低,逆转了对TMZ的化疗抵抗作用。此外,RGFP109良好的血脑屏障透过作用、较强的中枢神经系统组织代谢分布作用,以及对细胞组织的低毒性,都预示着RGFP109在胶质母细胞瘤化疗抵抗的逆转过程中有着良好的临床治疗价值。
[1] Li ZY,Zhang C,Zhang Y,et al.A novel HDAC6 inhibitor tubastatin A:controls HDAC6-p97/VCP-mediated ubiquitination-autophagy turnover and reverses temozolomide-induced ER stress-tolerance in GBM cells[J].Cancer Lett,2017,doi:10.1016/j.canlet.2017.01.025.
[2] Bredel M,Bredel C,Juric D,et al.Tumor necrosis factoralpha-induced protein 3 as a putative regulator of nuclear factor-kappaB-mediated resistance to O6-alkylating agents in human glioblastomas[J].J Clin Oncol,2006,24(2):274-287.
[3] Greene WC,Chen LF.Regulation of NF-kappaB action by reversible acetylation[J].Novartis Found Symp,2004,doi:10.1002/0470862637.
[4] Vermeulen L,De Wilde G,Van Damme P,et al.Transcriptional activation of the NF-kappaB p65 subunit by mitogen-and stress-activated protein kinase-1(MSK1)[J].EMBO,2003,22(6):1313-1324.
[5] Perkins ND,Gilmore TD.Good cop,bad cop:the different faces of NF-kappaB[J].Cell Death Differ,2006,13(5):759-772.
[6]Malvaez M,McQuown SC,Rogge GA,et al.HDAC3-selective inhibitor enhances extinction of cocaine-seeking behavior in a persistent manner[J].Proc Natl Acad Sci U S A,2013,110(7):2647-2652.
[7] Johnston TH,Huot P,Damude S,et al.RGFP109,a histone deacetylase inhibitor attenuates L-DOPA-induced dyskinesia in the MPTP-lesioned marmoset:a proof-ofconcept study[J].Parkinsonism Relat Disord,2013,19(2):260-264.
[8] Liu E,Wu J,Cao W,et al.Curcumin induces G2/M cell cycle arrest in a p53-dependent manner and upregulates ING4 expression in human glioma[J].J Neurooncol,2007,85(3):263-270.
[9] Perkins ND.Post-translational modifications regulating the activity and function of the nuclear factor kappa B pathway[J].Oncogene,2006,25(51):6717-6730.
Study on the Mechanism of Histone Deacetylase Inhibitor RGFP109 in Reversing Resistance of Glioma U251 Cells to Temozolomide
GUAN Chenfeng1,LI Yuzhen1,ZHANG Kaili1,LI Zongyang2,HUANG Guodong2(1.Dept.of Pharmacy,the Eighth Hospital Affiliated to Sun Yat-sen University,Guangdong Shenzhen 518000,China;2.Dept.of Neurosurgery,the First Hospital Affiliated to Shenzhen University,Guangdong Shenzhen 518035,China)
OBJECTIVE:To study the mechanism of histone deacetylase inhibitor RGFP109 in reversing resistance of glioma U251 cells.METHODS:TR/U251 cells resistance to temozolomide(TMZ)was extrablished.The test was divided into normal control group,TMZ group(40 μmol/L)and TMZ(40 μmol/L)+RGFP109(0-120 μmol/L)different concentrations groups.After 24 h of adding into related medicines,CCK-8 was used to detect the cell survival rate and calculate the half inhibitory concentration(IC50).TUNEL and Annexin V/PI were used to detect the cell apoptosis in normal control group,TMZ group and TMZ+RGFP109(42 μmol/L)group.Immunoblotting was used to detect the O6-methyl guanine-DNA methyltransferase(MGMT),Survivin,B lymphoma 2(Bcl-2),B lymphoma xL(Bcl-xL)protein expression;and gel migration test was used to detect the p65 acetylation level and its binding capacity with κB-DNA.RESULTS:Compared with normal control group,cell survival rate in TMZ+RGFP109 different concentrations groups was obviously decreased(P<0.05),showing a concentration-dependent manner.When the RGFP109 concentration was 42 μmol/L,the sensitivity of TMZ to TR/U251 cells was the same with U251 cells.Compared with normal control group,MGMT,Survivin,Bcl-2,Bcl-xL protein expressions in cells of TMZ groups were enhanced(P<0.01);p65 acetylation level had no obvious changes,while the binding capacity of p65 and κB-DNA was strengthened(P<0.01).Compared with TMZ group,MGMT,Survivin,Bcl-2,Bcl-xL protein expressions in cells of TMZ groups were weakened(P<0.01);p65 acetylation level was enhanced(P<0.01);and the binding capacity of p65 and κB-DNA was weakened(P<0.01).CONCLUSIONS:RGFP109 can reverse the resistance of U251 cells to TMZ by down-regulating the anti-apoptotic protein expressions adjusted by transcription factor κB(NF-κB)and weakening the binding of p65 and κB-DNA.
Histone deacetylase inhibitor RGFP109;Transcription factor κB;Temozolomide;Glioma U251 cells;Acetylation
R361+.3
A
1001-0408(2017)22-3091-05
2017-02-17
2017-06-01)(编辑:邹丽娟)
*主管药师。研究方向:神经肿瘤、临床药理学。电话:0755-83982222-30876。E-mail:guancf1117@sina.com
#通信作者:主任医师,教授,博士。研究方向:神经内镜、脑肿瘤基础和临床。电话:0755-83366388-3118。E-mail:jxgd211@163.com
DOI10.6039/j.issn.1001-0408.2017.22.18
