附睾上皮中单核吞噬细胞的研究进展①
2017-09-03马斌芳
马斌芳 汤 臻 马 赫 冯 潇 李 臻
(第四军医大学组织学与胚胎学教研室,西安710032)
附睾上皮中单核吞噬细胞的研究进展①
马斌芳 汤 臻②马 赫 冯 潇 李 臻
(第四军医大学组织学与胚胎学教研室,西安710032)
自20世纪60年代中期以来,许多研究人员对附睾的细胞和分子生物学进行了大量的研究,包括附睾的结构、基因表达、蛋白合成与功能研究等,但是附睾的免疫学研究报道相对较少。附睾管上皮为假复层纤毛柱状上皮,主要由主细胞、基细胞和亮细胞组成[1- 3]。近年来的研究发现附睾上皮中存在有单核吞噬细胞(Mononuclear phagocytes,MPs),高度提示男性生殖管道和免疫系统之间存在着动态的串话调节[4]。
1 单核吞噬细胞(Mononuclear phagocytes,MPs)
1.1 MPs的来源和分化 长期以来人们认为,巨噬细胞(Macrophage,Mφ)和树突状细胞(Dendritic cell,DC)来自血液中的单核细胞(Monocyte,Mo),这一观念在过去五年间被改变[5- 7],谱系示踪研究表明,稳态环境下,大多数组织中定居的Mφ来源于胚胎发育期的髓系祖细胞,并在局部自我更新;而炎症刺激后,循环的单核细胞进入组织并分化成Mφ和DC(图1)。成人体内DCs的分化方式如下:骨髓中的造血干细胞分化成普通单核祖细胞和普通树突前体细胞,单核祖细胞进一步分化为单核细胞,后者经过炎症感染后分化为单核DCs(Mononuclear DCs,moDCs)和单核Mφ(mononuclear Mφ,moMφ);而树突前体细胞进一步分化为DCs,最终形成经典DCs(classical DCs,cDCs)和浆细胞样DCs(plasmacytoid DCs,pDCs)[8]。每一个器官,在特定的微环境及其与外部环境动态作用下,形成高度特异性的MPs亚群[7]。因此,大多数外周器官都含有不同起源和表型的Mφ和DCs亚群,有些Mφ具有器官特异性的名称,如中枢神经系统的小胶质细胞、肝脏的库普弗细胞、肺脏中的尘细胞、皮肤的朗格汉斯细胞。DCs在不同组织也有不同名称,如:输出淋巴管中的面纱细胞,淋巴结中的滤泡树突状细胞等。
1.2 MPs的特性 Mφ和DCs是具有多种功能的免疫细胞,属于MPs中的不同家族,是专职抗原提呈细胞(Antigen- presenting cells,APCs),可内化外源性和内源性的抗原,与主要组织相容性复合体(Major histocompatibility complex,MHC)结合,形成抗原肽- MHC复合物表达在细胞表面并提呈给T细胞,刺激细胞毒性T细胞或辅助T细胞的分裂和分化,在组织自稳、防御感染、自身免疫及肿瘤等生理和病理状态中发挥重要的免疫调节作用。
Mφ的公认作用是对病原体、死亡细胞及其碎片的吞噬,被称为免疫系统的清道夫,在机体固有免疫中发挥重要作用。其细胞质较丰富,功能活跃时内含许多颗粒和空泡,具有变形运动和吞噬能力,主要参与非特异性和特异性免疫。活化后的Mφ可分化为M1和M2两个不同的亚群,M1型Mφ具有杀灭微生物及促炎症作用;M2型Mφ具有很强的免疫调节作用和组织修复能力但杀灭微生物功能很弱。在非特异性免疫中Mφ通过吞噬作用杀灭和清除病原体及异物,并介导炎症反应,而在特异性免疫中Mφ主要发挥免疫调节及抗原呈递功能[9]。相比Mφ,DCs的吞噬能力较弱,但细胞表面积较大,MHC表达水平比Mφ高10~100倍,具有较强捕获抗原和呈递抗原的能力,是特异性免疫应答的始动者,在获得性免疫中发挥重要作用[10]。cDCs存在多种功能特异的亚群,在外周非淋巴器官主要有CD103+DCs和CD11b+DCs两种亚型,CD103+DCs是专职的抗原提呈细胞,提呈外源性的抗原给CD8+T细胞,在病原体防御、肿瘤等免疫耐受中发挥重要作用[11,12],CD11b+DCs则主要表达高水平的MHC- Ⅱ分子,激活CD4+T细胞从而发挥免疫调节作用[13];pDCs则通过分泌干扰素参与抗病毒反应[14]。
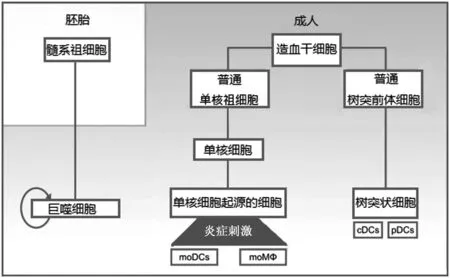
图1 小鼠MPs发生分化简图Fig.1 Simplified classification of mouse mononuclear phagocytes based on their ontogeny
简单区分Mφ和DCs并不能准确反映免疫系统的复杂性。首先,Mφ和DCs包括多种密切相关的细胞亚型,不同类型细胞的发生和功能各异,人们通常应用流式细胞技术检测细胞表面标记来区分MPs的亚群,但有些表面标记物并不能作为某种细胞的单一特征而是同时表达于多种细胞(表1[15])。例如CD11c和MHC- Ⅱ通常作为标志物被用于鉴别淋巴组织中的DCs,但是外周非淋巴组织中的Mφ也同时表达CD11c和MHC- Ⅱ;其次,Mφ和DCs的个体发生仍然是有争议的,二者在功能上也有所重叠,即DCs和Mφ都具有吞噬和抗原呈递功能[8]’最后,这些细胞具有极大的可塑性,为了应对变化的炎性环境,他们在形态、位置、表型和功能方面都在不断地变化。
2 附睾上皮中的MPs
2.1 附睾上皮中MPs的分布 附睾是精子成熟和储存的场所,其上皮属于假复层纤毛柱状上皮,主要由主细胞、亮细胞、狭窄细胞和基细胞(Basal cells,BCs)组成。这些细胞相互作用,共同维持一个相对稳定的环境以利于精子获得运动及受精能力[16- 18]。精子的成熟是一个复杂有序的过程,精子表达其他器官所没有的抗原,不但要抵御外来病原体的侵袭还要防止自身免疫,因此除了上皮细胞,免疫细胞也存在于附睾,如:上皮内淋巴细胞(又称Halo细胞)和Mφ[19- 21]。由于BCs表达Mφ特有抗原,并且形态和Mφ相似,研究者一度将BCs和Mφ相混淆,认为BCs就是附睾中的Mφ并发挥免疫功能[22- 24],后来Shum等[4]利用转基因鼠(CD11c- EYFP50和CX3CR1- GFP51)结合流式细胞及成像技术发现BCs和Mφ属于完全不同的细胞,Mφ表达F4/80、CX3CR1和CD11c,而BCs表达KRT5。目前认为,附睾中存在着错综复杂的MPs网络,MPs在附睾各段均有分布,且具有区域特异性[4]。在附睾起始段(Initial segment,IS),MPs(CD11c+、CX3CR1+)位于附睾上皮基底部,胞体紧贴基膜并伸出细长突起穿过上皮细胞到达管腔(图2);在头尾部,MPs位于附睾基膜和上皮细胞之间。Mφ在附睾各段分布不均一,而DCs在IS的分布明显比其他各段密集。Mφ在附睾头部有短的细胞突起,尾部几乎没有突起,DCs在头尾部均没有突起。此外在附睾管间隙及结缔组织膜上也存在少量Mφ和DCs。根据MPs的来源和分化,我们推测血液循环中的单核细胞和树突前体细胞进入附睾分化为成熟的CX3CR1+CD11c+F4/80+Mφs和CD11c+CD103+DCs,而附睾中定居的Mφ可在局部自我更新(图2),但此部分Mφ来源于胚胎时期的髓系祖细胞还是血液中的单核细胞还有待进一步研究。
表1 鉴别小鼠MPs的细胞表面标记[15]
Tab.1 Most common cell- surface markers used to identify murine MPs[15]

MarkerAlternatenamesExpressionCD11bITGAM,Mac-1Leukocytesincludingmonocytes/macrophsgesandsubsetsofDCsCD11cITGAXOftendescribedasaDCmarker,CD11cisalsofoundonsubsetsofmonocytesandmacropha-ges,aswellassubsetsoflymphocytes,NKcellsandneutrophilsCD103ITGAEExpressedonintestinalIELsandsubsetsofDCsCX3CR1CX3CL1receptorExpressedonsubsetsofmonocytes,DCs,macrophages,NKcellsandT-cells.F4/80EMR1(human)F4/80isexpressedbymurinematuremacrophagesMHCclassⅡMHCclassⅡExpressedonprofessionalAPCs,includingDCsandmacrophages
Note:MPs.Mononuclear phagocytes;DCs.Dendritic cells;NK.Natural killer;IELs.Intraepithelial lymphocytes;APCs.Antigen- presenting cells;MHC.Major histocompatibility complex;ITGAM.Integrin alpha M;ITGAX.Integrin alpha X;ITGAE.Integrin alpha E.
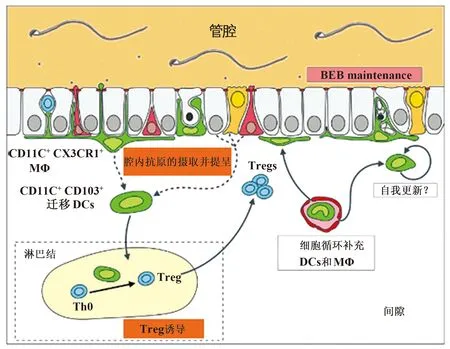
图2 稳定状态下小鼠附睾起始段中MPs的表型、分布及功能[15]Fig.2 Localization,phenotype and possible functions of MPs in steady[15]Note: Principal cells(gray),Clear or narrow cells(orange),BCs(red),lymphocytes(blue),MPs(green).
2.2 附睾上皮中MPs的生物学功能 MPs在淋巴器官以及外周非淋巴器官特别是小肠黏膜系统中的作用已被广泛研究。相对于与外界相通的器官如小肠或呼吸道,附睾处于相对稳定的环境,整个生育期附睾管腔被相对稳定的附睾液占据,只有在发育期会有大量精子涌入,尽管如此,附睾上皮仍然必须建立一个相对稳定的精子免疫防护机制。虽然很多学者都描述了Mφ和DCs在附睾中的存在,但是他们在附睾中的作用以及具体的免疫生理学机制目前尚不清楚。尽管小肠和附睾的环境不同,但他们的黏膜接受的是相似的免疫挑战,因此我们结合MPs的基本功能以及其在小肠黏膜中的作用,推测MPs在附睾中具有维护附睾内环境稳态,保证附睾精子正常成熟的作用。
2.2.1 维护血- 附睾屏障 血- 附睾屏障(Blood- epididymis barrier,BEB)由附睾上皮的紧密连接组成(图2),控制附睾管腔中的分子与外周血液和淋巴的相互作用,从而形成一种特定的环境,保护成熟中的精子不受外界的干扰,是附睾中天然的免疫生理屏障[25]。BEB功能的维持依赖于附睾上皮结构的完整,任何对附睾上皮紧密连接造成的破坏都将造成附睾生理和免疫屏障的开放,从而造成管腔微环境的改变以及精子抗原的泄露[26]。研究证实,对凋亡细胞的清除在维护附睾上皮中起着非常重要的作用,清除有缺陷的上皮细胞有助于上皮屏障结构的完整,保持附睾的自我免疫耐受,而清理不及时将会导致多种病理状态以及自身免疫性疾病[15,27- 29]。Mφ和DCs是清除凋亡细胞的专职细胞,有趣的是在附睾上皮很少发现凋亡细胞而MPs却分布很广,提示附睾上皮存在着高效的清除机制[30]。另外附睾上皮中的巨噬细胞高表达CX3CR1,已知凋亡细胞会释放“找到我”(find me)信号趋化吞噬细胞启动吞噬,而CX3CR1是“find me”分子CX3CL1的受体[15]。
MPs在附睾中的清除机制在输出小管结扎术(Efferent duct ligation,EDL)中被证实。EDL后,由于阻断了睾丸液进入附睾的起始段,从而引起附睾近端上皮细胞广泛的凋亡,这种急剧而大范围的凋亡可影响BEB结构的完整性[23,31]。然而研究者发现CX3CR1+CD11c+Mφ会通过表型和形态的改变对EDL造成的破坏做出快速反应,吞噬凋亡的上皮细胞及其碎片,保持附睾上皮紧密连接的完整[32](图2)。虽然EDL造成的这种凋亡在附睾正常生理中很少出现,但仍可以证实MPs在维持BEB稳定中的作用。而生理状态下上皮细胞的凋亡率很低,也可能在于Mφ有效的吞噬作用,使得上皮细胞能快速再生,防止其释放一些细胞残骸到附睾管腔,影响精子的成熟,具体机制还有待进一步研究[33]。
2.2.2 免疫监视并介导附睾局部的免疫反应 附睾最常见的病理反应是由尿路感染引起的附睾炎,附睾肿瘤更是极为罕见。在过去,人们很少关注附睾的免疫生理学。虽然附睾管腔内成分在整个生育期都保持相对恒定,但是附睾仍会受到致病菌的侵袭,特别是性传播细菌和病毒,如沙眼衣原体、淋病奈瑟菌和大肠杆菌可以经尿路引起附睾炎,从而引起暂时性或永久性的生育力改变[34,35];附睾也易受到病毒入侵,如人类免疫缺陷病毒HIV[36]。男性生殖功能的维持依赖于生殖器官及生殖道强有力的固有免疫和获得性免疫机制,虽然睾丸和附睾相邻,但相对于附睾,睾丸很少有炎症,表明睾丸的防御机制有附睾的参与,研究发现附睾可分泌大量的抑菌蛋白(β- 防御素)到管腔内从而参与固有免疫应答[37,38]。
鉴于Mφ和DCs的抗原提呈功能以及在附睾中的定位,其可能参与附睾的免疫监视。抗原提呈细胞(Antigen presenting cells,APs)捕获并提呈抗原后诱导获得性免疫应答,其可直接或间接的摄取抗原,在起始段,CX3CR1+CD11c+上皮内细胞可伸出长的突起直接获得管腔中的抗原,而附睾管周的APs可协同上皮细胞摄取管腔中成分[39](图2)。这种分工类似于其他的黏膜系统,如小肠,上皮中的杯状细胞、CX3CR1+Mφ、CD11c+DCs相互作用参与管腔抗原的摄取与提呈[40,41]。虽然附睾和小肠中的黏膜系统处于不同的环境,但他们有着极其相似的Mφ和DCs的分布。
附睾还会受循环血液中病原体的入侵,啮齿类动物附睾的血液供应并不丰富,但在IS,附睾管周却分布着密集的毛细血管网,包括有孔毛细血管[42,43]。IS的特征之一是具有较强的重吸收能力,睾丸液流经输出小管到达起始段时90%液体被重吸收,证明此处的毛细血管负责排出大量的液体,然而这个网络是双向的,IS处的毛细血管网除了重吸收附睾液外,或许也需要向附睾运输一些营养物质或者免疫细胞。虽然IS中毛细血管的的功能并不完全清楚,但是大量有孔毛细血管靠近附睾管可能会影响BEB的屏障功能。有趣的是,IS中Mφ和DCs尤其丰富,因此我们推测IS中的MPs不仅监测管腔成分的变化,而且监视血液中的抗原。在小肠,固有层中的CX3CR1+细胞和有孔毛细血管形成紧密联系以获取循环血液中的抗原,并提呈给CD8+T细胞诱导其分化[43]。基于附睾和小肠黏膜的相似性,IS可能是附睾中免疫反应极为活跃区,此处的Mφ和DCs可监测附睾管腔成分的变化以及毛细血管网中血流的变化,参与调节免疫反应。因此,IS中BEB可视为附睾中的天然免疫屏障,而Mφ和DCs是保护屏障的“卫士”。附睾的这种高度免疫活性可保护睾丸这个“免疫赦免”器官,使其免受病原体的入侵[44]。
2.2.3 诱导对精子抗原的免疫耐受 免疫系统的首要任务是保持对有害病原体的免疫防御和对自身抗原的免疫耐受之间的平衡。免疫耐受是与固有免疫和获得性免疫完全不同的免疫机制,分中枢耐受和外周耐受。中枢耐受形成于胚胎时期或免疫系统发育早期的胸腺和骨髓,涉及淋巴细胞识别和清除自身抗原,从而避免免疫系统对自身抗原的免疫反应。而外周耐受形成于T/B淋巴细胞成熟以后,有多种细胞和分子的参与,包括MPs[15]。生精细胞和成熟中的精子从青春期开始出现于生殖系统,表达机体其他部位没有的抗原,而此时中枢耐受已建立很长时间,所以当精子以1 000个/秒出现在附睾中时对于免疫系统来说是一个挑战[34,45],对精子抗原的自我免疫将导致不育,因此附睾在整个生育期必须有一个强大的耐受机制[34,45],这种机制称为外周耐受[46]。在小肠,CD103+DCs通过与上皮细胞或上皮中的Mφ相互作用,直接或间接地捕获抗原,然后在CCR7的作用下迁移到淋巴结,诱导CD4+调节性T细胞(regulatory T cells,Treg)的发展分化,Treg可表达转录因子FoxP3+,抑制效应T细胞的活化,从而避免对自身抗原或无害抗原的免疫反应[40,41,47]。附睾近段上皮密集分布着和在小肠黏膜中极为相似的MPs,上皮内的CX3CR1+Mφ可伸出长的突起到达管腔[4],新近研究证实CX3CR1+CD11c+Mφ具有吞噬功能,表明他们可以直接摄取附睾管腔中的可溶性抗原或微粒[39],因此我们推测Mφ可以直接获取精子抗原,或者改变附睾上皮细胞顶部的紧密连接,通过渗透间接获得精子成分,并通过与附睾上皮中的CD11c+CD103+DCs相互作用启动免疫耐受。而体外研究也证实从小鼠附睾分离的CD11c+MPs具有抗原提呈作用[48]。
此外附睾中也存在多种免疫抑制因子,如IL- 10、转化生长因子β、吲哚胺2,3加双氧酶(Indolea- mine 2,3- dioxygenase,Ido),Ido可通过调节色氨酸的分解代谢发挥免疫抑制作用,在小肠,CD11c+CD103+DCs可合成Ido,从而调节Treg的发展分化,参与小肠的口服免疫耐受[49]。在小鼠模型中破坏Ido可改变附睾的免疫平衡,影响精子的数量和质量,然而CD103+DCs不是附睾中Ido的主要来源,Ido在DCs和Mφ中的作用还有待进一步研究[50]。
2.2.4 参与精子的质量控制和附睾管的收缩 关于附睾上皮细胞监测并清除异常精子,控制精子质量这一学说一直备受争议[51- 53],有实验证实,附睾管结扎或输精管切除将会导致附睾上皮破裂、局部炎症,最后大量精子和免疫细胞(包括巨噬细胞)聚集形成精子肉芽肿,虽然附睾中存在精子自噬以及异常精子的吞噬[51,54],但目前还没有确切证据证实Mφ在监测和清除有缺陷精子这一生理活动中的作用。另外,最新研究显示,小肠肌层的Mφ通过与肠神经相互作用调节肠道的蠕动[55],而精子在附睾中的运输同样需要附睾管的收缩,因此我们推测附睾管周的巨噬细胞可能与周围神经相互作用,参与附睾管的收缩,以利于精子在附睾中的运动。
3 结语
人们对哺乳动物附睾的研究已有半个世纪,但对精子的成熟调控机制却知之甚少[56]。附睾的功能受其他器官系统以及附睾中免疫细胞的影响,表明男性生殖管道和免疫系统存在动态的串话机制。最近Mφ和DCs在附睾中的发现,使人们更加关注其在附睾中的生理学意义。人们致力于肠黏膜的研究已多年,相关黏膜免疫学知识在不断更新,幸运的是Mφ和DCs在肠和附睾中的功能和形态的相似性,使得人们能利用在小肠中的发现去推测附睾黏膜免疫的功能。EBE在附睾中的免疫学意义已被普遍认可[43],然而最新研究发现IS是附睾主要的免疫调节部位,MPs在IS密集分布且唯独在此处伸出长的突起到管腔,精子离开睾丸后在此处与上皮细胞,包括上皮内的MPs相互作用,因此IS被视为附睾中的“流式细胞分析仪”[15]。此外IS中淋巴管较少,推测IS并不是DCs迁徙和进行抗原提呈的主要部位,或者此处DCs迁徙和进行抗原提呈的效率非常高,稀疏的淋巴管就可以维持免疫平衡。而在附睾的头体尾部,MPs分布在上皮基底部以及分散在管周间隙中,且没有树状突起,说明并没有直接获取管腔抗原。有趣的是附睾尾部淋巴系统较为丰富,预示APCs除了IS也可在此处迁移到淋巴管中,因此在分析附睾独特黏膜功能时,必须考虑MPs在附睾不同节段(输出小管、头、体、尾)上皮中的分布差异以及形态的多样性。此外,Mφ和DCs在外周具有器官特异性,所以对Mφ和DCs及其他免疫细胞的研究必须在其各自相应的环境中,虽然附睾MPs形态、表型与小肠、肾脏、小脑相似,但在附睾独特微环境中的作用仍需进一步研究。
对附睾黏膜的研究不应只关注生殖生理学作用,还应进一步了解其在外周耐受和保护生殖管道不受病原体侵袭,以及保持附睾癌的极低发生率中的作用。研究附睾黏膜免疫学,将有助于阐明附睾免疫调节机制,进一步理解男性生殖调控并确定免疫避孕的有效靶点。
[1] Sullivan R,Mieusset R.The human epididymis:its function in sperm maturation[J].Hum Reprod Update,2016,22(5):574- 587.
[2] Wang H,Kumar TR.Segment- and cell- specific expression of D- type cyclins in the postnatal mouse epididymis[J].Gene Expr Patterns,2012,12(3- 4):136- 144.
[3] Robaire BHL.Efferent ducts,epididymis,and vas deferens:structure,functions,and their regulation[M].2nd edition.New York:Raven Press,1988:691- 771.
[4] Shum WW,Smith TB,Cortez- Retamozo V,etal.Epithelial basal cells are distinct from dendritic cells and macrophages in the mouse epididymis[J].Biol Reprod,2014,90(5):90.
[5] Gomez PE,Klapproth K,Schulz C,etal.Tissue- resident macrophages originate from yolk- sac- derived erythro- myeloid progenitors[J].Nature,2015,518(7540):547- 551.
[6] Hoeffel G,Chen J,Lavin Y,etal.C- Myb(+)erythro- myeloid progenitor- derived fetal monocytes give rise to adult tissue- resident macrophages[J].Immunity,2015,42(4):665- 678.
[7] Gosselin D,Link VM,Romanoski CE,etal.Environment drives selection and function of enhancers controlling tissue- specific macrophage identities[J].Cell,2014,159(6):1327- 1340.
[8] Da SN,Barton CR.Macrophages and dendritic cells in the post- testicular environment[J].Cell Tissue Res,2016,363(1):97- 104.
[9] Martinez FO,Gordon S.The M1 and M2 paradigm of macrophage activation:time for reassessment[J].F1000Prime Report,2014,6:13.
[10] Banchereau J,Steinman R M.Dendritic cells and the control of immunity[J].Nature,1998,392(6673):245- 252.
[11] Haniffa M,Collin M,Ginhoux F.Identification of human tissue cross- presenting dendritic cells:A new target for cancer vaccines[J].Oncoimmunology,2013,2(3):e23140.
[12] Joffre OP,Segura E,Savina A,etal.Cross- presentation by dendritic cells[J].Nat Rev Immunol,2012,12(8):557- 569.
[13] Mildner A,Jung S.Development and function of dendritic cell subsets[J].Immunity,2014,40(5):642- 656.
[14] Reizis B,Bunin A,Ghosh HS,etal.Plasmacytoid dendritic cells:recent progress and open questions[J].Annu Rev Immunol,2011,29:163- 183.
[15] Da SN,Smith TB.Exploring the role of mononuclear phagocytes in the epididymis[J].Asian J Androl,2015,17(4):591- 596.
[16] Cornwall GA.New insights into epididymal biology and function[J].Hum Reprod Update,2009,15(2):213- 227.
[17] Simerly C,Castro C,Hartnett C,etal.Post- testicular sperm maturation:centriole pairs,found in upper epididymis,are destroyed prior to sperm′s release at ejaculation[J].Scientific Report,2016,6:31816.
[18] Robaire BH.The epididymis[M].3rd ed.New York:Elsevier Academic Press,2006:1072- 1148.
[19] Serre VRB.Interactions of the immune system and the epididymis[M].New York:Kluwer Academic/Plenum,2002:219- 231.
[20] Seiler P,Cooper TG,Yeung CH,etal.Regional variation in macrophage antigen expression by murine epididymal basal cells and their regulation by testicular factors[J].J Androl,1999,20(6):738- 746.
[21] Flickinger CJ,Bush LA,Howards SS,etal.Distribution of leukocytes in the epithelium and interstitium of four regions of the Lewis rat epididymis[J].Anat Rec,1997,248(3):380- 390.
[22] Seiler P,Wenzel I,Wagenfeld A,etal.The appearance of basal cells in the developing murine epididymis and their temporal expression of macrophage antigens[J].Int J Androl,1998,21(4):217- 226.
[23] Seiler P,Cooper TG,Yeung CH,etal.Regional variation in macrophage antigen expression by murine epididymal basal cells and their regulation by testicular factors[J].J Androl,1999,20(6):738- 746.
[24] Yeung CH,Nashan D,Sorg C,etal.Basal cells of the human epididymis- - antigenic and ultrastructural similarities to tissue- fixed macrophages[J].Biol Reprod,1994,50(4):917- 926.
[25] Dube E,Cyr DG.The blood- epididymis barrier and human male fertility[J].Adv Exp Med Biol,2012,763:218- 236.
[26] Mital P,Hinton BT,Dufour JM.The blood- testis and blood- epididymis barriers are more than just their tight junctions[J].Biol Reprod,2011,84(5):851- 858.
[27] Elliott MR,Ravichandran KS.Clearance of apoptotic cells:implications in health and disease[J].J Cell Biol,2010,189(7):1059- 1070.
[28] Elliott MR,Ravichandran KS.ELMO1 signaling in apoptotic germ cell clearance and spermatogenesis[J].Ann N Y Acad Sci,2010,1209:30- 36.
[29] Hochreiter- Hufford A,Ravichandran K S.Clearing the dead:apoptotic cell sensing,recognition,engulfment,and digestion[J].Cold Spring Harb Perspect Biol,2013,5(1):a8748.
[30] Yeung C,Kai W,Cooper ATG.Why are epididymal tumours so rare?[J].Asian J Androl,2012,14(3):465- 475.
[31] Turner TT,Johnston DS,Finger JN,etal.Differential gene expression among the proximal segments of the rat epididymis is lost after efferent duct ligation[J].Biol Reprod,2007,77(1):165- 171.
[32] Smith TB,Cortez- Retamozo V,Grigoryeva L S,etal.Mononuclear phagocytes rapidly clear apoptotic epithelial cells in the proximal epididymis[J].Andrology,2014,2(5):755- 762.
[33] Kim B,Roy J,Shum WW,etal.Role of testicular lu minal factors on Basal cell elongation and proliferation in the mouse epididymis.[J].Biol Reprod,2015,92(1):9.
[34] Hedger M P.Immunophysiology and pathology of inflammation in the testis and epididymis[J].J Androl,2011,32(6):625- 640.
[35] Redgrove KA,McLaughlin EA.The role of the immune response in chlamydia trachomatis infection of the male genital tract:a double- edged sword[J].Front Immunol,2014,5:534.
[36] Mullen TE Jr,Kiessling RL,Kiessling AA.Tissue- specific populations of leukocytes in semen- producing organs of the normal,hemicastrated,and vasectomized mouse[J].AIDS Res Hum Retrovir,2003,19(3):235- 243.
[37] Dorin JR,Barratt CL.Importance of beta- defensins in sperm function[J].Mol Hum Reprod,2014,20(9):821- 826.
[38] Hall SH,Yenugu S,Radhakrishnan Y,etal.Characterization and functions of beta defensins in the epididymis[J].Asian J Androl,2007,9(4):453- 462.
[39] Wang P,Duan YG.The role of dendritic cells in male reproductive tract[J].Am J Reprod Immunol,2016,76(3):186- 192.
[40] Mazzini E,Massimiliano L,Penna G,etal.Oral tolerance can be established via gap junction transfer of fed antigens from CX3CR1(+)macrophages to CD103(+)dendritic cells[J].Immunity,2014,40(2):248- 261.
[41] McDole JR,Wheeler LW,McDonald KG,etal.Goblet cells deliver lu minal antigen to CD103+ dendritic cells in the small intestine[J].Nature,2012,483(7389):345- 349.
[42] Abe K,Takano H,Ito T.Microvasculature of the mouse epididymis,with special reference to fenestrated capillaries localized in the initial segment[J].Anat Rec,1984,209(2):209- 218.
[43] Hirai S,Naito M,Terayama H,etal.Difference in abundance of blood and lymphatic capillaries in the murine epididymis[J].Med Mol Morphol,2010,43(1):37- 42.
[44] Forrester JV,Xu H,Lambe T,etal.Immune privilege or privileged immunity?[J].Mucosal Immunol,2008,1(5):372- 381.
[45] Hedger MP H D.Immunophysiology of the male reproductive tract[M].Amsterdam:Elsevier Academic,2006:1195- 1286.
[46] Mueller DL.Mechanisms maintaining peripheral tolerance[J].Nat Immunol,2010,11(1):21- 27.
[47] Scott CL,Aumeunier AM,Mowat AM.Intestinal CD103+ dendritic cells:master regulators of tolerance?[J].Trends Immunol,2011,32(9):412- 419.
[48] Da SN,Cortez- Retamozo V,Reinecker HC,etal.A dense network of dendritic cells populates the murine epididymis[J].Reproduction,2011,141(5):653- 663.
[49] Matteoli G,Mazzini E,Iliev ID,etal.Gut CD103+ dendritic cells express indolea mine 2,3- dioxygenase which influences T regulatory/T effector cell balance and oral tolerance induction[J].Gut,2010,59(5):595- 604.
[50] Jrad- La mine A,Henry- Berger J,Damon- Soubeyrand C,etal.Indolea mine 2,3- dioxygenase 1(ido1)is involved in the control of mouse caput epididymis immune environment[J].PLoS One,2013,8(6):e66494.
[51] Jones R.Sperm survival versus degradation in the Mammalian epididymis:a hypothesis[J].Biol Reprod,2004,71(5):1405- 1411.
[52] Sutovsky P.Ubiquitin- dependent proteolysis in mammalian spermatogenesis,fertilization,and sperm quality control:killing three birds with one stone[J].Microsc Res Tech,2003,61(1):88- 102.
[53] Cooper TG,Yeung CH,Jones R,etal.Rebuttal of a role for the epididymis in sperm quality control by phagocytosis of defective sperm[J].J Cell Sci,2002,115(Pt 1):5- 7.
[54] Arrighi S,Romanello MG,Domeneghini C.Ultrastructure of the epithelium that lines the ductuli efferentes in domestic equidae,with particular reference to spermatophagy[J].Acta Anat(Basel),1994,149(3):174- 184.
[55] Muller PA,Koscso B,Rajani GM,etal.Crosstalk between muscularis macrophages and enteric neurons regulates gastrointestinal motility[J].Cell,2014,158(2):300- 313.
[56] Cooper TG.Epididymal research:more warp than weft?[J].Asian J Androl,2015,17(5):699- 703.
[收稿2017- 02- 16]
(编辑 倪 鹏)
10.3969/j.issn.1000- 484X.2017.08.027
①本文为国家自然科学基金(No.31272606)和陕西省自然科学基金(No.2014JZ006,No.2016JM8084)资助项目。
马斌芳(1982年-),女,硕士,讲师,主要从事男性生殖方面的研究,E- mail: zupeimbf@fmmu.edu.cn。
及指导教师:李 臻(1974年-),女,博士,副教授,硕士生导师,主要从事男性生殖方面研究,E- mail:lizhenhe@fmmu.edu.cn。
Q492.4
A
1000- 484X(2017)08- 1246- 06
②共同第一作者,第四军医大学临床医学系,西安710032。