EpCAM蛋白激活DC诱导抗原特异性CTL治疗卵巢癌的实验研究
2017-09-03杨晓东赵卫东席玉玲
杨晓东 赵卫东 席玉玲
(安徽医科大学附属省立医院妇产科,合肥230001)
·生物治疗·
EpCAM蛋白激活DC诱导抗原特异性CTL治疗卵巢癌的实验研究
杨晓东 赵卫东 席玉玲①
(安徽医科大学附属省立医院妇产科,合肥230001)
目的:探讨EpCAM蛋白激活树突细胞(DC)诱导产生CD8+细胞毒T淋巴细胞(CD8+CTL)进行卵巢癌免疫治疗的效果,为卵巢癌的临床治疗提供帮助。方法:利用EpCAM蛋白诱导成熟DC同时检测DC表面分子和白介素(IL)- 10与IL- 12表达量的变化,随后通过EpCAM- DC诱导EpCAM抗原特异性CD8+CTL,继而检测EpCAM- DC- CD8+CTL对正常卵巢上皮细胞IOSE80和卵巢癌细胞SKVO3的杀伤效果,同时检测干扰素(IFN)- γ释放量。随后进一步检测EpCAM- DC- CD8+CTL对卵巢癌移植裸鼠的肿瘤抑制程度,并通过病理学染色检测治疗后肿瘤组织变化情况。结果:与PBS刺激相比,EpCAM蛋白能够显著上调DC表面分子DC80、DC83、DC86和HLA- DR水平,依次达到4.79、4.85、4.60和10.91倍;同时EpCAM蛋白显著提高IL- 12释放和显著抑制IL- 10分泌(P<0.05)。DC- CD8+CTL与EpCAM- DC- CD8+CTL均引起少量IOSE80细胞凋亡(P>0.05),但EpCAM- DC- CD8+CTL对SKVO3细胞杀伤率是DC- CD8+CTL的6.82倍(P<0.05)。动物实验表明,经EpCAM- DC- CD8+CTL治疗后,BALB/c- nu/nu卵巢癌移植肿瘤体积比明显低于PBS组以及DC- CD8+CTL组,分别达到0.27和0.28倍(P<0.05)。HE染色显示 EpCAM- DC- CD8+CTL治疗导致肿瘤组织出现明显的病理学改变。结论:EpCAM蛋白刺激促进了DC成熟继而诱导产生EpCAM特异性CD8+CTL,EpCAM- DC- CD8+CTL能够高效的杀伤肿瘤细胞并延迟肿瘤生长,对卵巢癌临床免疫治疗具有重要意义。
卵巢癌;免疫治疗;EpCAM;DC;CTL
卵巢癌是女性中常见的生殖器官恶性肿瘤,是女性中死亡率最高的肿瘤之一。对女性的生命健康造成了严重的威胁[1,2]。手术、化疗以及放疗由于自身的局限性限制了其癌症治疗的效果,寻找特异性的卵巢癌治疗方案成为广大医疗工作者研究的重点[3]。肿瘤免疫治疗由于特异性强、治疗效果明显以及副作用低而受到了人们的关注[4]。EpCAM具有良好的肿瘤特异性,在肿瘤细胞膜表面高表达,使其成为肿瘤免疫治疗的理想靶点,推动了肿瘤免疫治疗的进行[5]。本研究通过EpCAM蛋白刺激而获得能够呈递EpCAM抗原的成熟DC细胞,后者进一步刺激T细胞而获得能够识别EpCAM蛋白的抗原特异性CD8+CTL细胞,并探讨了EpCAM特异性CD8+CTL的抗肿瘤特性,为卵巢癌的临床免疫治疗提供帮助。
1 材料与方法
1.1 材料 SKVO3细胞(人卵巢癌细胞系)和IOSE80细胞(人正常卵巢细胞系)购于美国ATCC,RPMI1640、DMEM培养基购于美国Cyagen;10%胎牛血清(FBS)购于天杭生物科技有限公司;粒细胞- 巨噬细胞集落刺激因子(GM- CSF)、EpCAM抗原、IL- 12和IL- 10酶联免疫吸附法试剂盒购于武汉默沙克生物科技有限公司;TNF- α、人IFN- γELISpot试剂盒、磁珠分选试剂盒(eBioscience)购于美国BD公司;Attune NxT声波聚焦流式细胞仪(ThermoFisher)及相关抗体购于美国BD公司;BS- 1101酶标分析仪购于南京德铁实验设备有限公司;CCK- 8试剂购于日本同仁化学研究所,游标卡尺购于台湾宝工工具有限公司;BALB/c- nu/nu裸鼠(4周)购于中国医学科学院药物研究所, 实验动物使用许可证号:SYXK(京)2004- 0001。裸鼠饲养及动物实验严格按照中国医学科学院药物研究所相关要求进行。
1.2 方法
1.2.1 EpCAM蛋白诱导成熟DC 采集健康志愿者新鲜外周血10 ml,室温下2 000 r/min离心20 min,收集处于上层和中层间的白色狭窄细胞带,并培养于6孔培养板内,贴壁2 h后,添加RPMI1640培养基2 ml,之后加入IL- 4 (500 U/ml)以及GM- CSF(1 000 U/ml),培养至第3天,分成2组,一组加入PBS,另一组加入EpCAM抗原,培养至第6天时候加入1 000 U/ml TNF- α,刺激DC成熟后,在第7~8天收获EpCAM- DC和成熟DC。未贴壁细胞转至另一个6孔培养板,加入2 ml RPMI1640(含10%FBS),同时加入50 ng/ml IL- 4以及100 ng/ml GM- CSF,进行T细胞培养。
1.2.2 DC表型检测 收集成熟DC以及EpCAM- DC,调整细胞密度为1×106个/ml,培养后加入CD80、DC83、DC86和HLA- DR抗体进行标记,之后加入二抗羊抗小鼠IgG- FITC孵育,最后用Attune NxT声波聚焦流式细胞仪(ThermoFisher)进行检测,操作严格按照产品说明进行。
1.2.3 IL- 10和IL- 12检测 将4×105个/ml成熟DC和EpCAM- DC细胞分别接种于6孔板中,培养至第2天收集细胞上清,采用酶联免疫吸附法检测IL- 10和IL- 12,吸光度由BS- 1101酶标分析仪测定,并通过标准曲线计算IL- 10和IL- 12浓度,操作流程严格按照说明书进行。
1.2.4 CD8+CTL的体外诱导培养 成熟DC以及EpCAM- DC经0.25 Gy γ射线照射后制备刺激细胞,按T细胞∶DC为10∶1比例进行共培养,同时加入 50 U/ml 的IL- 2,培养7 d,重复上述操作3次。收获CTL细胞,然后孵育CD8抗体,通过磁珠分选试剂盒(eBioscience)筛选CD8+CTL,相关操作流程严格按照试剂盒说明书进行。
1.2.5 细胞培养 SKVO3细胞培养于RPMI1640培养基中,同时加入10%胎牛血清FBS;IOSE80细胞培养于DMEM(高糖)培养基中,同时加入10%FBS;待细胞密度达到80%时,进行消化传代培养。
1.2.6 CD8+CTL肿瘤细胞杀伤效应检测 DC- CD8+CTL和EpCAM- DC- CD8+CTL分别和IOSE80与SKVO3细胞以40∶1的比例进行培养,培养24 h后,加入10 μl CCK- 8试剂,通过BS- 1101酶标分析仪测定吸光度,并计算相关细胞凋亡率,操作流程严格按照说明书进行。
1.2.7 ELISPOT检测IFN- γ 将IFN- γ抗体(Abc- am)预包被96孔板,加入DC- CD8+CTL和EpCAM- DC- CD8+CTL分别和IOSE80与SKVO3细胞共培养,单独CD8+CTL作阴性对照,植物血凝素刺激的CD8+CTL作阳性对照,细胞培养24 h后进行显色,然后计算IFN- γ阳性斑点数目,操作严格按照产品说明进行。
1.2.8 建立裸鼠卵巢癌模型 将100 μl SKVO3细胞(1×106个)接种于裸鼠背部,饲养形成卵巢癌荷瘤裸鼠。待肿瘤体积长至80 mm3时进行治疗实验。
1.2.9 CD8+CTL免疫治疗卵巢癌荷瘤小鼠 将18只卵巢癌荷瘤裸鼠随机分为3组:PBS组、DC- CD8+CTL组与EpCAM- DC- CD8+CTL组,每组各6只;PBS组裸鼠尾静脉注射100 μl PBS,DC- CD8+CTL组裸鼠尾静脉注射100 μl DC- CD8+CTL(2×107个),EpCAM- DC- CD8+CTL组裸鼠尾静脉注射100 μl EpCAM- DC- CD8+CTL (2×107个),每组裸鼠间隔一周进行1次治疗。
1.2.10 肿瘤体积检测 应用游标卡尺定期测量3组荷瘤裸鼠肿瘤长短直径,并计算各组裸鼠肿瘤体积,计算公式:肿瘤体积=(L×W2)/2,W表示肿瘤短直径,L表示肿瘤长直径。
1.2.11 肿瘤组织病理学检测 经不同方案治疗22 d的荷瘤裸鼠处死,收集肿瘤组织进行石蜡切片机苏木精- 伊红(HE)染色,详细程序严格按照HE染色程序与石蜡切片程序进行。

2 结果
2.1 EpCAM刺激对DC细胞表面分子的影响 流式细胞分析显示EpCAM刺激的DC细胞表面分子CD80、DC83、DC86和HLA- DR阳性细胞率显著升高,依次达到PBS刺激的表面分子阳性细胞的4.79、4.85、4.60和10.91倍(P<0.05),说明EpCAM刺激有利于DC细胞的抗原呈递,见图1。
2.2 EpCAM刺激DC释放IL- 10和IL- 12情况ELISA检测结果说明EpCAM能够显著抑制DC释放IL- 10,EpCAM- DC组IL- 10水平是DC组的0.83倍(P<0.05);然而EpCAM显著促进DC释放IL- 12,EpCAM- DC组IL- 12水平是DC组的1.48倍(P<0.05),见图2。
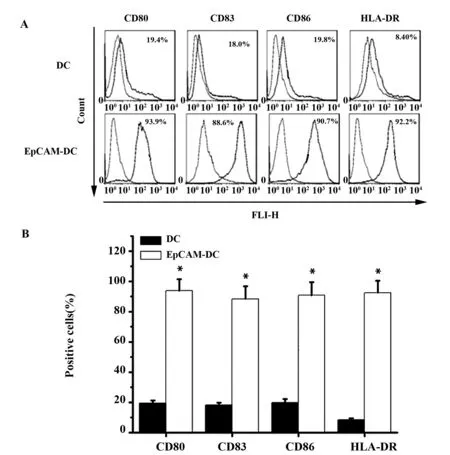
图1 EpCAM刺激对DC细胞表面标记物的影响Fig.1 Effect of EpCAM stimulation on surface markers of DC cellsNote: A.Effects of EpCAM stimulation on surface phenotype of DC by flow cytometry;B.Statistical analysis of DC surface phenotype positive cells.Compared with DC group,*.P<0.05.
2.3 CD8+CTL与IOSE80或SKVO3培养后IFN- γ释放情况 酶联免疫斑点实验显示,DC- CD8+CTL和EpCAM- DC- CD8+CTL分别与正常卵巢上皮细胞IOSE80共培养后,IFN- γ斑点数量相近,差异无统计意义(P>0.05);而EpCAM- DC- CD8+CTL与人卵巢癌细胞SKVO3共培养后,IFN- γ斑点数量显著高于DC- CD8+CTL组斑点数目,同时其显著高于EpCAM- DC- CD8+CTL与IOSE80共培养的IFN- γ的斑点数量(P<0.05),见图3。
2.4 CD8+CTL诱导细胞凋亡情况 应用CCK- 8检测CD8+CTL诱导细胞凋亡情况发现,DC- CD8+CTL与EpCAM- DC- CD8+CTL分别诱导IOSE80的细胞凋亡率相近,差异无统计学意义(P>0.05);与DC- CD8+CTL相比,EpCAM- DC- CD8+CTL能够显著提高卵巢癌细胞SKVO3凋亡率,其凋亡率增加6.82倍,EpCAM- DC- CD8+CTL诱导SKVO3的凋亡率是诱导IOSE80的凋亡率的6.37倍(P<0.05),见图4。
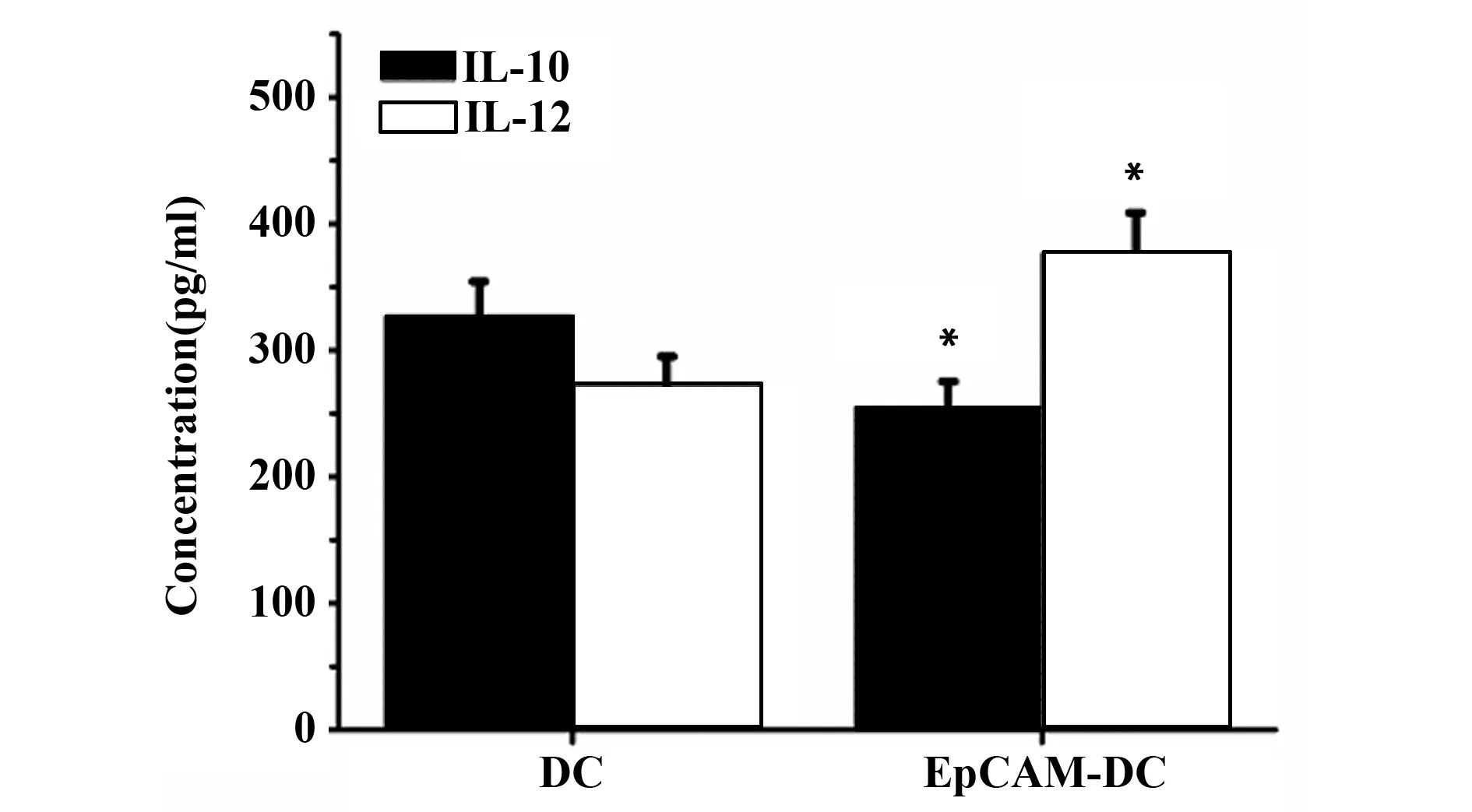
图2 EpCAM刺激对DC释放IL- 10与IL- 12的影响Fig.2 Effect of EpCAM stimulation on DC release of IL- 10 and IL- 12Note: Compared with DC group,*.P<0.05.

图3 CD8+ CTL和IOSE80或SKVO3细胞培养后IFN- γ释放情况Fig.3 Released of IFN- γ after CD8+ CTL and IOSE80 or SKVO3 cell cultureNote: Compared with DC- CD8+ CTL in the incubation of SKVO3,*.P<0.05;compared with EpCAM- DC- CD8+ CTL in the incubation of IOSE80,#.P<0.05.
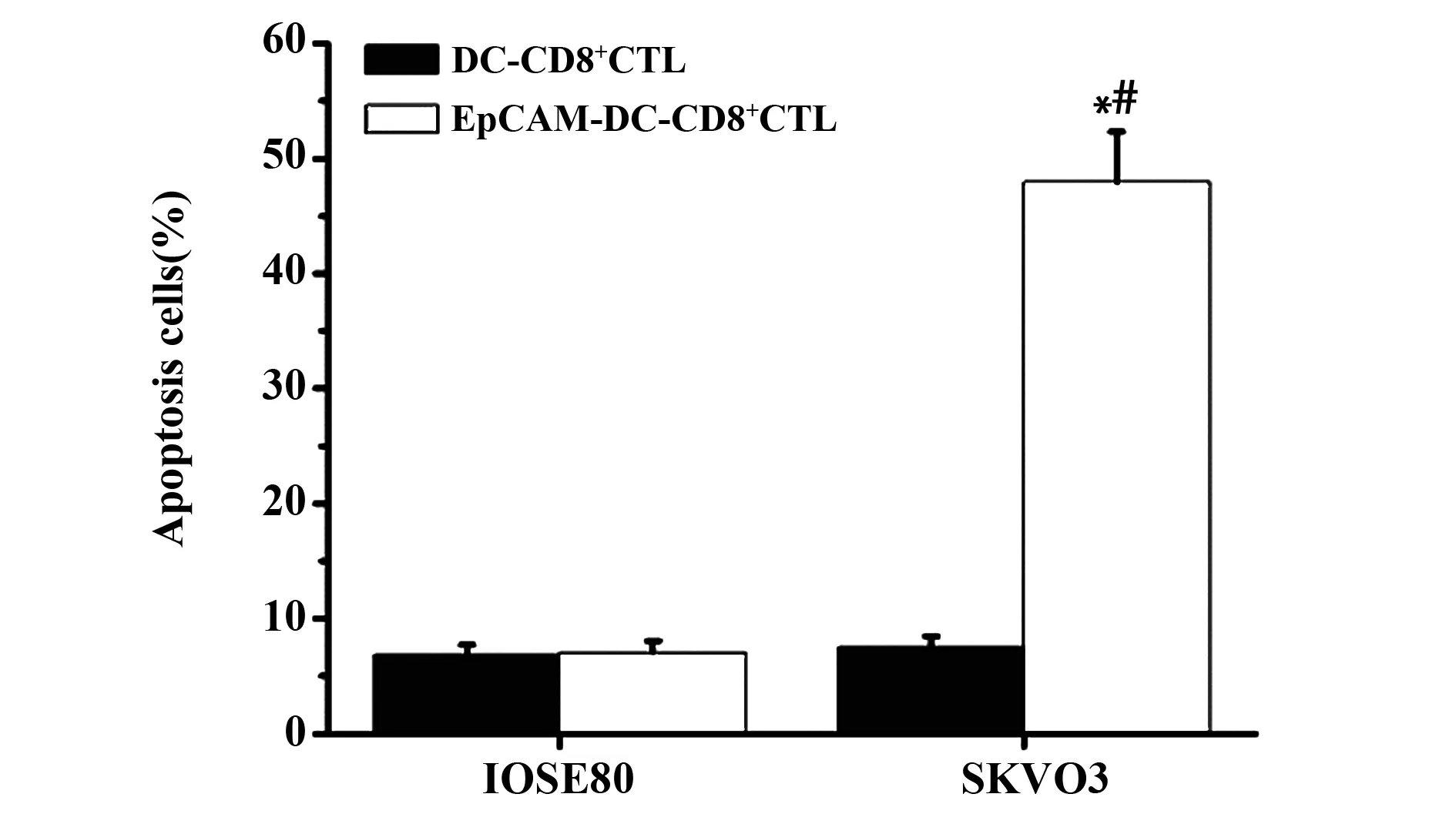
图4 CD8+ CTL诱导细胞凋亡情况Fig.4 CD8+ CTL induced apoptosisNote: Comparison of SKVO3 incubation with DC- CD8+ CTL,*.P<0.05;comparison of IOSE80 incubation with EpCAM- DC- CD8+ CTL,#.P<0.05.
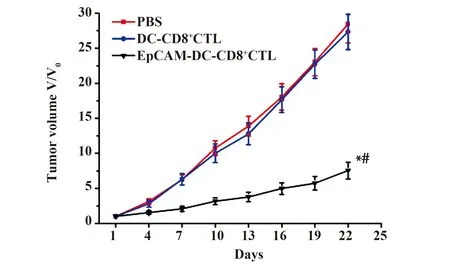
图5 各组荷瘤小鼠经免疫治疗后肿瘤体积变化情况Fig.5 Changes of tumor volume after immunotherapy in each group of miceNote: Compared with PBS group,*.P<0.05;compared with DC- CD8+ CTL group,#.P<0.05.
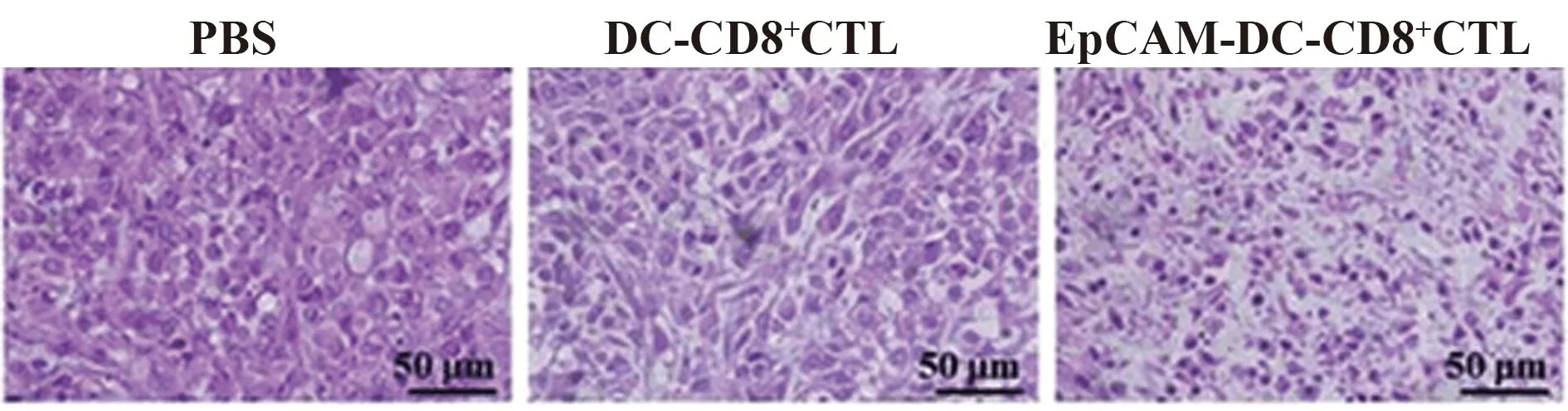
图6 CD8+ CTL治疗后BALB/c- nu/nu肿瘤组织HE染色Fig.6 HE staining of BALB/c- nu/nu tumor after CD8+ CTL treatment
2.5 CD8+CTL免疫治疗对BALB/c- nu/nu裸鼠卵巢癌肿瘤体积影响 免疫治疗前,各组BALB/c- nu/nu裸鼠肿瘤体比较差异不明显(P>0.05);PBS处理后BALB/c- nu/nu裸鼠肿瘤体积明显增加,达到28.45倍,BALB/c- nu/nu裸鼠经DC- CD8+CTL处理后,肿瘤体积明显增加,达到27.34倍,肿瘤体积比比较无差异(P>0.05)。BALB/c- nu/nu荷瘤小鼠经过EpCAM- DC- CD8+CTL处理后,肿瘤体积缓慢增加,达到治疗前的7.54倍,其肿瘤体积比明显低于PBS组以及DC- CD8+CTL组(P<0.05),见图5。
2.6 荷瘤小鼠经CD8+CTL治疗后肿瘤组织HE染色 BALB/c- nu/nu荷瘤鼠经PBS与DC- CD8+CTL处理后,肿瘤组织HE染色结果表明肿瘤细胞排列紧密同时核仁明显,未发现明显的病理学改变。EpCAM- DC- CD8+CTL处理后的肿瘤组织细胞核出现明显固缩同时细胞间隙增大,并且出现明显的水肿和空泡现象,见图6。
3 讨论
卵巢癌是女性中常见的生殖器官恶性肿瘤,多发于35岁以上的中年女性,且死亡率在女性妇科肿瘤中占首位[6]。目前,卵巢癌具有较高的死亡率,并且早期诊断困难,易错过最佳治疗时机,同时出现癌症转移[7]。对患者的生命健康造成严重威胁。手术、化疗以及放疗由于自身的局限性限制了其癌症治疗的效果,在杀伤肿瘤细胞的同时对身体造成严重的损伤[8]。如何特异性地进行癌症治疗成为了癌症治疗的关键。免疫治疗是一种先进的癌症治疗方式,具有特异性高、副作用小以及肿瘤杀伤效果明显的特点,受到了人们的广泛关注[9,10]。肿瘤免疫治疗能够通过提高免疫细胞的肿瘤抗原识别能力以及杀伤敏感性,免疫细胞回输后,能够提高机体固有免疫功能,达到杀伤肿瘤细胞的作用,同时减少了机体的损伤[11,12]。然而合适的肿瘤识别靶点是保证免疫治疗成功实施的关键[13]。EpCAM是一种钙离子非依赖性的是嗜同种上皮细胞间黏附分子,在上皮细胞中高表达,而卵巢肿瘤以卵巢上皮癌最为常见,因此EpCAM是上皮源性恶性肿瘤的理想标志物[14]。相关研究表明,EpCAM是一种理想的肿瘤干细胞表面标志物,对癌症的治疗具有重要的帮助作用。
本研究通过EpCAM抗原刺激DC获得可以呈递EpCAM抗原的成熟DC细胞,后者进一步刺激T细胞而得到能够特异识别EpCAM蛋白的CTL细胞,分离EpCAM抗原特异性CD8+CTL用于卵巢癌免疫治疗。研究表明,成熟前DC高效识别肿瘤抗原,从而促进其成熟,继而增强了其抗原呈递能力,有利于激活T细胞而获得抗原特异性CD8+CTL[15]。抗原呈递能力EpCAM蛋白刺激提高了DC表明分子CD80、CD83、CD86以及HLA- DR水平,CD83的升高表明了DC的成熟,CD83和CD86水平的升高有利于DC与T细胞的识别,而HLA- DR水平升高有利于激活T细胞,获得EpCAM特异性CD8+CTL,保证了免疫治疗的进行,促进卵巢癌细胞的杀伤[16]。IL- 12介导初始免疫反应以及继发免疫反应,同时触发Th1反应,是一种重要的免疫调节因子;IL- 12可以诱导T细胞释放IFN- γ,达到杀伤卵巢癌细胞的目的。然而DC分泌的IL- 10能够抑制Th1反应,促进了肿瘤细胞的免疫逃避,影响了肿瘤免疫治疗的效果[17,18]。EpCAM蛋白刺激后,DC高表达IL- 12,同时低表达IL- 10,因此,EpCAM蛋白的刺激促进了Th1反应的发生。卵巢癌细胞杀伤实验说明EpCAM- DC- CD8+CTL可以有效杀伤卵巢癌细胞SKVO3,而对IOSE80正常卵巢上皮细胞杀伤效果较低。动物实验进一步表明EpCAM- DC- CD8+CTL能够损伤肿瘤细胞,减缓肿瘤的发展。EpCAM- DC- CD8+CTL能够通过EpCAM有效识别卵巢癌上皮细胞,通过释放穿孔素破坏肿瘤细胞膜,同时释放颗粒酶激活caspases信号通路,促进肿瘤细胞凋亡;同时EpCAM- DC- CD8+CTL表明的FasL和肿瘤细胞的Fas相互识别,触发肿瘤细胞程序性死亡;达到治疗卵巢癌的目的[19,20]。以EpCAM为靶点的肿瘤免疫治疗对卵巢癌的治疗具有重要的帮助。
综上所述,本研究通过EpCAM刺激DC成熟,DC进一步刺激T细胞而获得EpCAM特异性CD8+CTL用于卵巢癌免疫治疗。EpCAM刺激后,成熟的DC表明标记物及IL- 12表达量显著升高,但IL- 10表达量显著降低;EpCAM- DC诱导的EpCAM特异性CD8+CTL具有特异性的卵巢癌杀伤能力,显著抑制移植肿瘤的发展。对卵巢癌的免疫治疗具有重要临床意义。
[1] Brawley OW.Ovarian cancer prevention:Time for primetime?[J].Cancer,2015,121(13):2121- 2123.
[2] Abiko K,Matsumura N,Hamanishi J,etal.IFN- |[gamma]| from lymphocytes induces PD- L1 expression and promotes progression of ovarian cancer[J].Brit J Cancer,2015,112(9):1501- 1509.
[3] Bowtell DD,Bhm S,Ahmed AA,etal.Rethinking ovarian cancer II:reducing mortality from high- grade serous ovarian cancer[J].Nat Rev Cancer,2015,15(11):668- 679.
[4] Gedye C,Van dWA,John T.Checkpoint immunotherapy for cancer- superior survival,unaccustomed toxicities[J].Int Med J,2015,45(7):696- 701.
[5] Liao MY,Kuo MY,Lu TY,etal.Generation of an anti- EpCAM antibody and epigenetic regulation of EpCAM in colorectal cancer[J].Int J Oncol,2015,46(4):1788- 1800.
[6] Li YL,Ye F,Hu Y,etal.Identification of suitable reference genes for gene expression studies of human serous ovarian cancer by real- time polymerase chain reaction[J].Arch Virol,2016,394(3):110- 116.
[7] Huang Z,Gao Y,Wen W,etal.Contraceptive methods and ovarian cancer risk among Chinese women:A report from the Shanghai women′s health study[J].Int J Cancer,2015,137(3):607- 614.
[8] Patch AM,Christie EL,Etemadmoghadam D,etal.Whole- genome characterization of chemoresistant ovarian cancer[J].Nature,2015,521(7553):489- 494.
[9] Gubin MM,Artyomov MN,Mardis ER,etal.Tumor neoantigens:building a framework for personalized cancer immunotherapy[J].J Clin Invest,2015,125(9):3413- 3421.
[10] Shore ND.Advances in the understanding of cancer immunotherapy[J].Bju Int,2015,116(3):321- 329.
[11] Valton J,Guyot V,Marechal A,etal.A multidrug- resistant engineered CAR T cell for allogeneic combination immunotherapy[J].Mol Ther,2015,23(9):1507- 1518.
[12] Soukup K,Wang X.Radiation meets immunotherapy- a perfect match in the era of combination therapy?[J].Int J Radiat Biol,2015,91(4):1- 15.
[13] Rambaldi A,Biagi E,Bonini C,etal.Cell- based strategies to manage leukemia relapse:efficacy and feasibility of immunotherapy approaches[J].Leukemia,2015,29(1):1- 10.
[14] Eberlein C,Rooney C,Ross SJ,etal.E- Cadherin and EpCAM expression by NSCLC tumour cells associate with normal fibroblast activation through a pathway initiated by integrin αvβ6 and maintained through TGFβ signalling[J].Oncogene,2015,34(6):704- 716.
[15] Mitchell DA,Batich KA,Gunn MD,etal.Tetanus toxoid and CCL3 improve dendritic cell vaccines in mice and glioblastoma patients[J].Nature,2015,519(7543):366- 369.
[16] Carreno BM,Magrini V,Becker- Hapak M,etal.Cancer immunotherapy.A dendritic cell vaccine increases the breadth and diversity of melanoma neoantigen- specific T cells[J].Science,2015,348(6236):803- 808.
[17] Bouhamdan M,Bauerfeld C,Talreja J,etal.MEK1 dependent and independent ERK activation regulates IL- 10 and IL- 12 production in bone marrow derived macrophages[J].Cell Signal,2015,27(10):2068- 2076.
[18] Mukherjee B,Paul J,Mukherjee S,etal.Antimony- resistant leishmania donovani exploits miR- 466i to deactivate host MyD88 for regulating IL- 10/IL- 12 levels during early hours of infection[J].J Immunol,2015,195(6):2731- 2742.
[19] Bai L,Takeshima SN,Isogai E,etal.Novel CD8(+) cytotoxic T cell epitopes in bovine leukemia virus with cattle[J].Vaccine,2015,33(51):7194- 7202.
[20] Noble A,Mehta H,Lovell A,etal.IL- 12 and IL- 4 activate a CD39- dependent intrinsic peripheral tolerance mechanism in CD8+T cells (pages 1438- 1448)[J].Eur J Immunol,2016,46(6):1438- 1448.
[收稿2016- 11- 23]
(编辑 张晓舟)
Experimental study on ovarian cancer immunotherapy by EpCAM activated dendritic cells induce antigen- specific CD8+cytotoxic T lymphocytes
YANG Xiao- Dong,ZHAO Wei- Dong,XI Yu- Ling.
Department of Gynaecology and Obstetrics,Anhui Provinical Hospital of Anhui Medical University,Hefei 230001,China
Objective:To observe the effect on ovarian cancer immunotherapy by dendritic cells (DC) which activated by Epithelial cell adhesion molecule (EpCAM) induce antigen- specific CD8+cytotoxic T lymphocytes (CTL) and to provide some help to ovarian cancer immunotherapy.Methods: Interleukin (IL)- 12,and IL- 10 of DC were tested after inducing by EpCAM.Subsequently,EpCAM specific CTL CD8+was induced by EpCAM- DC.The therapeutic effect and interferon (IFN)- γ of EpCAM- DC- CD8+CTL on normal ovarian epithelial cells IOSE80 and ovarian cancer cell SKVO3 was detected.After treatment of EpCAM- DC- CD8+CTL,the volume of ovarian tumor of bearing BALB/c- nu/nu mice was detected.Meanwhile,the morphology changes of tumor tissue were observed by HE staining.Results: Compared with PBS,EpCAM stimulation significantly inceased surface markers DC80,DC83,DC86 and HLA- DR levels,and added up to 4.79,4.85,4.60 and 10.91 times (P<0.05).EpCAM stimulation significantly increased the expression of IL- 12 and reduced the secretion of IL- 10 (P<0.05).Both of DC- CD8+CTL and EpCAM- DC- CD8+CTL resulted in minute amount of IOSE80 cell killing (P>0.05).However,the killing rate of EpCAM- DC- CD8+CTL on SKVO3 cells was 6.82- folds as much as that of DC- CD8+CTL.Animal experiments showed that ovarian cancer transplantation tumor volume ratio after EpCAM- DC- CD8+CTL treatment,was significantly lower than PBS group and DC- CD8+CTL group,which reached 0.27 and 0.28 times,respectively (P<0.05).HE staining showed that EpCAM- DC- CD8+CTL treatment resulted in significant changes of tumor tissues in pathology.Conclusion: EpCAM protein stimulated the maturation of DC that induced the production of EpCAM specific CD8+CTL.EpCAM- DC- CD8+CTL can effectively kill ovarian tumor cells and delay the growth of tumor,which is of great significance for the immunotherapy of ovarian cancer.
Ovarian cancer;Immunotherapy;EpCAM;DC;CTL
10.3969/j.issn.1000- 484X.2017.08.012
杨晓东(1983年-),男,主治医师,主要从事妇产科相关疾病诊治方面的研究,E- mail:yangxiaodong343@163.com。
及指导教师:赵卫东(1970年-),男,博士,主任医师,主要从事妇科微创手术及妇科恶性肿瘤综合治疗方面的研究,E- mail:4899511@qq.com。
R737.31
A
1000- 484X(2017)08- 1181- 05
①蚌埠医学院第一附属医院妇产科,蚌埠233004。
