左卡尼汀通过内质网应激ATF6通路抑制高糖诱导的HAECs凋亡*
2017-09-03高宏民李尚俭朱火兰刘仲伟
高宏民, 李尚俭, 朱火兰, 杨 瑜, 3, 刘仲伟△
(1陕西省大荔县医院心血管内科, 陕西 大荔 715100; 2陕西省人民医院心血管内科, 3西安医学院临床医学系, 陕西 西安 710000)
左卡尼汀通过内质网应激ATF6通路抑制高糖诱导的HAECs凋亡*
高宏民1, 李尚俭2, 朱火兰2, 杨 瑜2, 3, 刘仲伟2△
(1陕西省大荔县医院心血管内科, 陕西 大荔 715100;2陕西省人民医院心血管内科,3西安医学院临床医学系, 陕西 西安 710000)
目的: 探讨左卡尼汀对高糖诱导的人主动脉内皮细胞(HAECs)凋亡的影响及相关分子机制。方法: 以高糖培养基培养HAECs并诱导其发生凋亡,同时以不同浓度(50、100和200 μmol/L)的左卡尼汀对HAECs进行处理。以MTT法对细胞活力进行检测;Hoechst 33258染色及流式细胞术评估细胞凋亡情况;比色法对HAECs的caspase-3活性进行检测;Western blot法对细胞内质网应激信号通路蛋白及磷酸化水平进行分析。结果: 高糖培养诱导HAECs产生凋亡并显著抑制细胞活力。高糖培养的HAECs中产生内质网应激,其蛋白激酶R样内质网激酶(PERK)、肌醇需酶1(IRE1)及活化转录因子6(ATF6)信号通路均被显著激活,能够通过下游caspase-4/3级联瀑布反应诱导细胞凋亡。然而,左卡尼汀能够显著减少高糖诱导的HAECs细胞凋亡,使细胞存活率升高,且呈现出浓度依赖性。左卡尼汀可显著降低高糖培养HAECs诱发的内质网应激,通过下调位点1蛋白酶(S1P)及位点2蛋白酶(S2P)表达降低其对ATF6剪切形成的促凋亡因子ATF6 p50的水平;而左卡尼汀并未对PERK及IRE1信号通路活性表现出抑制作用。结论: 左卡尼汀能够抑制高糖对HAECs凋亡的诱导作用,其作用机制可能为抑制内质网应激相关的ATF6信号通路。
左卡尼汀; 内质网应激; 活化转录因子6; 细胞凋亡; 人主动脉内皮细胞
糖尿病(diabetes mellitus,DM)是一种常见的代谢紊乱综合征,以碳水化合物代谢显著障碍为基础,表现为血糖异常升高的一组综合征。流行病学研究发现,在糖尿病患者中动脉粥样硬化(artherosclerosis,AS)的发生率显著升高,其中冠心病的发生率为非糖尿病患者的4倍以上。因此,糖尿病被认为是AS的等危症[1]。许多直接或间接的病理因素参与了动脉粥样硬化的发生与发展,糖尿病致AS的发病机制也非常复杂[2]。但目前普遍认为,血糖代谢异常相关一系列病理因子,如氧化应激、晚期糖基化终产物(advanced glycation end products,AGEs)以及炎症因子等造成的血管内皮损伤在AS发病中扮演重要的角色[3]。
内皮细胞(endothelial cells,ECs)是血管内壁的单层细胞,是维持血管结构与功能完整的重要成分。ECs的凋亡与AS密切相关。研究表明,ECs损伤既是AS形成的始动因素,也参与了斑块形成、斑块侵蚀、斑块破裂以及血栓形成等过程。同样,血管内皮细胞凋亡也参与了糖尿病大血管及微血管并发症的发病过程[4]。细胞凋亡又被称为细胞程序化死亡,目前认为主要由3条信号通路介导,即死亡受体途径、线粒体途径以及内质网应激途径。近期的一些研究显示,糖尿病时的高血糖环境可通过激活内质网应激途径介导细胞凋亡[5]。
内质网(endoplasmic reticulum,ER)是真核细胞内重要的细胞器之一,是细胞蛋白质成熟、类固醇合成以及钙调控的主要场所。当细胞遭受病理因素作用时,引起大量未折叠及错误折叠蛋白在内质网腔内聚集,可通过未折叠蛋白反应(unfolded protein response,UPR)而诱发内质网应激。其3条信号通路,即蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)、肌醇需酶1(inositol-requiring enzyme-1,IRE1)及活化转录因子6(activating transcription factor 6,ATF6)均可将应激信号转导至CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homology protein,CHOP),后者可通过caspase-4的活化激活caspase瀑布级联反应而诱发细胞凋亡[6]。
左卡尼汀(L-carnitine,LCa)已在心血管疾病的临床实践中广泛使用,是一种协助细胞脂肪酸代谢产生能量的小分子量物质。左卡尼汀能够协助长链脂肪酸进入线粒体,并可清除线粒体内毒性脂肪酸代谢产物。研究表明,左卡尼汀能够显著改善心肌细胞缺氧、清除氧自由基并减少心肌细胞凋亡[7]。近期的一些研究表明,左卡尼汀的心血管保护作用可能与其影响内质网应激有关[8],但具体机制尚不完全清楚,且左卡尼汀对糖尿病血管内皮的保护作用仍少见报道。本研究拟以高糖处理人主动脉内皮细胞(human aortic endothelial cells,HAECs)诱发细胞凋亡,深入探讨左卡尼汀对内皮细胞是否具有保护作用及其机制是否涉及内质网应激。
材 料 和 方 法
1 实验材料
HAECs来源于ATCC;RPMI-1640培养基和胎牛血清购自Invitrogen;左卡尼汀、青霉素/链霉素混合液、四氮噻唑蓝(MTT)试剂盒和二甲基亚砜(DMSO)购自Sigma-Aldrich;Hoechst染色试剂盒、caspase-3活性检测试剂盒(比色法)和蛋白抽提试剂盒购自Beyotime;Annexin V-APC/PI双染细胞凋亡检测试剂盒购自凯基生物公司;RIPA裂解液购自Santa Curz;葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)抗体、caspase-4剪切体(cleaved caspase-4)抗体、caspase-3剪切体(cleaved caspase-3)抗体及GAPDH抗体购自Abcam;IRE1抗体、磷酸化IRE1(p-IRE1)抗体、PERK抗体、磷酸化PERK(p-PERK)抗体、位点1蛋白酶(site-1 protease,S1P)抗体、位点2蛋白酶(site-2 protease,S2P)抗体和ATF6剪切体(ATF6 p50)抗体购自CST;Super Signal West Pico化学发光试剂购自Thermo。
2 实验方法
2.1 细胞培养与处理 HAECs复苏后以2×108/L浓度接种于培养瓶中,以RPMI-1640培养基、10%胎牛血清及抗生素(青霉素/链霉素)配制的细胞培养液在37 ℃、饱和湿度及5% CO2环境下进行培养。每2~3 d换液1次,取2~4代处于对数生长期的HAECs进行后续试验。按照不同处理方式,将上述细胞分为5组:(1)正常对照(control)组:以RPMI-1640培养基对细胞进行对照干预;(2)高糖(high glucose,HG)损伤组:细胞培养液葡萄糖终浓度调整为30 mmol/L,培养48 h;(3)低剂量(50 μmol/L)左卡尼汀处理组(LCa50组):以终浓度为50 μmol/L左卡尼汀对HAECs进行处理,再以葡萄糖终浓度为30 mmol/L的细胞培养液对HAECs培养48 h;(4)中剂量(100 μmol/L)左卡尼汀处理组(LCa100组):以终浓度为100 μmol/L左卡尼汀对HAECs进行处理,再以葡萄糖终浓度为30 mmol/L的细胞培养液对HAECs培养48 h;(5)高剂量(200 μmol/L)左卡尼汀处理组(LCa200组):以终浓度为200 μmol/L左卡尼汀对HAECs进行处理,再以葡萄糖终浓度为30 mmol/L的细胞培养液对HAECs培养48 h。
2.2 细胞活力检测 采用MTT法对HAECs的活力进行检测。收集处于对数生长期的HAECs,接种于96孔细胞培养板(接种密度1×105/L)。培养24 h细胞贴壁后,按照2.1中描述的分组处理方法进行处理并培养48 h。每孔中加入20 μL 0.5g/L的MTT溶液继续培养4 h。小心弃去培养液并在每孔中加入150 μL的DMSO并振荡20 min待结晶完全溶解。在酶标仪以490 nm为波长测定每孔吸光度值。Control组的细胞活力设为100%,各组以control为参照。
2.3 细胞凋亡测定 采用Hoechst 33258荧光染色HAECs评估细胞凋亡。取Hoechst染色试剂盒中固定液孵育细胞15 min并以PBS洗涤2次,加入Hoechst 33258染色液孵育5 min并以PBS洗涤2次,滴加抗荧光淬灭剂封片,在倒置荧光显微镜下以激发波长350 nm、发射波长460 nm为条件进行观察。正常细胞核为淡染蓝色,凋亡细胞核则会出现致密浓染的蓝色团块。试剂盒使用步骤均参照生产商说明书进行。同时,采用流式细胞术评估细胞凋亡。0.2%胰酶处理后离心收集各组细胞。以500 μL结合缓冲液重悬细胞并调整细胞浓度为1×109/L。将100 μL细胞悬浮液加入5 mL流式管中,以Annexin V-APC/PI双染法处理样本后,以流式细胞仪检测。激发波长488 nm,在515 nm检测FTIC荧光,在560 nm检测PI荧光。试剂盒使用步骤均按照生产厂家提供的说明书进行。
2.4 Caspase-3活性的测定 采用比色法对HAECs内caspase-3的活性进行检测。收集各组细胞,PBS洗涤后以RIPA裂解液裂解细胞后,4 ℃、20 000×g条件下离心得到细胞上清液。上清液中加入终浓度为2 mmol/L的Ac-DEVD-pNA,室温下孵育2 h。在酶标仪以405 nm为波长测定每孔吸光度值。以control组为参照,各组caspase-3活力均以与control组的比值表示。
2.5 Western blot检测蛋白水平 收集各组细胞并离心,裂解细胞后,使用蛋白抽提试剂盒获得蛋白样本。以BCA法测定上清液中蛋白浓度。蛋白变性后以SDS-PAGE将蛋白分离,使用Bio-Rad半干转印系统,将蛋白电转印至聚偏二氟乙烯(PVDF)膜。5%脱脂牛奶封闭后,分别以I 抗(GRP78为1∶2 000,IRE1为1∶1 000,p-IRE1为1∶2 000, PERK为1∶1 000, p-PERK为1∶1 000, S1P为1∶1 000,S2P为1∶500, ATF6 p50为1∶1 000, cleaved caspase-4为1∶1 000,cleaved caspase-3为1∶2 000,GAPDH为1∶5 000)在4 ℃下孵育12 h。TBST洗涤后加入相应辣根过氧化物酶标记 II 抗,在室温下孵育1 h。暗室内使用Super Signal West Pico化学发光试剂后在X线胶片上曝光。
3 统计学处理
本研究使用统计学软件SPSS 16.0对所得数据进行统计学分析。数据以均数±标准差(mean±SD)表示。多组间比较使用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 左卡尼汀对高糖培养的HAECs活力的影响
与control组相比,HG组的HAECs活力显著降低,差异具有统计学意义(P<0.05)。而使用不同浓度左卡尼汀处理后,可见LCa50组、LCa100组及LCa200组的细胞活力均较HG组显著升高,且呈现出浓度依赖性(P<0.05),见表1。
表1 各组细胞活力和caspase-3活性变化的比较
Table 1.Comparison of the cell viability and caspase-3 activities in different groups (Mean±SD.n=3)
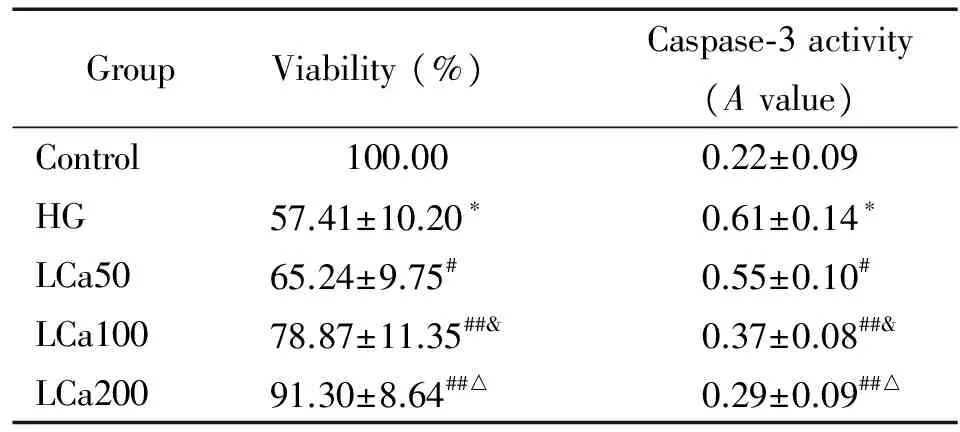
GroupViability(%)Caspase⁃3activity(Avalue)Control 100.000.22±0.09HG57.41±10.20∗0.61±0.14∗LCa5065.24±9.75#0.55±0.10#LCa10078.87±11.35##&0.37±0.08##&LCa20091.30±8.64##△0.29±0.09##△
*P<0.05vscontrol group;#P<0.05,##P<0.01vsHG group;&P<0.05vsLCa50 group;△P<0.05vsLCa100 group.
2 左卡尼汀对高糖培养的HAECs凋亡的影响
与control组相比,HG组HAECs的凋亡率显著升高,差异具有统计学意义(P<0.05)。以不同浓度左卡尼汀干预后,与HG组相比,各组HAECs的凋亡率显著降低,呈浓度依赖性,差异均具有统计学意义(P<0.05),见图1、2。
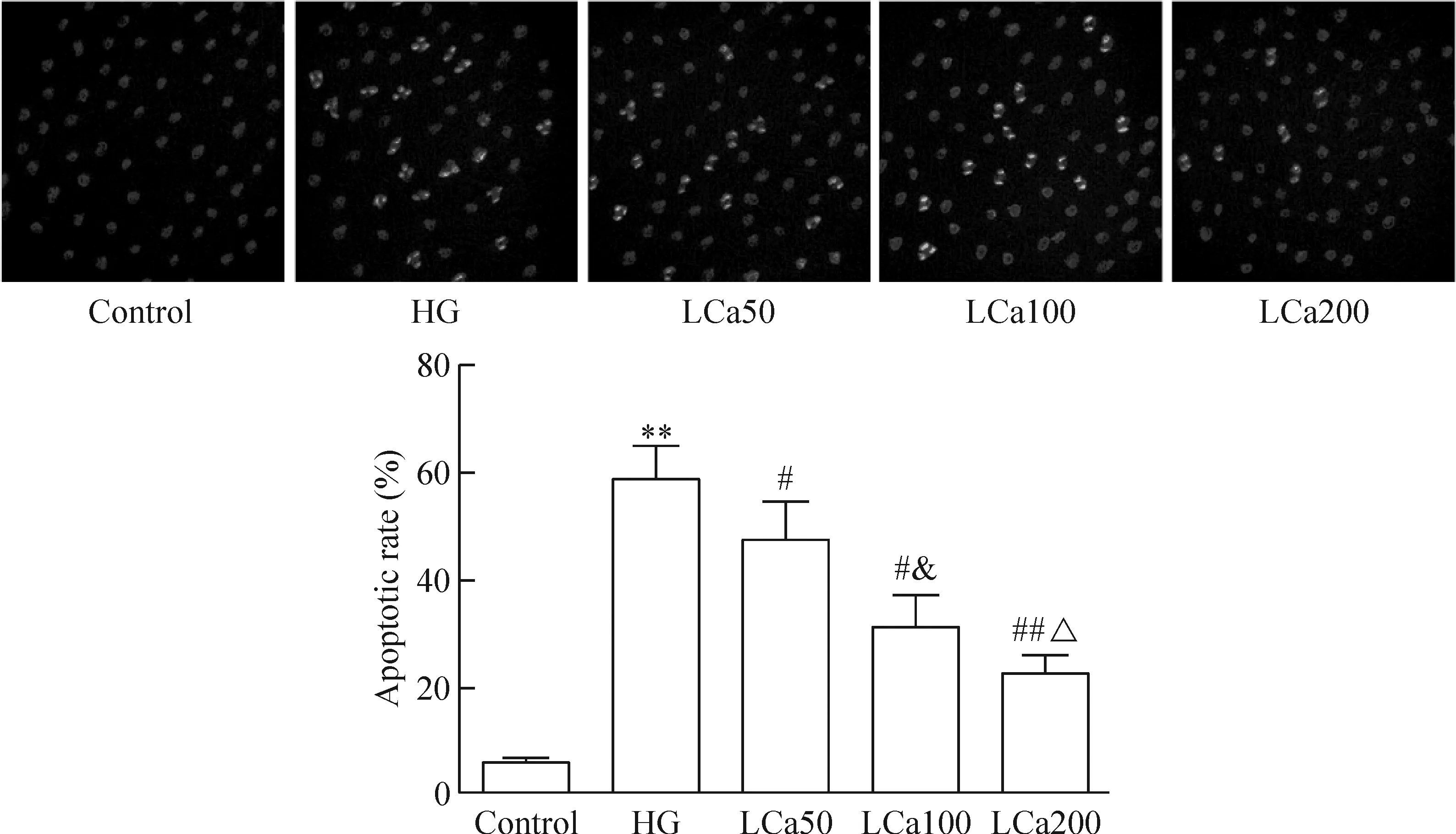
Figure 1.Hoechst 33258 fluorescence staining of the cells in different groups (×100). Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsHG group;&P<0.05vsLCa50 group;△P<0.05vsLCa100 group.
图1 各组细胞Hoechst 33258荧光染色及凋亡率比较
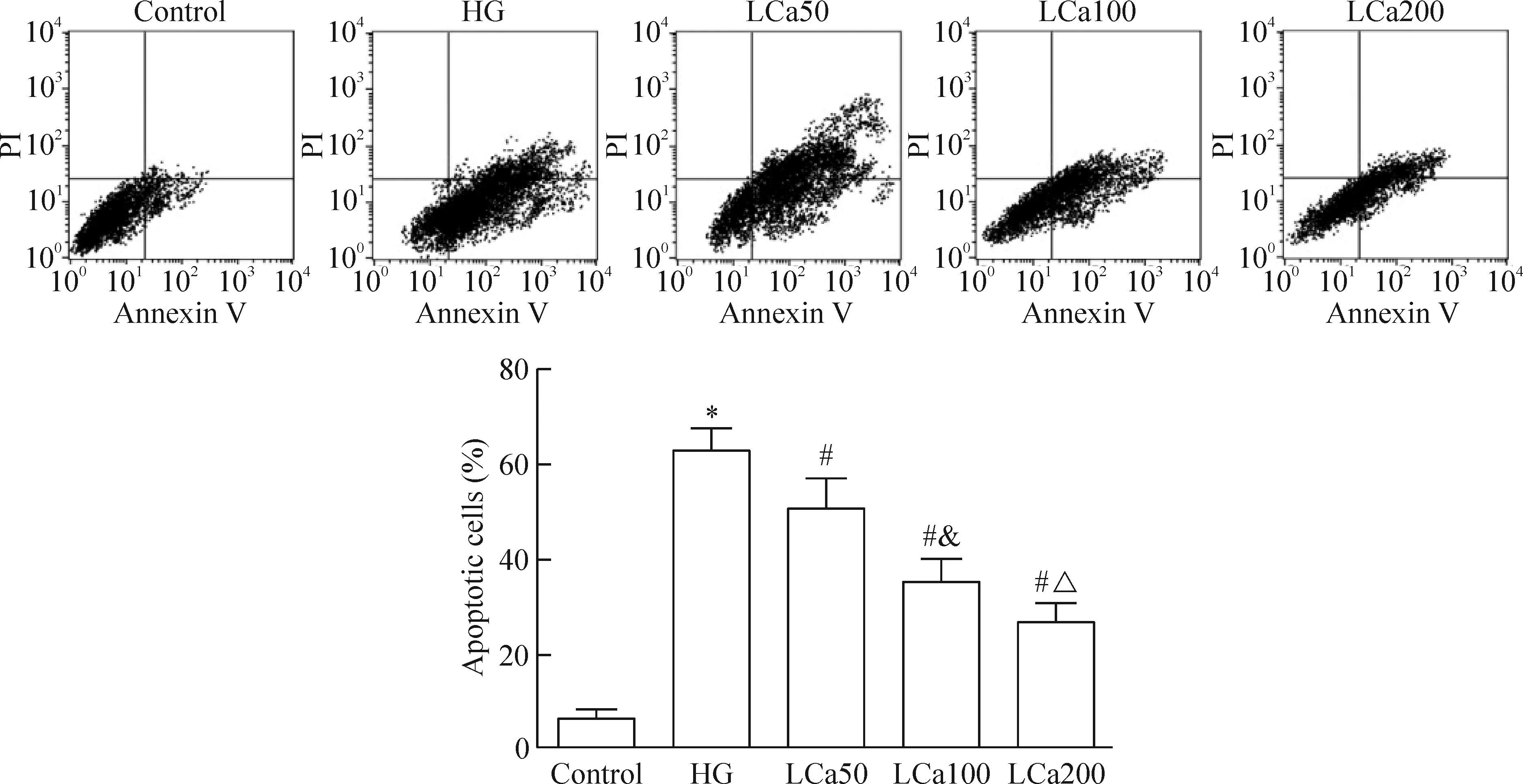
Figure 2.FCM apoptosis detection of the cells in different groups. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsHG group;&P<0.05vsLCa50 group;△P<0.05vsLCa100 group.
图2 各组细胞流式细胞术凋亡检测及凋亡率比较
3 左卡尼汀对高糖培养HAECs内caspase-3活力的影响
与control组相比,HG组的HAECs细胞内caspase-3活性显著升高,差异具有统计学意义(P<0.05)。与HG组相比,LCa50组、LCa100组及LCa200组的HAECs内caspase-3活性显著降低,呈浓度依赖性,差异均具有统计学意义(P<0.05),见表1。
4 左卡尼汀对高糖培养HAECs内质网应激凋亡信号通路的影响
与control组组相比,HG组HAECs的细胞内GRP78表达水平,IRE1磷酸化(p-IRE1/IRE)水平、PERK磷酸化(p-PERK/PERK)水平、ATF6 p50表达水平、S1P表达水平、S2P表达水平、CHOP表达水平、cleaved caspase-4的蛋白水平及cleaved caspase-3的蛋白水平均显著升高,差异均具有统计学意义(P<0.05)。以不同浓度左卡尼汀处理HAECs后,HAECs细胞内的GRP78表达水平显著下降(P<0.05),ATF6 p50的蛋白水平明显下降(P<0.05),S1P及S2P的表达水平明显下降(P<0.05),CHOP、cleaved caspase-4及cleaved caspase-3的蛋白水平明显下降(P<0.05),且呈现显著的浓度依赖性(P<0.05)。左卡尼汀处理对IRE1及PERK的磷酸化水平则无明显影响,见图3、表2。

Figure 3.The protein levels of endoplasmic reticulum stress proteins in the HAECs in different groups determined by Western blot.
图3 Western blot检测各组HAECs内质网应激信号通路蛋白水平的比较
讨 论
内质网是哺乳动物细胞中的重要细胞器之一,执行蛋白合成加工、氨基多糖及胆固醇代谢、细胞钙信号等功能。在多种病理生理因素的作用下,内质网功能出现障碍,其腔内蛋白质二硫键结合及氧化还原状态的改变会导致蛋白质无法折叠或错误折叠,进一步损伤内质网的功能,称为内质网应激。此时内质网可通过激发UPR对内质网腔内大量堆积的错误折叠蛋白进行处理来维持细胞的正常功能。但当细胞遭受的损伤过重,UPR对内质网及细胞内环境的恢复无法代偿时,内质网应激可诱导细胞凋亡[9]。
内质网应激的信号主要由3个内质网应激跨膜感受蛋白所介导,即PERK、IRE1与ATF6。正常生理状态下,PERK、IRE1及ATF6均与内质网分子伴侣GRP78结合而处于非活化状态。在内质网腔内大量堆积错误折叠蛋白时,GRP78从上述跨膜分子解离而使内质网应激信号通路激活,因此,GRP78表达水平也被认为是内质网应激的分子标志物[10]。本研究发现,使用高糖处理HAECs后,GRP78表达明显升高,表明HAECs内质网应激被活化。内质网应激PERK、IRE1及ATF6信号通路被激活后,均可使前凋亡因子CHOP表达升高,后者可通过激活AKT通路等途径对caspase-4进行剪切激活,从而激活caspase-9。活化的caspase-9进而激活caspase-3诱发caspase瀑布反应导致细胞凋亡[11]。本研究发现,高糖培养的HAECs中PERK、IRE1及ATF6信号通路均处于明显活化状态,CHOP表达升高,其下游的caspase-4/3剪切体水平升高,HAECs细胞凋亡增多,提示高糖可诱导HAECs通过内质网应激途径发生细胞凋亡。

表2 各组HAECs内质网应激信号通路蛋白表达相对水平比较
*P<0.05vscontrol group;#P<0.05vsHG group;&P<0.05vsLCa50 group;△P<0.05vsLCa100 group.
左卡尼汀又名L-β-羟基-γ-三甲氨丁酸,在细胞能量代谢中起关键的作用,可协助长链脂肪酸进入线粒体发生β-氧化。除上述药理作用以外,近年来的研究不断发现其新的药理活性,包括抗氧化、抑制细胞钙超载以及抗细胞凋亡等[12]。本研究发现,不同浓度的左卡尼汀处理能够显著减少caspase-4/3的蛋白水平并抑制高糖诱导的HAECs细胞凋亡。既往研究表明,左卡尼汀能够抑制氧化应激介导的内质网应激。在正常生理状态下,ATF6以酶原(ATF6 p90)储存于内质网。内质网应激发生后,ATF6 p90转运入高尔基体,在S1P及S2P的作用下发生水解,产生其活性剪切体ATF6 p50并转运至细胞核内,诱导CHOP等的表达[13]。本研究发现,使用左卡尼汀后,HAECs内S1P及S2P表达水平显著降低,ATF6剪切体表达水平显著降低, CHOP表达水平降低,细胞凋亡减少。上述结果表明左卡尼汀可以通过降低S1P及S2P水平,抑制ATF6的剪切激活,减少CHOP的表达,从而抑制内质网应激诱导的细胞凋亡。同时,本研究结果还表明,IRE1及PERK磷酸化水平则未出现显著变化,说明左卡尼汀干预内质网应激的主要通路为ATF6/CHOP。
由于客观条件所限,本研究也存在一定的局限性。本研究仅进行了体外研究,如果能够进行糖尿病动物模型体内研究,相信本研究结论将更有说服力;研究发现左卡尼汀能够抑制高糖培养对ATF6剪切激活的促进作用,从而抑制凋亡,但未能进行反证。若能以病毒载体将ATF6导入细胞造成高表达,视其能否减弱左卡尼汀对凋亡的抑制作用,就能提供ATF6是左卡尼汀作用靶点的更为有力的证据。本课题组将在后续研究中做更为深入的探讨。本研究的结果不仅能够深化我们对左卡尼汀药理机制的认识,而且为左卡尼汀在糖尿病合并冠心病临床治疗中的应用提供了理论基础。
[1] 申虎威, 李 燕, 邢 莉, 等. 血糖波动与糖尿病大血管病变的相关研究[J]. 中国病理生理杂志, 2010, 26(7):1311-1315.
[2] 金文胜, 潘长玉, 陆菊明, 等. 血糖与动脉粥样硬化的相关研究[J]. 中华糖尿病杂志, 2005, 13(1):19-22.
[3] Cantero AV, Portero-Otín M, Ayala V, et al. Methyl-glyoxal induces advanced glycation end product (AGEs) formation and dysfunction of PDGF receptor-beta: implications for diabetic atherosclerosis [J]. FASEB J, 2007, 69(4):922-924.
[4] 杨 慧, 邝素娟, 饶 芳, 等. Orai1通道调控内质网应激反应参与糖尿病血管内皮损伤[J]. 中国病理生理杂志, 2016, 32(8):1513.
[5] Liu ZW, Zhu HT, Chen KL, et al. Protein kinase RNA-like endoplasmic reticulum kinase (PERK) signaling pathway plays a major role in reactive oxygen species (ROS)-mediated endoplasmic reticulum stress-induced apoptosis in diabetic cardiomyopathy[J]. Cardiovasc Diabetol, 2013, 12:158.
[6] Yu Z, Luo X, Wang C, et al. Baicalin promoted site-2 protease and not site-1 protease in endoplasmic reticulum stress-induced apoptosis of human hepatocellular carcinoma cells[J]. FEBS Open Bio, 2016, 6(11):1093-1101.
[7] Zhu B, Zheng YF, Zhang YY, et al. Protective effect of L-carnitine in cyclophosphamide- induced germ cell apoptosis[J]. J Zhejiang Univ Sci B, 2015, 16(9):780-787.
[8] Ye J, Han Y, Chen X, et al. L-carnitine attenuates H2O2-induced neuron apoptosis via inhibition of endoplasmic reticulum stress [J]. Neurochem Int, 2014, 78:86-95.
[9] Comitato R, Guantario B, Leoni G, et al. Tocotrienols induce endoplasmic reticulum stress and apoptosis in cervical cancer cells [J]. Genes Nutr, 2016, 11:32.
[10]Zhao Y, Yan Y, Zhao Z, et al. The dynamic changes of endoplasmic reticulum stress pathway markers GRP78 and CHOP in the hippocampus of diabetic mice[J]. Brain Res Bull, 2015, 111: 27-35.
[11]Zou X, Qu Z, Fang Y, et al. Endoplasmic reticulum stress mediates sulforaphane-induced apoptosis of HepG2 human hepatocellular carcinoma cells[J]. Mol Med Rep, 2017, 15(1): 331-338.
[12]DiNicolantonio JJ, Lavie CJ, Fares H, et al. L-carnitine in the secondary prevention of cardiovascular disease: systematic review and meta-analysis [J]. Mayo Clin Proc, 2013, 88(6): 544-551.
[13]Sun L, Zhang SS, Lu SJ, et al. Site-1 protease cleavage site is important for the ER stress-induced activation of membrane-associated transcription factor bZIP28 in Arabidopsis [J]. Sci China Life Sci, 2015, 58(3):270-275.
(责任编辑: 陈妙玲, 罗 森)
Inhibitory effects of L-carnitine on high glucose-induced apoptosis of HAECs by suppressing ATF6 signaling
GAO Hong-min1, LI Shang-jian2, ZHU Huo-lan2, YANG Yu2, 3, LIU Zhong-wei2
(1DepartmentofCardiology,DaliCountyHospital,Dali715100,China;2DepartmentofCardiology,ShaanxiProvincialPeople’sHospital,3DepartmentofClinicalMedicine,Xi’anMedicalCollege,Xi’an710000,China.E-mail:liuzhongwei@xjtu.edu.cn)
AIM: To investigate the inhibitory effect of L-carnitine on high glucose-induced apoptosis of human aortic endothelial cells (HAECs) and the molecular mechanisms. METHODS: The apoptosis of HAECs was induced by high-glucose incubation. HAECs were treated with L-carnitine at different concentrations (50, 100 and 200 μmol/L). The cell viability was measured by MTT assay. The cell apoptosis was assessed by Hoechst 33258 staining and flow cytometry. Colorimetric method was employed to detect the caspase-3 activity in the HAECs. The protein expression and phosphorylation levels were determined by Western blot. RESULTS: High-glucose incubation dramatically decreased the cell viability and induced apoptosis. The protein kinase R-like endoplasmic reticulum kinase (PERK), inositol-requiring enzyme-1 (IRE1) and activating transcription factor 6 (ATF6) signaling pathways of endoplasmic reticulum stress were activated to induce cell apoptosis via down-stream caspase-4/3 cascade. However, L-carnitine treatment significantly attenuated the cell apoptosis and increased the cell viability in a concentration-dependent manner. L-carnitine also significantly suppressed endoplasmic reticulum stress and ATF6 signaling in high glucose-incubated HAECs without attenuating PERK and IRE1 signaling. The expression of site-1 protease (S1P) and site-2 protease (S2P) was inhibited by L-carnitine treatment, thus decreasing pro-apoptotic factor ATF6 p50 produced by ATF6 cleavage.CONCLUSION: L-carnitine inhibits high glucose-induced apoptosis of HAECs by inhibiting ATF6 signaling.
L-Carnitine; Endoplasmic reticulum stress; Activating transcription factor 6; Apoptosis; Human aortic endothelial cells
1000- 4718(2017)08- 1449- 06
2017- 01- 03
2017- 03- 15
国家自然科学基金资助项目(No. 81600646)
R587.1; R363
A
10.3969/j.issn.1000- 4718.2017.08.017
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 029-85251331-3194; E-mail: liuzhongwei@xjtu.edu.cn
