冬凌草甲素对人肝癌MHCC-97H细胞系侵袭和迁移的作用*
2017-09-03李春雨苏玮莲李经秀李国霞
李春雨, 王 琪, 申 珅, 苏玮莲, 李经秀, 李国霞
(1天津医科大学国际医学院, 天津 300070; 2同济大学附属上海市肺科医院肿瘤科, 上海 200433)
冬凌草甲素对人肝癌MHCC-97H细胞系侵袭和迁移的作用*
李春雨1△, 王 琪2, 申 珅1, 苏玮莲1, 李经秀1, 李国霞1
(1天津医科大学国际医学院, 天津 300070;2同济大学附属上海市肺科医院肿瘤科, 上海 200433)
目的: 探讨冬凌草甲素(oridonin)对肝癌细胞侵袭和迁移的影响及其机制。方法: 采用细胞培养技术培养人肝细胞癌MHCC-97H细胞,用不同浓度的冬凌草甲素处理肝癌细胞,采用划痕实验检测细胞的迁移能力;Transwell实验测定细胞的侵袭能力;黏附实验评价细胞的黏附能力;Western blot法检测LIM激酶1(LIMK-1)、丝切蛋白(cofilin)和磷酸化cofilin(p-cofilin)蛋白水平的改变。结果: 冬凌草甲素可明显降低肝癌细胞的体外侵袭、迁移及黏附能力(P<0.05),且在一定浓度范围内具有明显的量效关系。冬凌草甲素干预处理细胞后,cofilin的蛋白水平无明显变化,LIMK-1和p-cofilin的蛋白水平明显下调。结论: 冬凌草甲素体外具有抑制肝癌MHCC-97H细胞侵袭和迁移的作用,其机制可能与调控LIMK-1/cofilin信号通路有关。
冬凌草甲素; 肝细胞癌; 细胞侵袭; 细胞迁移; 细胞黏附
肝细胞癌(hepatocellular carcinoma,HCC)是发病率居全球第5位的恶性肿瘤,死亡率居全球第3位[1]。全世界一半以上的HCC发生在我国,且其发病率呈逐年上升趋势,严重威胁着人类健康[2]。侵袭与转移是导致HCC患者不能长期生存的主要原因[3]。因此,研发低毒、高效抗肿瘤转移药物成为转化医学的一项迫切任务。冬凌草甲素(oridonin)是清热解毒中药冬凌草的主要有效成分,近年其抗肿瘤潜力受到了国内外学者的关注[4-5],研究报道冬凌草甲素对胃癌、肝癌、肺癌等多种肿瘤细胞的增殖具有抑制作用[6]。但关于冬凌草甲素对肝癌细胞侵袭和转移的作用研究较少,本文探讨冬凌草甲素抗肝癌侵袭转移的作用及机制,以期为临床应用提供参考。
材 料 和 方 法
1 材料、试剂及仪器
MHCC-97H细胞来源于美国模式细胞培养物集存库(American Type Culture Collection,ATCC),由本实验室保存;冬凌草甲素(纯度≥98%)购自Aladdin;MTT和二甲基亚砜购自Sigma;Matrigel购自BD;抗LIM激酶1(LIM kinase-1,LIMK-1)、丝切蛋白(cofilin)和磷酸化cofilin(phosphorylated cofilin,p-cofilin)抗体购自Santa Cruz;全蛋白抽提试剂盒、SDS-PAGE凝胶电泳试剂盒、Western blot检测试剂盒和ECL化学发光底物试剂盒均购自南京凯基生物科技发展有限公司;CO2培养箱(SANYO);IX71荧光倒置显微镜(Olympus);全能型凝胶成像分析系统(G:BOX)。
2 方法
2.1 划痕实验检测MHCC-97H细胞的迁移能力 取对数生长期的MHCC-97H细胞消化,调整细胞浓度至5×108/L,铺于35 mm培养皿培养24 h,设冬凌草甲素低、中、高剂量及溶媒对照组,分组后加入不同浓度的冬凌草甲素(5、10、20 μmol/L)及溶媒进行干预,24 h后用10 μL枪头在培养皿底部中央划出均匀划痕,换液后继续培养24 h,于不同时间(0、3、6、9、12、24 h)在倒置显微镜下拍照,记录划痕宽度变化,分析MHCC-97H细胞迁移能力的变化。
2.2 Transwell实验检测MHCC-97H细胞的侵袭能力 Matrigel用PBS稀释成1 g/L,以每孔50 μL铺于Transwell小室聚碳酸酯膜,Transwell下室每孔加入600 μL含10%胎牛血清的RPMI-1640培养基,上室加入MHCC-97H细胞,细胞浓度为5×108/L,每孔50 μL;设冬凌草甲素低、中、高剂量及溶媒对照组,分组后加入不同浓度的冬凌草甲素(5、10、20 μmol/L)及溶媒对上室细胞进行干预,37 ℃孵育24 h后,弃上室液体,棉签擦去上膜未穿过膜的细胞,苏木精染色,倒置显微镜观察穿过膜的细胞,每张膜随机选取3个视野,计数穿过微孔的细胞数,分析细胞侵袭能力的变化。
2.3 细胞黏附实验检测MHCC-97H细胞的黏附能力 盖玻片用10 mg/L fibronectin包被,4 ℃过夜,风干后置于35 mm培养皿中;取对数生长期的MHCC-97H细胞,消化,计数,调整细胞浓度至3×108/L,加入35 mm培养皿中每皿1.5 mL,设冬凌草甲素低、中、高剂量及溶媒对照组,加入不同浓度的冬凌草甲素(5、10、20 μmol/L)及溶媒进行干预,37 ℃孵育24 h后,加入表皮生长因子(epidermal growth factor,EGF; 10 μg/L,每皿200 μL)或无血清培养基后,分别在5、15、30 min时,加入冰PBS终止反应,4%多聚甲醛固定,倒置显微镜观察每个培养皿的细胞黏附数,计算5个随机视野数目总和,分析细胞黏附能力的变化。
2.4 Western blot法检测LIMK-1、p-cofilin及cofilin的蛋白水平 胰酶消化收集经不同浓度的冬凌草甲素(5、10、20 μmol/L)干预48 h后的细胞,SDS细胞裂解液提取总蛋白,BCA法蛋白定量,SDS-PAGE分离,转膜,封闭1 h,加入鼠抗人LIMK-1、p-cofilin、cofilin及β-actin抗体,室温孵育2 h,洗涤后加入辣根过氧化物酶标记的兔抗鼠IgG抗体,室温孵育1 h,ECL化学发光试剂盒进行曝光,凝胶成像系统分析拍照并对凝胶条带信号强度半定量分析。
3 统计学处理
SPSS 19.0软件进行统计分析。计量数据以均数±标准差(mean±SD)表示,并用单因素方差分析法(one-way ANOVA)进行组间比较,以P<0.05为差异有统计学意义。
结 果
1 冬凌草甲素对人肝癌MHCC-97H细胞体外迁移能力的影响
肿瘤细胞的迁移能力与侵袭转移之间呈正相关。细胞划痕24 h后与溶媒对照组比较,不同浓度的冬凌草甲素处理的MHCC-97H细胞组划痕距离明显大于溶媒对照组(P<0.05),表明冬凌草甲素可抑制人肝癌MHCC-97H细胞的迁移,该作用呈量效关系,见图1。
2 冬凌草甲素对人肝癌MHCC-97H细胞体外侵袭能力的影响
本研究中引入了Matrigel,旨在模拟癌细胞在体内侵袭环境中的细胞外基质,考察冬凌草甲素对肝癌细胞侵袭能力的影响[7]。经不同浓度的冬凌草甲素处理的MHCC-97H细胞体外侵袭能力明显下降(P<0.05),冬凌草甲素显示出显著的抗癌细胞侵袭作用,该作用呈量效关系,见图2。
3 冬凌草甲素对人肝癌MHCC-97H细胞体外黏附能力的影响
恶性肿瘤细胞在侵袭和转移过程中,与宿主组织成分发生多次黏附。黏附与肿瘤侵袭转移密切相关。经不同浓度的冬凌草甲素处理的MHCC-97H细胞体外黏附能力明显下降(P<0.05),冬凌草甲素显示出显著的抗癌细胞黏附的作用,该作用呈量效关系,见图3。

Figure 1.Treatment with oridonin inhibited the migration ability of hepatocellular carcinoma MHCC-97H cells. A: microscopic pictures of MHCC-97H cells at 0 h and 24 h after treatment were shown (scale bar=100 μm); B: the results of wound healing assay in the MHCC-97H cells with various treatments for 3, 6, 9, 12 and 24 h. The migration distance was measured by a software-based method. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图1 冬凌草甲素对人肝癌MHCC-97H细胞体外迁移能力的影响
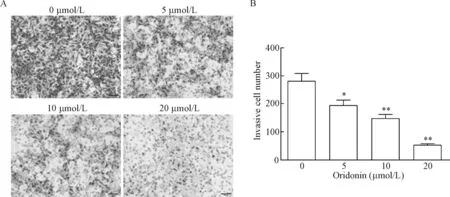
Figure 2.Treatment with oridonin inhibited the invasion ability of hepatocellular carcinoma MHCC-97H cells. A: the microscopic images of MHCC-97H cells at 24 h after treatment were shown (scale bar=100 μm); B: the results of Transwell assay in the MHCC-97H cells with various treatments for 24 h were showed. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图2 冬凌草甲素对人肝癌MHCC-97H细胞体外侵袭能力的影响
4 冬凌草甲素对LIMK-1/cofilin信号通路的调控作用
LIMK-1/cofilin信号通路在肿瘤侵袭转移过程中发挥重要作用。经不同浓度冬凌草甲素干预处理人肝癌MHCC-97H细胞后,cofilin蛋白表达水平无明显变化,而LIMK-1和p-cofilin的蛋白水平明显下调(P<0.05),且具有量效关系,见图4。
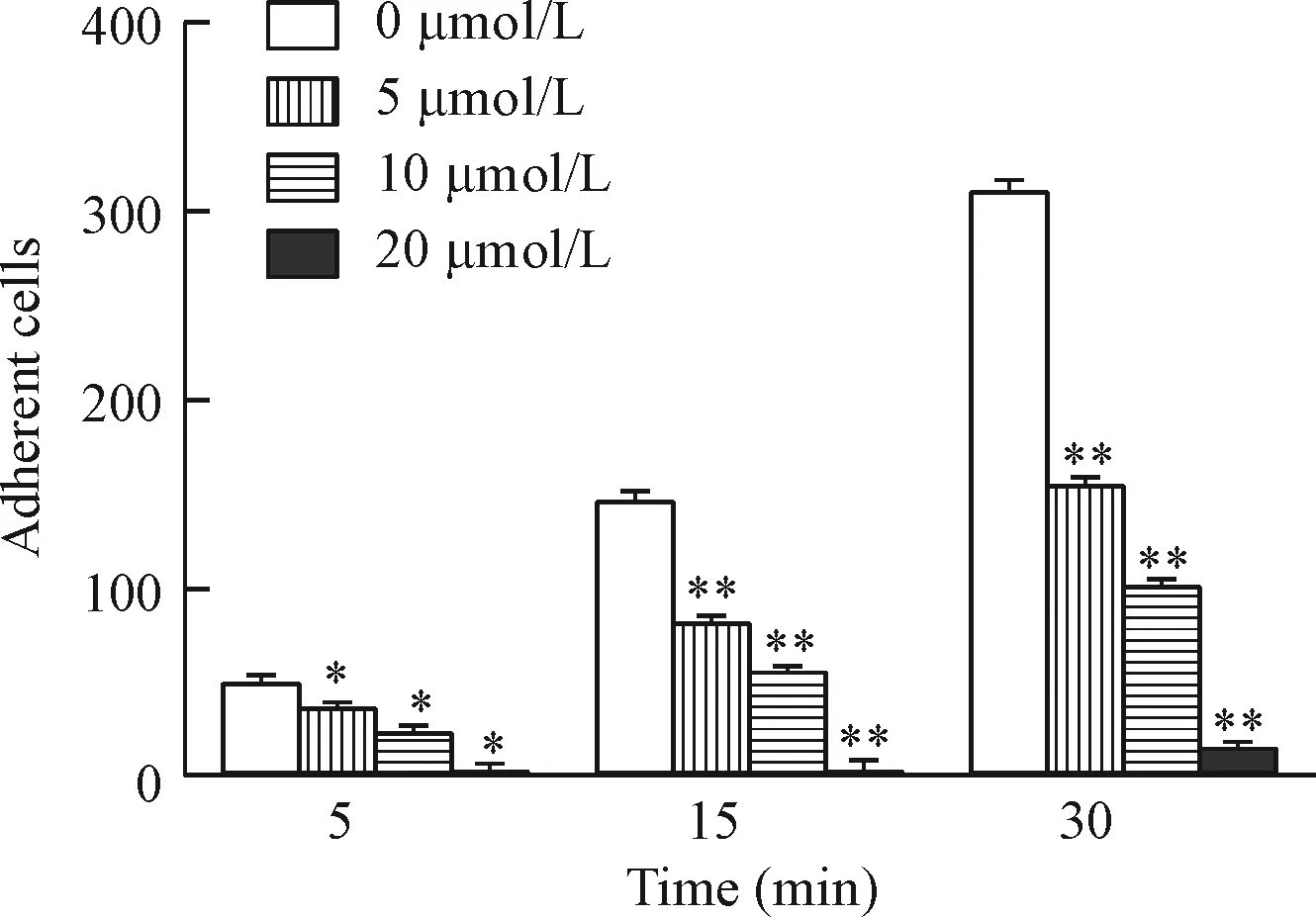
Figure 3.Treatment with oridonin inhibited the adhesion ability of hepatocellular carcinoma MHCC-97H cells. Adhesion assay results in MHCC-97H cells at 5, 15 and 30 min after treatment were shown. Cell numbers in five fields were counted for each coverslip under the microscope with ×200 magnification. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图3 冬凌草甲素对人肝癌MHCC-97H细胞体外黏附能力的影响
讨 论
我国是一个HCC发病大国,且发病率和死亡率呈不断上升趋势,大多数HCC患者确诊后的中位生存期是6~9个月,侵袭与转移是导致HCC患者不能长期生存的主要原因[8]。虽然目前临床上可以对HCC转移采取一些干预措施,如栓塞化疗、术前经皮穿刺肝动脉栓塞及生物治疗等,但整体效果仍十分有限[9]。侵袭和转移已成为影响手术效果和病人生存期的瓶颈,控制转移是决定患者预后的关键因素。因此,研发低毒、高效抗肿瘤转移药物具有重要临床意义。
冬凌草为清热解毒类中药,具有清热解毒、消炎止痛、抗肿瘤等功效[10]。临床应用广泛,特别是上呼吸道感染、慢性肝炎、关节风湿痛、食管癌等恶性肿瘤等方面取得了显著疗效[11]。冬凌草甲素是冬凌草的主要有效成分,近年其抗肿瘤潜力受到了国内外学者的瞩目。现代研究证实,冬凌草甲素对胃癌、肝癌、肺癌等多种肿瘤细胞的增殖具有抑制作用,且低毒并对骨髓、肝、肾等器官无明显损伤[12]。近年有研究提示冬凌草甲素能明显降低骨肉瘤MG-63细胞的趋化运动能力,机制与降低血管内皮生长因子的表达,抑制血管生成有关[13];冬凌草甲素能抑制肺癌NCI-H460、A549和PC-9细胞的侵袭,机制与调控MMPs表达、降解细胞外基质有关[14],提示冬凌草甲素防治肿瘤侵袭转移具有良好前景,值得进一步深入研究。
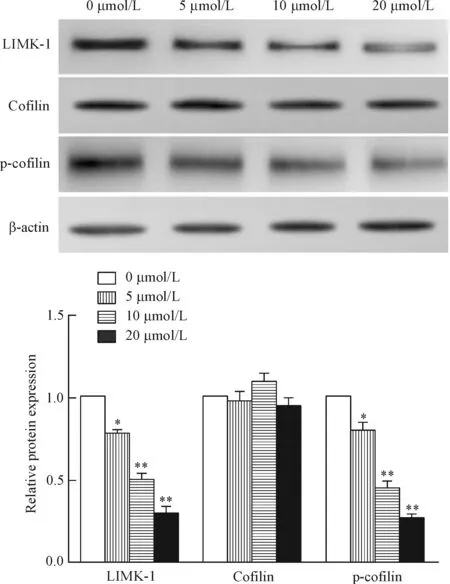
Figure 4.The effects of oridonin on the protein levels of LIMK-1, cofilin and p-cofilin in the MHCC-97H cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图4 冬凌草甲素对LIMK-1/cofilin信号通路蛋白表达的影响
本研究采不同浓度冬凌草甲素干预处理人肝癌MHCC-97H细胞,进行体外侵袭、迁移及黏附能力的考察,结果显示冬凌草甲素可明显降低MHCC-97H细胞的体外侵袭、迁移及黏附能力,且在一定浓度范围内具有量效关系。
细胞骨架由微丝、微管及中间纤维组成。其中微丝是由肌动蛋白(actin)组成的螺旋状纤维,是细胞骨架的主要组成部分,在维持细胞形态、有丝分裂、细胞迁移、细胞极性等方面起重要作用。Cofilin作为肌动蛋白结合蛋白,与肌动蛋白的功能和结构调节关系密切。活化的cofilin通过解聚多聚体的纤维状肌动蛋白(F-actin)为单体的球状肌动蛋白(G-actin),保证actin快速聚合与解聚。Cofilin的磷酸化和去磷酸化对调节肌动蛋白骨架活性以及肌动蛋白相关细胞运动中发挥关键作用。LIMK-1是cofilin磷酸化的主要激活物,并可介导其它多种因子诱导cofilin磷酸化,在肝癌的侵袭转移过程中发挥重要作用[15]。本实验结果显示,不同浓度冬凌草甲素干预处理人肝癌MHCC-97H细胞后,cofilin蛋白表达水平无明显变化,LIMK-1和p-cofilin蛋白水平明显下调,且具有量效关系,与体外侵袭、迁移及黏附实验结果一致,提示冬凌草甲素可能通过调控LIMK-1/cofilin信号通路抑制人肝癌MHCC-97H细胞的侵袭和转移。本研究为冬凌草甲素防治HCC侵袭转移提供了实验依据,具有重要的临床价值。
[1] Mazzoccoli G, Miele L, Oben J, et al. Epidemiology, clinical aspects of hepatocellular carcinoma and the role of sorafenib [J]. Curr Drug Targets, 2016, 17(1):783-799.
[2] 吕桂帅, 陈 磊, 王红阳. 我国肝癌研究的现状与前景[J]. 生命科学, 2015, 1(3):237-248.
[3] You K, Sun P, Yue Z, et al. NOR1 promotes hepatocellular carcinoma cell proliferation and migration through modulating the Notch signaling pathway[J]. Exp Cell Res, 2017, 352(2):375-381.
[4] 柳悄然, 张在云, 于晓明, 等. 冬凌草甲素对人肺癌NCI-H460细胞侵袭和迁移的影响[J]. 中国病理生理杂志, 2014, 30(8):1497-1500, 1518.
[5] 王 健, 周 雯, 宋秀宇, 等. 冬凌草甲素对人肺癌A549和PC-9细胞侵袭的抑制作用和机制研究[J]. 天津医药, 2015, 43(9):965-969.
[6] Li YC, Sun MR, Zhao YH, et al. Oridonin suppress cell migration via regulation of nonmuscle myosin IIA[J]. Cytotechnology, 2016, 68(3): 389-397.
[7] 陈 君, 焦德敏, 唐夏莉, 等. 姜黄素通过下调nectin-4抑制肺癌PC-9细胞的迁移和侵袭[J]. 中国病理生理杂志, 2017, 33(2):271-277.
[8] 罗耀玲, 黄铀新, 赖 平, 等. 低表达miR-21对苦参碱诱导的肝癌HepG2细胞凋亡的影响[J]. 中国病理生理杂志, 2017, 33(2):284-288.
[9] Niu J, Lin Y, Guo Z, et al. The epidemiological investigation on the risk factors of hepatocellular carcinoma: a case-control study in southeast China[J]. Medicine, 2016, 95(6): e2758.
[10]Liu QQ, Chen K, Ye QW, et al. Oridonin inhibits pancreatic cancer cell migration and epithelial-mesenchymal transition by suppressing Wnt/beta-catenin signaling pathway[J]. Cancer Cell Int, 2016, 16:57.
[11]Dong Y, Zhang T, Li J, et al. Oridonin inhibits tumor growth and metastasis through anti-angiogenesis by blocking the Notch signaling[J]. PLoS One, 2014, 9(12): e113830.
[12]彭延延, 施秋萍, 杨大朋, 等. 冬凌草甲素对人乳腺癌细胞侵袭的抑制作用及机制[J]. 苏州大学学报: 医学版, 2012, 32(3):318-321, 375.
[13]唐新桥, 朱宝玉, 王万春. 冬凌草甲素对MG-63转移的抑制效应和分子机制研究[J]. 食品与药品, 2013, 5(1):22-25.
[14]Xiao X, He Z, Cao W, et al. Oridonin inhibits gefitinib-resistant lung cancer cells by suppressing EGFR/ERK/MMP-12 and CIP2A/Akt signaling pathways[J]. Int J Oncol, 2016, 48(6):2608-2618.
[15]Chen P, Zeng M, Zhao Y, et al. Upregulation of Limk1 caused by microRNA-138 loss aggravates the metastasis of ovarian cancer by activation of Limk1/cofilin signaling[J]. Oncol Rep, 2014, 32(6):2070-2076.
(责任编辑: 陈妙玲, 罗 森)
Effects of oridonin on invasion and migration of human hepatocellular carcinoma MHCC-97H cells
LI Chun-yu1, WANG Qi2, SHEN Shen1, SU Wei-lian1, LI Jing-xiu1, LI Guo-xia1
(1InternationalMedicalSchool,TianjinMedicalUniversity,Tianjin300070,China;2OncologyDepartment,ShanghaiPulmonaryHospitalAffiliatedtoTongjiUniversity,Shanghai200433,China.E-mail:lichunyu@tmu.edu.cn)
AIM: To investigate the effects of oridonin on the invasion and migration of hepatocelluar carcinoma cells. METHODS: Human hepatocelluar carcinoma MHCC-97H cells were cultured and treated with 5, 10 or 20 μmol/L oridonin. The migration ability was measured by wound healing assay. The invasion ability was examined by Transwell invasion assay. The adhesion capabilities were evaluated by adhesion assay. The protein levels of LIM kinase-1 (LIMK-1), cofilin and phosphorylated cofilin (p-cofilin) were determined by Western blot. RESULTS: Oridonin inhibited the migration, invasion and adhesion abilities of MHCC-97H cells in a dose-dependent manner (P<0.05). After oridonin treatment, the expression of cofilin had no obvious change, but the protein levels of LIMK-1 and p-cofilin decreased significantly. CONCLUSION: Oridonin inhibits the invasion and migration of MHCC-97H cells. The mechanism may be related with the regulatory effect of oridonin on LIMK-1/cofilin signal transduction pathway.
Oridonin; Hepatocellular carcinoma; Cell invasion; Cell migration; Cell adhesion
1000- 4718(2017)08- 1423- 05
2017- 04- 26
2017- 07- 04
中国博士后科学基金面上项目(No. 2016M591398);天津医科大学科学基金青年项目(No. 2015KYZQ13);天津医科大学基本科研业务费资助项目(No. 2016YD07)
R329.21; R965
A
10.3969/j.issn.1000- 4718.2017.08.013
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 022-83336911; E-mail: lichunyu@tmu.edu.cn
