格列本脲对胶质母细胞瘤活性及细胞内酸碱平衡的影响*
2017-09-03盛华均杨清华朱淑娟
郭 玲, 盛华均, 刘 茜, 杨清华, 朱淑娟
(重庆医科大学基础医学院人体解剖教研室, 重庆 400016)
格列本脲对胶质母细胞瘤活性及细胞内酸碱平衡的影响*
郭 玲, 盛华均, 刘 茜, 杨清华, 朱淑娟△
(重庆医科大学基础医学院人体解剖教研室, 重庆 400016)
目的: 探讨格列本脲对胶质母细胞瘤活性及细胞内酸碱变化的影响。方法: 使用不同浓度的格列本脲(Glib)处理人胶质瘤细胞株U251和U87,通过CCK-8法筛选有效剂量;随后将实验分成对照组和药物处理组,划痕实验检测细胞迁移情况,细胞pH指示荧光探针检测细胞内pH变化,Western blot测定内向整流钾离子通道4.1(Kir4.1)和单羧酸转运蛋白1(MCT1)的表达情况。结果: CCK-8法检测结果显示,Glib作用于U251细胞和 U87细胞48 h的半数抑制浓度(IC50)分别为400.20 μmol/L和553.70 μmol/L,且在100~1 600 μmol/L的浓度区间范围内,Glib抑制U251细胞活力,在50~1 600 μmol/L的浓度区间范围内,Glib抑制U87细胞活力,两者均呈浓度依赖性(P<0.05);与对照组相比较,Glib不仅能够抑制细胞迁移(P<0.05),抑制作用与药物浓度呈正相关(P<0.05),而且使实验组细胞内荧光强度减弱(P<0.05),提示随着药物浓度的增高,细胞内pH值逐渐下降(P<0.05);实验组细胞的Kir4.1和MCT1蛋白含量明显降低,均有浓度依赖性(P<0.05)。结论: Glib在一定剂量范围内通过下调Kir4.1和MCT1表达诱导细胞内环境酸化,抑制胶质瘤细胞生长。
格列本脲; 胶质母细胞瘤; 细胞活性
胶质瘤是中枢神经系统最常见的颅内原发肿瘤[1],发生发展机制至今仍不完全清楚。世界卫生组织根据其病理特点将其划分为4个病理级别,即Ⅰ~Ⅳ级,其中Ⅰ~Ⅱ级属低级别,Ⅲ~Ⅳ级属高级别,也是恶性胶质瘤[2]。恶性胶质瘤其侵袭性强、术后复发率高,目前治疗效果不理想[3-4]。因此,探寻其机制及其防治迫在眉睫。
细胞内碱化与细胞增殖密切相关。研究表明内向整流钾离子通道4.1(inwardly-rectifying potassium channel 4.1,Kir4.1)和单羧酸转运蛋白(monocarbo-xylate transport proteins,MCT)的亚型MCT1均高表达于脑胶质瘤中,参与调节细胞增殖生长[5-10]。Kir4.1对K+具有强大的内向整流作用[11-12],MCT1主要参与乳酸及单羧酸的跨膜运输[10],二者均在维持胞内外酸碱平衡的过程中发挥重要作用[12]。研究还指出格列本脲(glibenclamide,Glib)可抑制胶质瘤U87细胞增殖和迁移[13],但具体机制不明。为此,本研究以胶质瘤U251细胞和U87细胞为研究对象,将从酸碱度的角度探讨Glib对胶质瘤细胞活性的作用及机制。
材 料 和 方 法
1 材料
1.1 细胞系与药物 U251细胞来自复旦IBS细胞资源中心,U87细胞来自重庆医科大学神经科学研究中心冻存;格列本脲(纯度>95%)购于Sigma,用二甲基亚砜溶解至稀释浓度为2×105μmol/L,0.22 μm过滤器超滤除菌后,分装后于-20 ℃储存,使用时用DMEM培养基稀释。
1.2 试剂与器材 DMEM培养基、青-链霉素和L-谷氨酰胺(HyClone);基础胎牛血清(博全生物科技有限公司);MCT1抗体(Abcam);Kir4.1抗体(博奥森公司);DAPI、0.25%EDTA胰蛋白酶、SDS-PAGE蛋白上样缓冲液、PVDF转移膜(0.22 μm)及细胞pH指示荧光探针BCECF-AM(重庆鼎国生物技术有限公司);RIPA裂解液(强)、BCA蛋白定量试剂盒、SDS-PAGE凝胶配制试剂盒、辣根过氧化物酶标记山羊抗兔IgG(H+L)和辣根过氧化物酶标记山羊抗小鼠IgG(H+L)均购自重庆碧云天科技有限公司。
2 方法
2.1 细胞培养 U251细胞和U87细胞加入含 10% 胎牛血清的DMEM培养基置于培养瓶中,放入37 ℃、5% CO2的饱和湿度培养箱中培养,2~3 d 传代,取对数生长期的细胞用于实验。
2.2 CCK-8实验检测细胞活力抑制率 取对数生长的U251和U87细胞,调整细胞数至5×108/L,以每孔100 μL接种至96孔板内,设空白组、对照组和不同药物浓度实验组,每组设置6个复孔,细胞贴壁后加不同浓度的Glib(12.5、25、50、100、200、400、600、800和1 600 μmol/L),在恒温培养箱内共培养48 h后每孔加入10 μL CCK-8溶液,2.5 h后用酶标仪检测吸光度(A)值,计算Glib对细胞的活力抑制率,实验重复3次,筛选出最适浓度。采用直线回归方法计算药物的半数抑制浓度(IC50),通过公式计算出Glib对细胞的活力抑制率。细胞活力抑制率(%)=(对照组A值-实验组A值)/(对照组A值-空白组A值)×100%。
2.3 划痕实验检测细胞迁移能力 制备细胞悬浮液浓度为1×107/L,估计细胞在48 h后可铺满整个6孔板,将细胞接种于6孔板内,6孔板于实验前用标记笔在6孔板背面划5条横线,不同浓度的Glib处理U251细胞和U87细胞,细胞贴壁后用200 μL枪头垂直于背面的横线划痕并清洗掉下的细胞,放入37 ℃、5% CO2的饱和湿度培养箱中培养,在0 h和48 h取样并拍照。实验重复3次,计算细胞迁移宽度比率=(各组0 h细胞间划痕宽度-48 h细胞间划痕宽度)/各组0 h细胞间划痕宽度×100%。
2.4 pH指示荧光探针检测细胞内pH变化 制备细胞悬浮液浓度为1×109/L,不同浓度Glib处理U251和U87细胞,按体积比1∶1将浓度为3 μmol/L 的BCECF-AM加入细胞悬浮液中,37 ℃孵育60 min,共聚焦检测光密度,参考荧光探针BCECF-AM在不同pH条件下的发射光谱,进行pH校准。
2.5 Western blot法检测Kir4.1通道和MCT1的蛋白表达 取对数生长期的细胞,分别加入Glib共培养48 h,分组情况同“2.3”,收集细胞,RIPA裂解液提取细胞总蛋白。BCA蛋白定量试剂盒测定蛋白浓度并定量,取上样量50 μg, SDS-PAGE分离蛋白,以湿转方式常规转膜至0.22 μm PVDF膜。封闭液37 ℃封闭2 h,分别加入 I 抗Kir4.1(1∶500)、MCT1(1∶1 000)和GAPDH/β-actin(1∶1 000),4 ℃孵育过夜, PBST洗膜后分别加入 II 抗孵育液(1∶6 000)37 ℃孵育30 min, PBST洗膜后ECL显影曝光。用Image Lab软件转换后测定灰度值,用目的蛋白灰度值与GAPDH或β-actin的灰度值的比值作为统计值分析。
3 统计学处理
所有数据均采用SPSS 19.0软件包进行数据分析,实验数据均以均数±标准差(mean±SD)表示,两组均数比较采用独立样本t检验,多组均数相互比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
结 果
1 CCK-8检测结果
Glib作用细胞48 h后,对U251细胞和U87细胞的IC50分别为400.20 μmol/L和553.70 μmol/L;与对照组相比,实验组细胞活力受到抑制,U251细胞和U87细胞的有效浓度范围分别为100 μmol/L~1 600 μmol/L和50 μmol/L~1 600 μmol/L,且抑制率与Glib浓度呈正相关(P<0.05)。后续实验组将分别采用100 μmol/L、300 μmol/L和500 μmol/L的Glib处理U251细胞,200 μmol/L、400 μmol/L和600 μmol/L的Glib处理U87细胞,见图1。

Figure 1.The concentration-dependent effect of Glib on U251 and U87 cell proliferation.
图1 Glib抑制U251和U87细胞增殖的量效关系
2 划痕实验检测结果
使用100、300和500 μmol/L Glib与U251细胞共培养48 h,200、400和600 μmol/L Glib与U87细胞共培养48 h后,对照组细胞划痕后相对迁移宽度明显小于药物处理组(P<0.05),且药物浓度越高,这种趋势越明显(P<0.05),表明随着Glib浓度增高,抑制细胞迁移能力逐渐加强,见图2。
3 pH荧光探针检测结果
图3是在激发波长为488 nm的荧光强度图,结果显示U251和U87细胞荧光强度均随着Glib浓度的增加而逐渐减弱(P<0.05)。据文献[13]介绍的荧光探针BCECF-AM在不同pH条件下的发射光谱参考显示,激发波长为488 nm可对应不同的pH值,且荧光强度越强,pH值越高,提示U251和U87细胞内pH值随着Glib浓度的升高而下降,有浓度依赖性。
4 Western blot 实验结果
不同浓度Glib分别处理2种细胞48 h后,Wes-tern blot结果显示:实验组各组Kir4.1蛋白和MCT1蛋白表达均低于对照组,差异有统计学意义(P<0.05);并且Kir4.1蛋白和MCT1蛋白表达与Glib浓度呈负相关(P<0.05);实验组两两之间比较,差异亦有统计学意义(P<0.05),见图4。
讨 论
细胞内外酸碱度变化与细胞增殖生长息息相关。Parks等[14]和Koltai[15]提出在肿瘤细胞生存发展过程中,增强细胞内酸性微环境能够促使细胞趋向死亡,而细胞外碱性环境增强则能够诱导细胞迁移、侵袭,反过来即细胞内的碱性状态更利于细胞增殖[16-17]。自1984年Chandy等[18]首先报道钾离子通道是T淋巴细胞增殖的主要通道以来,大量研究显示其与肿瘤细胞增殖密切相关,且相关实验基本停留在其对肿瘤细胞形态学的影响方面,进一步研究甚少。本实验利用钾离子通道阻断剂Glib作用于2种细胞系,一方面显示Glib在有效浓度范围内对胶质瘤U251细胞和U87细胞的活力具有明显抑制作用,且随着药物浓度的增高,抑制作用越强;另一方面,Glib可抑制胶质瘤细胞迁移,且具有浓度依赖性;这表明Glib可以抑制胶质瘤细胞的增殖生长和迁移。实验结果还表明Glib作用于2种细胞系后,胞内pH值下降,亦有浓度依赖性,呈负相关。这提示Glib可能影响了细胞内环境酸碱度变化从而影响胶质瘤细胞增殖生长。
细胞内酸碱度调节与众多因素有关,细胞膜上离子流动平衡至关重要。在哺乳动物中枢神经系统中,星形细胞作为最丰富的细胞类型,对细胞膜离子和水分子的平衡进行精确调控。如果细胞膜上这些调控蛋白在细胞膜上的表达和极化方式被打乱之后,将会破坏离子和细胞容积的平衡,将进一步影响细胞的酸碱度变化和细胞增殖[19]。Kir4.1对K+具有强大的内向整流作用[9],可诱导细胞外K+跨膜转运至细胞内[7],调节细胞内外离子平衡。课题组前期结果表明,与正常脑组织相比,Kir4.1高表达于胶质瘤组织[9,11-12],且表达与其恶性程度呈正相关。在胶质瘤细胞增殖过程中,细胞膜上的Kir4.1通道开放,促使细胞外K+进入细胞内,从而激活Na+,K+-ATP酶,[Na+]i降低,这使得Na+/H+交换体1(Na+/H+exchanger-1,NHE-1)开放,调节胞外Na+进入细胞内,同时将相应的H+转运至细胞外,从而维持新的细胞内、外电解质平衡和细胞内碱化状态[20-21]。若抑制Kir4.1通道,抑制K+进入细胞内,促使NHE-1减弱,胞内H+增多,细胞内呈现酸性环境,发挥抑制细胞增殖作用。本实验Western blot和pH实验结果与上述推测吻合,提示Glib可能通过上述途径参与抑制肿瘤细胞内碱化趋势。
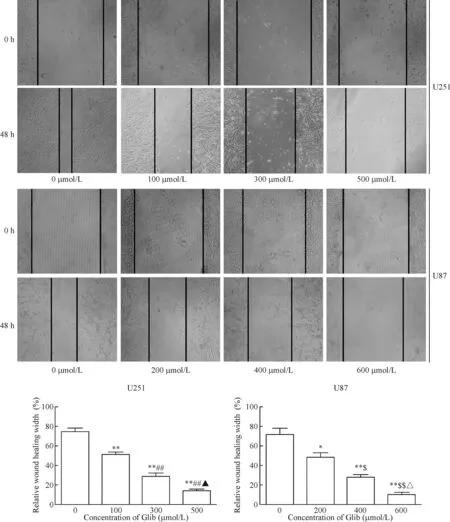
Figure 2.Effects of Glib at different concentrations on the migration of U251 cells and U87 cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group;##P<0.01vs100 μmol/L group;▲P<0.05vs300 μmol/L group;$P<0.05,$$P<0.01vs200 μmol/L group;△P<0.05vs400 μmol/L group.
图2 不同浓度Glib对U251和U87细胞迁移的影响
此外,能量亦是肿瘤细胞增殖生长过程中的必须元素,糖酵解是其提供能量的主要方式之一。糖酵解过程产生大量的乳酸和CO2等酸性代谢产物,使细胞内呈现酸性环境[22-23],这与细胞内酸碱度的维持亦密切相关。实验证明肿瘤细胞外pH值低于细胞内[24],提示细胞内及细胞膜上有相应的调控机制将其酸性物质排出体外,维持其碱性环境,利于细胞增殖。MCT家族作为肿瘤细胞中转运乳酸和清除H+的重要跨膜蛋白[10,17],参与维持细胞内、外电解质平衡。MCT1是MCT家族成员之一,主要参与乳酸及单羧酸的跨膜运输[10]。本课题组发现星形细胞瘤中的MCT1表达与正常脑组织相比明显增强,且恶性程度越高,MCT1表达越强烈[10]。肿瘤细胞在增殖生长过程中需要消耗大量的能量,而糖酵解之后,细胞膜上的MCT1需将细胞内过多的乳酸和H+转运至细胞外,维持细胞内外离子和酸碱平衡,促进肿瘤细胞增殖[20]。本实验Western blot实验结果表明,通过使用Glib作用于U251和U87细胞系后,MCT1蛋白表达下调。Glib亦可能通过抑制MCT1的表达,打乱了细胞膜内外有机物和无机物的转运平衡,从而参与抑制肿瘤细胞内碱化趋势的形成。

Figure 3.Effects of Glib at different concentrations on the intracellular pH values of U251 cells (A) and U87 cells (B).Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group;#P<0.05,##P<0.01vs100 μmol/L group;▲P<0.05vs300 μmol/L group;$P<0.05,$$P<0.01vs200 μmol/L group;△P<0.05vs400 μmol/L group.
图3 不同浓度格列本脲对U251和U87细胞内pH的影响

Figure 4.Effects of Glib at different concentrations on the protein expression of Kir4.1 and MCT1 in U251 cells (A) and U87 cells (B). Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group;##P<0.01vs100 μmol/L group;▲P<0.05vs300 μmol/L group;$P<0.05,$$P<0.01vs200 μmol/L group;△P<0.05vs400 μmol/L group.
图4 不同浓度格列本脲对U251和U87细胞中Kir4.1和MCT1蛋白表达的影响
综上所述,本实验使用钾离子通道阻滞剂Glib作用于2个细胞系,从细胞酸碱度角度阐释Glib对U251和U87细胞活力的抑制作用及其可能的机制,为临床实验提供实验数据。然而,细胞内代谢机制复杂,抑制机制路径众多,尚需进一步的实验研究方能给出清晰明确的结论。
[1] Ru Q, Shang BY, Miao QF, et al. A cell penetrating peptide-integrated and enediyne-energized fusion protein shows potent antitumor activity[J]. Eur J Pharm Sci, 2012, 47(4):781-789.
[2] Van Meir EG, Hadjipanayis CG, Norden AD, et al. Exciting new advances in neuro-oncology: the avenue to a cure for malignant glioma[J]. CA Cancer J Clin, 2010, 60(3):166-193.
[3] Walbert T, Chasteen K. Palliative and supportive care for glioma patients[J]. Cancer Treat Res, 2015, 163:171-184.
[4] Katz B. Neuro-muscular transmission in invertebrates [J]. Biol Rev Camb Philos Soc, 1949, 24(1):1-20.
[5] Butt AM, Kalsi A. Inwardly rectifying potassium channels (Kir) in central nervous system glia: a special role for Kir4.1 in glial functions[J]. J Cell Mol Med, 2006, 10(1): 33-44.
[6] Benton CR, Yoshida Y, Lally J, et al. PGC-1 alpha increases skeletal muscle lactate uptake by increasing the expression of MCT1 but not MCT2 or MCT4[J]. Physiol Genomics, 2008, 35(1):45-54.
[7] Hashimoto T, Hussien R, Brooks GA. Colocalization of MCT1, CD147, and LDH in mitochondrial inner membrane of L6 muscle cells: evidence of a mitochondrial lactate oxidation complex[J]. Am J Physiol Endocrinol Metab, 2006, 290(6):E1237-E1244.
[8] Saadoun S, Papadopoulos MC, Krishna S. Water transport becomes uncoupled from K+siphoning in brain contusion, bacterial meningitis, and brain tumours: immunohistochemical case review[J]. J Clin Pathol, 2003, 56(12):972-975.
[9] Tan G, Sun SQ, Yuan DL. Expression of Kir 4.1 in human astrocytic tumors: Correlation with pathologic grade [J]. Biochem Biophys Res Commun, 2008, 367(4):743-747.
[10]李文娟. MCTs在人星形细胞瘤中的表达变化及MCT抑制剂对U251细胞增殖的影响[D]. 重庆: 重庆医科大学, 2014.
[11]朱淑娟, 孙善全, 汪克建, 等. 水通道蛋白4和内向整流性钾通道4.1在星形细胞瘤组织中的共定位及表达差异[J]. 重庆医科大学学报, 2013, 38(9):974-978.
[12]朱淑娟, 孙善全, 许士叶, 等. 水通道蛋白4和8在不同级别星形细胞瘤组织中的表达[J]. 中国病理生理杂志, 2012, 28(5):796-801.
[13]Han F, Xu Y, Jiang D, et al. A BODIPY-derived fluorescent probe for cellular pH measurements[J]. Anal Biochem, 2013, 435(2):106-113.
[14]Parks SK, Chiche J, Pouyssegur J. pH control mechanisms of tumor survival and growth [J]. J Cell Physiol, 2011, 226(2):299-308.
[15]Koltai T. Cancer: fundamentals behind pH targeting and the double-edged approach[J]. Onco Targets Ther, 2016, 9:6343-6360.
[16]Ru Q, Tian X, Wu YX, et al. Voltage-gated and ATP-sensitive K+channels are associated with cell proliferation and tumorigenesis of human glioma[J]. Oncol Rep, 2014, 31(2):842-848.
[17]Sanità P, Capulli M, Teti A, et al. Tumor-stroma metabolic relationship based on lactate shuttle can sustain prostate cancer progression[J]. BMC Cancer, 2014, 14:154.
[18]Chandy KG, DeCoursey TE, Cahalan MD, et al. Vol-tage-gated potassium channels are required for human T lymphocyte activation[J]. J Exp Med, 1984, 160(2):369-385.
[19]Benfenati V, Ferroni S. Water transport between CNS compartments: functional and molecular interactions between aquaporins and ion channels[J]. Neuroscience, 2010, 168(4):926-940.
[20]Kraus M, Wolf B. Implications of acidic tumor microenvironment for neoplastic growth and cancer treatment: a computer analysis[J]. Tumor Biol, 1996, 17(3):133-154.
[21]Alfarouk KO. Tumor metabolism, cancer cell transporters, and microenvironmental resistance[J]. J Enzyme Inhib Med Chem, 2016, 31(6):859-866.
[22]Kosic M, Arsikin-Csordas K, Paunovic V, et al. Synergistic anticancer action of lysosomal membrane permeabilization and glycolysis inhibition[J]. J Biol Chem, 2016,291(44):22936-22948.
[23]Böhme I, Bosserhoff AK. Acidic tumor microenvironment in human melanoma[J]. Pigment Cell Melanoma Res, 2016, 29(5):508-523.
[24]Pappas CA, Ullrich N, Sontheimer M. Reduction of glial proliferation by K+channel blockers is mediated by chan-ges in pHi[J]. Neuroreport, 1994, 6(1):193-196.
(责任编辑: 陈妙玲, 罗 森)
Effect of glibenclamide on viability and acid-base equilibrium of glioblastoma cells
GUO Ling, SHENG Hua-jun, LIU Qian, YANG Qing-hua, ZHU Shu-juan
(TeachingandResearchSectionofHumanAnatomy,CollegeofBasicMedicine,ChongqingMedicalUniversity,Chongqing400016,China.E-mail:zhushujuan75@126.com)
AIM: To investigate the effect of glibenclamide (Glib) on the viability and acid-base equilibrium of glioblastoma cells. METHODS: U251 cells and U87 cells were treated with Glib at different concentrations. The inhibitory rates were detected by CCK-8 assay. The effective dose was screened and the experiment was divided into control group and drug treatment groups. The migration ability was monitored by wound healing assay, and intracellular pH was detected by pH indicator fluorescent probe. The protein expression levels of inwardly-rectifying potassium channel 4.1 (Kir4.1) and monocarboxylate transport protein 1 (MCT1) were determined by Western blot. RESULTS: The half maximal inhibitory concentrations (IC50) of Glib for 48 h exposure of U251 cells and U87 cells were 400.20 μmol/L and 553.70 μmol/L, respectively. The effective inhibition doses of Glib for U251 cells were from the ranges of 100 μmol/L to 1 600 μmol/L, and those for U87 cells were from 50 μmol/L to 1 600 μmol/L in a concentration-dependent manner (P<0.05). Glib not only inhibited the migration (P<0.05) of U251 cells and U87 cells, which was negatively correlated with drug concentration (P<0.05), but also reduced the intracellular fluorescence intensity in experimental group (P<0.05), suggesting that with the increase in drug concentration, the intracellular pH decreased gradually (P<0.05). The protein expression of Kir4.1 and MCT1 was down-regulated by treatment with Glib, and was negatively correlated with concentration of Glib. CONCLUSION: Glib, a kind of potassium channel blocker, induces intracellular acidification via down-regulating the expression of Kir4.1 and MCT1, thus inhibiting the growth of glioblastoma in a certain dose range.
Glibenclamide; Glioblastoma; Cell viability
1000- 4718(2017)08- 1405- 06
2017- 01- 06
2017- 04- 24
国家自然科学基金资助项目(No. 81502161);重庆市科委基础与前沿资助项目(No. cstc2014jcyjA10028);重庆医科大学基础医学院资助项目(No. 2013-5)
R739.41; R730.23
A
10.3969/j.issn.1000- 4718.2017.08.010
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 023-68485763; E-mail: zhushujuan75@126.com
